一种高通量检测EB病毒感染效率/抗体阻断EB病毒感染效率的方法与流程
本发明涉及生物医药技术领域,更具体地说,涉及一种高通量检测eb病毒感染效率/抗体阻断eb病毒感染方法。
背景技术:
病毒性预防性疫苗研发过程中一项重要的考察指标就是针对候选疫苗所诱导的中和抗体应答进行检测,而中和抗体的效价评估以及临床血清的中和效价检测则主要依赖于高通量的检测方法,要求在较短的时间内一次性可检测较多的样本量,这就要求中和检测方法的高通量。
现有技术主要包含两种,一种是依赖于eb病毒使淋巴细胞永生化实验的中和检测方法,该方法耗时比较久,实验周期约为四十天左右,不适合用于大规模临床血清的筛选和检测,主要通过利用细胞系生产的eb病毒感染人b细胞,eb病毒感染b细胞可以使b细胞发生永生化,因此可以借助b细胞永生化的转化效率来评价eb病毒的感染效率;另一种中和检测方法为基于流式细胞仪的检测方法,该方法不能对96孔板进行一次性读板检测,故无法满足高通量检测的要求,具体方法为在孔板中完成eb病毒感染细胞的实验流程,感染效率检测利用流式细胞仪对eb病毒的感染效率进行测定。
技术实现要素:
本发明第一个方面的目的在于提供一种高通量检测eb病毒感染效率的方法。
本发明第二个方面的目的,在于提供一种高通量检测多抗血清/抗体阻断eb病毒感染的效率的方法。
本发明所采取的技术方案是:
本发明的第一个方面,提供一种高通量检测eb病毒感染效率的方法,包括以下步骤:
s1:制备eb病毒感染的待测细胞样品;
s2:用高内涵检测仪器对待测细胞样品进行检测,并计算半数抑制浓度。
优选地,根据本发明第一个方面所述的方法,步骤s1中所述待测细胞样品的制备方法为:在96孔板中用病毒液感染待测细胞样品,培养后待测。
更优选地,根据本发明第一个方面所述的方法,步骤s1中所述待测细胞样品的制备方法为:在96孔板中用20μl病毒液感染104待测细胞样品,37℃二氧化碳培养箱感染120min后补充培养基至终体积为200μl,培养48小时后待测。
根据本发明第一个方面所述的方法,步骤s2所述用高内涵检测仪器对待测细胞样品进行检测时选用gfp荧光检测模块。
更具体地,根据本发明第一个方面所述的方法,所述gfp荧光检测模块的具体参数为:曝光时间80ms,曝光强度为50%,对焦高度为11μm。
更具体地,根据本发明第一个方面所述的方法,步骤s2所述用高内涵检测仪器对待测细胞样品进行检测时,物镜选用20x空气镜。
根据本发明第一个方面所述的方法,所述细胞待测样品放置于nunc96细胞板中。
本发明的第二个方面,提供一种高通量检测多抗血清/抗体阻断eb病毒感染的效率的方法,包括以下步骤:
s1:将病毒液与按倍数梯度稀释的抗体分别混合,孵育;
s2:于病毒液与抗体的混合液中加入等量的待测细胞样品,培养;
s3:用高内涵检测仪器对待测细胞样品进行检测,根据样品稀释度及eb病毒感染效率计算半数抑制浓度。
根据本发明第二个方面所述的方法,通过检测多抗血清/抗体对eb病毒的中和滴度,来衡量其阻断eb病毒感染的效率。
根据本发明第二个方面所述的方法,步骤s1在96孔板中用将20μl病毒液与按倍数梯度稀释的抗体分别混合,孵育。
根据本发明第二个方面所述的方法,步骤s2于病毒液与抗体的混合液中加入104待测细胞,37℃二氧化碳培养箱感染100~150min后补充培养基至终体积为200μl,培养48小时后待测。
根据本发明第二个方面所述的方法,步骤s3中所述用高内涵检测仪器对待测细胞样品进行检测时选用gfp荧光检测模块。
根据本发明第二个方面所述的方法,所述gfp荧光检测模块的具体参数为:曝光时间80ms,曝光强度为50%,对焦高度为11μm。
根据本发明第二个方面所述的方法,在检测多抗血清的中和滴度时,先将血清以原倍浓度为起始梯度,按照10倍倍稀稀释8个梯度,然后在96孔板中分别与20μl病毒液孵育,37度二氧化碳培养箱孵育2小时后再加入104被感染细胞,再在37度二氧化碳培养箱感染2小时后补充培养基至终体积为200μl,培养48小时后待测。
根据本发明第二个方面所述的方法,在检测单克隆抗体的中和滴度时,先将抗体以5mg/ml为起始梯度,按照5倍倍稀稀释8个梯度,然后在96孔板中分别与20μl病毒液孵育,37度二氧化碳培养箱孵育2小时后再加入104被感染细胞,再在37度二氧化碳培养箱感染2小时后补充培养基至终体积为200μl,培养48小时后待测。
根据本发明第二个方面所述的方法,步骤s3所述用高内涵检测仪器对待测细胞样品进行检测时,物镜选用20x空气镜。
根据本发明第二个方面所述的方法,所述细胞待测样品放置于nunc96细胞板中。
本发明的有益效果是:
本发明利用特定的检测方法和实验体系实现了eb病毒感染效率测定、中和抗体中和效价测定和临床血清中和滴度测定的高通量检测。大大缩减了检测所需要的时间,减少了病毒和血清用量,提高了检测的效率,为eb病毒特异中和抗体筛选和疫苗免疫临床血清的中和效价评估提供了高通量的简便的检测方法。
本发明同时通过现有eb病毒感染效率的流式细胞仪检测方法验证了本发明方法的准确性,在同一样品,同批次检测的结果来看,对两种方法检测得到的半数抑制浓度进行了相关性分析,其r2值为0.8942,分析结果显示两种方法的相关性较好。但采用高内涵检测仪器检测可一次性检测96个样品:而采用流式细胞仪需要一个流式管一个流式管的上样,而且还需要将样品转移到流式管中,不但耗时还非常浪费耗材,也由于检测方法的耗时,对于大批量检测容易产生较大的系统误差。
本发明的发明人经过长时间的实践摸索,还提供了该方法实验阶段和检测阶段使用的细胞数和感染时使用的病毒体积的具体参数。
附图说明
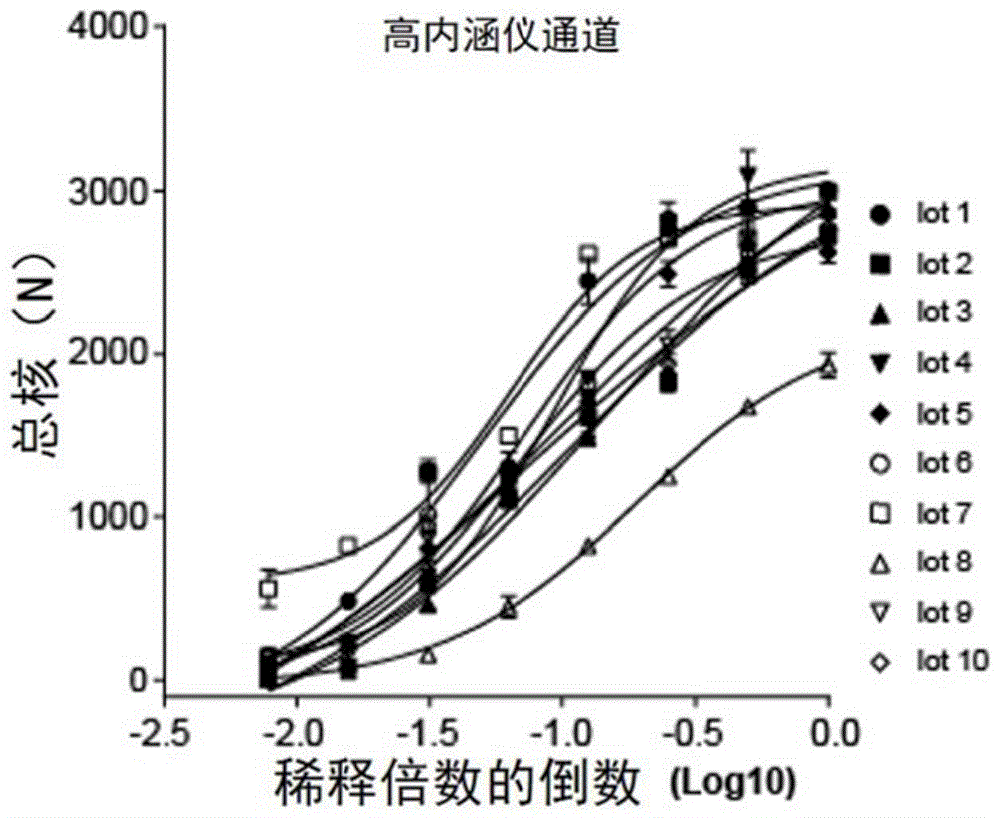
图1为高内涵仪器检测十批次eb病毒的感染效率。
图2为流式细胞仪检测十批次eb病毒的感染效率。
图3为两种方法检测十批次eb病毒感染效率的相关性分析。a图为两种方法检测十批次eb病毒感染效率散点图;b图为两种方法的线性相关图。
图4为高内涵仪器检测中和抗体72a1对不同感染效率eb病毒的中和阻断效率。
图5为流式细胞仪检测中和抗体72a1对不同感染效率eb病毒的中和阻断效率。
图6为两种方法检测中和抗体72a1对不同感染效率eb病毒的中和阻断效率的相关性分析。
图7为高内涵仪器检测32份临床血清阻断eb病毒感染的中和效价。其中a图为第1~8份临床血清阻断eb病毒感染的中和效价;其中b图为第9~16份临床血清阻断eb病毒感染的中和效价;其中c图为第17~24份临床血清阻断eb病毒感染的中和效价;其中d图为第25~32份临床血清阻断eb病毒感染的中和效价。
图8为流式细胞仪检测32份临床血清阻断eb病毒感染的中和效价。其中a图为第1~8份临床血清阻断eb病毒感染的中和效价;其中b图为第9~16份临床血清阻断eb病毒感染的中和效价;其中c图为第17~24份临床血清阻断eb病毒感染的中和效价;其中d图为第25~32份临床血清阻断eb病毒感染的中和效价。
图9两种方法检测32份临床血清阻断eb病毒感染中和效价的相关性分析。a图为两种方法检测32份临床血清阻断eb病毒感染效价散点图;b图为两种方法检测32份临床血清阻断eb病毒感染中和效价的线性相关图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。这些施例仅用于说明不拥有限制本发明的应用范围。下面实施例中所用的材料、试剂如无特殊说明,均可从商业途径得到。病毒生产细胞系cne2-ebv及病毒感染细胞系akata-neg为本室保存,抗体72a1由atcc保存的hb168杂交瘤细胞株分泌,其atcc编号为72a1(
实施例1高内涵仪器检测十批次eb病毒的感染效率
1、将病毒生产细胞系培养至90%的细胞汇合度,然后利用化学诱导剂佛波酯(终浓度20ng/ml)和丁酸钠(终浓度2.5mm)共同诱导病毒生产细胞系生产病毒,诱导后72小时收获细胞培养上清,通过高速离心的方法纯化并浓缩病毒,将病毒分装后保存在-80度备用。
2、cne2-ebv病毒生产十个批次;
3、将每批次病毒液按照2倍梯度稀释8个梯度,然后将稀释的病毒液与细胞混匀后置于37度二氧化碳培养箱孵育2小时;
4、2小时后通过离心去除病毒上清,然后用完全培养基将细胞重悬后转移到96孔板培养;
5、在二氧化碳培养箱培养48小时后进行高内涵仪检测,统计每孔的gfp阳性细胞数,以稀释度和gfp阳性细胞数作图计算每批次病毒的半数感染剂量,结果见图1。
从图中可以看出:高内涵检测结果显示十批次的病毒最高感染效率范围为1500-3000荧光点,说明:不同批次制备的病毒存在批次间的差异。
利用流式细胞仪检测十批次eb病毒的感染效率
1、将病毒生产细胞系培养至90%的细胞汇合度,然后利用化学诱导剂佛波酯(终浓度20ng/ml)和丁酸钠(终浓度2.5mm)共同诱导病毒生产细胞系生产病毒,诱导后72小时收获细胞培养上清,通过高速离心的方法纯化并浓缩病毒,将病毒分装后保存在-80度备用。
2、cne2-ebv病毒生产十个批次;
3、将每批次病毒液按照2倍梯度稀释8个梯度,然后将稀释的病毒液与细胞混匀后置于37度二氧化碳培养箱孵育2小时;
4、2小时后通过离心去除病毒上清,然后用完全培养基将细胞重悬后转移到96孔板培养;
5、在二氧化碳培养箱培养48小时后进行流式细胞仪检测,将gfp阳性细胞占总细胞数的百分比定义为每批次eb病毒的感染效率,以稀释度和感染效率作图计算每批次病毒的半数感染剂量,结果见图2。
从图中可以看出:流式细胞仪检测结果显示十批次的病毒最高感染效率范围为40%-60%的阳性细胞数,说明:同样地,不同批次制备的病毒存在批次间的差异。
对两种方法检测得到的半数感染剂量进行了相关性分析,结果见图3。从图中可以看出:分析结果表明r2值为0.8287,说明:结果显示两种方法的相关性较好。
实施例2利用高内涵检测仪器检测中和抗体72a1阻断eb病毒感染的中和效果
1、将病毒生产细胞系培养至90%的细胞汇合度,然后利用化学诱导剂佛波酯(终浓度20ng/ml)和丁酸钠(终浓度2.5mm)共同诱导病毒生产细胞系生产病毒,诱导后72小时收获细胞培养上清,通过高速离心的方法纯化并浓缩病毒,将病毒分装后保存在-80度备用。
2、cne2-ebv病毒生产如前所述;并且选择感染效率分别为10%、20%、40%的三个批次的eb病毒作为阻断对象;
3、将中和抗体72a1按照初始浓度为5mg/ml进行5倍稀释共稀释8个梯度用于阻断实验,然后将稀释的抗体72a1与不同感染效率的病毒混匀后置于37度二氧化碳培养箱孵育2小时;
4、2小时后将上述抗体和病毒混合物与定量的akata-neg细胞混匀后置于37度二氧化碳培养箱孵育2小时;
5、2小时后通过离心去除病毒和抗体的混合上清,然后用完全培养基将细胞重悬后转移到96孔板培养;
6、在二氧化碳培养箱培养48小时后进行高内涵仪器检测,检测每孔的gfp阳性细胞数,以抗体稀释度和gfp阳性细胞数作图计算72a1抑制不同病毒感染的半数抑制浓度,结果见图4。
从图中可以看出:72a1对三批次不同感染效率病毒的半数抑制浓度相似,说明:中和抗体72a1可以有效地阻断三批次不同感染效率的病毒
通过前期实验的多次摸索和重复验证,确定了病毒感染效率实验体系、多抗血清中和滴度实验体系、单克隆抗体中和滴度实验体系和相应的仪器设置等主要参数,详细如下:
①考察病毒感染效率所用实验体系:在96孔板中用20μl病毒液感染104被感染细胞,37度二氧化碳培养箱感染2小时后补充培养基至终体积为200μl,培养48小时后进行检测。
②考察多抗血清中和滴度所用实验体系:先将血清以原倍浓度为起始梯度,按照10倍倍稀稀释8个梯度,然后在96孔板中分别与20μl病毒液孵育,37度二氧化碳培养箱孵育2小时后再加入104被感染细胞,再在37度二氧化碳培养箱感染2小时后补充培养基至终体积为200μl,培养48小时后进行检测。
③考察单克隆抗体中和滴度所用实验体系:先将抗体以5mg/ml为起始梯度,按照5倍倍稀稀释8个梯度,然后在96孔板中分别与20μl病毒液孵育,37度二氧化碳培养箱孵育2小时后再加入104被感染细胞,再在37度二氧化碳培养箱感染2小时后补充培养基至终体积为200μl,培养48小时后进行检测。
④仪器设置的主要参数包括:所选用的96孔板为nunc96,物镜为20x空气镜,gfp荧光检测通道,曝光时间80ms,曝光强度为50%,对焦高度为11μm。
实施例3利用流式细胞仪检测中和抗体72a1阻断eb病毒感染的中和效果,并对两种检测方法的相关性进行分析
1、将病毒生产细胞系培养至90%的细胞汇合度,然后利用化学诱导剂佛波酯(终浓度20ng/ml)和丁酸钠(终浓度2.5mm)共同诱导病毒生产细胞系生产病毒,诱导后72小时收获细胞培养上清,通过高速离心的方法纯化并浓缩病毒,将病毒分装后保存在-80度备用。
2、cne2-ebv病毒生产如前所述;并且选择感染效率分别为10%、20%、40%的三个批次的eb病毒作为阻断对象;
3、将中和抗体72a1按照初始浓度为5mg/ml进行5倍稀释共稀释8个梯度用于阻断实验,然后将稀释的抗体72a1与不同感染效率的病毒混匀后置于37度二氧化碳培养箱孵育2小时;
4、2小时后将上述抗体和病毒混合物与定量的akata-neg细胞混匀后置于37度二氧化碳培养箱孵育2小时;
5、2小时后通过离心去除病毒和抗体的混合上清,然后用完全培养基将细胞重悬后转移到96孔板培养;
6、在二氧化碳培养箱培养48小时后进行流式细胞仪检测,将gfp阳性细胞占总细胞数的百分比定义为每批次eb病毒的感染效率,以抗体稀释度和感染效率作图计算72a1抑制不同病毒感染的半数抑制浓度,结果见图5。
从图中可以看出:72a1对三批次不同感染效率病毒的半数抑制浓度相似,说明:中和抗体72a1可以有效地阻断三批次不同感染效率的病毒。
两种方法检测中和抗体72a1对不同感染效率eb病毒的中和阻断效率具体结果见表1。
表1中和抗体72a1对不同感染效率eb病毒的中和阻断效率
从表情中可以看出:任何一种检测方法得出中和抗体72a1对三批次不同感染效率病毒的半数抑制浓度相似,并且两种方法得到的半数抑制浓度在同一数量级,说明:72a1对病毒的中和效果不受病毒最高感染效率的影响,并且两种方法得到的半数抑制浓度基本一致。
对两种方法检测得到的半数抑制浓度进行了相关性分析,结果见图6,其r2值为0.8401,分析结果显示两种方法的相关性较好。
从图中可以看出:两种方法得到的半数抑制浓度基本一致,说明:两种方法在检测中和抗体对病毒的半数抑制浓度时具有良好的相关性。
实施例4利用高内涵检测仪器检测多份临床血清对eb病毒的中和效价
1、将病毒生产细胞系培养至90%的细胞汇合度,然后利用化学诱导剂佛波酯(终浓度20ng/ml)和丁酸钠(终浓度2.5mm)共同诱导病毒生产细胞系生产病毒,诱导后72小时收获细胞培养上清,通过高速离心的方法纯化并浓缩病毒,将病毒分装后保存在-80度备用;
2、cne2-ebv病毒生产如前所述;并且选择感染效率为20%的eb病毒批次作为阻断对象;
3、将32份临床血清按照初始浓度1/10进行5倍稀释共稀释8个梯度用于阻断实验,然后将稀释的血清与感染效率为20%的病毒混匀后置于37度二氧化碳培养箱孵育2小时;
4、2小时后将上述血清和病毒混合物与定量的akata-neg细胞混匀后置于37度二氧化碳培养箱孵育2小时;
5、2小时后通过离心去除病毒和血清的混合上清,然后用完全培养基将细胞重悬后转移到96孔板培养;
6、在二氧化碳培养箱培养48小时后进行高内涵仪器检测,检测每孔的gfp阳性细胞数,以血清稀释度和gfp阳性细胞数作图计算血清抑制eb病毒感染的半数抑制浓度,结果见图7。
从图中可以看出:32份临床血清对病毒的半数抑制浓度不同,说明:临床血清对病毒的阻断效果差异较大。
实施例5利用流式细胞仪检测多份临床血清对eb病毒的中和效价,并对两种方法进行相关性分析
1、将病毒生产细胞系培养至90%的细胞汇合度,然后利用化学诱导剂佛波酯(终浓度20ng/ml)和丁酸钠(终浓度2.5mm)共同诱导病毒生产细胞系生产病毒,诱导后72小时收获细胞培养上清,通过高速离心的方法纯化并浓缩病毒,将病毒分装后保存在-80度备用;
2、cne2-ebv病毒生产如前所述;并且选择感染效率为20%的eb病毒批次作为阻断对象;
3、将32份临床血清按照初始浓度1/10进行5倍稀释共稀释8个梯度用于阻断实验,然后将稀释的血清与感染效率为20%的病毒混匀后置于37度二氧化碳培养箱孵育2小时;
4、2小时后将上述血清和病毒混合物与定量的akata-neg细胞混匀后置于37度二氧化碳培养箱孵育2小时;
5、2小时后通过离心去除病毒和血清的混合上清,然后用完全培养基将细胞重悬后转移到96孔板培养;
6、在二氧化碳培养箱培养48小时后进行流式细胞仪检测,将gfp阳性细胞占总细胞数的百分比定义为每批次eb病毒的感染效率,以血清稀释度和感染效率作图计算血清抑制eb病毒感染的半数抑制浓度,结果见图8。
从图中可以看出:32份临床血清对病毒的半数抑制浓度不同,说明:临床血清对病毒的阻断效果差异较大。
对两种方法检测得到的半数抑制浓度进行了相关性分析,结果见图9,
从图中可以看出:两种方法检测得到的32份临床血清对病毒感染阻断的半数抑制浓度总体分布相似,说明:两种方法的相关性较好其r2值为0.8942,分析结果显示两种方法的相关性较好。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!