一种用生物反应器罐流培养溶瘤腺病毒的工艺优化方法与流程
本发明属于生物工程技术领域,特别适用于用生物反应器罐流培养溶瘤腺病毒时所用到的一套工艺优化方法。
背景技术:
hek293细胞是腺病毒载体的包装细胞,腺病毒是用于基因治疗研究的热门载体,而溶瘤腺病毒集病毒治疗、基因治疗和免疫治疗为一体,在治疗肿瘤方面已取得可喜进展。2004年首例基因治疗产品“今又生”、2005年首个溶瘤病毒产品“安柯瑞”陆续在中国上市,使腺病毒载体实现了在临床上的真正应用。因此完善hek293细胞的大规模培养以及溶瘤腺病毒大规模培养技术具有越来越重要的市场意义。
目前,关于生物反应器用于腺病毒制备已有大量研究开发,比如中国专利(申请号:201310114752.6),其在病毒收获阶段采取批次换液收获,并通过破碎细胞收获细胞内病毒,这对于腺病毒制备来说不够完善,存在亚批次的问题,且加大了纯化难度。
要完善腺病毒载体扩增工艺首先必须建立在对hek293细胞生理和生长特性的全面认识,以及对腺病毒感染细胞后的复制机理有全面把握。首先,细胞感染病毒前后会发生各种变化,如细胞干重、蛋白和核酸含量、细胞大小都有不同程度的增加。感染病毒阶段,用含10%血清的培养基会降低感染效率,而用不含血清的培养基会使细胞状态变差从而也影响病毒感染效率,所以用含2%血清的培养基感染病毒是最佳选择。在细胞培养和病毒培养阶段通过罐流培养基,可以控制营养物质的适度补给,特别是葡萄糖的补给。因为一旦葡萄糖耗竭会导致病毒扩增停止。
根据“细胞密度效率”,病毒的产量未必跟细胞密度成正比,当细胞密度大于某个数量级,病毒产量不再增加,其原理尚未完全明确,可能于单位体积内营养物质的争夺和代理产物毒性有关。在腺病毒扩增的过程中,也同样存在最佳细胞密度,对于整个培养阶段而言,细胞密度的确定可以使整个工艺流程变得简便、经济。从而更适用于工业开发相关产品。
腺病毒的复制的最短周期大概在20小时左右,从与细胞表面受体结合,经过内吞作用进入细胞,然后是dna的复制、转录和表达以及病毒的组装。此外,病毒在感染细胞30-40小时后会通过细胞裂解释放到细胞外,因此通过罐流培养的方式,可以使罐内的病毒持续感染正常细胞,释放到培养基中的病毒通过流出液收获,最终有利于病毒总体滴度的提高。
技术实现要素:
本发明的目的是用生物反应器最大程度优化罐流培养溶瘤腺病毒的扩增工艺,已期获得更高滴度的溶瘤腺病毒,并且稳定该工艺,达到重复性好、稳定性高的特点,最终能用于溶瘤腺病毒产品的生产。
本发明是利用生物反应器扩增hek293细胞,从而建立罐流培养溶瘤腺病毒的全套工艺流程。细胞培养阶段用含10%血清的dmem培养基,采用罐流培养方式,将葡萄糖浓度控制在1-2g/l,9-10天后换成含2%血清的dmem培养基,接种病毒,感染5-6小时后采用罐流培养方式,将葡萄糖浓度控制在0.5-1.5g/l,收获病毒阶段使用无血清培养基,采用罐流培养方式,将葡萄糖浓度控制在0.5-1.5g/l,连续收获5-6天。该方法在减轻后期纯化难度并适应生物制品要求的基础上,尽量达到较高的病毒滴度。因此本发明所建立的优化工艺是具有良好的重复性和高效性的溶瘤腺病毒扩增工艺,可适用于任何用生物反应器罐流培养溶瘤腺病毒的生产。
本发明采用的技术方案是:应用生物反应器全面优化罐流培养扩增溶瘤腺病毒的大规模生产工艺,具体步骤如下:
(1)准备材料:
1、载体:fibra-cel片状载体200克;
2、细胞:人胚肾细胞hek293,购自美国atcc;
3、病毒:本发明所用病毒为重组5型腺病毒载体携带基因il-24的溶瘤腺病毒,自行构建,亦可以是不携带外源基因或是携带任何其他目的基因的5型腺病毒,或其他型别腺病毒,如ad2、ad6、ad26、ad35等;接种moi在30-60之间;
4、细胞生长液:含体积浓度10%血清(浙江天杭公司)的dmem培养基(美国gibco公司);
5、病毒感染液:含体积浓度2%血清(浙江天杭公司)的dmem培养基(美国gibco公司);
6、病毒收获液:不含血清的dmem培养基(美国gibco公司);
(2)细胞工厂培养种子细胞和病毒:细胞复苏后,在flask细胞培养瓶(美国corning公司)进行传代,每两天按1:3传代,直至1个10层工厂(美国corning公司),底面积为6360cm2,消化共得到约2×109个细胞,接种到3个10层细胞工厂,两天后1个10层工厂消化得到约2.0×109个细胞,作为细胞种子;另两个10层工厂用于扩增病毒种子,得到病毒滴度大于1×1012iu;
(3)在生物反应器内加入细胞生长液,接种hek293细胞,罐流培养8-9天,将葡萄糖浓度控制在1-2g/l,9-10天后换成病毒感染液,接种病毒,静止感染5-6小时后采用罐流培养方式,将葡萄糖浓度控制在0.5-1.5g/l,48小时后即收获病毒阶段使用无血清培养基,采用罐流培养方式,将葡萄糖浓度控制在0.5-1.5g/l,连续收获5-6天。生物反应器物理参数设定:ph7.0-7.4、温度37℃、溶氧20-60%。
本发明与其他生物反应器工艺比较,具有根据原理全面优化的特点,本工艺通过应用7.5l生物反应器和200gfibra-cel片状载体高密度连续罐流培养宿主细胞,连续罐流培养收获流出液即病毒液,病毒颗粒数高达1×1015vp以上。
本发明具有以下优点和效果:本发明集合了目前研究所发现的几乎所有最优化条件和参数,尽可能达到最大收获滴度,该方法同时具有很高的重复性和稳定性,在生产腺病毒产品中具有很好性价比和应用前景,为节约人力物力成本、提高产能打下基础。
说明书附图:
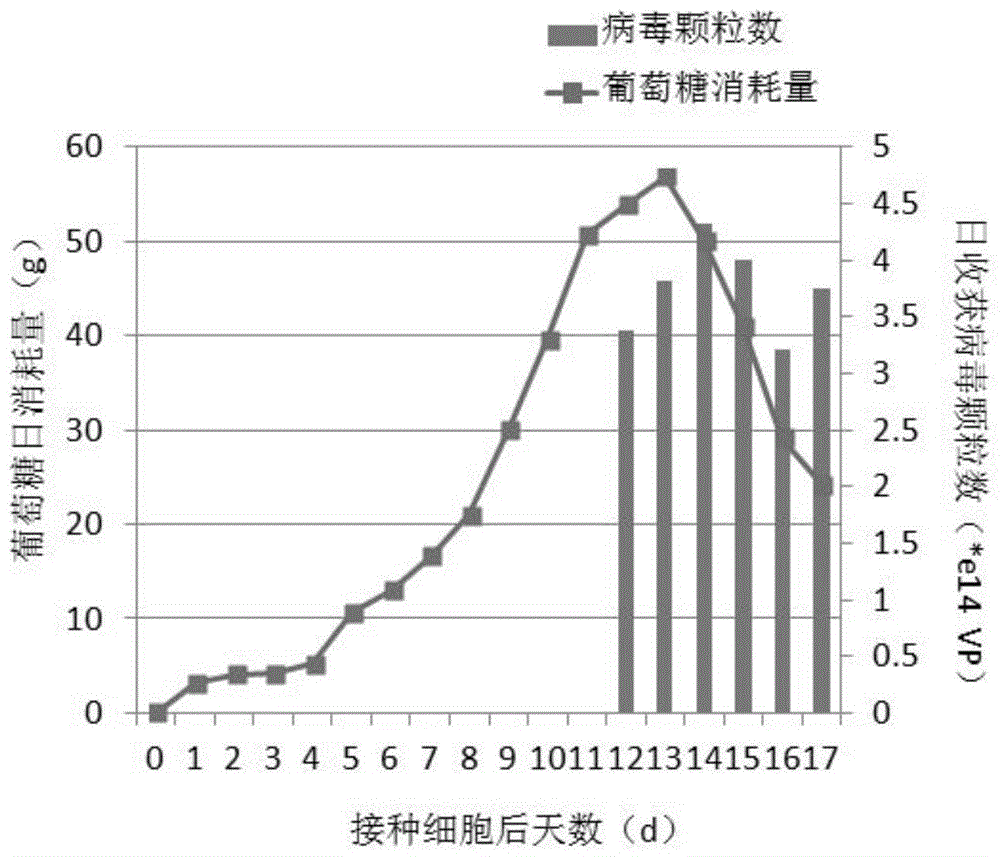
图1是nbsbioflo310反应器葡萄糖消耗和腺病毒颗粒数曲线图。
具体实施方式
实施例1
为使本发明更加容易理解,以下用具体实施方式来解释说明本发明。应理解的是:该实施案例仅用于说明本发明而不是对本发明进行限制,下面实施案例中未提及的具体实验方法,按照常规实验方法进行。
实施案例1
生物反应器:bioflo310反应器(美国nbs公司);
微载体:fibra-cel片状载体(美国nbs公司);
细胞:hek293,购自美国atcc;
病毒:重组5型腺病毒载体携带抗癌基因il-24的溶瘤腺病毒,自行构建;接种moi在30-60之间;
细胞生长液:含体积浓度10%血清(浙江天杭公司)的dmem培养基(美国gibco公司);
病毒感染液:含体积浓度2%血清(浙江天杭公司)的dmem培养基(美国gibco公司);
葡萄糖含量测定方法:用生物过程生化分析仪(深圳西尔曼公司)直接测定;
糖耗计算公式:糖耗=(流进液浓度×流进液体积+原罐内浓度×原罐内体积)—(流出液浓度×流出液体积+现罐内浓度×现罐内体积);
腺病毒颗粒数测定方法:高效液相色谱(hplc)法,仪器型号为waters2695,首先用标准品(自制,批号为20190214)建立标准曲线,计算峰值下面积,用260nm色谱提取数据,并计算260/280比值,样品vp值可以通过标准曲线获得。
细胞种子和病毒种子的培养:细胞复苏后,在flask细胞培养瓶(美国corning公司)进行传代,每两天按1:3传代,直至1个10层工厂(美国corning公司),底面积为6360cm2,消化共得到约2×109个细胞,接种到3个10层细胞工厂,两天后1个10层工厂消化得到约2.0×109个细胞,作为细胞种子;另两个10层工厂用于扩增病毒种子,得到病毒滴度大于1×1012iu;
生物反应器培养细胞:7.5l反应器内加入200gfibra-cel片状载体和ph7.6的磷酸盐缓冲液pbs,灭菌后过夜,弃去pbs后加入细胞生长液4l,接种hek293细胞,接种量约为2×109个细胞,罐流培养。培养参数设定为:ph7.0-7.4、温度37℃、溶氧20-60%、搅拌速度60rpm、将葡萄糖浓度控制在1-2g/l。每天定时取样测定葡萄糖消耗情况,从而控制流进液和流出液的体积,在稳定条件下,葡萄糖消耗与细胞密度线性相关。连续罐流培养9-10天后,日耗糖量可达到40g。具体工艺流程参数见表1,葡萄糖消耗情况见图1。
病毒收获:9-10天后换成病毒感染液,接种病毒,静止感染5-6小时后采用罐流培养方式,将葡萄糖浓度控制在0.5-1.5g/l,48小时后即收获病毒阶段使用无血清培养基,采用罐流培养方式,将葡萄糖浓度控制在0.5-1.5g/l,连续收获5-6天。具体工艺流程参数见表1,vp值测定结果见图1。
表1.生物反应器工艺流程表
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!