定向诱导hiPSC分化为神经细胞体系的HS5条件培养基的制作方法
本申请是申请日为2017年07月28日申请号为201710632172.4、发明创造名称为“定向诱导hipsc分化后的神经细胞体系、诱导方法及应用”的专利申请的分案申请。
本发明属于神经生物学领域,具体涉及定向诱导hipsc分化后的神经细胞体系、诱导方法及应用。
背景技术:
人诱导多能干细胞(humaninducedpluripotentstemcells,hipsc)来源的神经细胞对于细胞移植治疗缺血性脑卒中(以多种不同种系的神经细胞严重缺失为特点)具有显著效应。然而,现有的诱导hipsc细胞分化为神经细胞的操作效率低,稳定性差。
干细胞生物学的最新研究进展为再生医学提供了依据,其中hipsc细胞的定向分化可以为细胞移植治疗缺血性脑卒中(以各种神经元和神经胶质细胞的严重缺损为特性)患者提供了多种人类神经细胞。有效地诱导、纯化和植入人类神经细胞是建立以hipsc细胞为基础的神经细胞疗法所必需的。许多有关高效分化神经细胞的方法草案已被提出。然而,这些方法不足以提供成熟的神经细胞谱系,致使幼稚细胞混杂于其中,导致脑内移植后畸胎瘤的形成。此外,某些方法只能分化产生一个窄谱的神经细胞系,不能满足治疗缺血性脑卒中所需的多种细胞类型。更重要的是,为将hipsc细胞诱导的神经细胞应用于临床,诱导而来的神经系统细胞的分离纯化,以剔除非神经系统细胞及幼稚细胞是非常必要的。因此,建立基于hipsc细胞的神经诱导和纯化系统已被人们期待已久(rov,n.s.;cleren,c.;singh,s.k.;yang,l.;beal,m.f.;goldman,s.a.functionalengraftmentofhumanescell-deriveddopaminergicneuronsenrichedbycoculturewithtelomerase-immortalizedmidbrainastrocytes.nat.med.12:1259–1268;2006;yan,y.p.;yang,d.l.;zarnowska,e.d.;du,z.w.;werbel,b.;valliere,c.;pearce,r.a.;thomson,j.a.;zhang,s.c.directeddifferentiationofdopaminergicneuronalsubtypesfromhumanembryonicstemcells.stemcells23:781–790;2005;gerrard,l.;rodgers,l.;cui,w.differentiationofhumanembryonicstemcellstoneurallineagesinadherentculturebyblockingbonemorphogeneticproteinsignaling.stemcells23:1234–1241;2005;keirstead,h.s.;nistor,g.;bernal,g.;totoiu,m.;cloutier,f.;sharp,k.;steward,o.humanembryonicstemcell-derivedoligodendrocyteprogenitorcelltransplantsremyelinateandrestorelocomotionafterspinalcordinjury.j.neurosci.25:4694–4705;2005.)。
技术实现要素:
本发明所要解决的技术问题是为了克服目前现有技术提供的神经细胞谱系不成熟,致使幼稚细胞混杂于其中导致脑内移植后畸胎瘤形成的不足,提供一种定向诱导hipsc分化为神经细胞体系的方法、制得的神经细胞体系及其应用。本发明的方法诱导人类hipsc细胞定向分化为神经系统细胞,同时抑制非神经系统细胞的生成,从而获得成熟、广谱的神经细胞群。该神经细胞群不仅经过体外验证为具有电冲动发放的成熟神经元,而且这类神经细胞群在小鼠体内实验中也被证实,具有有效的治疗神经系统疾病(如脑卒中、脑损伤)的作用。
本发明解决上述问题的技术方案之一是:一种定向诱导hipsc分化为神经细胞体系的方法,其包括分阶段培养所述hipsc诱导其神经分化,所述阶段包括:
阶段a.共培养所述hipsc与骨髓基质细胞hs5于诱导培养基;
阶段b.用hs5条件培养基、即含有所述hs5的分泌液的诱导培养基连续培养所述hipsc;
阶段c.用培养神经元细胞的基础培养基继续培养所述hipsc。
其中,阶段a中所述的所述诱导培养基为本领域常规的诱导培养基;较佳地,所述诱导培养基包括下述组分:20-25%血清替代品、0.5-1.5mm的谷氨酰胺、8-20ng/ml表皮生长因子、8-12ng/ml脑源性神经营养因子、8-15ng/ml神经营养因子-3、0.5-1.5ng/ml转化生长因子β3、400~700ng/ml头蛋白以及2-3%b27添加剂的dmem/f12培养基,所述百分比为体积百分比。更佳地,为了在干细胞向神经细胞谱系分化的过程中有效地同步促进细胞分化产物的增殖活性,所述诱导培养基还包括1-1.5%非必需氨基酸、8-15ng/ml碱性成纤维细胞生长因子、0.08-0.15mmβ-巯基乙醇以及0.3-0.8mm双丁酰环磷酸腺苷。
进一步更佳地,所述培养基包括下述组分:20%血清替代品、1%非必需氨基酸、1mm的谷氨酰胺、0.1mmβ-巯基乙醇、10ng/ml碱性成纤维细胞生长因子、10ng/ml表皮生长因子、10ng/ml脑源性神经营养因子、10ng/ml神经营养因子-3、1ng/ml转化生长因子β3、0.5mm双丁酰环磷酸腺苷、500ng/ml头蛋白以及2%b27细胞培养添加剂dmem/f12培养基。所述的血清替代品优选为knockouttm血清替代品。
阶段a中所述的共培养可以为直接接触共培养或者非直接接触共培养,较佳地为直接接触共培养。
阶段a中所述的骨髓基质细胞hs5为抑制分裂的hs5;较佳地,所述抑制分裂的方法为照射;更佳地,所述照射的条件为:γ射线辐照强度75-85gy,照射时间为28-35分钟,所述的辐照强度优选为80gy,所述的照射时间优选为30分钟。
阶段a中所述的共培养的时间为本领域常规,较佳地为10-18天,更佳地为2周。
阶段b中所述的连续培养的时间为本领域常规,较佳地为8-18天,更佳地为2周。
阶段c中所述的继续培养的时间为本领域常规,较佳地为10-18天,更佳地为2周。
阶段b中所述的hs5条件培养基的制备方法为1)将5×106~2×107个经照射后的hs5细胞接种到8-15ml所述诱导培养基中;2)连续1~8天收集培养细胞的上清;3)将上清与所述诱导培养基以1:1~8:1比例混合即得;更佳地,所述hs5条件培养基的制备方法为:1)将1×107个经照射后的hs5细胞接种到10ml所述诱导培养基中;2)连续4天收集培养细胞的上清;3)将上清与所述诱导培养基以1:1比例混合即得。
阶段c中所述的基础培养基为添加有:15-30ng/mlbfgf、15-30ng/mlegf、1-3%b27添加剂、8-12μm佛司可林和0.1-0.3mm抗坏血酸的neurobasal培养基;较佳地,为了有效地维系处于分化终末阶段的成熟神经元的存活率,所述基础培养基还包括0.5-1.5%n2添加剂和0.5-1.5%胎牛血清;更佳地,阶段c所述的基础培养基为添加有:20ng/mlbfgf、20ng/mlegf、2%b27添加剂、1%n2添加剂、1%胎牛血清、10μm佛司可林和0.2mm抗坏血酸的neurobasal培养基,所述百分比为体积百分比。
本发明解决上述问题的技术方案之二是:一种上述方法诱导得到的神经细胞体系。较佳地,所述神经细胞体系包括:神经干细胞59.3±1.9%、多种功能性神经元28.2±2.1%、星形胶质细胞9.1±0.8%以及少突胶质细胞4.8±0.6%,所述百分比为占整个神经细胞体系的个数百分比。其中,所述的多功能性神经元细胞包括:多巴胺能神经元5.4±0.4%、乙酰胆碱能神经元9.3±0.6%、γ-氨基丁酸能神经元3.9±0.3%、5-羟色胺能神经元6.5±0.5%以及幼稚神经元3.1±0.4%;所述百分比为占整个神经细胞体系的个数百分比。
本发明解决上述问题的技术方案之三是:一种上述的神经细胞体系在制备脑组织细胞修复制剂中的应用;较佳地,所述制剂为治疗缺血性脑卒中、脑出血或者外伤导致的脑损伤的制剂。
本发明解决上述问题的技术方案之四是:一种初步诱导hipsc分化为神经细胞体系的诱导培养基,所述培养基为包括下述组分:20-25%血清替代品、0.5-1.5mm的谷氨酰胺、8-20ng/ml表皮生长因子、8-12ng/ml脑源性神经营养因子、8-15ng/ml神经营养因子-3、0.5-1.5ng/ml转化生长因子β3、400~700ng/ml头蛋白以及2-3%b27添加剂的dmem/f12培养基,所述百分比为体积百分比;较佳地,所述培养基还包括1-1.5%非必需氨基酸、0.08-0.15mmβ-巯基乙醇、8-15ng/ml碱性成纤维细胞生长因子以及0.3-0.8mm双丁酰环磷酸腺苷。若上述培养基组分的含量低于上述数值范围的下限,则hipsc在分化过程中的存活率很低(分化产物的总存活率低于40%);若高于上述数值范围的上限,则hipsc的分化产物不但存活率低(低于45%),而且hipsc向神经谱系细胞的分化效率亦显著降低(低于24%)。
在本发明一较佳实施例中,所述培养基为包括下述组分:20%血清替代品、1%非必需氨基酸、1mm的谷氨酰胺、0.1mmβ-巯基乙醇、10ng/ml碱性成纤维细胞生长因子、10ng/ml表皮生长因子、10ng/ml脑源性神经营养因子、10ng/ml神经营养因子-3、1ng/ml转化生长因子β3、0.5mm双丁酰环磷酸腺苷、500ng/ml头蛋白以及2%b27细胞培养添加剂的dmem/f12培养基;更佳地,所述血清替代品为knockouttm血清替代品。
本发明解决上述问题的技术方案之五是:一种定向诱导hipsc分化为神经细胞体系的hs5条件培养基,其为含有骨髓基质细胞hs5的分泌液的诱导培养基;所述hs5为经过照射的hs5;所述照射的条件为:γ射线辐照强度75-85gy,照射时间为28-35分钟,所述辐照强度优选为80gy,所述照射时间优选为30分钟;
较佳地,所述hs5条件培养基通过下述制备方法制得:1)将5×106~2×107个经照射后的hs5细胞接种到8-15ml所述诱导培养基中;2)连续1~8天收集培养细胞的上清;3)将所述上清与所述诱导培养基以1:1~8:1比例混合即得。其中,步骤1)中,若细胞数低于5×106个,则细胞接种后、照射前的存活率较低(一般会低于80%),而且产生细胞分泌物的浓度较低;若细胞数高于2×107个,则细胞接种过于拥挤,接受照射后的死亡率较高(可高于50%)。步骤2)中,若收集细胞培养基上清的天数少于1天,则是一种对细胞资源的浪费;若天数高于8天,则因为hs5细胞因照射后逐步死亡而产生较多的炎性因子、凋亡因子,不利于对hipsc的诱导培养。步骤3)中,收集的培养基上清与新鲜配制的诱导培养基的混合比例低于1:1,则混合后含有的hs5细胞分泌物浓度过低,不足以诱导hipsc的神经分化;若混合比例高于8:1,则培养基上清所占比例过高,其内不只是含有有效的诱导成分,亦含有较高浓度的hs5的代谢废物和促凋亡因子,对于hipsc的诱导是弊大于利的。
更佳地,所述hs5条件培养基通过下述制备方法制得:1)将1×107个经照射后的hs5细胞接种到10ml所述的诱导培养基中;2)连续4天收集培养细胞的上清;3)将所述上清与所述诱导培养基以1:1比例混合即得。
本发明解决上述问题的技术方案之六是:一种定向诱导hipsc分化为神经细胞体系中培养神经元细胞的基础培养基,所述的基础培养基为包括:15-30ng/mlbfgf、15-30ng/mlegf、1-3%b27添加剂、8-12μm佛司可林和0.1-0.3mm抗坏血酸的neurobasal培养基。若上述培养基组分的含量低于上述数值范围的下限,则可致hipsc分化而来的成熟神经元的存活率较低(会低于60%);若高于上述数值范围的上限,则可引发成熟神经元发生凋亡而致使其存活率低(可低于50%)。
较佳地,所述基础培养基还包括0.5-1.5%n2添加剂和0.5-1.5%胎牛血清。更佳地,所述的基础培养基为包括20ng/mlbfgf、20ng/mlegf、2%b27添加剂、1%n2添加剂、1%胎牛血清、10μm佛司可林和0.2mm抗坏血酸的neurobasal培养基,所述百分比为体积百分比。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
本发明将骨髓基质细胞(humanbonemarrowstromalcells,bmsc)hs5以及hipsc共培养,可以诱导人类hipsc细胞定向分化为神经系统细胞,同时抑制非神经系统细胞的生成,从而获得成熟、广谱的神经细胞群。该神经细胞群不仅经过体外验证为具有电冲动发放的成熟神经元,而且这类神经细胞群在小鼠体内实验中也被证实,具有有效的治疗神经系统疾病(如脑卒中、脑损伤)的作用。利用该发明中所使用的阶梯式培养方法以及一系列添加物,可以形成规范化、商业化的体外培养流程,从而迎合国内和国际上对于“ips诱导与移植疗法”的临床与科研需求。
附图说明
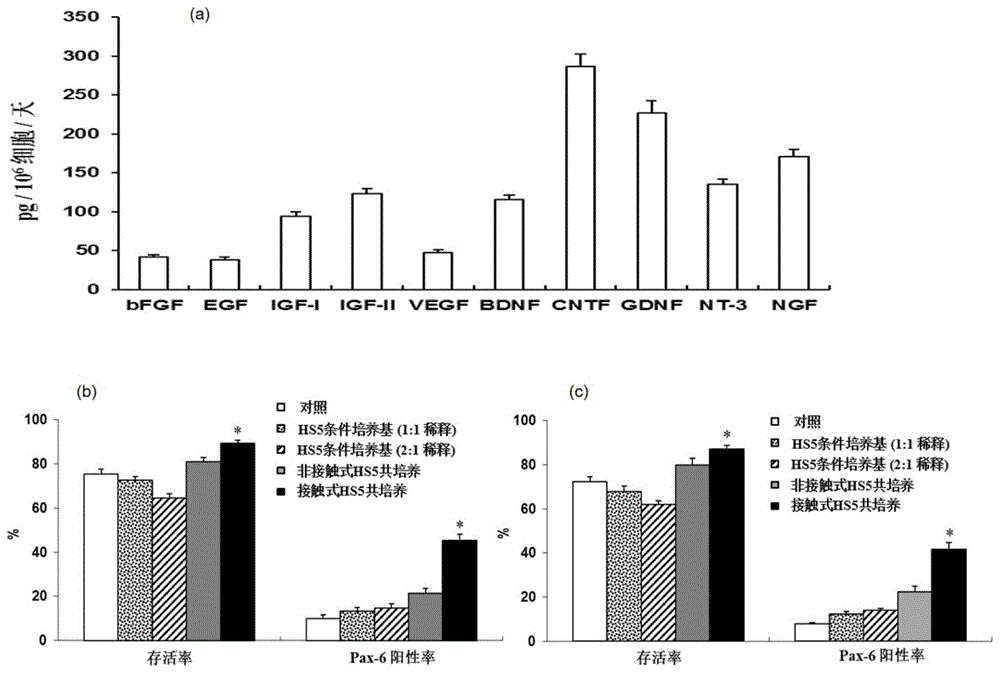
图1为hs5可分泌多种细胞因子(a)。以总体细胞存活率(b;c)及pax-6+(神经系统细胞的早期发育标志物)细胞占比(b;c)为评价指标,hs-5的直接接触式诱导培养对hipsc细胞(b、c分别针对hipsc的两种细胞系,即ips-1、imr90-1)的神经分化是最为有效的。
图2为hs5的接触式诱导培养通过激活hipsc细胞的notch受体来定向诱导hipsc细胞向神经系统细胞分化[*p<0.05vs.对照;▲p<0.05vs.对照或者对应的组(correspondinggroup)+l-685458;#p<0.05vs.对照+l-685458]。
图3为hipsc细胞在不同时间点分化出的pax-6+(神经系统细胞早期分化标志物)细胞占比的动态变化,以及处于未分化状态的hipsc细胞(ssea-4+)占比的动态变化。
图4为将hipsc来源的神经细胞(供体细胞)移植入沙鼠模型后8周,在宿主脑实质内展示了广泛的迁移能力。(a)移植后8周,供体细胞沿着注射针道扩散、迁移到周围的纹状体实质内,表明供体细胞可以耐受缺血性中风动物的机体内环境。灰线已大致标示出供体细胞的针道范围。(b)供体细胞在移植后8周,向周围脑实质扩散、迁移的情况。荧光染色所用抗体为小鼠抗人细胞核抗体(hun,1:100;chemicon)。免疫荧光染色阳性(绿色)细胞核即为供体细胞的细胞核。类似地,在受体动物的皮层、胼胝体、海马区同样发现了供体细胞的存在。(c)受体动物(沙鼠)的海马。(d-f)在受体动物的海马内存在供体细胞。荧光染色所用抗体为小鼠抗人细胞核抗体(hun,1:100;chemicon)。免疫荧光染色阳性(绿色)细胞核即为供体细胞的细胞核。显示在对照组(仅为生理盐水注射;d),海马内无供体细胞;在人骨髓基质细胞(hmsc;e)注射组,宿主海马内的阳性细胞数量较少;而在hipsc来源的神经细胞注射组(f),宿主海马内的供体细胞较多。
图5逆转录pcr实验结果。显示干性/未分化状态相关基因oct-4、alp表达逐渐消逝,在第二阶段末的共培养组中表达彻底消失;而神经前体细胞标志物nestin、musashi-1的表达逐渐增强;在第三阶段末,较成熟的神经细胞亚型,包括神经胶质细胞的标志物gfap、处于有丝分裂后期的成熟神经细胞标志物map-2、nurr-1,显示强表达状态。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
字母缩写:
hipsc:humaninducedpluripotentstemcell人类诱导多潜能干细胞
mef:mouseembryonicfibroblasts小鼠胚胎成纤维细胞
ksr:knockoutserumreplacement血清替代物
bfgf:basicfibroblastgrowthfactor碱性成纤维细胞生长因子
egf:epidermalgrowthfactor表皮生长因子
neaa:non-essentialaminoacids非必需氨基酸
bdnf:brain-derivedneurotrophicfactor脑源性神经营养因子
nt-3:neurotrophin-3神经营养因子-3
gfap:glialfibrillaryacidicprotein胶质原纤维酸性蛋白
map-2:microtubule-associatedprotein2微管相关蛋白2
nurr-1:nuclearreceptorrelatedprotein-1核受体相关蛋白1
oct-4:octamerbindingtranscriptionfactor4八聚体结合转录因子4
alp:alkalinephosphatase碱性磷酸酶
另,本发明中未特别说明的百分比(%)一般为体积百分比。
实验方法:
1、表达载体的构建
人notch1分子的细胞内活化型结构域(notchintracellulardomain,nicd),经pubmed检索,为genbanknm_017617中第1759-2444位的氨基酸序列,通过聚合酶链反应(polymerasechainreaction,pcr)进行扩增。特异性引物(上游5'-cgcggatccatgcgcaagcgccggcggcagcat-3';下游5'-acgtctagacacgtctgcctggctcgg-3')。pcr产物(2058bp)经bamhi/xbai酶切位点酶切后,插入到哺乳动物表达载体pcdna3.1(invitrogen)中,构建pcdna3.1/notch1(pcnicd)表达载体。细胞以2×104/cm2接种于6孔板中(0.5ml培养基/cm2),培养24小时后转染。用g418以250μg/ml的剂量筛选转染细胞约2–4周,直到单个克隆出现。
2、逆转录pcr
逆转录后获得的cdna第一条链进行特定基因序列的扩增。用sybrgreen法进行荧光定量pcr扩增反应(appliedbiosystems,fostercity,ca,usa)。应用比较ct法,对照组与实验组呈现出显著的倍数差异,具体如图2所示。
3、电生理分析
室温下,用axopatch-200b放大器(axoninstrumentsinc.,fostercity,ca,usa)进行细胞电压记录。膜片钳附带的吸管内含有120mm的葡萄糖酸钾,20mmkcl,10mmnacl,10mmegta,1mmcacl2,2mmmg-atp,0.3mmna-gtp以及10mmhepes/koh(ph7.2,280mosmol/kg),带有约3–5ω的电阻。在记录膜电位之前确保电流为0pa。
4、多巴胺释放试验
3阶段培养结束后,先用低浓度kcl溶液(4.7nm)冲洗细胞,然后用2ml高浓度kcl溶液(60mmkcl,85mmnacl,2.5mmcacl2,1.2mmmgso4,1.2mmkh2po4,11mmd-glucose,and20mmhepes/naoh;ph7.4)孵育15分钟。用高效液相色谱法(hplc)(htec500,eicomcorp.,sandiego,ca,usa)测定多巴胺浓度。
5、免疫印迹分析
总蛋白(20μg)经12%sds-page电泳、转膜后(millipore,billerica,ma,usa)滴加抗体。一抗分别是,兔抗nicd(1:1000;cellsignalingtechnology,beverly,ma,usa),兔抗hes1(hes1;1:500;chemicon,temecula,ca,usa),兔抗hes5(1:500;chemicon)和鼠抗α-tubulin抗体(1:2000;chemicon)。二抗是hrp(辣根过氧化物酶)标记的羊抗兔或羊抗鼠igg或igm(1:2000;millipore),利用图象软件量化条带强度(bio-rad,hercules,ca,usa)。
6、脑手术
动物实验符合美国国立卫生研究院的相关规定,并获得地方政府批准。成年雄性蒙古沙鼠(年龄12-13周,体重60–80克)经2%氟烷麻醉后暴露双侧颈总动脉,用动脉瘤夹闭塞5分钟后释放(ridenourtretal.brainres.1991;565(1):116-122)。对照组沙鼠施行无双侧动脉闭塞的假手术操作。
7、细胞移植
脑手术后3天,向沙鼠脑相应区域注入神经细胞(2.5×105个细胞/5μl生理盐水,即,将2.5×105个细胞悬浮于5μl生理盐水后,移植于受体脑的单侧;每只动物脑接受左、右单侧共计2次的移植),(5×105个/全脑;注射点位于前囟前0.5mm,中线外侧2mm和硬脑膜腹侧4mm),对照组沙鼠对应部位注入等量生理盐水。人骨髓间充质干细胞(humanmesenchymalstromalcells,hmsc)作为细胞对照。健康人骨髓穿刺采集操作经过区域伦理审查委员会批准并授予知情同意书。简要操作为,用1073μg/ml密度梯度分离液(gehealthcare,piscataway,nj,usa)收集单核细胞,以1.6×105/cm2的密度铺种于培养皿,培养基为添加有10%fbs,1%neaaand1mml-谷氨酰胺的低糖型dmem培养液。培养一段时间后,按同种方法、同样剂量将hmsc细胞悬液注入到沙鼠脑内。环孢霉素a(novartis,basel,switzerland)以10mg/kg/day剂量采用腹腔注射法注入到沙鼠体内。
8、行为分析
morris水迷宫实验(harvardapparatus,holliston,ma,usa)用来评估模型动物的空间认知能力。移植术后六周,对动物进行为期13天的训练,每天4次,在第14天进行正式的行为评估,同时进行空间探索实验。简而言之,在第14天,拆除水面下预设的动物休息平台,让动物在水迷宫中停留60秒。记录60秒内沙鼠穿越原平台位置的次数,同时记录沙鼠滞留于原平台所在的象限区域内的时间。
9、酶免疫测定
从离体脑组织中分离海马,加入缓冲液(20mmtris-hcl,137mmnacl,1mmdtt,0.5%tritonx-100and0.5mmpmsf;ph8.0)进行匀浆,4℃,14,000g离心30分钟。按照说明使用检测试剂盒(quantikinehs;r&dsystems)对碱性成纤维细胞生长因子进行定量测定。
10、组织学分析
离体脑组织沿冠状面作厚5μm的冰冻切片。在连续切片过程中以每第五张切片内的免疫反应阳性的细胞数计量供体细胞的数量,最后经abercrombieformula公式校正。另外,前囟与后囟之间约2-2.2mm的组织经连续切片后以0.2%硫素染色后拍照,显微镜下每帧图像以1mm×0.25mm维度的标尺框架进行测量、计数。海马ca1区中完整锥体神经元(细胞核大,核仁明显和细胞膜清晰)按照先前描述的方法进行计数。依据之前描述的标准对海马ca1区的细胞进行分级:0级,固缩的ca1锥体神经元占比<框架内细胞总数的10%;ⅰ级,固缩ca1锥体神经元占框架内细胞总数10%–40%;ⅱ级,固缩细胞占40%–70%;ⅲ级:固缩细胞占比≥70%。
11、免疫细胞化学
小鼠抗β-微管蛋白iii抗体(tuj1,1:500;sigma),小鼠抗o4抗体(1:50;chemicon),小鼠抗阶段特异性胚胎抗原-4抗体(ssea-4,1:100;santacruzbiotechnology,santacruz,ca,usa),小鼠抗pax-6抗体(1:100;santacruzbiotechnology);兔抗-nestin抗体(1:400;chemicon),兔抗胶质纤维酸性蛋白抗体(gfap,1:400;chemicon),兔抗突触素ⅰ抗体(1:500;chemicon),兔抗酪氨酸羟化酶抗体(th,1:100;chemicon),兔抗γ-氨基丁酸抗体(gaba,1:200;sigma),兔抗胆碱乙酰转移酶抗体(chat,1:200;sigma),兔抗5-羟色胺抗体(1:100;sigma)应用于细胞;而鼠抗人线粒体抗体(hmito,1:40;sigma),鼠抗人细胞核抗体(hun,1:100;chemicon),鼠抗人神经细胞粘附分子抗体(hncam,1:100;santacruzbiotechnology)应用于组织切片。细胞和切片用异硫氰酸荧光素(fitc)或四甲基异硫氰酸罗丹明(tritc)-标记的山羊抗鼠或抗兔igg或igm(1:100;millipore)或用生物素化的山羊抗鼠igg(1:100;vector,burlingame,ca,usa;)进行进一步的孵育。随后添加streptavidin-hrp(链霉亲和素-辣根过氧化物酶)并用二氨基联苯胺进行可视化免疫反应。冲洗细胞或切片,10μg/ml碘化丙啶(pi;sigma)或4',6-二脒基-2-苯基吲哚(dapi;sigma)进行复染色。
12、统计分析
数据均用平均值±标准误表示。snk检验和t检验进行两两比较分析,nemenyi检验进行海马锥体细胞层的组织学分级分析。应用spss17软件系统(spssinc.,chicago,il,usa),p值<0.05被认为有统计学意义。
实施例1骨髓基质细胞系hs5与hipsc细胞共培养体系的建立
利用人骨髓基质细胞系hs5(humanbonemarrowstromalcellline,crl-11882tm,americantypeculturecollection(atcc),manassas,va,usa)诱导hipsc细胞神经分化,诱导培养基的组成为:20%ksr、1%neaa、1mm的谷氨酰胺、0.1mmβ-巯基乙醇、10ng/mlbfgf、10ng/mlegf、10ng/mlbdnf、10ng/mlnt-3、2%b27、0.5mm双丁酰环磷酸腺苷、1ng/ml转化生长因子β3(上述组分均购自invitrogen)和500ng/ml头蛋白(noggin)(r&dsystems,明尼阿波利斯,明尼苏达州,美国)。其中,neaa、bfgf、β-巯基乙醇以及双丁酰环磷酸腺苷的添加是为了在干细胞向神经细胞谱系分化的过程中能有效地同步促进细胞分化产物的增殖活性;b27是一种无血清添加剂(主要含有维生素a、多种抗氧化剂及胰岛素),用于海马神经元和其他中枢神经系统神经元的生长和保持其短期或长期活性。b27添加剂是50×浓缩的液体,使用时需进行1:50稀释。
直接共培养细胞体系的建立,在与hipsc细胞共培养之前,hs5经照射(γ射线辐照(γ-irradiation)强度80gy作用于1×106个hs5细胞;时间30分钟;设备为gammacell1000elite214,mdsnordion,ottawa,ontario,canada)后以2×105个/孔,接种到6孔板上培养一天。
非直接接触共培养细胞体系的建立,在与hipsc细胞共培养之前,hs5细胞经照射后,以2×105个/嵌入槽,接种到组织培养嵌入槽中(thincerts,弗里肯豪森,德国),之后嵌套于6孔板中。准备hs5条件培养基(hs5-cm),1×107个hs5细胞经照射后接种到含有10ml上述诱导培养基的培养皿中。每天收集培养基上清,连续收集4天。使用前,收集的hs5-cm分别以1:1的比例(等体积新鲜配制的诱导培养基与hs5-cm按照等比例混合)稀释。hipsc细胞以2×105个/孔,接种于预涂有matrigel(dmem/f12培养液按照1:50的比例来稀释matrigel)的6孔板中。如果为抑制notch通路的实验,在培养第一天时即加入4μml-685458(notch信号通路抑制剂(购自calbiochemsandiego,ca,usa),孵育8天。
图1a显示,hs5可分泌多种细胞因子。利用上述两种不同的方法诱导分化8天后,比较神经前体细胞的细胞存活率和pax-6阳性率。结果显示,应用直接接触共培养方法诱导分化8天后,细胞存活率和pax-6阳性率分别为89.3±1.4%和45.2±2.8%,优于非接触共培养法(图1b)。应用hipsc细胞的另一个种系imr90-1细胞进行诱导分化,结果相同(图1c)。以上结果表明,基于hs5(humanbonemarrowstromalcellline,crl-11882tm,atcc,manassas,va,usa)的神经诱导分化方法中,直接共培养法较其他方法而言,更有利于促进神经前体细胞增殖分化。
实施例2hipsc细胞神经分化的三阶段培养
第一阶段:将hipsc细胞与hs5细胞以直接共培养方式诱导培养2周,诱导培养基的组成同实施例1,在六孔板中,hipsc细胞以2×105个/孔直接接种于1天前预铺的2×105个/孔hs5细胞层之上;对于平行对照组,hipsc细胞不是与hs5细胞共培养,而是直接接种于经matrigel涂布的6孔板内,之后用同样方法进行第2、3阶段培养。隔天换液一次。
第二阶段:用1:1稀释的hs5-cm培养基连续培养2周;hs5-cm培养基的配制:1×107个hs5细胞经照射后接种到含有10mlhipsc诱导培养基的培养皿中,每天收集废液,连续收集4天得hs5-cm培养基。使用前,收集的hs5-cm以1:1的比例稀释后应用(新鲜配制的hipsc诱导培养基与hs5-cm按照等体积比例混合)。
第三阶段:第二阶段培养结束后,细胞经酶解后以2×105个/孔,接种于预先涂布聚鸟氨酸和层粘连蛋白的6孔板内,之后进行第3阶段选择培养。用添加有20ng/mlbfgf、20ng/mlegf、2%b27、1%n2添加剂、1%fbs(invitrogen)、10μm佛司可林(forskolin,calbiochem,sandiego,ca,usa,亦名:毛喉素;系“腺苷酸环化酶激活剂”)和0.2mm抗坏血酸(sigma,st.louis,mo,usa)的neurobasal培养基(invitrogen)中培养2周。其中,n2添加剂和fbs的添加是为了能更有效地维系处于分化终末阶段的成熟神经元的存活率。
实施例3直接接触共培养激活hipsc细胞中的notch信号通路
鉴于notch配体delta1、delta3、jagged1和jagged2均可利用实验方法中“逆转录pcr”的方法轻易在hs5细胞中检测到(图2a),而在hipsc细胞及其衍生物中又可以检测到notch相应受体notch1、notch2和notch3(图2b),推测notch信号通路是hs5和hipsc细胞相互作用的媒介。nicd蛋白经γ-分泌酶作用后,与notch受体解离,且靶向作用于下游分子hes1和hes5。诱导分化8天后,利用实验方法中的“免疫印迹分析”方法检测各组hipsc衍生细胞中nicd蛋白的表达水平。结果显示,直接接触共培养组显著高于非接触共培养组和对照组(图2c-d),表明直接接触共培养方法能够显著激活hipsc细胞衍生物中的notch信号通路。值得注意的是,非接触共培养同样可以提高nicd、hes1、hes5的表达水平,尽管程度非常小。这表明hs5可能分泌一种对notch信号通路具有激活作用的可溶性分子。
与对照组非直接接触共培养相比,直接接触共培养8天后,hipsc衍生细胞中神经外胚层相关基因如sox-1、pax-6和nfh的表达水平明显增加,而内胚层,中胚层和干细胞相关基因表达降低(图2)。这些数据表明,hs5直接接触共培养可以促进hipsc细胞向神经细胞分化并同时阻断其向非神经细胞方向分化。随后,本发明进一步测试notch信号是否是hs5介导的神经诱导分化所必不可少的。添加notch信号通路抑制剂l-685458连续培养8天后,检测发现nicd、hes1、hes5在hs5共培养细胞中的表达水平明显降低,其中nicd和hes5减少后的水平与对照组使用l-685458的表达水平无明显差别(图2c-d),表明l-685458可以完全阻断notch通路的激活和活化。但是l-685458对hes1表达水平的影响较小(图2c-d),这进一步证实了hes1的表达不仅仅依赖于notch信号通路。此外,加入l-685458后,hs5直接接触共培养促进sox-1,pax-6和nfh表达的作用减弱,相反,非神经标记物的表达因脱抑制而增加(图2e),这表明notch信号通路在hs5介导的hipsc细胞神经诱导分化中起着举足轻重的作用。l-685458降低了实验组和对照组中pax-6阳性细胞的表达率,但是对细胞活力无明显影响(图2f,g)。另一方面,与只转染载体(pcdna3.1)的对照组相比较,转染有pcnicd(构建方法见实验方法)的ips-1细胞,培养8天后,pax-6阳性细胞明显增加(图2h),具有向神经细胞分化的倾向。这说明nicd,作为notch信号通路的效应因子,可以推动hipsc细胞向神经细胞分化。所有的数据表明,notch信号的活化可能是,至少部分是,直接共培养方法促进hipsc细胞向神经细胞谱系分化所必需的因素。
实施例4hipsc细胞来源的神经细胞体系的组成鉴定
hs5诱导培养后,pax-6表达阳性的神经前体细胞在第二阶段的连续培养中迅速增加,甚至在培养末期阳性率达到87.2±1.9%,与此同时,ssea-4阳性的未分化细胞数目逐渐减少直至到零(图3),rt-pcr反转录进行cdna合成,反应条件为42℃50min,95℃5min,再置于4℃环境储存。然后利用pcr扩增cdna中的目的基因。pcr基本反应条件为:(1)cdna预变性:94℃5min;(2)pcr扩增:94℃30sec,60℃30sec,72℃45sec,进行30次循环;(3)最后延伸阶段:72℃7min。引物序列参见表1。
表1用于反转录pcr的引物序列及目的基因长度
分析进一步证实(图5),干性基因转录因子oct-4和碱性磷酸酶(alp)在第二阶段末期未被检测到,而神经前体细胞标记物nestin和musashi-1表达明显增加。紧接着,在第三阶段培养末期发现了较为成熟(在第三阶段末,较成熟的神经细胞亚型,包括神经胶质细胞的标志物gfap、处于有丝分裂后期的成熟神经元标志物map-2以及多巴胺能神经元标志物nurr-1,显示强表达状态;见图5)的神经细胞亚型,包括tuj1阳性的神经元(28.2±2.1%),gfap阳性的星形胶质细胞(9.1±0.8%)和o4阳性的少突胶质细胞(4.8±0.6%)(图3),与此同时,pax-6阳性的神经前体细胞数逐渐减少到59.3±1.9%(图3),这表明,第三个阶段培养有利于神经前体细胞的规范化生长和成熟。与上述结果相一致,神经细胞亚型特异性基因的转录因子,包括星形胶质细胞的标志物gfap,有丝分裂后期神经元的标志物map-2和多巴胺能神经元标记物nurr-l,均可在第3阶段培养期检测到,而与中胚层(c-kit,sox-9和pparγ)和内胚层发育相关基因(afp,葡萄糖转运蛋白-2和淀粉酶)的表达均未检测到,这进一步证实了3阶段培养法不支持非神经细胞的生长。
特别注意的是,一些ssea-4阳性的hipsc细胞经诱导后逐渐转变为圆柱状,最终形成由pax-6阳性的神经前体细胞和tuj1阳性的神经元构成的管状花环结构,并在第2阶段自发分散成小团块,之后进一步向成熟的表型分化,正如在第3阶段大量涌现的tuj1阳性神经元中突触素ⅰ表达明显增加,这预示着突触的形成。同时,在这些细胞种群中,也检测到多巴胺亚型(th+)、gaba(gaba+)、胆碱(chat+)和5-羟色胺(serotonin+)阳性表达的神经元,对应的细胞占比(占总体细胞产物总量的百分比)分别为5.4±0.4%,3.9±0.3%,9.3±0.6%和6.5±0.5%。此外,在每一个培养阶段,hipsc衍生细胞的总数明显高于平行对照组,这表明基于hs5诱导分化的方法具有促进细胞生长的效应,其与hs5细胞中多种生长因子的检测结果相一致。最后,利用“电生理分析”以及“多巴胺释放试验”的方法:经高浓度k+去极化刺激,可探测到神经元的动作电位,利用高效液相色谱法可检测到每106个细胞会释放8.6±0.6pmol乙酰胆碱和72.5±6.2pmol多巴胺(n=12),这说明经过3阶段培养法产生的神经细胞是具有功能的。同时,rt-pcr分析显示中胚层,内胚层和多能性标记物在完成三阶段培养后逐步丧失表达,而对照组中c-kit、sox-9和afp蛋白持续表达。与对照组相比,3阶段培养法在诱导生成tuj1阳性的神经元,gfap阳性的星形胶质细胞和o4阳性的少突胶质细胞方面具有明显优势。
通过相应抗体检测不同神经系统细胞的标志物(参见下列文献:barberit,klivenyip,calingasanny,leeh,kawamatah,loonamk,perrieral,brusesj,rubiome,topfn,tabarv,harrisonnl,bealmf,moorema,studerl.neuralsubtypespecificationoffertilizationandnucleartransferembryonicstemcellsandapplicationinparkinsonianmice.natbiotechnol.2003;21(10):1200-1207;fongsp,tsangks,chanab,lug,poonws,lik,baumlw,nghk.trophismofneuralprogenitorcellstoembryonicstemcells:neuralinductionandtransplantationinamouseischemicstrokemodel.jneuroscires.2007;85(9):1851-1862.):小鼠anti-pax-6抗体(1:100;santacruzbiotechnology)、兔anti-nestin抗体(1:400;chemicon)分别检测神经干细胞的标志物pax-6、nestin,广谱的神经元、多巴胺能神经元、γ-氨基丁酸能神经元、胆碱能神经元、5-羟色胺能神经元、星形胶质细胞以及少突胶质细胞的标记物分别为β-微管蛋白、酪氨酸羟化酶、γ-氨基丁酸、胆碱乙酰转移酶、5-羟色胺、胶质纤维酸性蛋白和o4,相对应的抗体分别为小鼠anti-β-微管蛋白iii抗体(tuj1,1:500;sigma)、兔anti-酪氨酸羟化酶抗体(th,1:100;chemicon)、兔anti-γ-氨基丁酸抗体(gaba,1:200;sigma)、兔anti-胆碱乙酰转移酶抗体(chat,1:200;sigma)、兔anti-5-羟色胺抗体(1:100;sigma)、兔anti-胶质纤维酸性蛋白抗体(gfap,1:400;chemicon)以及小鼠anti-o4抗体(1:50;chemicon),上述抗体应用于细胞后(抗体赋予1~2小时)后,随后用异硫氰酸荧光素(fitc)或四甲基异硫氰酸罗丹明(tritc)-标记的山羊抗鼠或抗兔igg或igm(1:100;millipore)进行进一步的反应。冲洗细胞,用10μg/ml碘化丙啶(pi;sigma)或4',6-二脒基-2-苯基吲哚(dapi;sigma)进行复染色。检测结果显示:诱导得到的神经系统细胞包括固定比例的神经干细胞59.3±1.9%、多种功能性神经元28.2±2.1%(其中多巴胺能神经元5.4±0.4%、乙酰胆碱能神经元9.3±0.6%、γ-氨基丁酸能神经元3.9±0.3%、5-羟色胺能神经元6.5±0.5%以及幼稚神经元3.1±0.4%)、星形胶质细胞9.1±0.8%以及少突胶质细胞4.8±0.6%(详见实验方法中的“免疫细胞化学”方法)。
综上,三阶段培养法可以诱导生成一个多层次的神经细胞谱系,同时限制非神经细胞衍生物的生成。
效果实施例1诱导的神经细胞脑内移植可以改善脑卒中动物的认知功能
海马是脑缺血再灌注后较易受到损伤的部位之一。沙鼠脑缺血实验操作12小时后,硫素染色显示在海马ca1区存在广泛的细胞固缩和坏死(假手术对照组与脑卒中组12h后两组对比,每0.25mm2ca1区中完整的锥体神经元计数分别为218.6±9.5和121.3±8.9,p<0.0001)。随着时间的推移,ca1区内形态完整的锥体神经元(细胞核大,核仁清晰且细胞边缘完整)数目在脑手术后3天内持续降低(卒中手术后第1天与第3天每0.25mm2ca1区中完整的神经元数分别为,77.5±5.1和39.2±3.5,p<00.001)。在之后的时间窗(沙鼠脑卒中的手术操作后5天),锥体神经元的数量不再显著减少(第3天和第5天每0.25mm2ca1区中完整的锥体神经元数目分别为39.2±3.5和31.8±3.2,p=0.43)。脑卒中手术3天后,将三阶段诱导培养产生的5×105个(2.5×105/侧×2侧)神经细胞移植到缺血卒中沙鼠双侧尾壳核中,此时海马ca1区82.3±1.2%的锥体神经元广泛缺失。脑卒中造模手术前能够在150±4s内到达morris水迷宫逃生平台的沙鼠被用来做体内实验研究。脑卒中手术后,92.3%的沙鼠能够继续存活,并伴有嗜睡,昏迷,缺乏运动等现象。移植术后六周,未发现死亡沙鼠,也没有出现异常行为或进行性运动障碍,这说明经hipsc细胞分化的神经细胞脑内移植对沙鼠没有明显的不良反应。同时,14天的行为学评估发现经过脑内神经细胞移植的动物在水迷宫中停留的时间相较于hmsc移植组和生理盐水注射组逐步减少,证实经过脑内神经细胞移植的动物其学习与记忆能力强于hmsc移植组和生理盐水注射组。
在第14天行为学评估实验(即移植后56天,详见实验方法中的“行为分析”)显示,神经细胞移植组沙鼠到达逃生平台的时间(47.4±3.1s)明显少于生理盐水对照组(165.8±7.4s,p<0.0001)和hmsc移植组(96.7±6.6s,p<0.0001)。神经细胞移植组(47.4±3.1s)与假手术对照组(39.2±2.8s,p=0.282)之间在到达逃生平台的时间这一指标上无明显差异。150厘米直线路径实验显示各组沙鼠之间的游泳速度类似,由此说明沙鼠在水迷宫中找到逃生平台所花费的时间长短,学习与记忆等认知能力起着关键性作用。此外,在空间探索试验中,还发现神经细胞移植组沙鼠穿越原逃生平台所在位置的次数明显多于生理盐水对照组和hmsc移植组。在测量沙鼠在原逃生平台所在目标象限滞留时间长短时也出现同样的结果(即神经细胞移植组沙鼠在原逃生平台所在目标象限滞留的时间最长)。综上所述,植入由hipsc细胞分化而来的神经细胞有助于改善缺血性脑卒中动物的空间学习和记忆能力,且效果明显优于hmsc移植。
效果实施例2细胞脑内移植促进受损海马的恢复
脑移植8周后跟踪沙鼠脑内的植入细胞,结果如图4所示:在尾壳核中发现了大量的供体细胞,并且扩散迁移到周围的纹状体组织,这表明供体细胞可以耐受缺血性损伤动物的机体内环境。在皮层、胼胝体、海马区同样发现了供体细胞的存在。实验中并未发现脑内出血,小胶质细胞浸润或畸胎瘤的形成。脑缺血神经细胞移植组沙鼠海马ca1区内完整锥体神经元数量(190.6±11.1/0.25mm2ca1区)明显高于非nsc移植组(生理盐水对照组:68.8±4.1/0.25mm2ca1区,p<0.0001;hmsc移植组:143.2±6.5/0.25mm2ca1区,p=0.0002)。神经细胞移植组(190.6±11.1/0.25mm2ca1区)与假手术组(212.3±10.3/0.25mm2ca1区,p=0.075)海马ca1区锥体神经元的密度相类似。与此同时,在脑缺血经神经细胞移植的沙鼠海马区发现了hncam+细胞(humanneuralcelladhesionmolecule,用于探测沙鼠脑中的人类神经细胞),说明供体细胞具有活跃的迁移归巢活性。这些hncam+细胞位于海马内原始的锥体细胞层,其细胞形态类似完整的锥体神经元,表明hipsc细胞分化的神经细胞可以通过进一步分化和迁移直接参与损伤海马的结构重建。同样的,hun免疫染色(hun,humannucleus,亦用于探测沙鼠脑内的人类神经细胞)显示,神经细胞移植组海马ca1区供体细胞的数量(10.4±0.7/0.25mm2ca1区)明显高于hmsc移植组(3.2±0.4/0.25mm2ca1区,p<0.0001),这意味着hipsc细胞分化的神经细胞脑内移植,相对于hmsc移植,更有利于促进受损海马的结构重建与锥体神经元数量的恢复。在脑缺血生理盐水对照组海马区内同样检测到少量的内源性再生(ca1区内的神经元数由8周前的39.2±3.5/0.25mm2增长到68.8±4.1/0.25mm2,p<0.01),这表明自发性内源性再生促使ca1区神经元产生了轻微的增长,尽管如此,与假手术组正常海马相比,脑缺血生理盐水对照组海马ca1区神经元的损失(66.3±2.3%)依然显著。
另一方面,与脑缺血生理盐水对照组相比,移植8周后,神经细胞移植组ca1区的神经元多出了约121.9±8.9/0.25mm2。然而,组织学分析显示,海马ca1区只有约10.4±0.7/0.25mm2个神经元hun染色阳性,这表明外源性供体细胞主要通过促内源性再生机制来促进海马ca1区细胞结构的重建。鉴于脑室内碱性成纤维细胞生长因子不仅可以刺激内源性祖细胞的增殖,同时还可以促进其向神经细胞方向分化,推测供体细胞所产生的祖细胞募集效应可能与碱性成纤维细胞生长因子的旁分泌有关。为了检验这种猜测,本发明测量了移植术8周后沙鼠海马组织内碱性成纤维细胞生长因子的含量水平。结果表明,神经细胞移植组碱性成纤维细胞生长因子水平(195.8±11.8pg/mg蛋白)显著高于生理盐水对照组(133.2±8.9pg/mg蛋白,p<0.0001)和hmsc移植组(157.5±9.4pg/mg蛋白,p=0.006),这表明碱性成纤维细胞生长因子由供体细胞分泌后,通过旁分泌机制促进了海马内源性再生的调控过程。同样的,组织学分级分析显示,与脑缺血生理盐水对照组、hmsc移植组相比,神经细胞移植组海马区锥体层细胞结构受损程度较小、恢复较快。综上所述,hipsc细胞来源的神经细胞在移植后,一方面通过迁移、归巢行为整合至缺血受损的不同脑区;另一方面通过促内源性再生机制促进脑缺血动物受损海马的重建,进而改善其认知功能。
- 还没有人留言评论。精彩留言会获得点赞!