一种从胎盘中获取母体来源间充质干细胞的方法与流程
本申请涉及间充质干细胞制备
技术领域:
,特别是涉及一种从胎盘中获取母体来源间充质干细胞的方法。
背景技术:
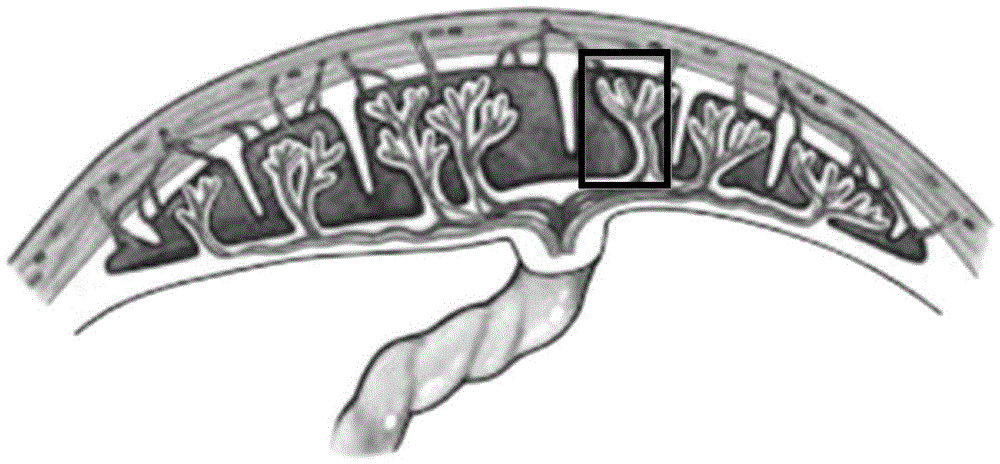
:间充质干细胞(mesenchymalstemcell,msc)是一群中胚层来源的具有自我更新和多向分化潜能的多能干细胞。最初由friedenstein等从鼠的造血器官中发现,且证明其在体外可以分化为成骨细胞和脂肪细胞。研究显示,间充质干细胞广泛存在于骨髓、脐带胎盘、脂肪等组织当中。胎盘是胎儿与母体之间物质交换的重要器官,是人类妊娠期间由胚胎胚膜和母体子宫内膜联合长成的母子间组织结合器官。胎盘中含有丰富的间充质干细胞,但是由于胎盘是母体和新生儿组织共同形成,因此,其中含有两种不同来源的间充质干细胞,即胎儿来源的间充质干细胞和母体来源的间充质干细胞。在临床应用中使用混合多人的细胞是具有极大风险的。目前,从胎盘中获取较高纯度母体来源间充质干细胞的方法是,从底蜕膜中分离出母体的间充质干细胞。这种方法的不足是,底蜕膜中获得的母体来源间充质干细胞数量非常少;而且底蜕膜和羊膜一起在分娩时会发生破碎断裂,很容易遗失,导致细胞来源丧失,无法获得母体来源间充质干细胞。因此,如何从底蜕膜以外的胎盘中制备或分离母体来源间充质干细胞,是本领域的研究重点和难点之一。技术实现要素:本申请的目的是提供一种新的从胎盘中获取母体来源间充质干细胞的方法。本申请具体采用了以下技术方案:本申请公开了一种从胎盘中获取母体来源间充质干细胞的方法,包括从胎盘距离脐带半径5cm内,且距离胎儿面0.5cm以上的位置处获取胎盘组织;采用酶消化液对胎盘组织进行酶消化处理,然后对酶消化处理的产物进行细胞培养,获得本申请的母体来源间充质干细胞。需要说明的是,本申请创造性的从底蜕膜以外的其它胎盘组织中获取母体来源间充质干细胞,解决了底蜕膜获取母体来源间充质干细胞数量少,且底蜕膜容易遗失的问题;为胎盘中制备或分离母体来源间充质干细胞提供了一种新的方案和途径。还需要说明的是,本申请所取的胎盘组织,其大小没有限制,只要是取自本申请限定的位置范围的胎盘组织,即可培养获取数量可观的母体来源间充质干细胞;相对于等量的底蜕膜而言,本申请可以获得更多的母体来源间充质干细胞,并且,不会出现类似底蜕膜的遗失问题。可以理解,本申请的关键之一是研究发现本申请特别限定的胎盘组织可以获取母体来源间充质干细胞;至于后续的胎盘组织清洗、剪切、酶消化、细胞获取、间充质干细胞培养等都可以参考现有的从组织中制备间充质干细胞的方法,在此不作具体限定。但是,为了提高本申请的母体来源间充质干细胞的纯度,本申请对后续步骤,特别是酶消化处理获取细胞的步骤进行了详细说明,详见以下技术方案。优选的,本申请的方法还包括剔除胎盘组织中的直接连通到胎儿面的血管或者白色结缔组织。需要说明的是,本申请所取的胎盘组织,其中部分可能含有直接连通到胎儿面的血管或者白色结缔组织,为了避免这些血管或者白色结缔组织影响母体来源间充质干细胞的纯度,本申请优选的技术方案中对其进行了剔除。可以理解,如果所取的胎盘组织本身没有这些血管或者白色结缔组织,则不用该步骤。优选的,酶消化液中含有胶原酶、透明质酸酶、中性蛋白酶和木瓜蛋白酶。需要说明的是,本申请研究发现,采用本申请限定的特殊的由多种酶复合的酶消化液进行酶消化处理,可以进一步提高所制备的母体来源间充质干细胞的纯度,减小新生儿细胞干扰,对临床应用具有重要意义。可以理解,如果对母体来源间充质干细胞的纯度要求较低,也可以采用其它的酶消化处理方案或者采用其它方式获取细胞,在此不作具体限定。优选的,酶消化液由胶原酶、透明质酸酶、中性蛋白酶和木瓜蛋白酶溶解于pbs溶液中制备而成。其中,pbs溶液即试验室常规使用的磷酸盐缓冲液。优选的,酶消化液中,胶原酶的浓度为质量分数0.3%-0.5%,透明质酸酶的浓度为质量分数0.1%-0.3%,中性蛋白酶的浓度为100-300u/ml,木瓜蛋白酶的浓度为质量分数0.03%-0.09%。优选的,本申请的方法中,酶消化处理具体包括,每克胎盘组织至少加入3ml酶消化液,37℃恒温震荡消化至少20分钟;然后,去除酶消化液,再加入新鲜的酶消化液,37℃恒温震荡消化至少40分钟。需要说明的是,本申请采用两次消化法对胎盘组织块进行消化。由于胎盘组织采样过程中可能会混入非常少量的杂质,例如表面残留的血管组织等,因此在第一次短暂的预消化后,去除消化液中含有的杂质细胞,此时绝大部分的母体来源间充质干细胞仍然在胎盘组织块中,然后再次对胎盘组织块进行消化,使得母体来源间充质干细胞从组织块中消化下来。本申请的两次消化法能够提高所获得的母体来源间充质干细胞的纯度。优选的,去除酶消化液的方式为,采用孔径50-100μm的细胞筛网将组织块捞出,弃去剩余液体。需要说明的是,本申请采用的细胞筛网,原则上只要能够将组织块捞出即可,50-100μm孔径只是本申请的一种实现方式中具体采用的细胞筛网。优选的,本申请的从胎盘中获取母体来源间充质干细胞的方法,具体包括以下步骤;1)取胎盘距离脐带半径5cm内,且距离胎儿面0.5cm以上的胎盘组织,并剔除所取胎盘组织中的直接连通到胎儿面的血管或者白色结缔组织;2)采用生理盐水清洗去除步骤1)获得的胎盘组织中的血块、毛细血管组织;3)将步骤2)清洗后的胎盘组织剪碎,并采用酶消化液进行酶消化处理;4)酶消化处理完成后,去除碎块,离心去除上清液;5)采用干细胞培养基重悬步骤4)离心获得的沉淀,并转移至培养瓶中进行培养;6)采用胰酶消化步骤5)的培养产物,消化下来的细胞即母体来源间充质干细胞。优选的,步骤4)中,去除碎块,具体包括,采用孔径50-100μm的细胞筛网将组织块捞出,然后对液体进行离心,收集沉淀细胞。优选的,步骤4)还包括,对捞出的组织块进行步骤3)的酶消化处理,然后再将混合物过孔径50-100μm的细胞筛网,对滤液进行离心,收集沉淀细胞。需要说明的是,对捞出的组织块进行步骤3)的酶消化处理,其目的是尽量多的从组织块中获取细胞,避免浪费;当然,原则上,在本申请的一种实现方式中,步骤3)已经进行两次酶消化处理的情况下,组织块中的大部分细胞已经被消化下来,如果考虑时间成本和生产效率,也可以不必要在步骤4)再对捞出的组织块进行步骤3)的酶消化处理。优选的,步骤5)中,重悬步骤4)离心沉淀产物加入的干细胞培养基量为,每克胎盘组织对应加入至少10ml干细胞培养基。优选的,步骤5)中,转移至培养瓶中进行培养,具体包括,在37℃、5%浓度co2的条件下恒温培养24-48小时,然后弃去上清液和残留组织,再加入新鲜干细胞培养基,在相同条件下继续培养至细胞汇合度达到80%-90%。优选的,本申请的方法还包括在步骤6)之前,采用生理盐水对步骤5)的培养产物进行至少一次清洗,然后再进行胰酶消化。优选的,步骤6)中,采用胰酶消化步骤5)的培养产物,具体包括,向步骤5)的培养产物中加入胰酶,室温消化至少2min;然后加入三倍胰酶体积的干细胞培养基,终止消化;混合物离心,弃上清液,获得细胞沉淀;采用生理盐水重悬细胞沉淀,然后再离心弃上清液;采用干细胞培养基重悬,即获得本申请的母体来源间充质干细胞。本申请的有益效果在于:本申请从胎盘中获取母体来源间充质干细胞的方法,解决了从胎盘中分离母体来源间充质干细胞的技术难题,所制备的母体来源间充质干细胞数量大、纯度高、不容易混杂新生儿细胞,能够满足临床应用需求;本申请的方法,解决了底蜕膜获取母体来源间充质干细胞数量少和底蜕膜容易遗失的问题,为从胎盘中获取母体来源间充质干细胞提供了一种新的方案和途径。附图说明图1是本申请实施例中胎盘组织的取材部位横截面示意图;图2是本申请实施例对分娩胎盘的母亲外周血str分型鉴定的部分结果图;图3是本申请实施例对试验1收获间充质干细胞的str分型鉴定的部分结果图;图4是本申请实施例对试验2收获间充质干细胞的str分型鉴定的部分结果图;图5是本申请实施例对试验3收获间充质干细胞的str分型鉴定的部分结果图;图6是本申请实施例试验1所得细胞流式检测表面标志物cd73的结果图;图7是本申请实施例试验1所得细胞流式检测表面标志物cd90的结果图;图8是本申请实施例试验1所得细胞流式检测表面标志物cd105的结果图;图9是本申请实施例试验1细胞流式检测表面标志物阴性指标的结果图;图10是本申请实施例试验2所得细胞流式检测表面标志物cd73的结果图;图11是本申请实施例试验2所得细胞流式检测表面标志物cd90的结果图;图12是本申请实施例试验2细胞流式检测表面标志物cd105的结果图;图13是本申请实施例试验2细胞流式检测表面标志物阴性指标的结果图;图14是本申请实施例试验3所得细胞流式检测表面标志物cd73的结果图;图15是本申请实施例试验3所得细胞流式检测表面标志物cd90的结果图;图16是本申请实施例试验3细胞流式检测表面标志物cd105的结果图;图17是本申请实施例试验3细胞流式检测表面标志物阴性指标的结果图。具体实施方式目前,除了从胎盘的底蜕膜中能够分离出纯度较高的母体来源的间充质干细胞以外,尚未有其他技术能够从胎盘的其余部分分离出母体来源的间充质干细胞。也就是说,现有的技术方案都是通过酶消化法从胎盘的底蜕膜中分离出母体来源的间充质干细胞,而胎盘的其他部分则不行。虽然胎盘的其它部分含有大量的间充质干细胞,但是,这些间充质干细胞大部分都是母体和新生儿细胞的混合,要准确的区分开胎盘当中的母体和新生儿的细胞,是一件非常重要且艰难的技术;目前尚没有有效的方案可以从底蜕膜以外的其它胎盘部分获得能够满足使用需求的母体来源的间充质干细胞。本申请研究发现,胎盘中,除了底蜕膜可以获取母体来源间充质干细胞以外,胎盘距离脐带半径5cm内、且距离胎儿面0.5cm以上的胎盘组织同样可以获得母体来源间充质干细胞;特别是配合本申请改进的酶消化液和酶消化处理,能够获得较高纯度的母体来源间充质干细胞,能够满足临床应用需求;并且,相对于等量的底蜕膜,本申请能够获得数量大、纯度高的母体来源间充质干细胞,解决了底蜕膜获取母体来源间充质干细胞数量小和底蜕膜容易遗失的问题。下面通过具体实施例对本申请作进一步详细说明。以下实施例仅对本申请进行进一步说明,不应理解为对本申请的限制。实施例一、主要试剂和材料干细胞培养基购自stempro,氯化钠注射液购自贵州天地,50ml离心管、t75培养瓶和t175培养瓶购自corning,胶原酶、透明质酸酶、中性蛋白酶和木瓜蛋白酶购自gibco。复合酶消化液:将胶原酶、透明质酸酶、中性蛋白酶和木瓜蛋白酶溶于pbs溶液中,制成复合酶消化液;并且,复合酶消化液中胶原酶的浓度为质量分数0.4%,透明质酸酶的浓度为质量分数0.1%,中性蛋白酶的浓度为200u/ml,木瓜蛋白酶的浓度为质量分数0.05%。对照酶消化液:将胶原酶溶于pbs溶液中,制成对照酶消化液,其中,胶原酶的浓度为质量分数0.5%。二、间充质干细胞制备本例采用同一个胎盘,按照不同的部位取材制备间充质干细胞。本例的胎盘由广东祈福医院提供。具体制备方法如下:试验11)打开装有胎盘的样本采集袋,用剪刀剪取胎盘距离脐带半径5cm的圆圈内,且距离胎儿面0.5cm以上的胎盘组织;取材部位如图1所示,图1为取材部位横截面示意图,其中,上表面为母体表面,下表面为胎儿面,黑色方框位置即取材部位。2)用组织镊夹住组织,尽量去除母体面富含的毛细血管组织,留下含有间质组织的部分,分离完毕后将组织放入培养皿中,采用生理盐水,本例具体采用的是氯化钠注射液,荡洗去除残血,重复采用氯化钠注射液清洗,直至清洗液澄清;3)将清洗后的绒毛丛取3g装入50ml离心管中,用手术剪将组织进一步剪碎至1-3mm3大小;4)向剪碎的组织块的离心管中加入10ml配制好的复合酶消化液,即胶原酶、透明质酸酶、中性蛋白酶和木瓜蛋白酶溶于pbs溶液中制成复合酶消化液,盖上离心管盖,上下颠倒混匀后放入恒温震荡仪中,设定温度37℃,转速190rpm,消化20分钟;5)步骤4)消化完成后,将离心管中的内容物过孔径50μm的细胞筛网,弃去滤液,将细胞筛网上的物质放入50ml离心管中,再加入10ml复合酶消化液,继续消化40分钟;6)步骤5)消化完成后,向盛有消化后组织悬液的离心管中加入30ml的pbs溶液,混匀;然后,将混合物过50μm的细胞筛网,去除碎块,将滤液收集起来,800g离心5min,去除上清液;7)步骤6)的离心沉淀中加入30ml干细胞培养基,用移液管吹打重悬沉淀,然后转移到1个t75培养瓶中,置于二氧化碳培养箱中进行培养,参数设定为温度37℃,二氧化碳浓度5%,相对湿度95%,以下培养条件都相同;8)培养24小时后,用移液管吸出培养瓶中的培养基弃去,然后加入30ml干细胞培养基,放回二氧化碳培养箱中,继续培养;9)待细胞生长到汇合度达到80%-90%的时候,将培养瓶中的培养基倒出,用移液管加入10ml氯化钠注射液,轻轻震摇荡洗,然后倒出,重复采用10ml氯化钠注射液荡洗,共清洗2次;10)向培养瓶加入2ml胰酶消化2分钟,轻轻拍打培养瓶底部使细胞脱落,左右摇晃数次混合均匀;11)加入6ml的干细胞培养基终止消化,将全部培养瓶内的细胞悬液吸出至50ml离心管中,500g、20℃离心5分钟,离心后,弃去上清液,得细胞沉淀;12)向细胞沉淀中加入15ml氯化钠注射液,重悬细胞沉淀,设置参数500g、20℃离心5分钟,离心后,倾倒上清液,得细胞沉淀;13)向细胞沉淀的离心管中加入10ml干细胞完全培养基,用移液管轻轻吹打混匀,得培养基细胞悬液;14)按照8000个/cm2的密度将步骤13)的细胞悬液加入到t175培养瓶中,加入干细胞培养基定容至25ml,将培养瓶放入二氧化碳培养箱中进行培养,参数设定为温度37℃,二氧化碳浓度5%,相对湿度95%;15)待细胞生长到汇合度达到80%-90%时,按照步骤9-12收获细胞;16)将收获的细胞检测流式,并根据《法庭科学dna实验室检验规范》(ga/t383-2002)标准检测str分型以确定收获的细胞的基因分型。同时,采用相同的方法对分娩该胎盘的产妇的血液进行str分型检测,以确定胎盘母系的基因分型。试验2本试验采用试验1中获取的胎盘组织,采用不同的酶消化液进行酶消化处理,制备本试验的间充质干细胞。具体如下:1)将清洗后的绒毛丛取3g装入50ml离心管中,用手术剪将组织进一步剪碎至1-3mm3大小;该“清洗后的绒毛丛”与试验1中步骤3)的“清洗后的绒毛丛”相同;2)向含有组织块的离心管中加入10ml配制好的对照酶消化液,即胶原酶溶于pbs溶液中制成的对照酶消化液,盖上离心管盖,上下颠倒混匀后放入恒温震荡仪中,设定温度37℃,转速190rpm,消化60分钟;3)步骤2)消化完成后,向盛有消化后组织悬液的离心管中加入30ml的pbs溶液,混匀;然后,将混合物过50μm的细胞筛网,去除碎块,将滤液收集起来,800g离心5min,去除上清液;4)步骤3)的离心沉淀中加入30ml干细胞培养基,用移液管吹打重悬沉淀,然后转移到1个t75培养瓶中,置于二氧化碳培养箱中进行培养,参数设定为温度37℃,二氧化碳浓度5%,相对湿度95%,以下培养条件都相同;5)培养24小时后,用移液管吸出培养瓶中的培养基弃去,然后加入30ml干细胞培养基,放回二氧化碳培养箱中,继续培养;6)待细胞生长到汇合度达到80%-90%的时候,将培养瓶中的培养基倒出,用移液管加入10ml氯化钠注射液,轻轻震摇荡洗,然后倒出,重复采用10ml氯化钠注射液荡洗,共清洗2次;7)向培养瓶加入2ml胰酶消化2分钟,轻轻拍打培养瓶底部使细胞脱落,左右摇晃数次混合均匀;8)加入6ml的培养基终止消化,将全部培养瓶内的细胞悬液吸出至50ml离心管中,500g、20℃离心5分钟,离心后,弃去上清液,得细胞沉淀;9)向细胞沉淀中加入15ml氯化钠注射液,重悬细胞沉淀,设置参数500g、20℃离心5分钟,离心后,倾倒上清液,得细胞沉淀;10)向细胞沉淀的离心管中加入10ml干细胞完全培养基,用移液管轻轻吹打混匀,得培养基细胞悬液;11)按照8000个/cm2的密度将步骤10)的细胞悬液加入到t175培养瓶中,加入干细胞培养基定容至25ml,将培养瓶放入二氧化碳培养箱中进行培养,参数设定为温度37℃,二氧化碳浓度5%,相对湿度95%;12)待细胞生长到汇合度达到80%-90%时,按照步骤6-9收获细胞;将收获的细胞检测流式,并根据《法庭科学dna实验室检验规范》(ga/t383-2002)标准检测str分型以确定收获的细胞的基因分型。试验31)采用试验1相同的胎盘样本,用剪刀剪取试样1标记的距离脐带半径5cm的圆圈外,且靠近胎儿面的胎盘组织;2)用组织镊夹住组织,尽量去除富含的毛细血管组织,留下含有间质组织的部分,分离完毕后将组织放入培养皿中,采用生理盐水,本例具体采用的是氯化钠注射液,荡洗去除残血,重复采用氯化钠注射液清洗,直至清洗液澄清;3)将清洗后的绒毛丛取3g装入50ml离心管中,用手术剪将组织进一步剪碎至1-3mm3大小;4)向剪碎的组织块的离心管中加入10ml配制好的复合酶消化液,即胶原酶、透明质酸酶、中性蛋白酶和木瓜蛋白酶溶于pbs溶液中制成复合酶消化液,盖上离心管盖,上下颠倒混匀后放入恒温震荡仪中,设定温度37℃,转速190rpm,消化20分钟;5)步骤4)消化完成后,将离心管中的内容物过孔径50μm的细胞筛网,弃去滤液,将细胞筛网上的组织放入50ml离心管中,再加入10ml复合酶消化液,继续消化40分钟;6)步骤5)消化完成后,向盛有消化后组织悬液的离心管中加入30ml的pbs溶液,混匀;然后,将混合物过50μm的细胞筛网,去除碎块,将滤液收集起来,800g离心5min,去除上清液;7)步骤6)的离心沉淀中加入30ml干细胞培养基,用移液管吹打重悬沉淀,然后转移到1个t75培养瓶中,置于二氧化碳培养箱中进行培养,参数设定为温度37℃,二氧化碳浓度5%,相对湿度95%,以下培养条件都相同;8)培养24小时后,用移液管吸出培养瓶中的培养基弃去,然后加入30ml干细胞培养基,放回二氧化碳培养箱中,继续培养;9)待细胞生长到汇合度达到80%-90%的时候,将培养瓶中的培养基倒出,用移液管加入10ml氯化钠注射液,轻轻震摇荡洗,然后倒出,重复采用10ml氯化钠注射液荡洗,共清洗2次;10)向培养瓶加入2ml胰酶消化2分钟,轻轻拍打培养瓶底部使细胞脱落,左右摇晃数次混合均匀;11)加入6ml的干细胞培养基终止消化,将全部培养瓶内的细胞悬液吸出至50ml离心管中,500g、20℃离心5分钟,离心后,弃去上清液,得细胞沉淀;12)向细胞沉淀中加入15ml氯化钠注射液,重悬细胞沉淀,设置参数500g、20℃离心5分钟,离心后,倾倒上清液,得细胞沉淀;13)向细胞沉淀的离心管中加入10ml干细胞完全培养基,用移液管轻轻吹打混匀,得培养基细胞悬液;14)按照8000个/cm2的密度将步骤13)的细胞悬液加入到t175培养瓶中,加入干细胞培养基定容至25ml,将培养瓶放入二氧化碳培养箱中进行培养,参数设定为温度37℃,二氧化碳浓度5%,相对湿度95%;15)待细胞生长到汇合度达到80%-90%时,按照步骤9-12收获细胞;将收获的细胞检测流式,并根据《法庭科学dna实验室检验规范》(ga/t383-2002)标准检测str分型以确定收获的细胞的基因分型。三、结果及分析1.细胞的流式检定结果本例对试验1、试验2和试验3收获的间充质干细胞进行流式细胞仪检测,结果如表1、图6至图17所示。表1三个试验用不同方法获得的细胞的流式检定结果表面标志物cd73cd90cd105阴性指标试验199.80%99.68%99.73%1.21%试验299.78%99.60%99.72%1.15%试验399.76%99.60%99.46%1.54%图6为试验1所得细胞流式检测表面标志物cd73的结果图,图7为试验1所得细胞流式检测表面标志物cd90的结果图,图8为试验1所得细胞流式检测表面标志物cd105的结果图,图9为试验1所得细胞流式检测表面标志物阴性指标的结果图,图10为试验2所得细胞流式检测表面标志物cd73的结果图,图11为试验2所得细胞流式检测表面标志物cd90的结果图,图12为试验2所得细胞流式检测表面标志物cd105的结果图,图13为试验2所得细胞流式检测表面标志物阴性指标的结果图,图14为试验3所得细胞流式检测表面标志物cd73的结果图,图15为试验3所得细胞流式检测表面标志物cd90的结果图,图16为试验3所得细胞流式检测表面标志物cd105的结果图,图17为试验3所得细胞流式检测表面标志物阴性指标的结果图。表1、图6至图17所示的结果显示,试验1、试验2和试验3获得的间充质干细胞的表面标志物全都合格;说明三种方式都能够有效的获得间充质干细胞。2.str分型检测结果本例对试验1、试验2和试验3收获的间充质干细胞进行了str分型检测,同时,对分娩该胎盘的产妇的血液也进行str分型检测,检测结果如图2至图5所示。图2为对分娩胎盘的母亲外周血str分型鉴定的结果,图3为对试验1收获的间充质干细胞的str分型鉴定结果,图4为对试验2收获的间充质干细胞的str分型鉴定结果,图5为对试验3收获的间充质干细胞的str分型鉴定结果。对比图2和图3的结果可见,两个结果图基因座表型相同,表明两者为同一人,说明试验1中获得的间充质干细胞来源自胎盘母体,即获得了高纯度的母体来源间充质干细胞。图4的结果显示,部分位点有三个峰,表明该份样本中混杂有第二个人的dna,即为胎儿细胞混杂在母亲细胞中所致,说明试验2获得的间充质干细胞包括来自于母体的细胞和来自于胎儿的细胞。图5的结果显示,部分位点有三个峰,表明该份样本中混杂有第二个人的dna,即为胎儿细胞混杂在母亲细胞中所致,说明试验3获得的间充质干细胞同样包括来自于母体的细胞和来自于胎儿的细胞。对比分析以上结果可以看出,采用本例的取材部位,即胎盘距离脐带半径5cm内,且距离胎儿面0.5cm以上的胎盘组织,结合本例特殊的复合酶消化液和酶消化处理,可以获得高纯度的母体来源间充质干细胞,即试验1。试验2与试验1的取材部位相同,但是,由于采用的酶消化液和酶消化处理具体条件不同,会导致一定的新生儿细胞混杂,影响母体来源间充质干细胞的纯度。试验3虽然采用了试验1相同的复合酶消化液和酶消化处理;但是,试验3的取材位置不正确,无法分离获得母体来源间充质干细胞,所获得的间充质干细胞中同时含有母体来源细胞和新生儿细胞。以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属
技术领域:
的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1