一种人羊膜上皮干细胞的分离方法和制备方法与流程
本发明属于生物技术领域,具体涉及一种人羊膜上皮干细胞的分离、制备、无血清培养方法及其产物。
背景技术:
羊膜是胎盘的最内层,位于胎儿绒毛膜的表面,是与发育中的胎儿联系紧密的胚胎发育早期产物,也是母体与胎儿间进行物质交换的重要组织。羊膜为半透明的薄膜,有韧性,无神经、血管和淋巴管,包裹着羊水和胎儿,提供胚胎生长发育的环境。其厚度仅为0.02~0.5mm,由上皮层、基底层和基质层(结缔组织层)组成。羊膜的基质层与绒毛膜之间有一层海绵层,由稀疏、松散和并排结合的胶原纤维组成。由于人羊膜和绒毛膜连接很松散,这为从胎盘上分离羊膜提供了有利条件。人羊膜主要分5层:①上皮层,大部分为单层立方上皮,有合成、分泌和沉积基底膜和细胞外间质成分的能力。②基底膜,由狭窄的无细胞网状纤维构成,厚度不一,含i型胶原纤维网,层粘连蛋白和硫肝糖蛋白。③致密层,薄而致密,无细胞,由网织纤维组成。④纤维母细胞层,是羊膜厚度的主要组成部分,由疏松纤维母细胞和网状纤维构成。⑤海绵层,由波浪状网织纤维构成。其中上皮层即为复层上皮细胞。羊膜上皮面高度褶皱,整张羊膜展开可达2m2,含大约2亿个细胞。
羊膜是一种临床使用历史较为悠久的生物医学材料,早在一百多年前就作为一种敷料应用于外科,上世纪初作为一种供体材料应用于外科皮肤移植手术中,1940年roth用羊膜修补损伤的结膜,kim和tseng在1995年把保存的羊膜运用于兔角膜重建术中并取得成功后,人们开始对羊膜的生物学特性有了一个全新的、深入的认识。羊膜移植可用于多种疾病或损伤的治疗,如皮肤烧伤、皮肤溃疡和眼表疾病等。
干细胞(stemcells)是一类具有自我更新能力(self-renewing)的多潜能细胞,在一定条件下,它可以分化成多种功能细胞。干细胞的分类有两种方法,一是根据干细胞所处的发育阶段分为胚胎干细胞(embryonicstemcells,escs)和成体干细胞(somaticstemcell,sscs)。第二种分类方法是根据干细胞的发育潜能分为三类:全能干细胞(totipotentstemcells,tscs)、亚全能干细胞(pluripotentstemcells,pscs)、多能干细胞(multipotentstemcells,mscs)和单能干细胞(unipotentstemcells,uscs)。
羊膜形成于原肠胚之前的受精第8天,与胚胎干细胞具有同一发育组织来源,由内细胞团发育而来,故保留有多能干性。羊膜细胞保持有前原肠胚胚胎细胞的可塑性,羊膜组织主要由来源于外胚层的羊膜上皮和来源于中胚层的羊膜间充质细胞两类细胞组成。人羊膜上皮干细胞具有类似于胚胎干细胞的向内胚层、中胚层和外胚层三种胚原基层细胞分化的潜能,是一种亚全能干细胞(pluripotentstemcells,pscs)。
干细胞有着巨大的医学应用前景,但要将其成功地用于临床实践,必须解决的首要问题是细胞来源问题、医学伦理问题、移植排斥反应和致瘤性等问题。人羊膜上皮干细胞来源于新生儿产后废弃物羊膜,容易大量获得细胞,易于质量控制,不会带来伦理学问题。人羊膜上皮干细胞具有干细胞旁分泌功能,能够分泌多种神经营养因子、神经递质和生长因子,可促进神经细胞生长,对于神经损伤修复具有较好疗效。人羊膜上皮干细胞的端粒酶活性较弱,自身增殖能力非常有限,因此无致瘤性。人羊膜上皮干细胞不表达hla-ⅱ类抗原,无法启动抗原提呈反应,因此不会引发免疫排斥反应。该类细胞还能分泌表达多种抗炎症因子和相关蛋白,具有治疗炎症、纤维化的潜能;其分泌的免疫抑制因子则对自身免疫性疾病具有较好的疗效。此外,与传统的羊膜移植不同的是,单层人羊膜上皮干细胞可制成干细胞制剂,可经局部注射或静脉输注等方式移植入人体,大大增加了疾病治疗的适用范围。因此,人羊膜上皮干细胞将成为干细胞治疗领域非常重要的一类细胞来源,是再生医疗、细胞治疗和组织工程理想的种子细胞。
目前分离和培养人羊膜上皮干细胞的方法不尽相同,效果也大相径庭。分离方法有用胶原酶和胰酶混合消化法、胶原酶、胰酶和dna酶混合消化法等,培养方法也包括有血清培养和无血清培养等不同方法。胶原酶的使用容易导致羊膜间充质干细胞污染,降低人羊膜上皮干细胞的纯度,且胶原酶和dna酶的价格都比较昂贵。
目前学者大多采用含fbs的有血清培养液体系来进行人羊膜上皮干细胞的培养和冻存,然而,血清的使用会带来动物源性病原体污染和引发免疫排斥反应等问题,因此不能保证其临床应用安全性。
虽然市场上有很多商品化的干细胞专用无血清培养基,但绝大多数的干细胞无血清培养基都是针对间充质干细胞、神经干细胞、胚胎干细胞和诱导多能干细胞(inducedpluripotentstemcells,ipscells)而开发的。与间充质干细胞、神经干细胞、胚胎干细胞和ips细胞不一样的是,人羊膜上皮干细胞的无血清培养体系和工艺还很不成熟,也没有商品化的人羊膜上皮干细胞专用无血清培养基。目前,虽然有少数研究报道采用无血清无动物源体系培养人羊膜上皮干细胞,如澳大利亚莫纳什医学研究所建立的临床级的人羊膜上皮干细胞培养制备体系中采用的是无血清无动物源的人表皮角质形成细胞和人角膜上皮细胞专用培养基epilife(参考文献amnionepithelialcellisolationandcharacterizationforclinicaluse.currprotocstemcellbiol.2010;chapter1:unit1e.6.和isolation,cryopreservationandcultureofhumanamnionepithelialcellsforclinicalapplications.jvisexp.2014;(94):52085.),但是这两篇研究报道中的epilife对人羊膜上皮干细胞的培养效果很不理想,细胞贴壁率极低(即使在使用包被试剂的情况下),细胞增殖能力差(仅为有血清体系的25%左右),因此性能良好的支持人羊膜上皮干细胞贴壁和增殖的无血清培养体系尚有待建立。
因此,本领域迫切需要提供新的增值能力好、培养效果佳的人羊膜上皮干细胞的分离和制备方法。
技术实现要素:
为了解决现有的人羊膜上皮干细胞分离方法对羊膜上皮细胞的破坏,以及细胞内残留动物血清引发的动物源性病原体污染、异种蛋白排斥反应的技术问题,本发明提供了一种人羊膜上皮干细胞的分离方法,利用所述分离方法得到的人羊膜上皮干细胞以及一种源自羊膜组织的干细胞的制备方法。
申请人发现,本发明所述分离方法无需剪切羊膜组织,所得羊膜上皮细胞完整性更强,而且源自羊膜组织的干细胞制备方法中使用无血清无动物源培养基,避免了由于干细胞中残存血清造成的动物源性病原体污染和异种蛋白反应,从而完成了本发明。
为解决上述技术问题,本发明第一方面提供一种人羊膜上皮干细胞的分离方法,该分离方法包括以下步骤:
(1)使用重组胰蛋白酶预处理羊膜组织,去除重组胰蛋白酶,得到预处理的羊膜组织;
(2)使用重组胰蛋白酶消化步骤(1)所得预处理的羊膜组织,收集消化液;
(3)在步骤(2)所得消化液中加入消化终止剂,将所得消化液过滤,离心,弃去上清收集沉淀细胞,即得。其中步骤(1)为使用1×tryple预处理羊膜组织,去除1×tryple,得到预处理的羊膜组织。
其中所述的1×tryple为本领域常规市售重组胰蛋白酶(厂家:gibco)。所述预处理的时间较佳地为10~50分钟,更佳地为20~40分钟,优选地为30分钟。所述预处理的温度较佳地为本领域常规预处理温度,更佳地为37℃。
其中所述的羊膜组织为本领域常规的羊膜组织,更佳地为人羊膜组织。所述羊膜组织采集对象为孕39周内行剖宫产的产妇,产妇健康,无急慢性传染病、无家族遗传病、无乙型肝炎病毒、丙型肝炎病毒、艾滋病病毒、人类嗜t细胞病毒、疱疹病毒、巨细胞病毒、梅毒螺旋体和支原体等病原体。较佳地,所述羊膜是在未经剪碎的情况下进行消化的。
其中步骤(2)为使用tryple消化步骤(1)所得预处理的羊膜组织,收集消化液。
其中所述的tryple为本领域常规市售重组胰蛋白酶。本发明中,trypleselect简称为tryple。
其中所述tryple的浓度较佳地为2×~10×,更佳地为4×~6×,优选地为5×,其中所述tryple浓度为将10×tryple进行不同比例稀释后所得到的酶浓度。所述消化的时间较佳地为50~90分钟,更佳地为60~80分钟,优选地为70分钟。所述消化的温度为本领域常规的酶消化温度,更佳地为37℃。
所述的消化较佳地还包括振荡步骤,所述振荡的速度较佳地为50~200rpm,更佳地为100rpm。
步骤(3)为在步骤(2)所得消化液中加入消化终止剂,将所得消化液过滤,离心,弃去上清收集沉淀细胞,即得。
其中所述的消化终止剂为本领域常规消化终止剂,较佳地包括:含10%fbs的dmem/f-12以及含血小板裂解物(hpl,helios公司)、b27supplement(b27,gibco公司)、ctsb27supplement(ctsb27,gibco公司)的dmem/f-12中的一种或多种,优选地为含10%hpl的dmem/f-12。
其中所述离心力较佳地为300g~800g,更佳地为650g,所述离心的温度较佳地为20~25℃,更佳地为22℃,所述离心的时间较佳地为5~10分钟,更佳地为5分钟。
本发明的一个较佳实施例为:采用胎盘羊膜为原材料制备上皮细胞。制备方法较佳地包括以下步骤:选取孕39周内剖宫产分娩的胎盘,剥离羊膜,置于运输液中4℃运输,12小时内抵达gmp细胞制备车间。pbs反复洗涤将羊膜中的血块去除干净,置于1×tryple消化液中预消化30min,去除预消化液;将羊膜置于5×tryple消化液中于37℃消化70min,收集消化液并终止消化,100目不锈钢筛网过滤得细胞悬液,离心去上清,保留细胞沉淀,即分离得到人羊膜上皮干细胞。分离得到的人羊膜上皮干细胞可扩增培养、即时使用或冷冻保存。
其中所述的无血清保存液包括但不限于cellvationtmcryopreservationmedium(美国mpbio)、cryoscarlessdmso-free(日本bioverde)、cryostorcs10(美国biolife)。
与部分研究者采用的胶原酶消化法、胶原酶和胰酶混合消化法下相比,本发明单纯胰酶消化法分离获得的人羊膜上皮干细胞高丰度表达上皮细胞标志物cd326,低表达间质细胞标志物cd90、cd105,表明本发明的分离方法获得的细胞为高纯度的上皮性质的羊膜干细胞,而不夹杂间质来源的羊膜细胞污染,因此是一种高纯度的人羊膜上皮干细胞。
本发明分离获得所得人羊膜上皮干细胞可以广泛应用于再生医疗、细胞治疗或者组织工程等不同领域。
为解决上述技术问题,本发明第二方面提供一种源自羊膜组织的干细胞的培养制备方法,所述的培养制备方法包括以下步骤:
(1)在无血清细胞培养基中对本发明所述的人羊膜上皮干细胞进行原代培养和传代培养。
(2)从步骤(1)所得包含干细胞的培养基中收集人羊膜上皮干细胞。
其中步骤(1)为在无血清细胞培养基中对本发明分离的人羊膜上皮干细胞进行原代培养和传代培养。
步骤(1)所述的原代培养为本领域常规的原代培养方法,所述原代培养较佳地包括以下步骤:将所述人羊膜上皮干细胞以0.3~1.5×105/cm2的密度接种于无血清培养基中,在37℃体积分数为5%的co2中培养,每隔2~3天换液一次,细胞达到90%~100%融合时加入1×tryple,消化10~15min,加入等体积的培养基终止消化,将所得细胞悬液以300~800g离心5~10分钟,弃上清,即得p0代细胞。
其中所述羊膜上皮细胞的接种密度较佳地为1.0×105/cm2,所述原代培养的温度优选地为37℃,所述离心力较佳地为650g,所述离心的时间较佳地为5分钟。
本发明所述培养基为本领域常规细胞培养基,较佳地为无血清细胞培养基,所述的基础培养基较佳地包括dmem、dmem/f-12、rpmi1640中的一种或多种。
所述的无血清培养基中的血清替代品为humanplateletlysate(hpl)、b27supplement(b27)、ctsb27supplement(ctsb27)、n2supplement(n2)、ctsn2(ctsn2)。
所述haescs无血清培养基的成分较佳地包括:dmem/f-12,1%~20%hpl(体积百分比),所述血清替代品较佳地为10%hpl、0.5~2mm丙酮酸钠、1~2mm非必须氨基酸、1~2mml-谷氨酰胺和1~20ng/ml人表皮生长因子;更佳地包括:dmem/f-12、10%hpl、1mm丙酮酸钠、1mm非必须氨基酸、2mml-谷氨酰胺和10ng/ml人表皮生长因子。
其中所述的传代培养为本领域常规传代培养方法。所述传代培养的方法较佳地包括以下步骤:将原代培养所得p0代细胞利用培养基重悬,以1.0×105/cm2的密度重新接种至haescs培养基,培养扩增至细胞融合后即得p1代人羊膜上皮干细胞。
其中所述步骤(2)为从步骤(1)所得包含干细胞的培养基中收集干细胞。
其中所述收集干细胞的方法为本领域常规方法,包括离心,过滤等方法,具体请参考本领域的技术手册或者文献资料,例如干细胞操作手册。较佳地,根据本发明所述分离、制备方法制得的人羊膜上皮干细胞具有以下特征:
(1)每张羊膜可分离获得0.6~2×108个人羊膜上皮干细胞,在标准培养条件下贴壁生长于塑料培养器皿中,细胞呈卵圆形、三角形和多角形,表现出典型的铺路石外观,核质比大,细胞质均匀,透光度好;羊膜上皮细胞在5~7天的培养周期中,可达90%~100%融合,细胞活力可保持在95%左右,细胞可传代至大约4~5代。
(2)高纯度上皮细胞:高丰度表达上皮细胞标志物cd326、pan-cytokeratin,不表达血细胞标志物cd34和cd45。
(3)不表达ii类主要组织相容性抗原hla-dr、hla-dq。
(4)干细胞分化潜能:表达多种多能干性标志物如ssea-4、nanog,具有向中胚层成骨细胞分化的潜能。
(5)无致瘤性:不表达端粒酶活性,细胞增殖能力受限,体内移植无致瘤性。
为解决干细胞制备中的无血清技术问题,本发明采取的技术方案之三为:一种人羊膜上皮细胞的无血清冻存体系,包括以下步骤:
(1)将无血清培养体系中收获得到的人羊膜上皮干细胞以无血清冻存液进行重悬,并转移至冻存管或冻存袋中。
(2)将步骤(1)所得的细胞转至程序降温仪,进行程序降温后冻存,并转移至液氮中长期保存。
其中所述的无血清冻存液包括但不限于cellvationtmcryopreservationmedium(美国mpbio)、cryoscarlessdmso-free(日本bioverde)、cryostorcs10(美国biolife)。
本发明采用的无血清冻存技术保存的人羊膜上皮干细胞复苏后存活率可达90%以上,较好的保持了细胞的功能和特性。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明所述的人羊膜上皮干细胞分离方法具有快速、操作简便和成本低廉等优点,可快速获得大量活性较高的人羊膜上皮干细胞;gmp车间内遵循良好操作规范制备的人羊膜上皮干细胞可直接用于建库;本发明所述干细胞的制备方法利用无血清的培养方式大大降低了动物源性污染和免疫排斥反应的发生,无血清的冻存方式避免了因移植前清洗不够而导致残留动物蛋白超标的问题,使得建库的人羊膜上皮干细胞可直接用于科学研究和临床治疗,该技术方案具有广阔的应用前景。
附图说明
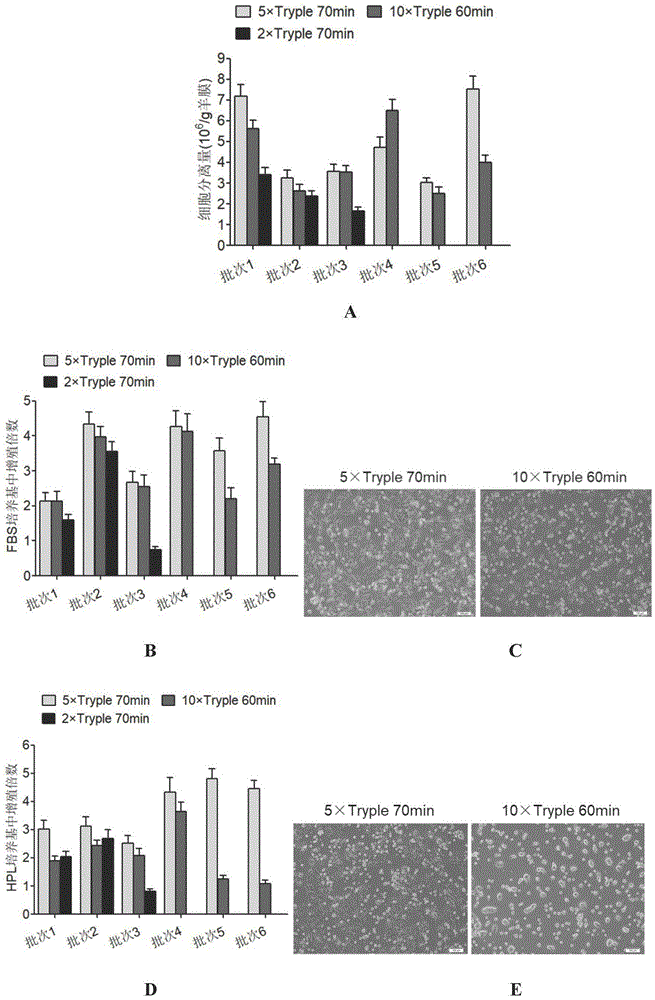
图1所示为不同浓度tryple和不同消化时间对人羊膜上皮干细胞分离效果的比较。图1a为不同浓度和不同消化时间分离的人羊膜上皮干细胞数量比较,图1b为不同浓度和不同消化时间分离的人羊膜上皮干细胞在含fbs的无血清培养基中增殖倍数的比较,图1c不同浓度和不同消化时间分离的人羊膜上皮干细胞在含fbs培养基中贴壁情况,图1d不同浓度和不同消化时间分离的人羊膜上皮干细胞在含hpl培养基中增殖倍数的比较,图1e不同浓度和不同消化时间分离的人羊膜上皮干细胞在含hpl的无血清培养基中贴壁情况,图1f为5×tryple消化所得细胞在含fbs、hpl无血清培养基中增殖倍数比较,图1g为10×tryple消化所得细胞在含fbs、hpl无血清培养基中增殖倍数比较。
图2所示为新鲜分离的人羊膜上皮干细胞(pre-p0)免疫表型流式鉴定结果。
图3所示为不同种类血清替代物对人羊膜上皮干细胞培养扩增效果的比较。其中图3a为培养细胞数量的比较,图3b为培养细胞状态比较的代表性图例。
图4所示为不同种类血清替代物培养的人羊膜上皮干细胞表面干性标志物sssea4和上皮标志物cd326的流式表型检测结果。
图5所示为本发明优选的hpl培养基与澳大利亚莫纳什医学研究所建立的临床级的无血清无动物源培养体系对人羊膜上皮干细胞培养效果的比较。
图6表示p1代人羊膜上皮干细胞的流式鉴定结果。图6a为cd326、pan-cytokeratin流式鉴定结果,图6b为cd34、cd45流式鉴定结果,图6d为hla-dr、hla-dq流式鉴定结果。
图7表示人羊膜上皮干细胞向成骨细胞分化的茜素红(ars)染色和alp染色检测结果。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例1人羊膜上皮干细胞的酶消化分离条件
经产妇知情同意,采集孕39周前行剖宫产的健康胎儿的胎盘羊膜,所选取羊膜采集对象为孕38周内行剖宫产的产妇。经检测,产妇身体健康,无急慢性传染病、家族遗传病、无乙型肝炎病毒、丙型肝炎病毒、艾滋病病毒、人类嗜t细胞病毒、疱疹病毒、巨细胞病毒、梅毒螺旋体和支原体等病原体,羊膜的采集在无菌条件下进行。
羊膜采集后置于羊膜保存液中,在4℃环境下运输,12h内抵达gmp细胞制备车间进行人羊膜上皮干细胞的消化分离。
将羊膜从保存液中取出,置于pbs中漂洗2~3次,镊子刮除血块。将整张羊膜置于1×tryple(gibco,a1217702)中,37℃恒温振荡仪内预消30min,弃去预消化液,用镊子将羊膜转移至5倍于羊膜质量(以g表示)的不同浓度(2×、5×、10×)的tryple中,37℃恒温摇床内消化不同时间(70、90min),速度为100rpm/min,收集消化液并加入等体积的培养基终止消化,100目不锈钢筛网过滤得细胞悬液,650g离心5min去上清,保留细胞沉淀,细胞计数仪计数,获得分离细胞量数据。
将pre-p0细胞分别重悬于2种培养基中(分别含fbs、hpl),以1.0×106/孔的密度接种于6孔板中(重复3孔),置于37℃、体积分数为5%的co2细胞培养箱中培养,3~4天后首次换液并拍照,之后每2~3天换液1次,待细胞长满后,显微镜下拍照,1×tryple消化收集细胞,计数,将每孔细胞收获量/接种量(1.0×106),得扩增倍数。
参见图1,结果说明:
分离数量:根据前3批次胰酶分离结果可以看出,2×tryple消化的分离效果最差,所得细胞最少,因此后3批次实验中将2×tryple消化条件去除(图1a)。除其中1个批次的5×tryple分离效果较差外,其余5个批次羊膜都是5×tryple分离效果好于10×tryple。
细胞增殖和贴壁:无论是在fbs培养基中还是hpl培养基中,5×tryple消化所得细胞的增殖倍数高于10×tryple消化所得细胞。10×tryple消化所得细胞质量差于5×tryple消化所得细胞,其贴壁效果差于5×tryple消化所得细胞,尤其是在更高级别的hpl培养基中,表明10×tryple消化对细胞损伤较大,所得细胞质量较差。
细胞对培养基的要求:5×tryple消化所得细胞在fbs、hpl培养基中培养的增殖倍数无明显差异,但是10×tryple消化所得细胞在hpl培养基中的增殖倍数要低于fbs培养基,表明10×tryple消化方式的适用性更差。
实施例2新鲜分离的人羊膜上皮干细胞(pre-p0)表型检测
胰酶消化分离得到pre-p0细胞,用facs缓冲液(含2%fbs的pbs)离心洗涤细胞2次,以facs缓冲液重悬细胞,并调整细胞浓度为1×106/100μl,分装至若干管,往各管细胞中分别加入cd90、cd105以及各自的同型对照抗体,4℃条件下避光孵育30min,facs缓冲液离心洗涤细胞2次,500μlfacs缓冲液重悬细胞,立即上机检测。
参见图2,结果说明:胰酶消化分离得到pre-p0细胞不表达cd90、cd105两种经典的间充质干细胞标志物,表明分离得到的人羊膜上皮干细胞无间充质干细胞污染,纯度较高。
实施例3人羊膜上皮干细胞的无血清培养基筛选
将pre-p0细胞分别重悬于6种培养基中,分别fbs(dmem/f-12,10%浓度胎牛血清,1mm丙酮酸钠、1mm非必须氨基酸、2mml-谷氨酰胺和10ng/ml人表皮生长因子)、hpl(dmem/f-12,10%浓度血小板裂解物,1mm丙酮酸钠、1mm非必须氨基酸、2mml-谷氨酰胺和10ng/ml人表皮生长因子)、b27(dmem/f-12,加入2%体积的gibco公司b27supplement,1mm丙酮酸钠、1mm非必须氨基酸、2mml-谷氨酰胺和10ng/ml人表皮生长因子)、ctsb27(dmem/f-12,加入2%体积的gibco公司ctsb27supplement,1mm丙酮酸钠、1mm非必须氨基酸、2mml-谷氨酰胺和10ng/ml人表皮生长因子)、n2(dmem/f-12,加入1%体积的gibco公司n2supplement,1mm丙酮酸钠、1mm非必须氨基酸、2mml-谷氨酰胺和10ng/ml人表皮生长因子)、ctsn2(dmem/f-12,加入1%体积的gibco公司ctsn2supplement,1mm丙酮酸钠、1mm非必须氨基酸、2mml-谷氨酰胺和10ng/ml人表皮生长因子)。以上6种培养基除fbs外,其余5种均为无血清培养基。以1.0×106/孔的密度接种于6孔板中(重复3孔),置于37℃、体积分数为5%的co2细胞培养箱中培养,3~4天后首次换液并拍照,之后每2~3天换液1次,待细胞长满后,显微镜下拍照,1×tryple消化收集细胞,计数,将每孔细胞收获量,并以fbs培养所得细胞数量作为基准值,计算其他6种培养基所得细胞的相对数量(%)。
参见图3,结果说明:培养7天左右的时间,fbs、hpl培养细胞的融合度最高,b27、ctsb27培养细胞的融合度相对较低,n2、ctsn2培养细胞的融合度最低。fbs和hpl培养的细胞数量最多,两者无明显差异,其次为b27、ctsb27,而n2、ctsn2培养细胞数量最少。
相比于fbs培养基,hpl培养的细胞体积较小,状态最好,折光性好。b27、ctsb27培养的细胞体积较大,容易接触抑制,细胞增殖数量明显少于fbs和hpl。
实施例4不同种类血清替代物培养的人羊膜上皮干细胞sssea4、cd326的流式检测结果
根据实施例3的结果显示,n2和ctsn2培养的细胞生长最慢,汇合度最低,因此本发明有选择地将n2、ctsn2两种培养基排除在本实施例研究外,将pre-p0细胞分别重悬于4种培养基中(分别为fbs、hpl、b27、ctsb27),以1.0×106/孔的密度接种于6孔板中培养,待细胞长满后,扩增传代至p1,1×tryple消化收集p1细胞,用facs缓冲液(含2%fbs的pbs)离心洗涤细胞2次,以facs缓冲液重悬细胞,并调整细胞浓度为1×106/100μl,分装至若干管,往各管细胞中分别加入cd90、cd105以及各自的同型对照抗体,4℃条件下避光孵育30min,facs缓冲液离心洗涤细胞2次,500μlfacs缓冲液重悬细胞,立即上机检测。
参见图4,结果说明:与其他3种培养基hpl、b27、ctsb27相比,fbs培养的p1代细胞ssea4、cd326表达阳性率都较低,表明fbs培养基在维持人羊膜上皮干细胞的干性上可能更弱;且fbs培养的细胞cd326(epcam)表达量也较低,提示fbs有可能使人羊膜上皮干细胞发生上皮间质转化(epithelial-mesenchymaltransition,emt),不利于人羊膜上皮干细胞的上皮性质维持。
实施例5本发明优选的hpl培养基与澳大利亚莫纳什医学研究所建立的临床级的无血清无动物源培养体系对人羊膜上皮干细胞培养效果的比较。
将pre-p0细胞分别重悬于2种无血清培养基中,即hpl(dmem/f-12,10%浓度血小板裂解物,1mm丙酮酸钠、1mm非必须氨基酸、2mml-谷氨酰胺和10ng/ml人表皮生长因子)、epilife(gibco产品,epilifetmmedium),以1×106/孔的密度接种于6孔板中,置于37℃、体积分数为5%的co2细胞培养箱中培养,3~4天后首次,之后每2~3天换液1次,待细胞长满后,1×tryple消化收集细胞,计数,将每孔细胞收获量,以含hpl培养基所得细胞数量作为基准值,计算epilife培养基所得细胞的相对数量(%)。
参见图5,结果说明:与含hpl培养基相比,上皮细胞专用的无血清无动物源培养基epilife培养的细胞数量仅为hpl培养基数量的30%左右,表明epilife并不适合人羊膜上皮干细胞的培养。
实施例6人羊膜上皮干细胞的流式表型检测
待细胞生长至90%~100%融合后,用pbs清洗细胞两次洗去除培养液,加入1×tryple重组酶于37℃条件下消化10~15min,收集细胞。
用facs缓冲液(含2%fbs的pbs)离心洗涤细胞2次,以facs缓冲液重悬细胞,并调整细胞浓度为1×106/100μl,分装至若干管,往各管细胞中分别加入cd326、pan-cytokeratin、cd34、cd45、ssea-4、nanog、hla-dr、hla-dq以及各自的同型对照抗体(其中pan-cytokeratin、nanog为胞内蛋白,需要固定破膜后再孵育抗体,所有抗体用量均参照产品说明书),4℃条件下避光孵育30min,facs缓冲液离心洗涤细胞2次,500μlfacs缓冲液重悬细胞,立即上机检测。我们分离培养的人羊膜上皮干细胞表达ssea-4、nanog,提示具有干细胞特性。
参见图6,结果说明:分离培养的人羊膜上皮干细胞高表达上皮标志物cd326、pan-cytokeratin,且cd34、cd45表达阴性,无血细胞污染,表明分离培养的人羊膜上皮干细胞纯度高。人羊膜上皮干细胞hla-dr、hla-dq低表达,表明免疫原性低。
实施例7人羊膜上皮干细胞具有向成骨细胞分化的干细胞潜能
将人羊膜上皮干细胞重悬于无血清培养基中,以2.5×105/孔的密度接种于12孔板中,培养3~4天,待细胞生长至70%~80%融合后,更换为成骨诱导培养基,之后每3天换液1次,培养28天后,茜素红染色检测钙沉积,alp试剂盒检测碱性磷酸酶活性。
参见图7,结果说明:经过28天左右的诱导,人羊膜上皮干细胞可出现钙沉积而被茜素红染成红色,且alp染色阳性,表明人羊膜上皮干细胞具有向成骨细胞分化的潜能,即本发明的无血清无动物源培养基可支持人羊膜上皮干细胞培养,并维持其干细胞特性。
按照本发明方法制备的人羊膜上皮细胞表现出以下特征:平均每张羊膜可获得0.6~2亿个上皮细胞;在标准培养条件下贴壁生长于塑料培养器皿中,细胞呈卵圆形、三角形和多角形,表现出典型的铺路石外观,核质比大,细胞质均匀,透光度好;羊膜上皮细胞在5~6天的培养周期中,可达90%~100%融合,细胞活力可保持在95%左右,细胞可稳定传代至大约4~5代;表达上皮细胞标志物cd326、pan-cytokeratin,表达干细胞标记物ssea-4和nanog,不表达血细胞标志物cd34和cd45,不表达ii类主要组织相容性抗原hla-dr和hla-dq;无血清体系可维持其较好的生长状态和干细胞特性。
在此说明书中,本发明已参照特定的实施例作了描述,实施例的说明只是用于帮助理解本发明的方法及其核心思想。本发明的说明是说明性的而非限制性的,本领域的技术人员可以在不脱离本发明原理的前提下轻易地做出改进和修饰,但这些改进和修饰也都落入本发明权利要求保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!