一种原位检测外泌体多重microRNA的纳米金荧光探针及其制备方法与应用与流程
本发明属于分子生物技术和生物检测领域,具体涉及一种原位检测外泌体多重microrna的纳米金荧光探针及其制备方法与应用。
背景技术:
乳腺癌是全世界女性中最常见的癌症,也是女性癌症死亡的主要原因。根据2018年全球癌症数据显示,乳腺癌占女性所有诊断癌症总数的24.2%及所有癌症死亡数中的15.0%,均位居第一。早期诊断、适当治疗、复发和转移监测对降低乳腺癌的死亡率非常重要。外泌体是细胞主动分泌的粒径为50~150nm的细胞外囊泡,具有脂质双分子层膜结构,通过其携带源细胞的dna、mrna、microrna(mirna)、蛋白质、脂质和代谢产物等与受体细胞进行细胞间的信息交流。mirna是一类由内源基因编码的长度为18-25个核苷酸的非编码单链rna,在细胞分化、增殖、凋亡,以及疾病过程等生物进程中起基因表达调控作用,诸多疾病的发生与mirna的表达水平息息相关。近年来研究[参考文献:lanhy,luhq,wangx,etal.micrornasaspotentialbiomarkersincancer:opportunitiesandchallengesbiomedresearchinternational.2015,2015:1-17.hannafonbn,trigosoyd,callowaycl,etal.plasmaexosomemicrornasareindicativeofbreastcancer.breastcancerresearch.2016,18(1):90-104.lix,renz,tangj,etal.exosomalmicrornamir-1246promotescellproliferation,invasionanddrugresistancebytargetingccng2inbreastcancer.cellularphysiology&biochemistry.2017,44:1741-1748.asagas,kuoc,nguyent,etal.directserumassayformicrorna-21concentrationsinearlyandadvancedbreastcancer.clin.chem.2011,57:84–91.]报道了血浆/血清外泌体中的mirna作为肿瘤的微创液体生物标志物,用于各种癌症的诊断、治疗和预后监测。乳腺癌细胞mcf-7分泌的外泌体有选择性富集其亲本细胞中mir-1246、mir-21、mir-122等mirna的作用,且这些核酸的含量远远高于正常乳腺上皮细胞mcf-10a分泌的外泌体中相应mirna的含量。通过从16个乳腺癌病人与健康对照组血浆提取外泌体分析,两者的mir-1246、mir-21的表达量均具有显著性差异,受试者特征工作曲线(roc)显示血浆外泌体中mir-1246、mir-21表达量的组合优于单个指标,可作为乳腺癌诊断的生物标志物。
目前常用检测mirna的方法主要有实时定量荧光pcr(rt-qpcr)、基因微阵列、northern印迹法、高通量测序技术、原位杂交、基因表达系列分析、电化学发光等方法,每种方法都各有优缺点。当它们应用于血浆/血清外泌体内mirna的测定,需要经过一系列繁琐的操作,如外泌体的提取、外泌体内rna提取、逆转录合成cdna等,对血浆/血清样品需求量较大,成本高,耗时费力,精密度与重现性较差。所以开发一种操作简便可原位检测血浆标本外泌体中mirna的液体活检方法,将具有很好的临床应用前景。
技术实现要素:
为了克服现有技术存在的问题,本发明的第一方面的目的,在于提供一种原位检测外泌体多重microrna的纳米金荧光探针。
本发明的第二方面的目的,在于提供上述原位检测外泌体多重microrna的纳米金荧光探针的制备方法。
本发明的第三方面的目的,在于提供一种包含上述原位检测外泌体多重microrna的纳米金荧光探针的试剂。
本发明的第四方面的目的,在于提供上述原位检测外泌体多重microrna的纳米金荧光探针的应用。
本发明的第五方面的目的,在于提供一种检测外泌体中mir-1246、mir-21的方法。
为了实现上述目的,本发明所采取的技术方案是:
本发明的第一个方面,提供一种原位检测外泌体多重microrna的纳米金荧光探针,由纳米金、microrna的捕获dna、microrna的报告dna制成:其中,所述的microrna的报告dna标记有不同的荧光基团,所述的microrna的捕获dna标记有巯基基团;
所述的microrna包括mir-1246、mir-21;
所述的mir-1246的捕获dna的序列为5-cctgctccaaaaatccatt-3;
所述的mir-1246的报告dna的序列为5-aatggatttttg-3;
所述的mir-21的捕获dna的序列为5-tcaacatcagtctgataagct-3;
所述的mir-21的报告dna的序列为5-agcttatcagactg-3。
所述的microrna还包括:用于阴性对照质量控制的mir-54。
所述的mir-54的捕获dna的序列为5-ctcggattatgaagattacgggta-3;
所述的mir-54的报告dna的序列为5-aatggatttttg-3。
所述的microrna的捕获dna与所述的巯基基团之间还包括间臂(spacer);优选为c3h6-[(c2h4o)6-po3-]3、polya(多聚腺嘌呤)和polyt(多聚胸腺嘧啶)中的至少一种;更优选为c3h6-[(c2h4o)6-po3-]3。
所述的polya中a的数量优选为7~10个。
所述的polyt中t的数量优选为7~10个。
所述的荧光基团优选为cy5、cy7、cy3、5-tamra、texasred、rox、calflurored590、calflurored610、calflurored635、quasar670、quasar705和alexa700中的至少一种。
所述的纳米金的直径优选为11~14nm;更优选为11.6~13.6nm;最优选为13nm。
本发明的第二个方面,提供本发明第一方面的原位检测外泌体多重microrna的纳米金荧光探针的制备方法,具体如下:分别将microrna的捕获dna与其相应的报告dna混合,杂交后形成dna双链,再加入纳米金中,冷冻,加入nacl溶液,解冻,离心去沉淀,清洗沉淀,得到原位检测外泌体多重microrna的纳米金荧光探针。
所述的microrna包括mir-1246、mir-21时,所述的mir-1246的捕获dna、mir-21的捕获dna、mir-1246的报告dna、mir-21的报告dna、纳米金的摩尔比优选为300~380:360~440:300~380:360~440:3;更优选为360~380:380~400:360~380:380~400:3。
所述的microrna包括mir-1246、mir-21、mir-54时,所述的mir-1246的捕获dna、mir-21的捕获dna、mir-54的捕获dna、mir-1246的报告dna、mir-21的报告dna、mir-54的报告dna、纳米金的摩尔比优选为300~380:360~440:360~440:300~380:360~440:360~440:3;更优选为360~380:380~400:380~400:360~380:380~400:380~400:3。
所述的杂交的方法优选为先在95℃下反应4~6min,接着在16~20℃下反应25~35min。
所述的纳米金优选通过柠檬酸盐还原法以氯金酸(haucl4)为原料制备得到,具体如下:将氯金酸溶液和水混合加热至沸后加入柠檬酸钠溶液,避光继续加热至沸反应15~25min,搅拌冷却至室温即可,得到。
所述的冷冻的条件优选为-30~-10℃下冷冻1.5~3h;更优选为-25~-20℃下冷冻2~2.5h。
所述的氯化钠的终浓度优选为80~120mm。
所述的解冻的条件优选为16~20℃下解冻1~1.5h;更优选为17~19℃下解冻1~1.2h。
所述的离心的条件优选为12000~15000rpm,2~6℃离心10~20min;更优选为13500~15000rpm,3~5℃离心14~16min。
所述的清洗优选采用含nacl的hepes;更优选为含100mmnacl、ph=7.6的hepes。
本发明的第三方面,提供一种试剂,包含所述的原位检测外泌体多重microrna的纳米金荧光探针。
本发明的第四方面,提供第一方面的原位检测外泌体多重microrna的纳米金荧光探针或第三方面所述的试剂在制备检测外泌体中mir-1246、mir-21的试剂盒中的应用。
所述的原位检测外泌体多重microrna的纳米金荧光探针或第三方面所述的试剂在制备检测、筛选乳腺癌的试剂盒中的应用。
本发明的第五方面,提供一种检测外泌体中mir-1246、mir-21的方法,将所述的原位检测外泌体多重microrna的纳米金荧光探针与外泌体共孵后作为样品液,检测该样品液荧光信号,根据荧光信号判定样品中mir-1246、mir-21的含量。
所述的外泌体优选为经蛋白酶k和rnasea处理后的外泌体。
本发明的有益效果是:
本发明设计合成了一种可同时检测乳腺癌生物标志物mir-1246、mir-21、并可以同步进行阴性靶标mir-54测定的原位检测外泌体多重microrna的纳米金荧光探针,其中阴性靶标mir-54的测定可以监测探针测定细胞上清或血浆外泌体过程中可能产生的假阳性信号,以确认探针对靶标mir-1246、mir-21的特异性响应,从而判断探针的正常工作状态与结果的可靠性。
该探针可同时定量检测3种合成的靶标mirna(mir-54、mir-1246、mir-21),线性响应范围在0~20nm,其中,对mir-1246的灵敏度为1.60fold/nm,检出限为0.20nm,比我们前期报道的单靶标mir-1246探针具有更高的灵敏度(0.748fold/nm)和更低的检出限(0.68nm),并对相应的靶标特异性响应。
该探针与mcf-7细胞外泌体孵化约1h即可进入其中,对目标mirna产生定量响应荧光信号,特异性响应外泌体内靶标的表达水平,可实现以血浆外泌体中mir-1246、mir-21的表达水平作为标志物进行乳腺癌诊断。
采用该探针同时原位检测人血浆标本外泌体中2种核酸标志物(mir-1246、mir-21),探针检测到的信号强度是与血浆中外泌体响应产生的,外泌体加样回收率为94%-108%;对人的血浆标本进行检测,以两个核酸(mir-1246、mir-21)为诊断指标的受试者特征工作曲线图均可获得100%的敏感度和特异性;表明原位检测外泌体多重microrna的纳米金荧光探针对乳腺癌血浆的检测具有更高的灵敏度和准确性,说明原位检测外泌体多重microrna的纳米金荧光探针用于诊断乳腺癌具有更高的准确性。
附图说明
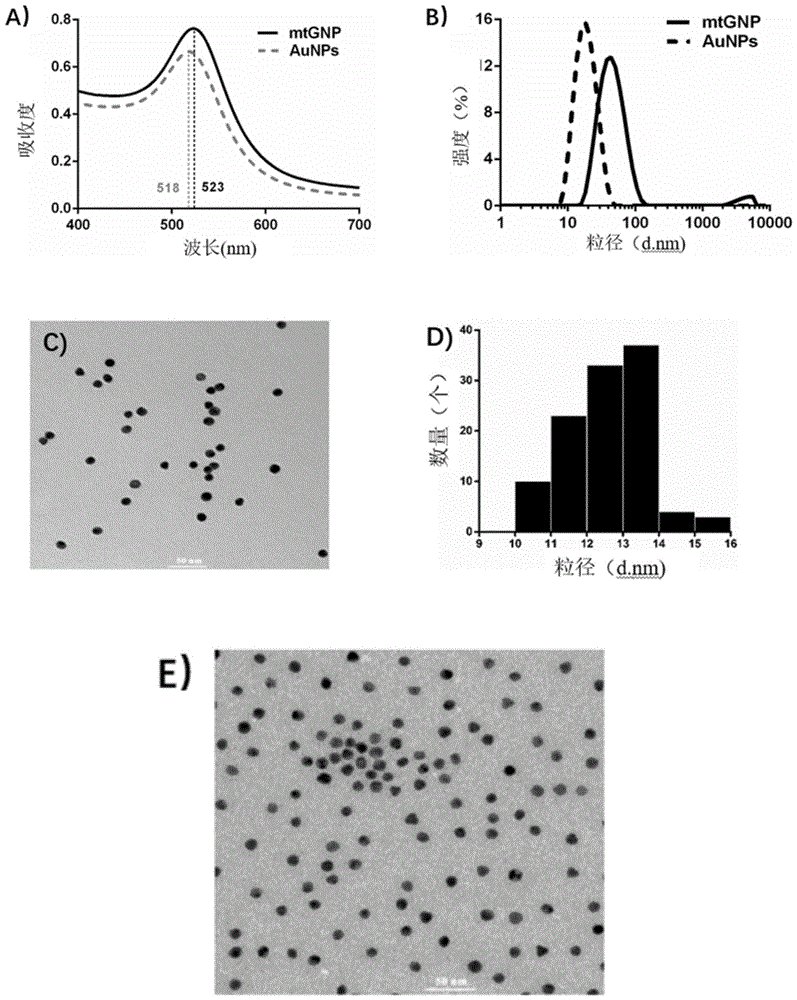
图1是纳米金(aunps)和多重靶标纳米金荧光探针(mtgnp)的结构表征图:其中,a)为纳米金和多重靶标纳米金荧光探针的紫外可见分光光谱图;b)为动态光散射法测定的粒径分布图;c)为纳米金的透射电子显微镜图;d)为透射电子显微镜下观察到的纳米金的粒径分布图;e)为多重靶标纳米金荧光探针的透射电子显微镜图。
图2是外泌体的结构表征图:其中,a)为纳米颗粒跟踪分析仪测量的mcf-7外泌体粒径分布图;b)为mcf-7外泌体的透射电子显微镜图;c)为透射电子显微镜下观察到的mcf-7外泌体的粒径分布图(n=110);d)为mcf-7细胞及其外泌体的蛋白质印迹分析图。
图3是多重靶标纳米金荧光探针对不同寡核苷酸序列的响应信号图:其中,a)为多重靶标纳米金荧光探针对不同浓度的靶标的响应信号图;b)为多重靶标纳米金荧光探针对错配序列的响应信号图。
图4是多重靶标纳米金荧光探针对mcf-7外泌体的响应信号图:其中,a)为多重靶标纳米金荧光探针检测mcf-7外泌体的动力学曲线图;b)为多重靶标纳米金荧光探针对不同浓度mcf-7外泌体的响应信号图。
图5是多重靶标纳米金荧光探针对mcf-7外泌体及mcf-10a外泌体的响应信号图:其中,a)为破坏外泌体外部游离核酸后多重靶标纳米金荧光探针对mcf-7外泌体的响应信号图;b)为多重靶标纳米金荧光探针对不同浓度的mcf-7外泌体及mcf-10a外泌体的响应信号图。
图6是多重靶标纳米金荧光探针与mcf-7外泌体共孵后的透射电子显微镜图。
图7是多重靶标纳米金荧光探针检测血浆的结果图:其中,a)为多重靶标纳米金荧光探针对健康人血浆和乳腺癌患者血浆的响应信号散点图;b)为以多重靶标纳米金荧光探针对血浆中mir-1246响应信号为分类器的的受试者工作特征曲线图;c)为以多重靶标纳米金荧光探针对血浆中mir-21响应信号为分类器的受试者工作特征曲线图。
具体实施方式
以下通过具体的实施例对本发明的内容作进一步详细的说明。
本实施例中所使用的材料、试剂等,如无特别说明,为从商业途径得到的试剂和材料。
本实施例中采用的pbs为0.01m,ph=7.4的pbs。
实施例1多重靶标纳米金荧光探针(multi-targetinggoldnano-probe,简称mtgnp)的制备及结构表征
1.多重靶标纳米金荧光探针的制备
(1)反应所需的玻璃仪器经新鲜配制的王水浸泡6h以上,然后依次用蒸馏水、超纯水冲洗干净,烘干备用。采用柠檬酸钠还原氯金酸得到13nm的纳米金溶胶,具体如下:精密量取17.00ml0.1%氯金酸溶液和33.0ml的超纯水加入100ml圆底烧瓶中,安装好冷凝装置,设置油浴锅温度为125℃进行加热。加热至沸后迅速加入5ml38.8mm柠檬酸钠溶液,避光继续加热反应20min,此时液体呈酒红色,即为直径约13nm(电镜下的裸直径)的纳米金溶胶。关闭热源,继续搅拌冷却至室温,4℃避光保存。用紫外分光光度法测定合成的纳米金溶胶浓度,浓度约为10nm。
(2)取1.8μl100μmmir-1246的捕获dna、2.0μl100μmmir-21的捕获dna、2.0μl100μmmir-54的捕获dna分别与1.8μl100μmmir-1246的报告dna、2.0μl100μmmir-21的报告dna、2.0μl100μmmir-54的报告dna混合杂交,于95℃水浴加热5min变性后转移至18℃下反应30min杂交为dna双链,得到mir-1246的dna双链溶液、mir-21的dna双链溶液、mir-54的dna双链溶液。
(3)将步骤(2)得到的三种dna双链溶液加入150μl10nm步骤(1)得到的13nm纳米金(aunanoparticles,aunps)溶胶中,随后迅速置于-20℃下冷冻2h,取出冰体加入nacl溶液使其终浓度为100mm,接着在18℃条件下解冻1h后,15000rpm、4℃离心15min,吸去上清并加入25mmhepes(含100mmnacl,ph=7.6)100μl重悬洗涤去除多余的游离dna序列,重复上述离心重悬洗涤操作三次,最后将沉淀重悬于25mmhepes(含100mmnacl,ph=7.6)100μl中,得到多重靶标纳米金荧光探针,即原位检测外泌体多重microrna的纳米金荧光探针,4℃保存备用,此过程需注意避光。
表1.mtgnp的寡核苷酸链序列
注:spacer=c3h6-[(c2h4o)6-po3-]3。
2.多重靶标纳米金荧光探针的结构表征
对上述制备的多重靶标纳米金荧光探针采用以下三种常用表征方式进行表征分析:
(1)紫外可见分光光度法(uv-vis):将上述制备的纳米金溶胶和多重靶标纳米金荧光探针分别用纯水稀释4倍后在400-700nm测定其紫外可见光谱,结果如图1a)所示:多重靶标纳米金荧光探针的最大吸收峰为523nm,比纳米金溶胶的紫外可见光最大吸收峰(518nm)红移了5nm,说明多重靶标纳米金荧光探针的粒径有所增大,纳米金颗粒表面键合上了寡核苷酸链。然后通过朗伯-比尔定律(消光系数ε=2.7×108lmol-1cm-1)计算得到多重靶标探针的浓度大约为16.5nm。
(2)动态光散射仪(dynamiclightscattering,dls):上述制备的纳米金溶胶和多重靶标纳米金荧光探针分别用纯水稀释成1ml于检测皿,放入粒度仪中,设置为size模式,按照说明书进行参数设定,测定在0-10000nm范围的水合粒径分布,结果如图1b)所示:mtgnp在溶液体系的平均直径为41.54nm,pdi=0.215,mtgnp的粒径比纳米金颗粒的粒径(16.70nm)明显增大,进一步说明寡核苷酸链连接到纳米金颗粒表面。
(3)透射电子显微镜(transmissionelectronmicroscope,tem):分别吸取10μl上述制备的纳米金溶胶和多重靶标纳米金荧光探针滴在铜网上,静置吸附10min后用滤纸吸去多余的液体,静置30min待其自然风干,置于电压为80kv的透射电子显微镜下观察,结果如图1c)、1d)所示:所得多重靶标纳米金荧光探针呈现球形,粒径分布均匀,与纳米金溶胶相比,探针的聚集度有所增加,由于纳米金表面接有双链dna使其趋于交联聚集。
实施例2外泌体的提取与表征
为验证多重靶标纳米金荧光探针可以进入外泌体检测mirna,首先从乳腺癌细胞mcf-7和正常乳腺上皮细胞mcf-10a的细胞上清液中提取分离外泌体并对其进行结构鉴定。
1.外泌体的提取
(1)外泌体的收集
mcf-7细胞接种在补充有10%胎牛血清,1%青链霉素(100iu/ml青霉素和链霉素100μg/ml)的dmem培养基中,于5%co2,37℃条件下培养。长满至50%-60%时,更换培养液(成分组成同上,但胎牛血清需经过超高速离心去除其中的外泌体),继续培养24-48h后收集细胞上清。血清去外泌体的方法如下:在4℃、120000×g超速离心10h后收集上清液(弃掉离心管底部颜色较深部分),并经过0.22μm微孔滤器过滤除菌。
(2)外泌体的提取和分离
将步骤(1)得到的细胞上清经差速离心分离提取外泌体,具体如下:
去除残留的细胞:4℃,300×g,离心10min后吸取上清液进入下步操作;
去除残留的死细胞:4℃,2000×g,离心20min后吸取上清液进入下步操作;
去除残留的细胞碎片:4℃,10000×g,离心30min后吸取上清液进入下步操作;
获取高纯度外泌体:4℃,100000×g,离心70min,弃去上清液保留沉淀,加pbs重悬后,继续在4℃,100000×g,离心80min,离心后弃去上清液保留沉淀,即为外泌体,将它重悬于100μlpbs中,-80℃保存。
2.外泌体的表征
(1)外泌体的纳米颗粒跟踪分析(nanoparticletrackinganalysis,nta)
将分离得到的外泌体用pbs稀释1000倍,吸取样品1ml,在配备蓝色激光(405nm)的nanosightns300系统(malverninstruments,uk)进行纳米颗粒跟踪分析。纳米颗粒对激光的散射影像反映其布朗运动,被记录捕获60s,重复记录5次。使用nta软件对视频进行分析,以获得纳米颗粒的浓度和大小分布,结果如图2a)所示:外泌体粒径在30-200nm以内的颗粒数量占92.1%。
(2)外泌体的大小和形貌观察
将分离得到的外泌体用pbs稀释成浓度约为108个/μl的样品液。取样品液滴于薄膜上,用镊子夹住铜网轻轻放置在液滴上1min吸附悬浮的外泌体。然后取一滴3%的磷钨酸(ph7.0)滴在铜网上,复染2min。接着滴加双蒸水洗涤多余的磷钨酸染色液并用滤纸吸干,静置30min,待其干燥后使用透射电子显微镜(transmissionelectronmicroscope,tem)观察,结果如图2b)所示:外泌体的形貌为具有膜结构的圆形或杯状结构;对外泌体粒径统计,结果如图2c)所示:显示其粒径分布均在50-150nm之间。
(3)外泌体的特征蛋白印迹分析(westernblot)
mcf-7细胞总蛋白的提取和定量:吸掉培养液,加入2mlpbs缓冲液重复洗涤三次并吸掉,加入1ml胰蛋白酶消化2min后终止消化,并将细胞混悬液转移至离心管,800rpm离心5min,弃上清,加入pbs缓冲液洗涤,重复上述操作3次后吸干离心管内的pbs缓冲液。加入适量ripa强裂解液(含1mmpmsf)摇匀置于冰上裂解20min,然后4℃,12000×g,离心5min,吸取上清液于-20℃保存备用即可。接着用bca试剂盒按照说明书对细胞mcf-7总蛋白提取液进行蛋白定量。
向20μl外泌体加入10μlripa裂解液(康为世纪,cw2333s)(含1mmpmsf,索莱宝,bl507a)冰上裂解20min,然后分别吸取20μl外泌体裂解液和细胞总蛋白液(约100μg)于1.5mlep管,加入5×蛋白上样缓冲液(杭州弗德,fd006)(5μl混匀后置于100℃恒温金属浴下15min,使蛋白变性。接下来在sds-page凝胶孔中加入上述样品25μl,在s-1:80v15min(浓缩蛋白),s-2:120v80min(分离蛋白)进行跑电泳。结束后,进行转膜操作:将电泳胶置于润湿的转膜板的黑色面,剪切合适尺寸经甲醇活化30s并用转膜液润洗的pvdf膜(millipore,us)覆盖在电泳胶上,组装好压膜装置并放入转膜槽,冰浴转膜200ma60min。接着进行切膜,对照marker找到目标蛋白分子量进行切割,用tbst缓冲溶液洗涤,10min/次共3次,然后将膜放入5%脱脂牛奶中室温摇床封闭1.5h。将pvdf膜取出用tbst洗涤,10min/次共3次,放入相应的稀释1:1000的一抗:anti-cd63(ab134045,abcam)、anti-calnexin(ab22595,abcam)和anti-tsg101(ab125011,abcam)中4℃摇床过夜。次日将pvdf膜取出用tbst缓冲液洗涤,10min/次共3次。接着放入二抗稀释液(1:4000)(fdr007,杭州弗德)中室温摇床孵育2h。结束后用tbst缓冲液洗膜10min/次共3次。通过用ecl化学发光试剂盒(杭州弗德,fd8020)对膜显色,在多功能成像分析仪(fluorchemr,usa)进行曝光,从而得到目标蛋白显影图像,实验结果如图2d)所示:显示出明显的cd63和tsg101蛋白条带,而没有calnexin蛋白条带,表明得到的外囊泡具有外泌体属性。
实施例3多重靶标纳米金荧光探针的检测性能
1.多重靶标纳米金荧光探针对合成的mir-1246、mir-21、mir-54的检测性能
在384孔酶标板中每孔加入终浓度为1nm的mtgnp,然后分别加入终浓度为5、10、20、30、40、50nm的合成mirna-1246、mirna-54、mirna-21,补充hepes(25nm,含300mmnacl)缓冲液至总体积为50μl,以空白探针溶液(终浓度为1nm的mtgnp,补充hepes(25nm,含300mmnacl)缓冲液至总体积为50μl)做背景。每个浓度平行3孔,4℃避光孵化30min,然后用多功能酶标仪分别测定各荧光基团的荧光强度,各激发波长与发射波长分别为:rox:575/605nm;cy5:630/670nm;cy7:743/767nm,分别以各波长处的荧光强度/探针空白荧光强度(s/b)对相应靶标的浓度作图,结果如图3a)所示:各靶序列的浓度在0~20nm内产生的信号呈线性关系,最大检测浓度为30nm,其中对mir-1246的线性拟合曲线为y=1.60x+1.71,响应灵敏度为1.60fold/nm,相关系数为0.9978,检出限为0.20nm,比我们前期报道的单靶标mir-1246探针具有更高的灵敏度(0.748fold/nm)和更低的检出限(0.68nm)(参见insitudetectionofplasmaexosomalmicrorna-1246forbreastcancerdiagnosticsbyaaunanoflareprobe.zhaily,limx,panwl,etal.acsappliedmaterials&interfaces.2018,10(46):39478-39486.)。
接着,为了研究探针是否对靶标特异性响应,设计合成mcf-7外泌体内含有的mir-105和mir-122、与三个靶标(mirna-1246、mirna-54、mirna-21)分别差别1、2、4个碱基的寡核苷酸r-1-r-9、以及含有mir-1246或与1246互补的长度为59、79、110个核苷酸的序列r-10-r-12(序列见表2)。在384孔酶标板中每孔加入终浓度为1nmmtgnp,然后分别加入终浓度为50nm上述的错配序列以及50nm靶标,补充hepes(25nm,含300mmnacl)缓冲液至总体积为50μl,以空白探针溶液(终浓度为1nm的mtgnp,补充hepes(25nm,含300mmnacl)缓冲液至总体积为50μl)做背景。每个浓度平行3孔,4℃避光孵化30min,然后用多功能酶标仪分别测定各荧光基团的荧光强度,各激发波长与发射波长分别为:rox:575/605nm;cy5:630/670nm;cy7:743/767nm,得到图3b)所示的1nmmtgnp分别与50nm上述的错配序列以及50nm靶标的响应信号图:mtgnp对错配2个碱基以内的mirna产生的荧光信号小于它与靶标产生的荧光信号强度的26%,而对超过2个错配碱基的mirna产生约等于背景的荧光信号;表明mtgnp对mir-1246和mir-21具有较好的选择性响应。
表2.mtgnp选择性实验所用dna/rna序列
注:下划线“”的序列与mir-1246部分或完全相同(其中dna中的“t”等同于rna中的“u”);下划线
2.多重靶标纳米金荧光探针对mcf-7细胞上清外泌体的检测性能
(1)mtgnp对外泌体快速响应产生定量荧光信号
在384孔酶标板中加入终浓度为108个/μl的mcf-7外泌体、终浓度为30mmedta和终浓度为1nm的mtgnp,补充hepes缓冲液至50μl,以空白探针溶液(终浓度为30mmedta和终浓度为1nm的mtgnp,补充hepes缓冲液(25nm,含300mmnacl)至50μl)做背景。每个浓度平行3孔,4℃避光孵化30min,每隔30min,然后用多功能酶标仪分别测定各荧光基团的荧光强度,各激发波长与发射波长同本实施例的1中,分别以各波长处的荧光强度/探针空白荧光强度(s/b)对时间作图,结果如图4a)所示:随着时间的增加信号增强,0.5h后产生的荧光强度与空白相比已有明显差异,在1h左右达到信号的最大值,说明mtgnp与外泌体响应快速。
然后,以1h作为孵化时间,检测mtgnp与不同浓度的mcf-7外泌体共孵后的信号:在384孔酶标板中加入终浓度为1nmmtgnp、终浓度为30mmedta和终浓度分别为0.1×108个/μl,0.2×108个/μl,0.5×108个/μl,1.0×108个/μl,2.0×108个/μl的mcf-7外泌体,补充hepes缓冲液至50μl,以空白探针溶液(终浓度为30mmedta和终浓度为1nm的mtgnp,补充hepes缓冲液(25nm,含300mmnacl)至50μl)做背景。每个浓度平行3孔,4℃避光孵化1h,然后用多功能酶标仪分别测定各荧光基团的荧光强度,各激发波长与发射波长同本实施例的1中,分别以各波长处的荧光强度/探针空白荧光强度(s/b)对外泌体浓度作图,结果如图4b)所示:mtgnp产生的荧光信号与mcf-7外泌体的浓度呈显著正相关,当外泌体浓度为2×107个/μl时产生的信号与空白探针背景值已有明显差异,显示了较低的检测限;当外泌体浓度为2×108个/μl时,mtgnp对靶mir-1246和mir-21的响应信号达到12-13,显示了较高的灵敏度;而mtgnp对mir-54产生的信号不随外泌体浓度的变化而变化,均接近探针空白水平,说明在探针中设计mir-54作为探针质控靶标是成功的;此处的质控信号为阴性,表明mtgnp在外泌体体系下稳定,而另外两个荧光基团产生的信号很有可能是与外泌体中相应目标mirna响应的信号,并非探针与外泌体表面蛋白或分离时共沉淀的杂质产生的假阳性信号。
(2)mtgnp进入外泌体与相应靶标特异性响应
1)破坏外泌体外部游离核酸后mtgnp对外泌体的响应
为了验证细胞上清液经超速离心破裂的外泌体释放出来的rna黏附、或者来源于培养基或者细胞中的其它含rna结构的物质如核糖核蛋白复合物(rnps)、病毒粒子黏附污染等是否产生干扰信号,我们进行了破坏mcf-7外泌体外部游离核酸后与mtgnp共孵实验:在384孔酶标板中加入终浓度为1nmmtgnp、终浓度为30mmedta和终浓度分别为0.5×108个/μl的mcf-7外泌体,补充hepes缓冲液至50μl。每个浓度平行3孔,4℃避光孵化1h,然后用多功能酶标仪分别测定各荧光基团的荧光强度,各激发波长与发射波长同本实施例的1中,其中,处理组的mcf-7外泌体先加入蛋白酶k,破坏干扰蛋白以及外泌体外部与mirna结合的蛋白分子,再用rnasea破坏游离的rna结构,再加入mtgnp进行孵化,结果如图5a)所示:用蛋白酶k、rnasea处理的mcf-7外泌体产生的信号强度降低不明显(均约为未处理的88%),说明外泌体外部确实存在少量rna干扰物质,但mtgnp与外泌体孵化产生的信号主要来源于其内部。
2)mtgnp定量响应外泌体中相应靶标的表达量
采用本实施例2中(1)相同的方法测定正常乳腺上皮细胞mcf-10a外泌体中相应靶序列的相对含量,结果如图5b)所示:mtgnp对mcf-7外泌体和正常乳腺上皮细胞系mcf-10a外泌体的检测信号均有浓度依赖关系,但mcf-10a外泌体内相应靶序列的信号均低于mcf-7的,表示mcf-10a的外泌体中也存在靶mir-1246和mir-21,但其浓度低于mcf-7外泌体中的,这也与我们的二代测序结果(未列出)相一致。也与文献(plasmaexosomemicrornasareindicativeofbreastcancer,hannafonbn,trigosoyd,callowaycl,etal.breastcancerresearch.2016,18(1):90-104.)报道mir-1246、mir-21在mcf-7细胞和正常乳腺上皮细胞系mcf-10a细胞分泌的外泌体中表达量有显著性差异一致。说明mtgnp可以特异性响应外泌体内靶标的表达水平。
3)透射电子显微镜(tem)观察多mtgnp进入外泌体的情况
将终浓度为2×108个/μlmcf-7外泌体和终浓度为5nmmtgnp孵化2h后作为样品液,在电镜下观察探针进入外泌体的情况:在铜网上滴一滴样品液,2min后用滤纸吸干多余的外泌体溶液,再滴一滴3%磷钨酸进行负染,2min后用滤纸吸干,最后滴一滴双蒸馏水进行洗去多余的磷钨酸染色液,并且立即用滤纸吸干,自然放置约30min样品干燥后,于电压为80kv的透射电子显微镜下观察mtgnp与外泌体的位置情况,结果如图6所示:说明mtgnp能够进入外泌体内部。
实施例4mtgnp检测人血浆外泌体
1.mtgnp检测血浆外泌体的加样回收率
上述实验结果证明了多重靶标探针能够进入外泌体对靶标特异性响应,接下来我们对其在人血浆标本中的检测性能进行研究。采用标准加入法,即随机选取2份健康人血浆样本,分别加入终浓度为0.5×108个/μl和1.0×108个/μlmcf-7外泌体,加入蛋白酶k(0.1mg/ml)37℃孵化30min,再加入蛋白酶k抑制剂pmsf(5mm),室温孵化20min以中止蛋白酶k的作用,再加入rnasea(4u/ml)37℃孵化30min以破坏血浆游离rna,最后和终浓度为1nmmtgnp补充hepes缓冲液至50μl,在4℃条件下孵化1h,然后用多功能酶标仪分别测定各荧光基团的荧光强度,各激发波长与发射波长同实施例3的1中,根据mtgnp对外泌体的定量响应曲线计算出相应的浓度(cexosomes+plasma),同法测定未加外泌体的血浆标本中的外泌体浓度(cplasma),通过公式(1)计算加样回收率。
recovery=(c(exosomes+plasma)-c(plasma)/c(exosomes))×100%(1)
实验结果表明(表3),mtgnp测得的加样(外泌体)回收率分别为100.0~108.0%(以与mir-1246结合产生荧光信号计算)和94.0~109.0%(以与mir-21结合产生荧光信号计算),说明探针检测到的信号强度是与血浆中外泌体响应产生的,且较为准确。
表3.mtgnp检测人血浆外泌体的回收率
注:#以mir-1246产生的荧光信号计算,*以mir-21产生的荧光信号计算。
2.mtgnp检测人血浆样本
以上结果说明,mtgnp应用于血浆外泌体的检测,不需提取分离血浆中外泌体,通过蛋白酶k和rnasea简单处理血浆后,将探针与血浆孵化即可检测进入其中与靶标响应。建立基于mtgnp原位检测血浆外泌体中靶标的方法进行临床乳腺癌患者血浆标本的分析:分别取21例乳腺癌患者和24例健康人的血浆样本40μl,加入0.5μl蛋白酶k(终浓度为0.1mg/ml)37℃孵化30min,再加入2.5μl蛋白酶k抑制剂pmsf(终浓度为5mm),室温孵化20min以中止蛋白酶k的作用,再加入1μlrnasea(终浓度为4u/ml)37℃孵化30min以破坏血浆游离rna,最后加入3μlmtgnp(终浓度为1nm)在4℃孵化1h,以hepes补充总体积为50μl。用多功能酶标仪分别测定各荧光基团的荧光强度,其激发波长与发射波长分别为:rox:575/605nm;cy5:630/670nm;cy7:743/767nm。绘制散点图和受试者工作特征曲线图(roc),对比两组样本的信号大小,结果如图7a)、7b)所示:由图7a)的散点图可知,以mir-1246为诊断指标时,健康对照组血浆(n=24)平均s/b=2.87±0.84;而乳腺癌患者(n=21)的信号为9.18±1.66,且所有的信号高于6.9,t检验显示乳腺癌组与正常对照组的平均信号水平有显著差异(p<0.0001);通过受试者工作特征曲线(roc)(图7b))说明在最佳截断值6.30处,阳性敏感度和特异性均为100%,曲线下面积(auc)为1;以mir-21为诊断指标时,健康对照组血浆(n=24)平均s/b=2.01±0.35;而乳腺癌患者(n=21)的信号为8.22±1.91,且所有的信号高于4.48,t检验显示乳腺癌组与正常对照组的平均信号水平有显著差异(p<0.0001);通过受试者工作特征曲线(roc)(图7c))说明在最佳截断值3.59处,阳性敏感度和特异性均为100%,曲线下面积(auc)为1,说明诊断的准确度高。
从血浆检测结果可知,与我们前期报道的单靶标mir-1246探针相比,多重靶标纳米金探针对乳腺癌血浆的检测具有更高的灵敏度和准确性,说明设计合成同时检测多个生物标志物mirna的探针用于诊断乳腺癌具有更高的准确性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>南方医科大学
<120>一种原位检测外泌体多重microrna的纳米金荧光探针及其制备方法与应用
<130>
<160>23
<170>patentinversion3.5
<210>1
<211>24
<212>dna
<213>人工序列
<400>1
ctcggattatgaagattacgggta24
<210>2
<211>14
<212>dna
<213>人工序列
<400>2
tacccgtaatcttc14
<210>3
<211>21
<212>dna
<213>人工序列
<400>3
tcaacatcagtctgataagct21
<210>4
<211>14
<212>dna
<213>人工序列
<400>4
agcttatcagactg14
<210>5
<211>19
<212>dna
<213>人工序列
<400>5
cctgctccaaaaatccatt19
<210>6
<211>12
<212>dna
<213>人工序列
<400>6
aatggatttttg12
<210>7
<211>19
<212>rna
<213>人工序列
<400>7
aauggauuuuuggagcagg19
<210>8
<211>22
<212>rna
<213>人工序列
<400>8
uagcuuaucagacugauguuga22
<210>9
<211>24
<212>rna
<213>人工序列
<400>9
uacccguaaucuucauaauccgag24
<210>10
<211>23
<212>rna
<213>人工序列
<400>10
ucaaaugcucagacuccuguggu23
<210>11
<211>25
<212>rna
<213>人工序列
<400>11
uggagugugacaauggugguguuug25
<210>12
<211>19
<212>dna
<213>人工序列
<400>12
aatggatttttggagcagt19
<210>13
<211>19
<212>dna
<213>人工序列
<400>13
aatggatttttggagcaat19
<210>14
<211>19
<212>dna
<213>人工序列
<400>14
aatgtctttttgctgcagg19
<210>15
<211>22
<212>dna
<213>人工序列
<400>15
tagcttatcagactgatgttgc22
<210>16
<211>22
<212>dna
<213>人工序列
<400>16
tagcttatcagactgatgtttc22
<210>17
<211>22
<212>dna
<213>人工序列
<400>17
tagctgctcagacttctgttga22
<210>18
<211>24
<212>dna
<213>人工序列
<400>18
tacccgtaatcttcataatccgat24
<210>19
<211>24
<212>dna
<213>人工序列
<400>19
tacccgtaatcttcataatccggt24
<210>20
<211>24
<212>dna
<213>人工序列
<400>20
tacccagaatcttcagcatccgag24
<210>21
<211>59
<212>dna
<213>人工序列
<400>21
gcgcctccgacatcaagataaatggatttttggagcagggcgcctccgacatcaagata59
<210>22
<211>79
<212>dna
<213>人工序列
<400>22
gcgcctccgacatcaagatcacatcaagataatggatttttggagcagggcgcctccgac60
atcaagatcacatcaagat79
<210>23
<211>110
<212>dna
<213>人工序列
<400>23
ggaggtcgcgtatgcctccgacatcaagatcacatcaagatcctgctccaaaaatccatt60
gcgcctccgacatcaagatcacaaataactaaaaaaaaaaaaaaaaaaaa110
- 还没有人留言评论。精彩留言会获得点赞!