一种活性肽融合蛋白及其制备方法与流程
1.本发明属于基因工程技术领域,具体涉及一种具备抗菌功能的活性肽融合蛋白及其制备方法。
背景技术:
2.抗菌肽(antimicrobial peptides,amps)是一类具有抗菌活性的生物短肽,一般由10-60个氨基酸残基组成。抗菌肽在自然界中分布广泛、种类繁多,从哺乳动物、鸟类、两栖动物、鱼类、昆虫到植物等生物体内均有发现,是机体先天性免疫系统的重要组成部分。目前已有成百上千种具有抗菌活性的多肽被分离鉴定。
3.抗菌肽的作用机理是与细胞膜表面相互作用,使细胞膜的通透性发生改变,打破酸碱平衡,改变渗透压平衡,形成离子通道,导致细菌裂解而死亡,因而对细菌、真菌、衣原体、支原体、病毒和肿瘤细胞等有着广泛的抑制作用。抗菌肽一般结合方式为非靶向结合,不容易产生耐药性,并且对抗生素耐药菌株有效,因而有望成为新一代的肽类抗生素,在医药、畜牧养殖添加剂、食品添加剂等方向具有广泛应用价值。
4.igg类的免疫球蛋白是人类血液中含量最多的蛋白质,其半衰期可长达21天,fc片段是保持igg免疫球蛋白较长半衰期的主要原因。fc片段和新生fc受体(fcrn)结合,避免了进入溶酶体中被降解。因此,igg的fc片段常被用来与活性蛋白或者肽段连接构成融合蛋白,用来提高活性蛋白或肽段的体内半衰期,达到长效的目的。
5.目前市场上传统抗菌肽由于片段小,入血后易被酶降解,半衰期较短,成药性差,因此,需要对传统抗菌肽分子进行适当修饰,以提高其抗菌效价、降低或消除其副作用。
6.中国专利201510486586.1中公开了一种抗菌肽-溶菌酶融合蛋白的制备方法,该蛋白从n端到c端依次包含抗菌肽thanatin蛋白、3gsa柔性肽、t4溶菌酶蛋白,该蛋白被证明在提高仔猪成活率、降低保育猪的腹泻率、降低保育猪的呼吸道病发病率方面具有显著效果,可用于制备相关药物制剂。但是该融合蛋白主要应用于畜牧养殖尤其猪的养殖中,应用范围较小。
7.中国专利201711091432.8中公开了一种抗菌融合蛋白及其用途,该融合蛋白含有抗菌蛋白片段rbpi21和抗菌肽ll-37,分子量大,能延长融合蛋白的体内的作用时间,并且还具有更广阔的抗菌谱,杀菌效果大为增强,可广泛应用于抗菌、抗内毒素等技术领域。但依靠分子量大小延长融合蛋白的作用时间的效果有待进一步优化。
技术实现要素:
8.为了解决上述问题,本发明针对传统抗菌肽半衰期短、成药性差的问题,提供了一种活性肽融合蛋白及其制备方法。本发明提供的活性肽是一种新型抗菌生物活性肽,其融合蛋白具有更好的抗菌活性、更低的溶血性及细胞毒性和更长的半衰期。此外,本发明提供的制备方法得率高,所制备的活性肽纯度高,为其实现产业化奠定了技术基础。
9.一方面,本发明提供了一种生物活性肽,该生物活性肽为抗菌肽。所述的生物活性
肽的氨基酸序列为seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5中的一种;优选为seq id no:2。所述的生物活性肽不属于任何传统分类的抗菌肽,属于新型抗菌肽,是在传统的哺乳动物来源抗菌肽基础上,进行了氨基酸序列优化改造。
10.应当明确的是,本发明提供的生物活性肽单独存在时即可发挥抗菌效果,或和其它蛋白融合存在时亦可发挥抗菌效果。
11.另一方面,本发明提供了一种具备抗菌功能的融合蛋白,所述的融合蛋白包括:具有抗菌作用的生物活性肽(抗菌肽)和其他蛋白。
12.所述的融合蛋白为单体或同源二聚体;所述的同源二聚体的两个单体的相互作用为非共价或者共价结合。
13.进一步地,所述的融合蛋白包括:具有抗菌作用的生物活性肽,fc片段或其突变体,和链接元件。
14.具体地,所述的融合蛋白可以表示为rept@fc,其中rept代表生物活性肽;@代表了链接元件,将rept和fc结合在一起;fc代表人fc片段或其突变体。
15.优选地,所述的融合蛋白为单体。
16.另优选地,所述的融合蛋白为同源二聚体;所述的同源二聚体包含了两条相同的肽链(或称单体),两个单体的相互作用为非共价或者共价结合。
17.进一步地,所述的生物活性肽的氨基酸序列为seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5中的一种;优选为seq id no:2。
18.进一步地,所述的生物活性肽不属于任何传统分类的抗菌肽,属于新型抗菌肽,是在传统的哺乳动物来源抗菌肽基础上,进行了氨基酸序列优化改造。
19.具体地,所述的fc片段是igg免疫球蛋白的恒定区片段。
20.进一步地,所述的fc片段包含免疫球蛋白ch2和ch3区;所述的免疫球蛋白来自人或其他哺乳动物。
21.优选地,所述的fc片段来自人,进一步优选为人igg4免疫球蛋白。
22.具体地,所述的融合蛋白由rept直接或者间接与fc片段通过链接元件连接而成,其中,所述地链接元件是由2-20个柔性氨基酸组成,所述地氨基酸选自gly、ser、ala、thr中的至少一种。
23.进一步地,所述地链接元件为(ala-ala-ala-ala-ser)
n
;其中n为1-5之间的整数,优选为2。
24.在一些实施例中,所述的活性肽融合蛋白为seq id no:6所示的氨基酸序列或与seq id no:6所示的氨基酸序列具有90%以上同源性且具有相同功能的衍生蛋白质。
25.再一方面,本发明提供了含有前述融合蛋白编码基因的生物材料。
26.具体地,所述的生物材料包括但不限于含有前述融合蛋白编码基因的质粒载体及转基因的宿主细胞。
27.又一方面,本发明提供了前述融合蛋白的制备方法。
28.具体地,包括以下步骤:
29.(1)基因合成:人工合成目的蛋白质的编码基因,并对编码基因进行密码子优化;
30.(2)转化表达:将优化后的编码基因构建到真核表达载体上,通过电转或者化学试剂转染入真核细胞中,并在真核细胞中表达;
31.(3)分离纯化目的融合蛋白。
32.所述的步骤(2)的转化表达方法包括瞬时转染表达和稳定转染表达。
33.优选地,所述瞬时转染表达真核表达载体为ptt5。
34.优选地,所述瞬时转染表达真核细胞为expi cho-s细胞。
35.优选地,所述稳定转染表达真核表达载体为pcdna3.1(+)。
36.优选地,所述稳定转染表达真核细胞为cho细胞。
37.所述的步骤(3)纯化方法包括但不限于亲和色谱法、离子交换法、体积排阻法、超滤法。
38.在一些实施例中,优化后的rept@fc核苷酸序列如seq id no:7所示。
39.又一方面,本发明提供了上述融合蛋白在制备抗菌制剂中的应用。
40.具体地,所述的抗菌制剂作用菌包括但不限于革兰氏阴性菌、革兰氏阳性菌或真菌;进一步地,所述的抗菌制剂作用菌包括但不限于大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌或白色念珠菌。
41.具体地,所述应用包括但不限于,将前述融合蛋白作为添加剂制备抗菌制剂。
42.所述抗菌制剂包括但不限于注射剂、溶液剂、凝胶剂、乳液剂、吸入剂、滴眼剂、喷雾剂。
43.所述的抗菌制剂中还可能包含其他可接受的载体或添加剂,包括但不限于乙醇、微晶纤维素、羟甲基纤维素纳、卡波姆、聚山梨酯类、泊洛沙姆、吐温-80、甘油。
44.又一方面,本发明提供了一种抗菌制剂。
45.所述的抗菌制剂包括前述的融合蛋白。
46.所述的融合蛋白在抗菌制剂中的添加量为0-1000mg/g,优选为100-200mg/g。
47.所述抗菌制剂包括但不限于注射剂、溶液剂、凝胶剂、乳液剂、吸入剂、滴眼剂、喷雾剂。
48.所述的抗菌制剂中还可能包含其他可接受的载体或添加剂,包括但不限于乙醇、微晶纤维素、羟甲基纤维素纳、卡波姆、聚山梨酯类、泊洛沙姆、吐温-80、甘油。
49.本发明的研究显示,如上所述的活性肽融合蛋白对革兰氏阴性菌、革兰氏阳性菌或真菌,具有广谱性,应用范围广,这表明本发明提供的活性肽可以用于制备成抗菌制剂,为当前杀菌消毒领域提供一种新的选择。
附图说明
50.图1为rept@fc二聚体示意图。
51.图2为ptt5-rept@fc和pcdna3.1(+)-rept@fc的载体图谱。
52.图3为融合蛋白sds-page结果。
53.图4为融合蛋白hplc-sec结果。
具体实施方式
54.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊
说明,均可从商业途径得到。
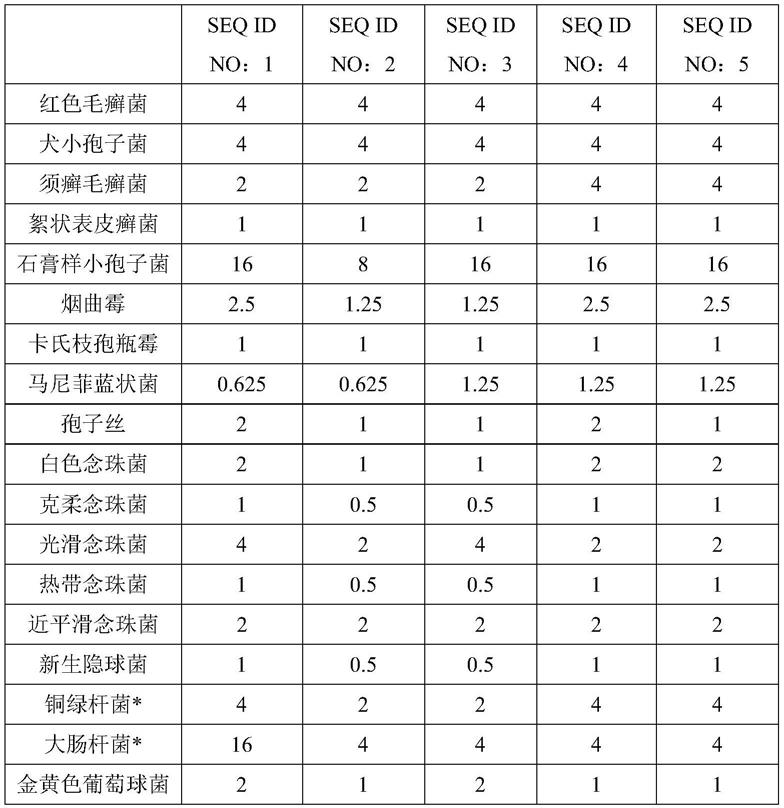
55.实施例1生物活性肽抗菌敏感性试验
56.本实施例中的检测的5种生物活性肽可依据本领域常规的化学合成或克隆表达的方法获得,无论哪种方法获得,均为鉴定过序列正确性的肽产物。本实施例中为化学合成方式。
57.1)实验菌株为18种实验室保存的标准菌株和临床分离菌株,其中包括耐药菌。
58.2)培养基:mh琼脂培养基由中国药品生物制品检定所购进,mh肉汤培养基和脑心浸液培养基为difco公司产品。
59.3)供试药物:待测生物活性肽由外包公司采用化学固相合成,纯度检定大于95%。
60.4)试验步骤:采用二倍稀释法进行药敏试验,18种试验菌分别用营养脑心浸液或者mh肉汤培养基扩增;
61.供试样品溶解后用相应培养基二倍稀释成各种所需的浓度,分别加适量到孔板中;
62.将扩增的试验菌等体积加入相应的孔板中,37℃培养24小时,测定od
600
的吸光值,判定最低抑菌浓度mic。
63.seq id no:1-5生物活性肽最低抑菌浓度mic(μg/ml)统计表:
[0064][0065]
注:上表中标注*的菌为耐药菌。
[0066]
从mic分析可以得出,seq id no:1-5的生物活性肽都具有良好的抑菌能力,其中对念珠菌抑制作用很高,其中seq id no:2具有较优的抑菌能力,因此作为候选序列进行进一步开发,但这并不作为对本发明权利要求的保护范围的限定,在本发明权利要求的保护范围内,通过以上试验可以知晓,seq id no:1-5均能够实现相应技术效果。
[0067]
实施例2一种表达融合rept@fc蛋白的重组细胞株的构建
[0068]
rept@fc质粒构建:根据基因库中搜索到的人igg4的基因序列,经过密码子优化后人工合成获得rept@fc(seq id no:7)的核苷酸序列,rept@fc基因经基因合成公司合成并通过ta克隆构建到ptt5和pcdna3.1(+)中,测序验证构建质粒的准确性,获得重组质粒dna。
[0069]
rept@fc氨基酸序列为seq id no:6,编码rept@fc氨基酸的核苷酸为seq id no:7。
[0070]
构建含有活性肽融合蛋白的表达载体的方法如下:
[0071]
(1)采用全基因合成技术合成rept@fc的基因片段:seq id no:7。seq id no:7中包括seq id no:8,seq id no:9,seq id no:10。其中,seq id no:8为生物活性肽rept基因序列,该序列是根据cho细胞偏好性进行设计,其编码的氨基酸序列为seq id no:2;seq id no:9为链接元件aaaat的基因序列,作用是链接rept和fc;seq id no:10为人fc的基因序列,氨基酸序列为:seq id no:11,作用为增强活性肽的抑菌能力及延长活性肽的半衰期;5’端和3’端分别具有限制性内切酶ecori和bamhi。
[0072]
上述序列表达的rept@fc氨基酸序列如seq id no:6所示。
[0073]
(2)载体组装克隆:
[0074]
本实施例采用gibson组装的方法构建表达载体;具体是以步骤(1)合成的rept@fc基因片段为模板,常规方法设计引物进行pcr扩增,回收681bp的片段,即为活性肽融合蛋白基因。活性肽融合蛋白基因采用cutsmart缓冲液在37℃的孵育温度下,50倍量的ncoi和xhoi进行消化、酶切1h,用ecori和bamhi酶切ptt5和pcdna3.1载体,回收5.3k的线性化载体。将线性载体dna100ng,pcr片段dna500ng,加入10μl 2
×
gibson mix,添加无菌水至20μl,在50℃的温度下孵育半个小时。取10μl组装产物转化大肠杆菌化学感受态细胞dh10b,转化菌液涂布于含100μg/ml氨苄霉素的lb平板上37℃过夜培养,次日挑取单克隆提取质粒测序,构建得到含有rept@fc的表达载体,该载体命名为ptt5-rept@fc和pcdna3.1(+)-rept@fc。构建后的载体图谱见图2。
[0075]
构建含有pcdna3.1(+)-rept@fc表达载体的重组cho细胞株方法如下:
[0076]
将测序正确的重组载体pcdna3.1(+)-rept@fc通过常规方法转化cho细胞株,得到的重组cho细胞命名为cho-pcdna3.1(+)-rept@fc。
[0077]
实施例3生物活性肽融合蛋白rept@fc的表达
[0078]
实施例2得到的重组cho细胞cho-pcdna3.1(+)-rept@fc按照3-5
×
105cells/ml传代培养,培养条件为温度37℃、co
2 5%、转速120rpm、湿度70-80%,培养3-4天,细胞密度为3-4
×
106cells/ml。转染当天取样计数,控制细胞密度不高于4
×
106cells/ml,细胞活率大于95%。dna的用量1μg/ml,pei的用量为3μg/ml,将dna和pei加入细胞培养体积10%的opti-mem培养基中37℃孵育15min,然后使用移液器将其缓慢加入到细胞培养液中,该过程应在3min内完成,然后将转染后的细胞放入摇床中继续培养。转染24h后,添加10%supplement补料培养基,并降温至32℃继续培养,培养过程控制葡萄糖的含量为2-8g/l。当
活细胞密度低于70%,取细胞悬液10000rpm离心30min收集rept@fc上清。
[0079]
实施例4生物活性肽融合蛋白rept@fc纯化
[0080]
用pbs(ph=7.0)缓冲液平衡protein a亲和介质(购自美国ge公司),然后将实施例4中的上清上载到proteina亲和柱上,大于3倍柱体积的pbs(ph=7.0)缓冲液洗杂,100mm柠檬酸缓冲液(ph=3.0)洗脱、收集流出液,流出液用100mm tris-hcl(ph=9.0)缓冲液中和至中性。
[0081]
实施例5生物活性肽融合蛋白rept@fc鉴定
[0082]
实施例4收集的融合蛋白sds-page结果如图3所示,hplc-sec结果如图4所示。
[0083]
实施例6生物活性肽融合蛋白rept@fc抗菌敏感性实验
[0084]
参考实施例1的方法对实施例4纯化后的生物活性肽融合蛋白rept@fc进行抗菌敏感性实验,所得结果如下:
[0085][0086][0087]
结果表明,生物活性肽融合蛋白rept@fc相对于单纯的生物活性肽的抗菌作用好,最低抑菌浓度更低,即在达到同样的抑菌效果时,使用量更少。
[0088]
实施例6 sd大鼠静脉给予rept@fc急性毒性试验
[0089]
通过sd大鼠单次静脉注射给予rept@fc,以评价rept@fc引起的毒性反应和动物死亡情况。本试验共设计2组,每组10只动物,雌雄各半。本试验给予剂量分别为0(阴性对照)和200mg/kg体重。给药后密切观察动物临床症状6小时,此后连续观察14天。给药前动物称
重1次,以后每周1次。观察期结束后,所有存活的动物均进行解剖。
[0090]
整个试验期间未见动物死亡。试验期间各组动物临床观察均未见明显异常。给药前、后第7天和第14天200mg/kg体重组雌、雄动物平均体重与0mg/kg组动物相比无统计学差异。观察期间大体解剖未见给药后有关的异常。
[0091]
可见,rept@fc融合蛋白最大耐受剂量(mtd)大于200mg/kg,具有良好的安全性。
[0092]
实施例7其它融合蛋白的制备与检测
[0093]
参照实施例2-6的制备方法和检测方法对分别利用本申请seq id no:1、3、4、5构成的融合蛋白进行制备和检测。融合蛋白1的氨基酸序列如seq id no:12所示;融合蛋白3的氨基酸序列如seq id no:13所示;融合蛋白4的氨基酸序列如seq id no:14所示;融合蛋白5的氨基酸序列如seq id no:15所示。结果如下:
[0094][0095][0096]
结果表明,生物活性肽融合蛋白1、3、4、5相对于单纯的生物活性肽(seq id no:1、3、4、5)的抗菌作用好,最低抑菌浓度更低,即在达到同样的抑菌效果时,使用量更少。且生物活性肽蛋白均具有良好的安全性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1