一种T细胞抗原受体、其多聚体复合物及其制备方法和应用
一种t细胞抗原受体、其多聚体复合物及其制备方法和应用
技术领域
1.本发明涉及生物医药技术领域,具体涉及一种t细胞抗原受体、多聚体复合物,及其制备方法和应用。
背景技术:
2.eb病毒(epstein-barr virus,ebv)是epstein和barr于1964年从伯基特氏淋巴瘤(burkitt’s lymphoma,bl)的样本中分离的一种γ疱疹病毒,也是第一个被公认的致瘤病毒。ebv原发感染主要发生在人类口咽部的上皮细胞,后因其显著的嗜b淋巴细胞特性,能感染b细胞并在记忆b细胞中长期潜伏存在,导致被感染者终身携带,故而在成人血清中病毒抗体的阳性率超过90%。尽管ebv感染对绝大多数免疫功能正常的人并不会构成太大的威胁,但对于患有先天性或获得性免疫缺陷的人群,ebv会导致多种危及生命的疾病。此外,ebv潜伏感染表达的蛋白(6个核蛋白ebna1、2、3a、3b和3c,ebna-lp以及3个潜伏期膜蛋白lmp1、lmp2a、lmp2b)能刺激细胞增生和转化,已被证实与多种恶性肿瘤的发生、发展、临床预后直接相关,包括ebv相关的移植后淋巴细胞增生性疾病(ebv related post-transplant lymphoproliferative diseases,ebv-ptld)、伯基特氏淋巴瘤、霍奇金淋巴瘤(hodgkin’s lymphoma,hl)、鼻咽癌(nasopharyngeal carcinoma,npc)、胃癌(gastric cancer)等。根据潜伏蛋白在这些疾病中的差异表达,将ebv潜伏型分为i、ii、iii期。目前,靶向eb病毒的抗病毒治疗由于耐药性以及严重副作用等问题,尚不能实现对多种ebv相关疾病的有效控制。
3.papadopounds等最先发现,输注ebv健康携带者的淋巴细胞可以治愈ptld患者,随后临床发展出自体ebv-ctls细胞疗法。目前ebv-ctls已在ebv相关淋巴瘤和鼻咽癌中开展了临床应用,发现其人体内安全性良好并有一定的治疗效果,但体外培养的ctls的诸多不足也限制了其临床疗效。首先,ctls中肿瘤相关ebv抗原的特异性t细胞数量较少(<0.05%),因此一般需进行大剂量(大于10
10
)的多次回输(4-6次);其次,较长的制备周期导致等待治疗时间长,伴随着的t细胞分化亚群的变化进一步导致其体内功能弱;此外,制备的细胞因人而异,疗效难以保证。因此,亟待开发更特异性、体内杀伤肿瘤能力更强、更持久的靶向ebv抗原的细胞免疫疗法,用于ebv相关鼻咽癌或淋巴瘤的治疗。
4.t细胞是获得性免疫系统的重要组成部分,介导了病原体、自身病变细胞和肿瘤的清除,是维持机体稳态的防护力量。t细胞受体(t cell receptor,tcr)是t细胞的身份标识,tcr通过对靶细胞主要组织相容性复合体(mhc)及所提呈的抗原复合体的识别,引发t细胞的激活和一系列后续细胞信号传递和其他生理反应,从而使得抗原特异性的t细胞对其靶细胞发挥免疫效应。tcr-t细胞疗法是将肿瘤/病毒抗原肽高特异性、高亲和力的t细胞受体克隆后,通过基因转导技术导入患者自体的t细胞,使自体t细胞可以特异的识别肿瘤/病毒的抗原多肽,进而清除肿瘤或病原体的技术。与car-t相比,tcr-t疗法可识别更广泛的肿瘤抗原(胞内蛋白和膜蛋白),呈现更加强的杀伤作用的同时伴随较低细胞因子风暴,对实体瘤的治疗有更大的潜力。目前tcr-t疗法已在肺癌、结肠癌、滑膜细胞肉瘤等多种实体肿
瘤的临床试验中观察到显著疗效,但因为主要针对的靶点多为肿瘤相关抗原如cea、gp100、mart-1、maga-a3和ny-eso-1等,发现了脱靶效应和毒副作用。对于ebv感染相关的恶性疾病,ebv抗原作为外来抗原,有较强的免疫原性并且不易发生脱靶效应,是理想的潜在靶标。
5.ebv潜伏膜蛋白lmp2a能促进细胞的增殖、存活和迁移并协助上皮间质转化,是所有ii型和iii型疾病/恶性肿瘤中表达的ebv主要基因之一。据文献报道,在回输的ebv-ctl中,lmp2特异性的ctl细胞比例与其临床疗效密切相关,这些证据表明lmp2可以作为ebv感染相关的ii/iii型疾病如鼻咽癌治疗的靶点。例如:专利cn1526072a公开了ebv肿瘤相关潜伏膜蛋白的胞外结构域的鉴定方法和与之反应的抗体试剂的选择方法,并具体公开了ebv lmp2胞外域的氨基酸序列。专利cn1269804a中公开的众多ebv的t细胞ctl表位。专利cn108289950a公开了一种特异于人hla呈递的ebv lmp2的t细胞受体样抗体药剂,其中所述的t细胞受体识别的抗原肽表位为clgglltmv。专利wo2017085471公开了一种特异识别抗原肽为sscsscplsk的tcr序列。此外,非专利文献dual non-contiguous peptide occupancy of hla class i evoke antiviral human cd8 t cell response and form neo-epitopes with self-antigens(ziwei xiao等,sci rep,2017)公开了在hla-a*1101个体中,有7/8的个体利用相同的trbv4-1片段作为ssc的主要识别特异性。专利cn109306005a公开了一种eb病毒特异性t细胞抗原受体及其应用。但是,现有技术中均未公开本发明所述的tcr。
技术实现要素:
6.本发明发现lmp2蛋白的hla-a*0201限制肽flyalalll,是免疫原性较强的抗原表位,可以引发机体产生特异的t淋巴细胞和相应的免疫反应,因此,本发明提供了可以特异性结合ebv潜伏期蛋白lmp2肽(包含序列flyalalll)的t细胞抗原受体及其在制备治疗与ebv相关疾病的产品中的应用。本发明所述的tcr能够特异性地识别对应的pmhc复合物,激活tcr t细胞,进而产生高水平的细胞因子ifnγ、il2、tnfα,显著地杀伤靶细胞并延长负荷肿瘤的小鼠的寿命。
7.具体的,本发明的第一方面,提供了一种t细胞抗原受体,所述的t细胞抗原受体特异性结合ebv潜伏期膜蛋白lmp2,其中,结合表位包含seq id no:5。
8.优选的,所述的ebv潜伏期膜蛋白lmp2包含seq id no:28所示的氨基酸序列,或者包含与seq id no:28具有至少80%同源性的氨基酸序列。优选的,所述的t细胞抗原受体至少包含一个α链可变区和/或β链可变区。优选的,所述的t细胞抗原受体是αβ异二聚体。优选的,其包含α链的cdr1α-cdr3α和β链的cdr1β-cdr3β。
9.进一步优选的,cdr3α的氨基酸序列如seq id no:37或38所示,或与seq id no:37或38所示氨基酸序列具有至少80%同源性。进一步优选的,cdr3β的氨基酸序列如seq id no:39或40所示,或与seq id no:39或40所示氨基酸序列具有至少80%同源性。进一步优选的,cdr1α的氨基酸序列如seq id no:41所示或与seq id no:41所示氨基酸序列具有至少80%同源性。进一步优选的,cdr2α的氨基酸序列如seq id no:42或与seq id no:42所示氨基酸序列具有至少80%同源性。进一步优选的,cdr1β的氨基酸序列如seq id no:43所示或与seq id no:43所示氨基酸序列具有至少80%同源性。进一步优选的,cdr2β的氨基酸序列如seq id no:44所示或与seq id no:44所示氨基酸序列具有至少80%同源性。
10.更进一步优选的,cdr1α-cdr3α和cdr1β-cdr3β选自:seq id no:41、42、37、43、44、39;seq id no:41、42、38、43、44、40;seq id no:41、42、38、43、44、39;或,seq id no:41、42、37、43、44、40。
11.在本发明的一个具体实施方式中,所述的cdr1α-cdr3α及cdr1β-cdr3β选自下列任一组:
[0012][0013]
在本发明的一个具体实施方式中,所述的α链的氨基酸序列如seq id no:33或34所示,或与seq id no:33或34所示氨基酸序列具有至少80%同源性。
[0014]
在本发明的一个具体实施方式中,所述的β链的氨基酸序列如seq id no:31或32所示,或与seq id no:31或32所示氨基酸序列具有至少80%同源性。
[0015]
优选的,所述t细胞抗原受体的α链和β链通过linker序列连接,linker序列优选为furin-sgsg-p2a序列(以下简写fp2a)。进一步优选的,所述的fp2a的氨基酸序列如seq id no:35所示。优选的,所述的连接顺序可以为α链、fp2a、β链,或者β链、fp2a、α链。
[0016]
在本发明的一个具体实施方式中,所述的连接顺序为β链、fp2a、α链。
[0017]
在本发明的一个具体实施方式中,所述t细胞抗原受体的氨基酸序列选自seq id no:22或23所示,或与seq id no:22或23所示氨基酸序列具有至少80%同源性。
[0018]
优选的,所述的t细胞抗原受体通过主要组织相容性复合物分子(mhc)或多聚体复合物的呈递,与来自ebv潜伏期膜蛋白lmp2肽特异性结合。其中,所述的多聚体复合物包含抗原肽,所述的抗原肽包含seq id no:5。优选的,所述的多聚体复合物还包括单体,生物素分子,以及链霉亲和素分子或亲和素分子,其中,所述单体包括mhc分子α链胞外区和β2m链,所述单体与所述生物素分子偶联,所述生物素分子与所述链霉亲和素或亲和素分子结合。
[0019]
本发明的第二方面,提供了一种抗体或其抗原结合片段,所述的抗体或其抗原结合片段特异性结合ebv潜伏期膜蛋白lmp2,其中,结合表位包含seq id no:5。
[0020]
优选的,所述的ebv潜伏期膜蛋白lmp2包含seq id no:28所示的氨基酸序列,或者包含与seq id no:28具有至少80%同源性的氨基酸序列。优选的,所述的抗体或其抗原结合片段至少包含一个α链可变区和/或β链可变区。优选的,所述的抗体或其抗原结合片段是αβ异二聚体。优选的,其包含α链的cdr1α-cdr3α和β链的cdr1β-cdr3β。
[0021]
进一步优选的,cdr3α的氨基酸序列如seq id no:37或38所示,或与seq id no:37或38所示氨基酸序列具有至少80%同源性。进一步优选的,cdr3β的氨基酸序列如seq id no:39或40所示,或与seq id no:39或40所示氨基酸序列具有至少80%同源性。进一步优选的,cdr1α的氨基酸序列如seq id no:41所示或与seq id no:41所示氨基酸序列具有至少80%同源性。进一步优选的,cdr2α的氨基酸序列如seq id no:42或与seq id no:42所示氨基酸序列具有至少80%同源性。进一步优选的,cdr1β的氨基酸序列如seq id no:43所示或与seq id no:43所示氨基酸序列具有至少80%同源性。进一步优选的,cdr2β的氨基酸序列
如seq id no:44所示或与seq id no:44所示氨基酸序列具有至少80%同源性。
[0022]
更进一步优选的,cdr1α-cdr3α和cdr1β-cdr3β选自:seq id no:41、42、37、43、44、39;seq id no:41、42、38、43、44、40;seq id no:41、42、38、43、44、39;或,seq id no:41、42、37、43、44、40。
[0023]
在本发明的一个具体实施方式中,所述的cdr1α-cdr3α及cdr1β-cdr3β选自下列任一组:
[0024][0025][0026]
在本发明的一个具体实施方式中,所述的α链的氨基酸序列如seq id no:33或34所示,或与seq id no:33或34所示氨基酸序列具有至少80%同源性。
[0027]
在本发明的一个具体实施方式中,所述的β链的氨基酸序列如seq id no:31或32所示,或与seq id no:31或32所示氨基酸序列具有至少80%同源性。
[0028]
优选的,所述抗体或其抗原结合片段的α链和β链通过linker序列连接,linker序列优选为furin-sgsg-p2a序列(以下简写fp2a)。进一步优选的,所述的fp2a的氨基酸序列如seq id no:35所示。优选的,所述的连接顺序可以为α链、fp2a、β链,或者β链、fp2a、α链。优选的,所述的抗体或其抗原结合片段还可以包含如fab、fab’、fab
’-
sh、fv、scfv、(fab’)2、单结构域抗体、双抗体(dab)或线性抗体的片段。
[0029]
在本发明的一个具体实施方式中,所述的连接顺序为β链、fp2a、α链。
[0030]
在本发明的一个具体实施方式中,所述抗体或其抗原结合片段的氨基酸序列选自seq id no:22或23所示,或与seq id no:22或23所示氨基酸序列具有至少80%同源性。
[0031]
本发明的第三方面,提供了一种核酸,所述的核酸编码本发明所述的抗体或其抗原结合片段,或者本发明所述的t细胞抗原受体的cdr1α-cdr3α、cdr1β-cdr3β、α链、β链或t细胞抗原受体。
[0032]
优选的,编码t细胞抗原受体α链的核酸序列如seq id no:14或15所示,或与seq id no:14或15核酸序列具有至少80%同源性。优选的,编码t细胞抗原受体β链的核酸序列如seq id no:9或10所示,或与seq id no:9或10核酸序列具有至少80%同源性。优选的,所述编码t细胞抗原受体α链的核酸序列与编码t细胞抗原受体β链的核酸序列之间通过编码fp2a的核酸序列链接。其中,所述的fp2a的核酸序列如seq id no:36所示或与seq id no:36所示核酸序列具有至少80%同源性。优选的,编码抗体或其抗原结合片段或者t细胞抗原受体的核酸序列如seq id no:29或30所示,或与seq id no:29或30所示核酸序列具有至少80%同源性。优选的,所述的核酸序列可以是经密码子优化的。进一步优选的,所述的密码子优化包括将病毒等使用的大量稀有密码子变为对应的哺乳动物密码子和/或移除mrna不稳定基序和/或隐藏的剪接位点。
[0033]
本发明的第四方面,提供了一种表达载体,所述的表达载体包含本发明所述的核酸。
[0034]
优选的,所述的表达载体能够在体内或体外或离体条件下表达。进一步优选的,所述的表达载体在体内细胞中持续高水平表达。优选的,所述的表达载体为原核表达载体或慢病毒表达载体。进一步优选的,所述的原核表达载体为大肠杆菌系列。在本发明的一个具体实施方式中,所述的表达载体为pet-26b或pet28a+。
[0035]
在本发明的一个具体实施方式中,所述的表达载体为phage-ires-rfp。
[0036]
进一步优选的,所述的表达载体中β链、α链与骨架载体的连接顺序为启动子、β链、furin-p2a、α链、ires和rfp序列。
[0037]
本发明的第五方面,提供了一种宿主细胞,所述的宿主细胞包含本发明所述的核酸或所述的表达载体。
[0038]
优选的,所述的宿主细胞可以是真核的或原核的。更优选的,所述的宿主细胞为酵母细胞、293细胞、cho细胞、大肠杆菌等。
[0039]
在本发明的一个具体实施方式中,所述的宿主细胞为stbl3、bl21或transetta。
[0040]
本发明的第六方面,提供了一种免疫细胞,所述的免疫细胞表达本发明所述的t细胞抗原受体。
[0041]
优选的,所述的免疫细胞包括但不限于淋巴细胞(包括t细胞、b细胞)。进一步,所述免疫细胞是b细胞,所述b细胞表达上述的抗体或其抗原结合片段。所述免疫细胞是t细胞,所述t细胞的t细胞抗原受体结构如上所限定。
[0042]
本发明的第七方面,提供了一种免疫细胞的制备方法,包括将编码本发明所述的t细胞抗原受体的核酸序列转染至免疫细胞中表达获得。
[0043]
优选的,所述的免疫细胞包括但不限于淋巴细胞(包括t细胞、b细胞)。进一步,所述免疫细胞是b细胞,所述b细胞表达上述的抗体或其抗原结合片段。所述免疫细胞是t细胞,所述t细胞的t细胞抗原受体结构如上所限定。优选的,还包括敲除细胞内源性tcr的步骤。具体的,可以为将靶向内源tcr的guide构建至慢病毒载体,与包装质粒、转染试剂共转至t细胞。
[0044]
本发明的第八方面,提供了一种重组t细胞的制备方法,包括如下步骤:
[0045]
1)从阳性t细胞克隆得到本发明的核酸序列;2)分离、培养原代t细胞;3)将步骤1)得到的核酸序列递送至步骤2)所述的原代t细胞中,获得表达本发明所述t细胞抗原受体的重组t细胞。
[0046]
优选的,所述的t细胞选自造血干细胞或外周血淋巴细胞(pbl)源t细胞。
[0047]
本发明的第九方面,提供了一种抗体或其抗原结合片段或t细胞抗原受体的制备方法,包括如下步骤:
[0048]
(1)从阳性t细胞克隆得到本发明的核酸序列;(2)将步骤(1)得到的核酸序列连接至载体骨架,获得表达载体;(3)将步骤(2)获得的表达载体转化至宿主细胞,然后诱导其表达;(4)获得抗体或其抗原结合片段或者t细胞抗原受体。
[0049]
优选的,所述的阳性t细胞为与mhc呈递的ebv潜伏期膜蛋白lmp2肽特异性结合。进一步优选的,所述的mhc呈递的ebv潜伏期膜蛋白lmp2肽为单体或多聚体复合物。
[0050]
本发明的第十方面,提供了一种多聚体复合物,所述多聚体复合物包含本发明所述的t细胞抗原受体。
[0051]
优选的,所述多聚体复合物还包括单体,生物素分子,以及带荧光标记的链霉亲和
素分子或亲和素分子,其中,所述单体包括mhc分子α链胞外区和β2m链及抗原肽,所述单体与所述生物素分子偶联,所述生物素分子与所述链霉亲和素或亲和素分子结合。优选的,所述的mhc分子α链胞外区的c端连接avi-tag序列。优选的,所述的mhc分子α链胞外区不含信号肽序列。并在成熟肽序列前面添加m氨基酸。优选的,所述的β2m链不含有信号肽序列。且在成熟肽序列前面添加m和a两个氨基酸。
[0052]
在本发明的一个具体实施方式中,所述的β2m链为不含信号肽且在成熟肽序列前加了两个氨基酸,优选为m、a。
[0053]
进一步优选的,所述的抗原肽包含seq id no:5。进一步优选的,所述的mhc分子选自hla-a*0201。
[0054]
在本发明的一个具体实施方式中,所述的多聚体复合物包含:
[0055]
(1)t细胞抗原受体;优选为seq id no:22或23,或与seq id no:22或23所示氨基酸序列具有至少80%同源性;(2)单体,所述的单体包括抗原肽、c端连接avi-tag序列的mhc分子α链胞外区和不含信号肽的β2m链;所述的抗原肽为seq id no:5;(3)生物素分子;以及(4)链霉亲和素分子或亲和素分子;其中,所述单体与所述生物素分子偶联,所述生物素分子与所述链霉亲和素或亲和素结合。
[0056]
优选的,所述的mhc分子为mhc i类分子或mhc ii类分子。更优选的,所述的mhc分子为mhc i类分子。优选的,所述的mhc分子选自hla-a*0201。
[0057]
在本发明的一个具体实施方式中,所述的mhc分子α链的氨基酸序列如seq id no:33或34所示,或与seq id no:33或34所示氨基酸序列具有至少80%同源性。
[0058]
在本发明的一个具体实施方式中,所述的mhc分子的β2m链如seq id no:3所示或与seq id no:3所示氨基酸序列具有至少80%同源性。
[0059]
为提高抗原肽-mhc四聚体与t细胞抗原受体结合的特异性,所述的单体还包括至少一个氨基酸的化学修饰、突变、插入和/或缺失。
[0060]
优选的,所述的mhc分子α链胞外区和β2m链为非共价缔合或共价连接。进一步优选的,所述共价连接为经由二硫键连接。
[0061]
优选的,所述的多聚体复合物至少包含一个单体。优选的,每个单体至少偶联一个生物素分子。
[0062]
本发明的第十一方面,提供了一种本发明所述的多聚体复合物的制备方法,包括如下步骤:i)表达和纯化在c端连接avi-tag序列的mhc分子α链胞外区和β2m链;ii)将抗原肽、步骤i)获得的在c端连接avi-tag序列的mhc分子α链胞外区和β2m链复性折叠,制备单体;iii)将步骤ii)制备的单体生物素化,获得生物素化的单体;iv)将步骤iii)获得的生物素化的单体与带荧光标记的链霉亲和素或亲和素反应,制备抗原肽-mhc分子四聚体;v)将步骤iv)得到的抗原肽-mhc分子四聚体与t细胞共孵育,形成t细胞抗原受体与抗原肽-mhc分子四聚体复合物,钓取特异性t细胞抗原受体。
[0063]
优选的,所述步骤i)中包括分别克隆在编码c端连接avi-tag序列的mhc分子α链胞外区的核苷酸序列和mhc分子β2m链的核苷酸序列,连接至载体后,转化到表达菌中培养,加入诱导剂,提取包涵体。进一步优选的,所述表达菌培养至od
600
值在0.2-0.4之间。进一步优选的,所述诱导剂加入后的最终摩尔浓度为0.5-1mm。
[0064]
优选的,诱导表达4-6h。优选的,所述步骤ii)包括β2m链的复性折叠,即将抗原肽、
mhc分子β2m链、c端连接avi-tag序列的mhc分子α链胞外区依次加入稀释缓冲液中避光水浴,其中,所述的β2m链的复性折叠包括包涵体变性、加入蛋白酶抑制剂,而后透析。优选的,所述的抗原肽、不含信号肽的β2m链与c端连接avi-tag序列的α链的摩尔比为(30-50):(2-2.5):1。进一步优选为40:2:1。优选的,所述步骤ii)中还包含纯化单体的步骤。优选的,所述步骤iii)中的生物素化是在bira酶的催化下,将单体与biomixa、biomixb结合。优选的,所述步骤iii)中还包括纯化生物素化单体的步骤。优选的,所述步骤iv)中的单体与链霉亲和素反应的摩尔比为(4-7):1。
[0065]
本发明的第十二方面,提供了本发明所述的t细胞抗原受体、所述的抗体或其抗原结合片段、所述的核酸、所述的表达载体、所述的宿主细胞、所述的免疫细胞或者所述的多聚体复合物的应用,所述的应用包括在制备诊断或治疗与ebv相关疾病的产品中的应用,或者在t细胞标记、检测、细胞分选或活化中的应用。
[0066]
优选的,所述的与ebv相关疾病选自传染性单核细胞增多症、连锁淋巴细胞增生综合症、病毒性嗜血细胞综合症、口腔毛状黏膜白斑病、病毒性脑膜炎、周围神经炎、病毒性肺炎、病毒性心肌炎、鼻咽癌、霍奇金淋巴瘤、伯基特淋巴瘤、胃癌、肝细胞癌、淋巴上皮样肉瘤、唾液腺肿瘤、乳腺癌、胸腺瘤、原发性渗出性淋巴瘤或b/t/nk细胞淋巴瘤。
[0067]
本发明的第十三方面,提供了一种药物组合物或试剂盒,其包含下列任一组:i)本发明所述的t细胞抗原受体;ii)本发明所述的核酸;iii)本发明所述的表达载体;iv)本发明所述的宿主细胞;v)本发明所述的免疫细胞;vi)本发明所述的多聚体复合物;或,vii)本发明所述的抗体或其抗原结合片段。
[0068]
优选的,所述的药物组合物还可以包含药学上可接受的辅料。优选的,所述的药物组合物还可以与其他治疗剂共同使用。进一步优选的,所述的治疗剂可以为免疫调节剂。
[0069]
本发明的第十四方面,涉及一种检测ebv lmp2的方法,所述的方法包括将待检测样品与本发明所述的抗体或其抗原结合片段或者t细胞抗原受体接触,然后检测ebv lmp2与抗体或其抗原结合片段或者t细胞抗原受体形成的复合物。
[0070]
优选的,所述检测ebv lmp2为检测ebv lmp2的存在或含量。其中,所述的存在表示有无,所述的含量可以为表达量或蛋白浓度等。优选的,所述的抗体或其抗原结合片段或者t细胞抗原受体包括可检测的标记物。
[0071]
在本发明的一个具体实施方式中,所述的标记物可以是his和/或ha。
[0072]
本发明所述的检测ebv lmp2的方法,不是疾病的诊断方法。首先,待检测样品并非生物体或其离体组织或细胞,其次,即便生物体中存在ebv lmp2或者包含一定浓度或表达水平的ebv lmp2也并非确定是疾病,只是一种可能性。
[0073]
本发明的第十五方面,涉及一种治疗与ebv相关疾病的方法,所述的方法包括给予个体有效量的本发明所述抗体或其抗原结合片段、所述的t细胞抗原受体、所述的核酸、所述的表达载体、所述的宿主细胞、所述的免疫细胞或所述的药物组合物。
[0074]
优选的,所述的治疗与ebv相关疾病的方法包括将本发明所述的t细胞抗原受体定位在与ebv相关疾病(优选为肿瘤或转移性肿瘤)的附近,以提高毒素或免疫刺激剂的效力。进一步,所述ebv相关疾病选自传染性单核细胞增多症、连锁淋巴细胞增生综合症、病毒性嗜血细胞综合症、口腔毛状黏膜白斑病、病毒性脑膜炎、周围神经炎、病毒性肺炎、病毒性心肌炎、鼻咽癌、霍奇金淋巴瘤、伯基特淋巴瘤、胃癌、肝细胞癌、淋巴上皮样肉瘤、唾液腺肿
瘤、乳腺癌、胸腺瘤、原发性渗出性淋巴瘤或b/t/nk细胞淋巴瘤。
[0075]
本发明的第十六方面,涉及一种诊断与ebv相关疾病的方法,所述的方法包括取样,将样品与本发明所述的抗体或其抗原结合片段或t细胞抗原受体接触,然后检测ebv lmp2与抗体或其抗原结合片段或t细胞抗原受体形成的复合物。优选的,所述的抗体或其抗原结合片段或t细胞抗原受体包括可检测的标记物。
[0076]
本发明所述的tcr能够特异性地识别对应的ebv lmp2抗原肽或pmhc复合物,激活tcr t细胞,进而产生高水平的细胞因子ifnγ、il2、tnfα,显著地杀伤靶细胞并延长负荷肿瘤的小鼠的寿命。
[0077]
本发明所述的“lmp2”包含lmp2a和lmp2b。lmp2a和lpm2b的区别在于lmp2a中存在一个额外的n-末端119个氨基酸的胞质结构域,除此之外lmp2a和lpm2b的结构均相同。同时,无论是lmp2a或lmp2b均包含本发明所述的t细胞抗原受体或者抗体结合的抗原肽区域。
[0078]
本发明所述的“同源性”是指在使用氨基酸序列或核苷酸序列的方面,本领域技术人员可以在不改变原序列主要结构或功能的前提下,根据实际工作需要对序列进行调整,使使用序列与本发明所述的具体序列相比,具有(包括但不限于)1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,11%,12%,13%,14%,15%,16%,17%,18%,19%,20%,21%,22%,23%,24%,25%,26%,27%,28%,29%,30%,31%,32%,33%,34%,35%,36%,37%,38%,39%,40%,41%,42%,43%,44%,45%,46%,47%,48%,49%,50%,51%,52%,53%,54%,55%,56%,57%,58%,59%,60%,70%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%的同源性。例如,本发明所述的“与seq id no:37或38所示氨基酸序列具有至少80%同源性”即为在保留与ebv潜伏期膜蛋白lmp2肽表位:mhc复合物结合功能的前提下,可以根据实际工作需要对seq id no:37或38进行调整,例如取代、缺失和/或插入一个或多个氨基酸等。其中,所述的至少80%包括但不限于80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%。
[0079]
本发明所述的“个体”包括但不限于人或非人哺乳动物。优选的,所述的非人哺乳动物包括但不限于小鼠、大鼠、猴子、猪或兔子等。
[0080]
本发明所述的“有效量”是指在以单个或多个剂量给予至患者或器官之后提供所希望的治疗或预防的本发明所述的产品的量或剂量。
[0081]
本发明所述的“诊断”是指以查明患者过去、诊断时或将来是否患有疾病或病症,或者是查明疾病的进展或将来可能的进展,或者是评估患者对治疗的反应。
[0082]
本发明所述的“治疗”表示减缓、中断、阻止、控制、停止、减轻、或逆转一种体征、症状、失调、病症、或疾病的进展或严重性,但不一定涉及所有疾病相关体征、症状、病症、或失调的完全消除,且是指在疾病已开始发展后改善疾病或病理状态的体征、症状等等的治疗干预。
[0083]
本发明所述的“产品”包括但不限于本发明所述的抗体或其抗原结合片段、所述的t细胞抗原受体、所述的核酸、所述的表达载体、所述的宿主细胞、所述的免疫细胞或者所述的多聚体复合物,以及其他辅助或与上述上述产品协同的试剂。
[0084]
本发明所述的“产品”可以为试剂盒、芯片、抗体偶联物或多功能抗体等药物组合物。
[0085]
本发明所述的“和/或”包括择一列出的项目以及任何数量的项目组合。
[0086]
本发明所述的“包括”或“包含”是开放式的描述,含有所描述的指定成分或步骤,以及不会实质上影响技术效果的其他指定成分或步骤。其在本技术中用于描述蛋白质或核酸的序列时,所述蛋白质或核酸可以是由所述序列组成,或者在所述蛋白质或核酸的一端或两端可以具有额外的氨基酸或核苷酸,但仍然具有本发明所述的活性。
[0087]
本发明所述的“trbv”表示是t细胞受体β可变区,“trac”表示是t细胞受体β恒定区。
附图说明
[0088]
以下,结合附图来详细说明本发明的实施例,其中:
[0089]
图1:单体的sds page检测结果,其中,m为蛋白marker,条带1、2为单体;
[0090]
图2:a0201-flyalalll-四聚体染色结果;
[0091]
图3:tcrβ链和α链在phage载体中连接示意图,其中连接顺序依次为启动子、β链、furin-p2a、α链、ires和rfp序列;
[0092]
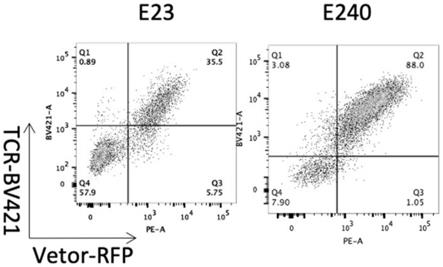
图4:流式细胞检测hla-a*a0201 flyalalll特异性tcr(e23,e240)的膜表面表达情况,其中,bv421系列荧光素中的一种,bv的全称是brilliant violet;
[0093]
图5:流式细胞检测hla-a*a0201 flyalalll特异性tcr(e23,e240)与ebv lmp2四聚体探针结合的亲和力;
[0094]
图6:e23-tcr-t、e240-tcr-t细胞因子il2、tnfα及ifnγ的释放水平及靶细胞荧光素酶水平的检测结果图,其中,e23、e240代表实施例2制备的tcr,ne代表空白对照组,nt代表只有t细胞组,control cells为未转lmp2的raji细胞,0.5:1、1:1、2:1为效靶比;
[0095]
图7:淋巴瘤动物模型中评价e23-tcr、e240-tcr在小鼠体内抑制肿瘤生长情况。
具体实施方式
[0096]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0097]
实施例1:ebv抗原表位四聚体的构建和效果检测
[0098]
一、ebv抗原表位四聚体的构建
[0099]
1)表达序列优化的hla-a*0201(其氨基酸序列如seq id no:1所示,核苷酸序列如seq id no:2所示)的α链和β2m链(其氨基酸序列如seq id no:3所示,核苷酸序列如seq id no:4所示)。其中,α链的结构为相应hla型α链的胞外区序列链接了avi-tag序列,以bamhi酶切位点间隔,以提供生物素化的位点。β2m链去掉了信号肽序列,在成熟肽序列前面加了两个氨基酸(m和a)。表达载体为pet28a+,表达菌为transetta或bl21。iptg浓度为0.5mm,诱导表达4h。提取α链和β2m链蛋白包涵体。
[0100]
2)ebv抗原表位(抗原肽)的选择:hla-a*0201型对应抗原表位flyalalll(seq id no:5)。
[0101]
3)pmhc i单体折叠及纯化:将步骤2)所述抗原肽、相应的步骤1)所述β2m链复性蛋
reverse transcriptase,invitrogen)。根据产品说明书通过两轮pcr(kod-plus-neo,toyobo)扩增出tcrα基因片段。
[0119]
反转录引物为:trac1-cgaccagcttgacatcacag(seq id no:11)。
[0120]
pcr扩增引物为:上游引物3:trav_f1(seq id no:125至169,其中seq id no:125也可以单独作为制备α基因的可变区片段的trav_f1),
[0121]
上游引物4:trav_f2(seq id no:170至211,其中seq id no:170也可以单独作为制备α基因的可变区片段的trav_f2)。
[0122]
下游引物3:trac2-gttgctcttgaagtccatagacctc(seq id no:12)
[0123]
下游引物4:trac3-cagggtcagggttctggata(seq id no:13)
[0124]
具体的,根据pcr聚合酶kod-plus-neo产品说明书,一轮pcr体系为20μl,退火温度为60℃,反应30个循环。取第一轮pcr反应的产物1μl,作为二轮pcr的模板,二轮pcr体系为30μl,退火温度为60℃,反应30个循环。然后将第二轮pcr产物跑琼脂糖胶,将对应大小的条带进行切胶回收(天根胶回收试剂盒),送测序,测序引物为下游引物4。得到tcrα基因序列,具体的e23、e240的tcrα基因序列分别如seq id no:14、15所示。
[0125]
二、phage-tcr载体的构建
[0126]
将tcrβ,fp2a,tcrα经长引物(包含fp2a序列)overlap-pcr扩增(kod-plus-neo,toyobo)得到tcrβ-fp2a-tcrα片段,分别命名为e23或e240的phage-tcr质粒。
[0127]
扩增的引物为:上游引物5:
[0128]
e23:atttcaggtgtcgtgaagcggccgcgccaccatgagcatcggcctcct(seq id no:16)
[0129]
e240:atttcaggtgtcgtgaagcggccgcgccaccatgagcatcggcctcct(seq id no:17)
[0130]
下游引物5:
[0131]
tctccagcctgcttcagcaggctgaagttagtagctccgcttccgctccgtttccgccggaaatcctttctcttgaccatg(seq id no:18)
[0132]
上游引物6:
[0133]
e23:tcagcctgctgaagcaggctggagacgtggaggagaaccctggacctatggaaactctcctgggagtgtct(seq id no:19)
[0134]
e240:tcagcctgctgaagcaggctggagacgtggaggagaaccctggacctatggaaactctcctgggagtgtct(seq id no:20)
[0135]
下游引物6:agggatcctctagactcgagctagctcagctggaccacagccgca(seq id no:21)。
[0136]
具体的,先用引物5和引物6分别将tcrβ和tcrα扩增出来,pcr体系为50μl,退火温度为60℃,反应30个循环。将pcr产物跑胶回收(天根胶回收试剂盒),分别取回收产物1μl作为模板,用上游引物5和下游引物6进行overlap pcr,pcr体系为50μl,退火温度为60℃,反应30个循环。跑琼脂糖胶得到约1800bp的条带,进行切胶回收。
[0137]
将慢病毒载体phage-ires-rfp用noti和nhei进行双酶切。酶切体系为40μl,其中含noti和nhei分别1.5μl,质粒2-3μg,37℃酶切6h,然后在体系里加入1μl碱性磷酸酶(neb),处理1h以减少质粒自连,将酶切后的质粒跑胶回收,用nanodrop测浓度,作为骨架用于构建质粒。
[0138]
根据clone express ii one step cloning kit产品说明书,将tcr通过overlap
与酶切后线性化的phage-ires-rfp载体进行连接(见图3),转化至stbl3菌株,在含氨苄的lb平板上培养12-16h,挑取单克隆隆菌进行测序,测序引物选用phage载体上的引物seq-phage-f和seq-phage-r,以及下游引物4。获得相应tcr,简称分别为e23(其氨基酸序列如seqidno:22所示)、e240(其氨基酸序列如seqidno:23所示)。
[0139]
实施例3:pmhc四聚体染色法检测tcr的膜表达和亲和力
[0140]
1、构建内源性tcr敲除的jurkatt细胞系
[0141]
基于jurkat细胞tcr的序列特征,在α链和β链的恒定区设计guide序列(tra_oligo1-caccgtctctcagctggtacacggc(seqidno:24),tra_oligo2-aaacgccgtgtaccagctgagagac(seqidno:25),trb_oligo1-caccgggctcaaacacagcgacctc(seqidno:26),trb_oligo2-aaacgaggtcgctgtgtttgagccc)(seqidno:27)。
[0142]
将合成的α链和β链的guide序列分别构建到sgrna-lenticrispr-puro和sgrna-lenticrispr-bsd慢病毒载体中,与包装质粒pspax2,pmd2.g和pei转染试剂按照一定的比例共转293t细胞,收取48h和72h的细胞培养上清,浓缩后的两个病毒同时感染人类jurkatt细胞系。感染48h后用合适浓度的嘌呤霉素和杀稻瘟菌素进行药杀,直至两个药物各自的对照组细胞全部死亡。存活的细胞用流式分选单细胞到96孔板中进行培养。对于获得的单克隆细胞系,用tcrα链和β链的抗体分别对其表达进行鉴定,两条链都缺陷的细胞株即为获得的内源性tcr敲除的jurkat t细胞,命名为jc5。
[0143]
2、构建稳定整合ebv tcr的jc5细胞系
[0144]
将实施例2构建的e23、e240的phage-tcr质粒分别与包装质粒pspax2,pmd2.g以及转染试剂pei按照一定的比例混合,转染293t细胞。收取48h和72h的细胞培养上清,浓缩后感染对数生长期的jc5细胞(moi=0.3)。感染3天后,用抗人cd3和抗人tcrαβ流式抗体对细胞进行染色,将相同tcr表达水平的细胞分选后进行培养,即为jc5-tcr细胞系。
[0145]
3、tcr上膜情况及亲和力检测
[0146]
取1
×
106jc5-tcr细胞,用brilliant violet 421
tm
anti-human tcrαβ(biolegend)以及相应的ebv lmp2 pmhc四聚体-apc(tetramer-apc)染色,之后进行流式分析。
[0147]
由图4、5可知,所制备的针对ebv lmp2 hla-a*a0201 flyalalll的特异e23-tcr、e240-tcr均可以正确表达并且展示在细胞膜外,且与对应四聚体探针具有一定的亲和力。
[0148]
实施例4:人原代tcr t细胞的构建及体外功能检测
[0149]
1、人类原代t细胞的分离、培养和慢病毒感染
[0150]
为了进一步验证所筛选到的tcr对ebv lmp2抗原的识别和杀伤功能,采用淋巴细胞分离液ficoll从志愿者的外周血中分离得到单个核细胞(pbmc),然后根据easysep human t cell isolation kit(stem cell technologies)产品说明书,从pbmc中通过阴选的方法获得t细胞,用含有100u/ml il2的1640完全培养基将细胞重悬至1
×
106细胞/ml,培养在抗cd3/cd28抗体包被的培养皿中进行激活。激活48h后,用慢病毒体系将装载有tcr的病毒颗粒(由实施例2制备)感染t细胞,感染方法为32℃下1500rpm离心2h,取出后放在37℃细胞培养箱培养10h,然后通过添换培养基终止感染,并继续放在37℃细胞培养箱进行培养。感染三天后可用流式细胞仪将tcr阳性的细胞分选出来,获得tcrt细胞,即e23-tcr-t、e240-tcr-t。
[0151]
2、靶细胞的构建
[0152]
用慢病毒体系将分别装载有lmp2-rfp、hla-a*0201-bsd以及luciferase-gfp的病毒颗粒感染对数生长期的raji细胞。通过药物筛选及流式分选,得到同时稳定表达lmp2、hla-a分子以及luciferas-gfp的raji细胞,命名为raji-hla-a*a0201-lmp2-luciferase。
[0153]
3、tcr在人原代t细胞中的体外功能验证
[0154]
将raji-hla-a*0201-lmp2、未转lmp2的raji细胞与e23-tcr-t,e240-tcr-t细胞及1g4 t细胞按照1:0.5、1:1、1:2的数量比例进行共培养后,共培养24h后,分别收集细胞和上清,初步检测了e23-tcr-t和e240-tcr-t细胞的激活和靶细胞的死亡情况。从胞外细胞因子tnfα、il2和ifnγ(见图6)的释放水平来看,e240-tcr-t及e23-tcr-t同靶细胞共孵育后,与对照组1g4 t相比,可以显著地引起t细胞的激活。且从靶细胞裂解后的释放的荧光素酶量可反映出靶细胞死亡情况(见图6)。实验结果证明,本发明实施例构建的e23-tcr-t及e240-tcr-t细胞可以特异性地被ebv lmp2抗原肽提呈细胞激活,且能够显著地杀伤靶细胞。
[0155]
同时,tcrα链和β链的cdr3高变区对tcr的功能影响最大。已有实验证实,cdr3高变区即便高度相似,只相差一个氨基酸,其功能也会相差甚远。例如,将tcr e141的α链和β链的cdr3区首位后的氨基酸依次突变成丙氨酸,构建在慢病毒载体上,制备相应的tcr-t细胞。将其与靶细胞1:1共培养,检测荧光素酶量以及细胞因子tnfα、il2和ifnγ的分泌量。结果显示,未突变的e141遇到hla matched-raji后能有效的清除靶细胞,并且特异的产生大量的细胞因子il2。并且,在a3、a5、a6以及b6、b7、b8这些位点,单个氨基酸的突变足以让tcr t细胞彻底失活(具体参见专利cn202010373100.4)。相应的,突变后的tcr,虽然仅一个氨基酸不同,但足以让tcr-t细胞彻底失活。由此可见,虽然靶点相同,但仅有一个氨基酸不同就会使两个近乎相同的tcr产生完全不同的技术效果,更不用说多个氨基酸不同。
[0156]
实施例5:动物模型构建及ebv-tcr-t体内功能检测
[0157]
eb病毒主要感染鼻咽上皮细胞和b细胞,与鼻咽癌和多种b细胞淋巴瘤的发生发展密切相关。本实施例分别构建了b细胞淋巴瘤小鼠模型和鼻咽癌实体瘤模型,以验证所鉴定的tcr的体内功能。
[0158]
将3
×
105raji-hla-a*0201-lmp2-luciferase肿瘤细胞通过尾静脉接种给5-6周的nod/scid il-2rγnull(ncg)雌鼠,构建淋巴瘤模型(见图7),记为第1天。第5天时,将小鼠分为4个小组,分别为a:pbs注射组(注射等体积pbs);b:对照tcr-t细胞注射组(tcr-1g4-t细胞);c:ebv tcr-t注射组(e23-tcr-t细胞);d:ebv tcr-t注射组(e240-tcr-t细胞),b、c、d组小鼠尾静脉注射5
×
106tcr-t细胞,a组注射等体积200μl pbs。第8天时进行二次注射,具体操作与第5天一致。在接下来的几周监测小鼠体内肿瘤细胞生长情况,t细胞体内增殖情况以及小鼠存活情况。如图7所示,与对照组比较,本发明实施例构建的ebv特异性e23-tcr-t、e240-tcr-t细胞能够显著地杀伤小鼠体内肿瘤细胞,提高小鼠的存活率。
[0159]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1