一种欣源片辅助降血脂效果的实验研究方法与流程
1.本发明具体涉及一种欣源片辅助降血脂效果的实验研究方法。
背景技术:
2.随着我国经济发展和生活水平的日益提高,高脂血症(hyperlipoidemia)的发病率也随之上升。高脂血症是由于脂质代谢异常,引起的体内血脂水平过高产生的,可引起动脉粥样硬化和冠心病,继而发生心源性猝死[2]。高脂血症患者心血管疾病死亡率为血脂正常患者的两倍,因此对于高血脂的预防和日常控制尤为重要[3]。临床上常用的降血脂药物有他汀类、胆固醇吸收抑制剂、胆汁酸螯合剂、烟酸类、贝特类等,其中他汀类应用最为广泛。
[0003]
欣源片是由红曲、植物甾醇、纳豆冻干粉、葡萄籽提取物、淀粉、二氧化硅、羧甲基淀粉钠、硬脂酸镁、包衣粉(羟丙基甲基纤维素、聚乙二醇、滑石粉、红氧化铁、黄氧化铁、黑氧化铁)等原料制成。红曲中含有他汀类成分,其中以洛伐他汀(lovastatin)为主,具有降脂效果;纳豆中含有纳豆激酶 (nattokinase,k),具有溶栓效果。欣源片将两者合用,做为一种保健食品,达到辅助降血脂的效果。红曲在我国有近千年的使用历史,是传统的曲类中药。红曲是曲霉科真菌红曲霉的菌丝体寄生在粳米上而成的红曲米。出于《饮膳正要》,主饮食积滞,活血化瘀,健脾消食。明代李时珍在《本草纲目》中评价红曲“此乃人窥造化之巧者也,奇药也”。《本草经解》中记载红曲“入足厥阴肝经,足太阴脾经”。在古代诸多中药典籍中记载着红曲具有活血化瘀,健脾消食的功效。近年来,红曲逐渐运用在降脂药物中,得到诸多关注。
[0004]
纳豆,起源于中国古代秦汉时期(公元前221年
‑
公元220年)。其制做是由黄豆通过纳豆菌(枯草杆菌)发酵而制成的豆制品,具有黏性,气味较臭,味道微甜的特点。不仅保有黄豆的营养价值、富含维生素k2、提高蛋白质的消化吸收率,更重要的是发酵过程产生了多种生理活性物质,具有溶解体内纤维蛋白及其他调节生理机能的保健作用。其中富含多种营养素,常吃可以预防便秘、腹泻等肠道疾病,提高骨密度,预防骨质疏松,还可以双向调节血压,溶解陈旧血栓斑块,调节血脂,能消除疲劳,综合提高人体免疫力。基于以上,本实验通过对大鼠进行实验,对欣源片的降血脂、溶血栓的药理作用进行研究验证;通过对比格犬进行实验,对欣源片在体内的生物利用度进行考察。为保健食品的研发及改良工作提供参考依据。
技术实现要素:
[0005]
本发明的目的在于一种欣源片辅助降血脂效果的实验研究方法,以解决现有的技术问题。
[0006]
为实现上述目的,本发明提供如下技术方案:一种欣源片辅助降血脂效果的实验研究方法,抗高脂血症实验研究包括以下步骤:
[0007]
a、动物模型的建立及分组:sd大鼠于标准温度22~25℃和湿度40%~60%环境中
适应性喂养1周后,随机分为空白组和实验组。空白组大鼠给予普通饲料,实验组大鼠给予高脂饲料,其余条件相同,连续喂养10周。于眼眶静脉丛取血1.5ml,用测定试剂盒分别测定低密度脂蛋白胆固醇(low densitylipoprotein chesterol,ldl
‑
c)、高密度脂蛋白胆固醇(high density lipteincholesterol,hdl
‑
c)、甘油三酯(triglyceride,tg)、总胆固醇(totalcholesterol,tc)的水平。实验大鼠的血脂水平与空白组相比,出现显著性差异,即为造模成功。
[0008]
将造模成功的实验组sd大鼠随机分为5组。分别为模型组,洛伐他汀阳性药组(1.8mg/kg),欣源片低剂量组(162mg/kg),欣源片中剂量组(324mg/kg),欣源片高剂量组(648mg/kg),每组各8只。分组后,空白组和高脂组继续分别给予普通饲料和高脂饲料,并开始灌胃给药(0.1ml/10g),每天一次。空白组和模型组给予等量的羧甲基纤维素钠,其余各组给药剂量如上,连续给药4周。
[0009]
b、血清指标检测:大鼠禁食12h后,于眼眶静脉丛取血1.5ml,4℃静置2h, 4000r/min离心20min,取分离的上层血清,使用酶联免疫检测仪测定血脂相关指标ldl
‑
c、hdl
‑
c、tc、tg。
[0010]
c、肝组织处理及he染色:配置10%的水合氯醛,大鼠腹腔注射0.4ml/100g。解剖大鼠,用多聚甲醛进行全身灌流,取右叶肝脏。将肝组织样本脱蜡、水化。使用harris苏本素染液内染色,再取出脱水、制片。将最后成片置于200 倍和400倍光学显微镜下观察组织细胞病理学改变。
[0011]
d、数据统计学处理:所有的数据结果均以mean
±
sem表示,采用单因素方差分析进行统计学分析,若p<0.05则表示存在显著性差异,若p<0.01则表示存在极显著性差异。
[0012]
优选的,药代动力学实验分析方法包括以下步骤:
[0013]
a、比格犬给药方案:取6只适应环境的健康比格犬,试验前12h禁食不禁水,分别给予8片欣源片,给药2h后统一给水,6h后统一给食。
[0014]
分别在给药前(0h)和给药后0.5h,1h,2h,3h,4h,5h,6h,8h, 12h,24h,采集犬腿静脉血2ml,置于2ml抗凝的离心管中。
[0015]
b、内标对照品溶液的制备:精密称取辛伐他汀和甲苯磺丁脲各1.00mg,加入乙腈定容至10ml,得0.1mg/ml的辛伐他汀和甲苯磺丁脲的混合溶液。用乙腈稀释至10ng/ml,即得内标溶液。
[0016]
c、血浆样品的处理:取500μl血浆置于抗凝离心管中,精密加入内标溶液 1500μl,置于超低温高速离心机内,5℃,10000r/min离心10min,连续两次,吸取上层血浆移入聚丙烯管中,密封,避光,置于
‑
80℃冰箱中冷冻保存,供实验用。
[0017]
d、标准曲线的绘制:精密称取洛伐他汀标准品12.50mg,并加入乙腈定容至10ml容量瓶中,进行稀释,分别得到浓度为1250、625、125、62.5、6.25ug/ml 的洛伐他汀乙腈溶液。精密吸取上述溶液各10μl,依次进样,测定并记录峰面积积分值,以峰面积积分值为纵坐标y,进样浓度x(mg)为横坐标,进行线性回归,得洛伐他汀的回归方程为y=2685.3x+83128r=1。结果表明洛伐他汀在浓度6.25~1250ug/ml的范围内,浓度和峰面积线性关系良好。
[0018]
e、供试品溶液的制备:精密称定欣源片片重633.2mg,粉碎研磨,精密称定 20mg,加入乙腈定容至10ml容量瓶中,超声溶解30min,5000r/min离心 10min,取上清液待测。精密称定洛伐他汀胶囊内容物244.3mg,精密称定 20mg,加入乙腈定容至10ml容量瓶中,超声
溶解30min,5000r/min离心 10min,取上清液待测。
[0019]
f、样品含量测定:取上述处理好的欣源片上清液和洛伐他汀胶囊上清液,分别进样10μl,在238nm波长的检测器下测得吸光度,并带入标准曲线方程。计算得到欣源片每片含有洛伐他汀11.23mg,每片洛伐他汀胶囊中含有洛伐他汀17.43mg。
[0020]
优选的,步骤f中检测器中的各参数分别为:色谱柱:wondasil c18 superb (4.6mm
×
250mm,5μm);检测波长:238nm;流速:1.0ml/min;进样量:10μl;流动相:乙腈:水=85:15。
[0021]
优选的,抗凝及溶栓实验研究包括以下步骤:
[0022]
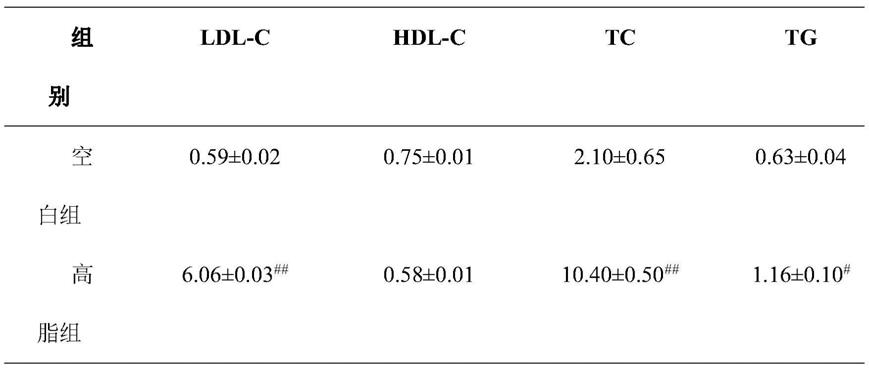
a、分组及给药:按照成人每天6片欣源片,每片重600mg,即人服用的剂量为51.43mg/kg,将此剂量设为中等剂量,换算为大鼠的低、中、高剂量分别为:162mg/kg、324mg/kg和648mg/kg(相邻剂量比为1:2);小鼠的低、中、高剂量分别为:231mg/kg、463mg/kg和925mg/kg。空白对照组、假手术组、模型组均使用等剂量的0.5%cmc
‑
na溶液。阳性药物阿司匹林的剂量及配制:人服用的剂量为每天100mg,即1.43mg/kg b.wt,换算为大鼠的剂量为:9.00mg/kg;小鼠的剂量为13.00mg/kg。将各个浓度的欣源片、阿司匹林分别溶于0.5%的cmc
‑
na溶液中,灌胃使用,现用现配。
[0023]
b、对小鼠尾出血时间影响:采用断尾法研究欣源片对小鼠尾出血时间的影响。将40只适应性喂养后的icr小鼠随机分为5组,即空白对照组(control),阿司匹林阳性药组(aspirin),欣源片低剂量组,欣源片中剂量组,欣源片高剂量组,每组各8只。分组后,按照2.1的剂量每天给予小鼠灌胃给药(1 ml/100g),连续7天。末次给药后1h,取小鼠于固定器中,使尾部与地面保持垂直,用锋利剪刀距离尾尖1.5mm处剪断,并开始计时,用滤纸每隔一段时间轻触断口处,观察滤纸是否沾有血迹,直至滤纸无血迹出现,并记录时间,此时间即为尾出血时间。
[0024]
c:对小鼠凝血时间的影响:采用毛细管法研究欣源片对小鼠尾出血时间的影响。按照步骤b中的方式分组后,每天给予灌胃给药(1ml/100g),连续7 天。末次给药后1h,用内径为1mm长10cm的玻璃毛细管(用前用砂轮在毛细管表面每5mm做出划痕,方便折断)插入小鼠内眦球后静脉丛取血,血液快速流出为佳,自血液流入管内开始计时,每隔10s折断毛细管,每次折断约5mm,并缓慢向左右拉开,直至出现血凝丝停止计时,所得时间即为凝血时间。
[0025]
d、对大鼠三氯化铁致颈动脉血栓形成的影响将66只适应性喂养后的sd大鼠随机分为6组,即假手术组(control)、模型组(model)、阿司匹林阳性药组(aspirin)、欣源片低剂量组、欣源片中剂量组、欣源片高剂量组,每组11只。分组后,按照2.1的剂量每天给予灌胃给药(1ml/100g),连续7天。末次给药1h后,每组取8只,使用10%水合氯醛麻醉,分离大鼠两侧颈总动脉,血管下置小片塑料薄膜(4cm
×
1.8cm)用于保护血管周围组织,将吸有20μl 35%fecl3的滤纸片(1cm
×
1cm)敷在颈总动脉上30min,假手术组用生理盐水代替35%fecl3,观察血液流通情况,去纸片20min后,迅速剪下颈总动脉血栓部位血管1cm,放于滤纸片上吸干余血精密称湿重。放入70℃的烘箱2h后称干重。计算血栓形成抑制率。
[0026]
血栓形成抑制率=(模型组血栓质量平均值-给药组血栓质量平均值)/模型组血栓质量平均值
×
100%
[0027]
将每组剩余3只大鼠,分离左颈动脉,用浸满35%fecl3的滤纸敷于动脉上,假手术
组用生理盐水代替35%fecl3,固定30min,取颈动脉于4%多聚甲醛中固定,he染色,切片,观察血栓形成情况。
[0028]
e、对大鼠下腔静脉血栓形成的影响:将步骤d中的实验动物末次给药后,大鼠腹腔注射10%水合氯醛麻醉,固定。沿腹中线切开腹壁,玻璃分针分离出下腔静脉,于下腔静脉和左肾静脉交叉下方手术线结扎,结扎后缝合腹壁。6 h后重新打开腹腔,在结扎下方2cm处夹闭血管,剖开管腔,取出栓子,用滤纸吸干残血后,精密称湿重。置70℃烘箱中,烘2h后精密称干重,并按上面公式计算血栓形成抑制率。
[0029]
f、对大鼠凝血参数的影响:将2.4实验动物末次给药1h后10%水合氯醛麻醉,眼底静脉丛取血,采用枸橼酸钠1:9抗凝采血,将抗凝血用离心机2500 r
·
min
‑
1,离心15min,取血浆用半自动血凝仪测定凝血酶原时间(pt)、鞣花酸活化部分凝血活酶时间(aptt)、凝血酶时间(tt)。
[0030]
g、数据统计学处理采用prim 8软件进行统计学处理,所有数据结果均以 mean
±
sem表示,使用单因素方差分析的方法进行检验,若p<0.05则表示存在显著性差异,若p<0.01则表示存在极显著性差异。
附图说明:
[0031]
图1:肝组织病理切片,a、正常组b、模型组c、欣源片低剂量组d、欣源片 中剂量组e、欣源片高剂量组f、洛伐他汀组;
[0032]
图2:欣源片对小鼠尾出血时间的影响(n=8);
[0033]
图3:欣源片对小鼠凝血时间的影响(n=8);
[0034]
图4:欣源片对颈动脉血栓形成湿重的影响(n=8);
[0035]
图5:欣源片对颈动脉血栓形成干重的影响(n=8);
[0036]
图6:fecl3致颈动脉血栓生成he染色;
[0037]
图7:欣源片对下腔静脉血栓形成湿重的影响(n=8);
[0038]
图8:欣源片对下腔静脉血栓形成干重的影响(n=8);
[0039]
图9:欣源片对凝血酶原时间(pt)、活化部分凝血活酶时间(aptt)和凝血酶时间(tt)的影响(n=8);
[0040]
图10:洛伐他汀在比格犬血浆内的标准曲线;
[0041]
图11:加样回收率线性曲线方程。
[0042]
与现有技术相比,本发明的有益效果是:
[0043]
1、本发明通过抗高脂血症药理研究,能明确表示低、中、高剂量组的欣源片均可降低大鼠的ldl
‑
c和tg水平,高剂量的欣源片可降低大鼠tc水平;同时,低剂量组的欣源片对肝细胞的改善作用不明显,中、高剂量组可以改善大鼠肝脏细胞的脂肪化程度;欣源片可以辅助降血脂,缓解肝细胞脂肪变性。
[0044]
2、本发明通过抗凝及溶栓药理研究,在小鼠止血实验中,与空白组相比,低、中、高剂量组均出现明显显著性差异(p<0.01),表明,欣源片可以显著延长小鼠止血时间;在小鼠的凝血实验中,与空白组相比,中、高剂量组出现明显的显著性差异(p<0.01),表明,欣源片可以显著延长小鼠凝血时间;在三氯化铁诱导血栓形成实验中,与模型组相比,中剂量组出现显著性差异 (p<0.05),高剂量组出现明显的显著性差异(p<0.01),he染色表明服用欣源
片后,可以抑制颈动脉血管中血栓的生成,因而欣源片可以抑制fecl3 诱导颈动脉血栓形成;在下腔静脉血栓形成实验中,与模型组相比,低、中、高剂量组均出现明显的显著性差异(p<0.01),表明,欣源片可以抑制下腔静脉血栓形成;在凝血参数检测实验中,与模型组相比,欣源片低、中、高剂量组与空白组相比,pt均出现显著性差异(p<0.01);欣源片低、中剂量组与空白组相比aptt出现显著性差异(p<0.05),高剂量组的aptt出现显著性差异(p<0.01);欣源片中、高剂量组与空白组相比,tt时间均有所延长(p<0.05);表明欣源片可以延长凝血因子的凝血时间。欣源片可以延长小鼠和大鼠体内、外的凝血时间,并对诱导的大鼠血栓形成具有抑制作用。
[0045]
3、本发明通过药代动力学实验,测定比格犬血浆中母体药物洛伐他汀的浓度,并进行药代动力学分析,欣源片中洛伐他汀的达峰时间tmax为(1.167
ꢀ±
0.931)h,最大血药浓度cmax为(62.333
±
41.386)mg/ml,消除半衰期 t1/2为(5.954
±
4.962)h。以梯形法计算,血药浓度
‑
时间曲线下面积auc (0
‑
24)为(137.4
±
95.98)mg/l*h,auc(0
‑
∞)为(165.99
±
98.529)mg/l*h,体内滞留时间mrt为(2.266
±
0.507)h;洛伐他汀在比格犬血浆中专属性良好,不受血浆中内源性物质的影响,0.10ng/ml~100mg/ml范围内线性关系良好,得回归方程:f=0.0427c+0.0611r=0.9997在上述条件下,测得洛伐他汀的最低检测浓度为0.10ng/ml高中低三种浓度的回收率均高于75%,其他检测rsd值均低于15%。
具体实施方式
[0046]
下面将结合本发明实施例中的图和表,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0047]
实验一
[0048]
药品提供:
[0049]
欣源片由康道生物(南通)有限公司提供;洛伐他汀胶囊(成都永康制药有限公司,批号171102);低密度脂蛋白胆固醇测定试剂盒(南京建成生物工程研究所,货号a113
‑1‑
1);高密度脂蛋白胆固醇测定试剂盒(南京建成生物工程研究所,货号a112
‑1‑
1);甘油三酯测定试剂盒(南京建成生物工程研究所,货号a110
‑1‑
1);总胆固醇测定试剂盒(南京建成生物工程研究所,货号a111
‑1‑
1)。
[0050]
实验动物:
[0051]
180
‑
220g sd大鼠,spf级,雌雄各半,购于南京青龙山动物繁殖场,许可证号:scxk(沪)2018
‑
0004。
[0052]
高脂饲料配方:
[0053]
由南通特洛菲饲料科技有限公司提供(货号tp25540)。含有10%脂肪、3%胆固醇、0.5%胆盐、0.2%丙硫氧嘧啶。
[0054]
欣源片抗高脂血症实验研究包括以下步骤:
[0055]
a、动物模型的建立及分组:sd大鼠于标准温度22~25℃和湿度40%~60%环境中适应性喂养1周后,随机分为空白组和实验组。空白组大鼠给予普通饲料,实验组大鼠给予高脂饲料,其余条件相同,连续喂养10周。于眼眶静脉丛取血1.5ml,用测定试剂盒分别测定
低密度脂蛋白胆固醇(low densitylipoprotein chesterol,ldl
‑
c)、高密度脂蛋白胆固醇(high density lipteincholesterol,hdl
‑
c)、甘油三酯(triglyceride,tg)、总胆固醇(totalcholesterol,tc)的水平。实验大鼠的血脂水平与空白组相比,出现显著性差异,即为造模成功。
[0056]
将造模成功的实验组sd大鼠随机分为5组。分别为模型组,洛伐他汀阳性药组(1.8mg/kg),欣源片低剂量组(162mg/kg),欣源片中剂量组(324mg/kg),欣源片高剂量组(648mg/kg),每组各8只。分组后,空白组和高脂组继续分别给予普通饲料和高脂饲料,并开始灌胃给药(0.1ml/10g),每天一次。空白组和模型组给予等量的羧甲基纤维素钠,其余各组给药剂量如上,连续给药4周。
[0057]
b、血清指标检测:大鼠禁食12h后,于眼眶静脉丛取血1.5ml,4℃静置2h, 4000r/min离心20min,取分离的上层血清,使用酶联免疫检测仪测定血脂相关指标ldl
‑
c、hdl
‑
c、tc、tg。
[0058]
c、肝组织处理及he染色:配置10%的水合氯醛,大鼠腹腔注射0.4ml/100g。解剖大鼠,用多聚甲醛进行全身灌流,取右叶肝脏。将肝组织样本脱蜡、水化。使用harris苏本素染液内染色,再取出脱水、制片。将最后成片置于200 倍和400倍光学显微镜下观察组织细胞病理学改变。
[0059]
d、数据统计学处理:所有的数据结果均以mean
±
sem表示,采用单因素方差分析进行统计学分析,若p<0.05则表示存在显著性差异,若p<0.01则表示存在极显著性差异。
[0060]
以上实施例中,适应性喂养sd大鼠一周后,活动能力、反应能力、敏捷度良好,饮食正常,毛色光亮,大鼠精神状态良好。分组喂养10周后,喂养高脂饲料大鼠表现毛色发黄,粪便稀溏,食欲降低,血液黏稠。给予药物后,给药各组与模型组相比,食欲增强。
[0061]
(1)高脂血症大鼠模型的建立:
[0062]
如表1所示,造模四周后,同空白组相比,高脂组血清ldl
‑
c、tc水平均显著升高(p<0.01),高脂组血清tg水平明显升高(p<0.05),证明大鼠高脂血症模型造模成功。
[0063]
表1空白组与高脂组造高血脂模型血脂数据(mmol/l,mean
±
sem)
[0064][0065]
注:#p<0.05,##p<0.01与空白组相比。
[0066]
(2)欣源片对高脂血症大鼠血脂的影响
[0067]
如表2所示,与空白组相比,模型组大鼠ldl
‑
c、tc、tg显著升高(p<0.01)。与模型组相比,欣源片低、中剂量组大鼠ldl
‑
c和tg显著降低(p<0.01),而欣源片高剂量组大鼠ldl
‑
c、tc和tg等三个指标均显著降低(p<0.01)。
[0068]
表2欣源片对高脂血症大鼠血脂的影响(mmol/l,mean
±
sem)
[0069][0070][0071]
注:#p<0.05,##p<0.01与空白组相比。*p<0.05,**p<0.01与模型组相比。
[0072]
(3)给药4周后,在空白组大鼠的肝脏深红色,质地柔软坚韧;模型组大鼠的肝脏呈现淡黄色,质地变硬且易碎,断面呈颗粒状。
[0073]
(4)利用he染色从病理学角度观察肝脏发生病变情况
[0074]
镜下观察到,空白对照组大鼠肝脏细胞正常,细胞边界及细胞核清晰,胞浆呈粉红色(图1a)。模型组出现炎症和肝细胞脂肪变性,胞浆中出现大的脂肪滴,并将细胞核挤向一侧,肝细胞体积明显增大且肿胀,细胞核颜色加深,细胞与细胞间界限不清(图1b)。低剂量组肝细胞情况与模型组大致相同(图 1c)。中剂量组、高剂量组、洛伐他汀组肝细胞形态相近,炎症、肝细胞肿大、脂变较模型组轻微,胞浆中脂肪滴较模型组明显减小,以小脂滴为主,细胞核压迫情况与模型组相比较轻,细胞核形态更为清晰,细胞与细胞间界限较为清晰,脂肪变性程度较低(图1d
‑
f)。
[0075]
综上所述:通过喂养高脂饲料建立大鼠高脂血症模型。大鼠在连续灌胃给药4 周后,低、中、高剂量组的欣源片均可降低大鼠的ldl
‑
c和tg水平,高剂量的欣源片可降低大鼠tc水平。he染色结果表明,低剂量组的欣源片对肝细胞的改善作用不明显,中、高剂量组可
以改善大鼠肝脏细胞的脂肪化程度。在本实验条件下,欣源片可以辅助降血脂,缓解肝细胞脂肪变性。
[0076]
实验二药品提供:欣源片【康道生物(南通)有限公司,批号:20181123】;阿司匹林肠溶片(沈阳奥吉娜药业有限公司,批号:181003);鞣花酸活化部分凝血活酶测定试剂盒、凝血酶原测定试剂盒、凝血酶测定试剂盒、纤维蛋白原测定试剂盒(山西亚森医疗器械有限公司);羧甲基纤维素钠(国药集团化学试剂有限公司),水合三氯乙醛(上海阿拉丁生化科技股份有限公司);通用型组织固定液(武汉塞维尔生物科技有限公司)。
[0077]
仪器与设备型号:分析天平(奥豪斯仪器有限公司);steellex半自动血凝仪(北京中勤世帝生物技术有限公司);超低温冰箱(thermo fisherscientific);高速冷冻离心机(kubota corporation);电冰箱(合肥美菱股份有限公司);电热鼓风干燥箱(上海博讯医疗器械厂);leica dm2500 正置荧光显微镜(徕卡显微系统有限公司)。
[0078]
实验动物:18
‑
22g icr小鼠和180
‑
220g sd大鼠,spf级,雌雄各半,大鼠购于斯贝福(北京)生物技术有限公司,实验动物合格证号:scxk(京) 2019
‑
0010;小鼠购于浙江省医学科学院,实验动物合格证号:scxk(浙) 2019
‑
0002。饲养于23
±
2℃,自由进食和饮水,分笼饲养,适应一周后开始试验。
[0079]
欣源片抗凝及溶栓实验研究包括以下步骤:
[0080]
a、分组及给药:按照成人每天6片欣源片,每片重600mg,即人服用的剂量为51.43mg/kg,将此剂量设为中等剂量,换算为大鼠的低、中、高剂量分别为:162mg/kg、324mg/kg和648mg/kg(相邻剂量比为1:2);小鼠的低、中、高剂量分别为:231mg/kg、463mg/kg和925mg/kg。空白对照组、假手术组、模型组均使用等剂量的0.5%cmc
‑
na溶液。阳性药物阿司匹林的剂量及配制:人服用的剂量为每天100mg,即1.43mg/kg b.wt,换算为大鼠的剂量为:9.00mg/kg;小鼠的剂量为13.00mg/kg。将各个浓度的欣源片、阿司匹林分别溶于0.5%的cmc
‑
na溶液中,灌胃使用,现用现配。
[0081]
b、对小鼠尾出血时间影响:采用断尾法研究欣源片对小鼠尾出血时间的影响。将40只适应性喂养后的icr小鼠随机分为5组,即空白对照组(control),阿司匹林阳性药组(aspirin),欣源片低剂量组,欣源片中剂量组,欣源片高剂量组,每组各8只。分组后,按照2.1的剂量每天给予小鼠灌胃给药(1 ml/100g),连续7天。末次给药后1h,取小鼠于固定器中,使尾部与地面保持垂直,用锋利剪刀距离尾尖1.5mm处剪断,并开始计时,用滤纸每隔一段时间轻触断口处,观察滤纸是否沾有血迹,直至滤纸无血迹出现,并记录时间,此时间即为尾出血时间。
[0082]
c:对小鼠凝血时间的影响:采用毛细管法研究欣源片对小鼠尾出血时间的影响。按照步骤b中的方式分组后,每天给予灌胃给药(1ml/100g),连续7 天。末次给药后1h,用内径为1mm长10cm的玻璃毛细管(用前用砂轮在毛细管表面每5mm做出划痕,方便折断)插入小鼠内眦球后静脉丛取血,血液快速流出为佳,自血液流入管内开始计时,每隔10s折断毛细管,每次折断约5mm,并缓慢向左右拉开,直至出现血凝丝停止计时,所得时间即为凝血时间。
[0083]
d、对大鼠三氯化铁致颈动脉血栓形成的影响将66只适应性喂养后的sd大鼠随机分为6组,即假手术组(control)、模型组(model)、阿司匹林阳性药组(aspirin)、欣源片低剂量组、欣源片中剂量组、欣源片高剂量组,每组11只。分组后,按照2.1的剂量每天给予灌
胃给药(1ml/100g),连续7天。末次给药1h后,每组取8只,使用10%水合氯醛麻醉,分离大鼠两侧颈总动脉,血管下置小片塑料薄膜(4cm
×
1.8cm)用于保护血管周围组织,将吸有20μl 35%fecl3的滤纸片(1cm
×
1cm)敷在颈总动脉上30min,假手术组用生理盐水代替35%fecl3,观察血液流通情况,去纸片20min后,迅速剪下颈总动脉血栓部位血管1cm,放于滤纸片上吸干余血精密称湿重。放入70℃的烘箱2h后称干重。计算血栓形成抑制率。
[0084]
血栓形成抑制率=(模型组血栓质量平均值-给药组血栓质量平均值)/模型组血栓质量平均值
×
100%
[0085]
将每组剩余3只大鼠,分离左颈动脉,用浸满35%fecl3的滤纸敷于动脉上,假手术组用生理盐水代替35%fecl3,固定30min,取颈动脉于4%多聚甲醛中固定,he染色,切片,观察血栓形成情况。
[0086]
e、对大鼠下腔静脉血栓形成的影响:将步骤d中的实验动物末次给药后,大鼠腹腔注射10%水合氯醛麻醉,固定。沿腹中线切开腹壁,玻璃分针分离出下腔静脉,于下腔静脉和左肾静脉交叉下方手术线结扎,结扎后缝合腹壁。6 h后重新打开腹腔,在结扎下方2cm处夹闭血管,剖开管腔,取出栓子,用滤纸吸干残血后,精密称湿重。置70℃烘箱中,烘2h后精密称干重,并按上面公式计算血栓形成抑制率。
[0087]
f、对大鼠凝血参数的影响:将2.4实验动物末次给药1h后10%水合氯醛麻醉,眼底静脉丛取血,采用枸橼酸钠1:9抗凝采血,将抗凝血用离心机2500 r
·
min
‑
1,离心15min,取血浆用半自动血凝仪测定凝血酶原时间(pt)、鞣花酸活化部分凝血活酶时间(aptt)、凝血酶时间(tt)。
[0088]
g、数据统计学处理采用prim 8软件进行统计学处理,所有数据结果均以 mean
±
sem表示,使用单因素方差分析的方法进行检验,若p<0.05则表示存在显著性差异,若p<0.01则表示存在极显著性差异。
[0089]
(1)欣源片对小鼠尾出血时间的影响实验采用断尾法研究欣源片对小鼠尾出血时间的影响,将断尾开始截至滤纸上无血迹出现的时间记作出血时间作为观察指标。小鼠进行断尾后,受损部位的血管内皮下胶原和皮下基质暴露,血小板黏附于胶原上,随后发生血小板聚集、释放等,出现血小板血栓,使受损血管出现堵塞,血流停止。实验结果(表3、图2)显示,随着欣源片给药剂量的升高,尾出血时间也随之延长(p<0.01),低、中、高剂量的欣源片,均能显著延长小鼠的止血时间。表明欣源片可以延长小鼠尾出血时间,且具有剂量依赖性。
[0090]
表3欣源片对小鼠尾出血时间的影响(mean
±
sem,n=8)
[0091][0092]
根据图2可知:空白组:连续7天给药0.5%cmc
‑
na的正常icr小鼠;欣源片低、中、高:分别连续7天给药为欣源片低、中、高剂量组icr小鼠;aspirin:连续7天给药阿司匹林的阳性对照组icr小鼠;x、y轴分别代表组别和尾出血时间(min)。**为该组与空白组相比,出现显著性差异(p<0.01)。
[0093]
(2)对小鼠凝血时间的影响实验采用毛细玻管法研究欣源片对小鼠全血凝血时间的影响,将取血开始至首次出现凝血丝的时间记作凝血时间作为观察指标。实验结果(表4、图3)显示,随着欣源片给药剂量的升高,凝血时间也随之延长,其中欣源片低剂量组未出现显著性差异,欣源片中剂量组出现显著性差异(p<0.05),欣源片高剂量组出现显著性差异(p<0.01)。表明欣源片可以延长小鼠全血凝血时间,且具有剂量依赖性。
[0094]
表4欣源片对小鼠凝血时间的影响(mean
±
sem,n=8)
[0095][0096][0097]
根据图3可知:空白组:连续7天给药0.5%cmc
‑
na的正常icr小鼠;欣源片低、中、高:分别连续7天给药为欣源片低、中、高剂量组icr小鼠;aspirin:连续7天给药阿司匹林的阳性对照组icr小鼠;x、y轴分别代表组别和小鼠凝血时间(s)。*为该组与空白组相比,出现显著性差异(p<0.05);**为该组与空白组相比,出现显著性差异(p<0.01)。
[0098]
(3)对大鼠三氯化铁致颈动脉血栓形成的影响实验采用三氯化铁法诱导颈动脉血栓形成,将取出的血栓称重为血栓湿重,将血栓烘干,称重为干重,并计算得到血栓形成抑制率。实验结果(表5、表6、图4、图5显示),模型组与假手术组相比,具有显著性差异,证明三氯化铁可以诱导血栓形成。其中,欣源片低剂量与模型组血栓湿重和干重均未出现显著性
差异;欣源片中剂量组与模型组相比血栓湿重出现显著性差异(p<0.05)干重出现显著性差异(p<0.01);欣源片高剂量组与模型组相比湿重、干重均出现显著性差异(p<0.01)。由此可以得出欣源片可以抑制三氯化铁诱导的颈动脉血栓形成,且呈剂量依赖性。
[0099]
表5欣源片对大鼠三氯化铁致颈动脉血栓形成湿重的影响(mean
±
sem,n=8)
[0100][0101][0102]
表6欣源片对大鼠三氯化铁致颈动脉血栓形成的干重影响(mean
±
sem,n=8)
[0103][0104]
综上所述:control:连续7天给药0.5%cmc
‑
na的正常sd大鼠,分离血管,但不敷
fecl3纸片;model:连续7天给药0.5%cmc
‑
na的正常sd大鼠,分离血管,敷fecl3纸片;欣源片低、中、高剂量组:分别为连续7天给药欣源片低、中、高剂量的sd大鼠,分离血管,敷fecl3纸片;aspirin:连续7 天给药阿司匹林的阳性对照组sd大鼠,分离血管,敷fecl3纸片;x、y轴分别代表组别和血栓重量(mg)。##为模型组与空白组相比,具有显著性差异 (p<0.01);*为该组与模型组相比,出现显著性差异(p<0.05);**为该组与模型组相比,出现显著性差异(p<0.01)。
[0105]
将三氯化铁诱导形成血栓的血管进行he染色,得到结果如图6所示。结果显示,模型组与假手术组相比,血栓生成明显;欣源片低、中、高剂量组与模型组相比,血栓生成较模型组减少。
[0106]
(4)对大鼠下腔静脉血栓形成的影响实验采用结扎法致使下腔静脉血栓形成,将取出的血栓称重为血栓湿重,将血栓烘干,称重为干重,并计算得到血栓形成抑制率。结果(表7、表8、图7、图8)显示,模型组与假手术组相比,具有显著性差异,证明结扎下腔静脉可以诱导血栓形成。欣源片低、中、高剂量组与模型组相比均出现显著性差异(p<0.01)。可以得出,欣源片可以抑制大鼠下腔静脉结扎诱导的血栓生成,且随着欣源片剂量升高,抑制血栓效果逐渐增强。
[0107]
表7欣源片对大鼠下腔静脉血栓形成湿重的影响(mean
±
sem,n=8)
[0108][0109]
表8欣源片对大鼠三氯化铁致颈动脉血栓形成的干重影响(mean
±
sem,n=8)
[0110]
[0111][0112]
综上所述:control:连续7天给药0.5%cmc
‑
na的正常sd大鼠,分离血管而不结扎;model:连续7天给药0.5%cmc
‑
na的正常sd大鼠,分离血管且结扎;dllow、dlmedium、dlhigh:分别为欣源片低、中、高剂量组sd大鼠,分离血管且结扎;aspirin:连续7天给药阿司匹林的阳性对照组sd大鼠,分离血管且结扎;x、y轴分别代表组别和血栓重量(mg)。##为模型组与空白组相比,具有显著性差异(p<0.01);**为该组与假手术组相比,出现显著性差异(p<0.01)。
[0113]
(5)对大鼠凝血参数的影响采用眼底静脉丛取血,用半自动血凝仪测定凝血酶原时间(pt)、活化部分凝血活酶时间(aptt)、凝血酶时间(tt)作为观察指标。结果如表9、图9显示,结果显示,欣源片低、中、高剂量组与空白组相比均可显著延长pt时间(p<0.01);欣源片低、中剂量组与空白组相比,可显著延长aptt时间(p<0.05),欣源片高剂量组与空白组相比,可显著延长aptt时间(p<0.01);欣源片低剂量组与空白组相比tt时间未出现显著性差异,欣源片中、高剂量组与空白组相比出现显著性差异(p<0.05)。以上研究表明,欣源片中、高剂量均可显著延长大鼠体外凝血时间,证明欣源片对大鼠体外凝血有抑制作用。
[0114]
表9欣源片对大鼠凝血参数的影响(n=8)
[0115][0116]
根据图9可知:control:连续7天给药0.5%cmc
‑
na的正常sd大鼠;欣源片低、中、高:分别为连续7天分别给药欣源片低、中、高剂量组的sd大鼠; aspirin:连续7天给药阿司匹林的阳性对照组sd大鼠;x、y轴分别代表组别和时间(s)。*为该组与空白组相比,出现显著性差异(p<0.05)。**为该组与空白组相比,出现显著性差异(p<0.01)。
[0117]
综上所述,本试验通过手术造模方式分别研究欣源片对小鼠止血时间的影响、对小鼠全血凝血时间的影响、对大鼠三氯化铁诱导颈动脉血栓的影响、对大鼠下腔静脉血栓的影响和对大鼠凝血参数的影响。根据各个实验的观察指标,得出欣源片溶栓的效果。在小鼠止血实验中,与空白组相比,低、中、高剂量组均出现明显显著性差异(p<0.01)。表明,欣源片可以显著延长小鼠止血时间;在小鼠的凝血实验中,与空白组相比,中、高剂量组出现明显的显著性差异(p<0.01),表明,欣源片可以显著延长小鼠凝血时间;在三氯化铁诱导血栓形成实验中,与模型组相比,中剂量组出现显著性差异(p<0.05),高剂量组出现明显的显著性差异(p<0.01),he染色表明服用欣源片后,可以抑制颈动脉血管中血栓的生成,因而欣源片可以抑制fecl3诱导颈动脉血栓形成;在下腔静脉血栓形成实验中,与模型组相比,低、中、高剂量组均出现明显的显著性差异(p<0.01),表明,欣源片可以抑制下腔静脉血栓形成;在凝血参数检测实验中,与模型组相比,欣源片低、中、高剂量组与空白组相比,pt均出现显著性差异(p<0.01);欣源片低、中剂量组与空白组相比aptt出现显著性差异(p<0.05),高剂量组的aptt出现显著性差异 (p<0.01);欣源片中、高剂量组与空白组相比,tt时间均有所延长(p<0.05);表明欣源片可以延长凝血因子的凝血时间。因而,我们可以得出,欣源片可以延长小鼠和大鼠体内、外的凝血时间,并对诱导的大鼠血栓形成具有抑制作用。
[0118]
实验三
[0119]
欣源片的药代动力学实验分析,包括以下步骤:
[0120]
a、比格犬给药方案:取6只适应环境的健康比格犬,试验前12h禁食不禁水,分别给予8片欣源片,给药2h后统一给水,6h后统一给食。
[0121]
分别在给药前(0h)和给药后0.5h,1h,2h,3h,4h,5h,6h,8h, 12h,24h,采集犬腿静脉血2ml,置于2ml抗凝的离心管中。
[0122]
b、内标对照品溶液的制备:精密称取辛伐他汀和甲苯磺丁脲各1.00mg,加入乙腈定容至10ml,得0.1mg/ml的辛伐他汀和甲苯磺丁脲的混合溶液。用乙腈稀释至10ng/ml,即得内标溶液。
[0123]
c、血浆样品的处理:取500μl血浆置于抗凝离心管中,精密加入内标溶液 1500μl,
置于超低温高速离心机内,5℃,10000r/min离心10min,连续两次,吸取上层血浆移入聚丙烯管中,密封,避光,置于
‑
80℃冰箱中冷冻保存,供实验用。
[0124]
d、标准曲线的绘制:精密称取洛伐他汀标准品12.50mg,并加入乙腈定容至 10ml容量瓶中,进行稀释,分别得到浓度为1250、625、125、62.5、6.25ug/ml 的洛伐他汀乙腈溶液。精密吸取上述溶液各10μl,依次进样,测定并记录峰面积积分值,以峰面积积分值为纵坐标y,进样浓度x(mg)为横坐标,进行线性回归,得洛伐他汀的回归方程为y=2685.3x+83128r=1。结果表明洛伐他汀在浓度6.25~1250ug/ml的范围内,浓度和峰面积线性关系良好。
[0125]
e、供试品溶液的制备:精密称定欣源片片重633.2mg,粉碎研磨,精密称定 20mg,加入乙腈定容至10ml容量瓶中,超声溶解30min,5000r/min离心 10min,取上清液待测。精密称定洛伐他汀胶囊内容物244.3mg,精密称定 20mg,加入乙腈定容至10ml容量瓶中,超声溶解30min,5000r/min离心 10min,取上清液待测。
[0126]
f、样品含量测定:取上述处理好的欣源片上清液和洛伐他汀胶囊上清液,分别进样10μl,在238nm波长的检测器下测得吸光度,并带入标准曲线方程。计算得到欣源片每片含有洛伐他汀11.23mg,每片洛伐他汀胶囊中含有洛伐他汀17.43mg。
[0127]
以上实验步骤f中检测器中的各参数分别为:色谱柱:wondasil c18 superb (4.6mm
×
250mm,5μm);检测波长:238nm;流速:1.0ml/min;进样量:10μl;流动相:乙腈:水=85:15。
[0128]
(1)血浆中标准曲线的制备及最低检测浓度的测定
[0129]
精密量取空白血浆500μl,精密加入不同量的洛伐他汀乙腈溶液和内标溶液,使洛伐他汀浓度分别为0.10,0.39,0.78,1.56,3.13,6.25,12.50,25.00, 50.00,100.00ng/ml。按“血浆样品的处理”项下方法操作,利用浓度c对对照品与内标峰面积比f作线性回归方程。
[0130]
犬血浆在0.10ng/ml~100mg/ml范围内线性关系良好,得回归方程: f=0.0427c+0.0611r=0.9997在上述条件下,测得洛伐他汀的最低检测浓度为0.10ng/ml。:(图10)
[0131]
(2)绝对回收率的测定
[0132]
分别配置高(300ng/ml)、中(30ng/ml)、低(3ng/ml)三种浓度的洛伐他汀乙腈溶液,分别精密量取500μl,按照加入1500μl的内标溶液,最终配置成高(75ng/ml)、中(7.5ng/ml)、低(0.75ng/ml)的洛伐他汀与内标混合溶液。
[0133]
取3μl进样分析,记录峰面积,利用浓度c对对照品与内标峰面积比f作线性回归方程。按照同样方法配置成高(75ng/ml)、中(7.5ng/ml)、低 (0.75ng/ml)的洛伐他汀与内标混合溶液。并按照“血浆样品的处理”项下方法操作,取3μl上清进样分析,记录峰面积。将峰面积代入回归方程,得到相应的浓度,进而计算出血浆中洛伐他汀的回收率。(图11)(表10
‑
12)
[0134]
表10高浓度洛伐他汀与内标峰面积比
[0135]
75ng/ml血浆乙腈17.5477.69927.2997.25436.6726.995
46.9966.75956.5817.538均值7.0197.243rsd(%)5.8325.186
[0136]
表11中浓度洛伐他汀与内标峰面积比
[0137]
75ng/ml血浆乙腈11.0301.13921.0131.12631.0531.05641.1081.04351.1621.056均值1.0731.084rsd(%)5.7044.135
[0138]
表12低浓度洛伐他汀与内标峰面积比
[0139]
75ng/ml血浆乙腈10.5510.71120.5630.71230.5780.66640.5650.66150.6050.672均值0.5720.684rsd(%)3.2993.647
[0140]
表13高、中、低浓度洛伐他汀的绝对回收率
[0141]
乙腈浓度(ng/ml)0.7507.50075.000乙腈峰面积0.6841.0847.243血浆峰面积0.5721.0737.019血浆浓度(ng/ml)0.5876.18072.615绝对回收率(%)78.282.496.8
[0142]
得到高、中、低三种浓度的绝对回收率(n=5)分别为78.2%、82.4%和96.8%。
[0143]
(3)药代动力学参数
[0144]
比格犬服用欣源片后,药代动力学参数如表14所示。
[0145]
表14实测单次给药后比格犬药代动力学参数
[0146][0147][0148]
在6只比格犬体内进行单剂量给药后的药代动力学研究,参数tmax为 (1.167
±
0.931)h,cmax为(62.333
±
41.386)mg/ml,t1/2为(5.954
±ꢀ
4.962)h,auc(0
‑
24)为(137.4
±
95.98)mg/l*h,auc(0
‑
∞)为(165.99
ꢀ±
98.529)mg/l*h,mrt为(2.266
±
0.507)h。
[0149]
综上所述,本实验以6只比格犬为研究对象,测定血浆中母体药物洛伐他汀的浓度,并进行药代动力学分析。实验结果显示,欣源片中洛伐他汀的达峰时间tmax为(1.167
±
0.931)h,最大血药浓度cmax为(62.333
±
41.386) mg/ml,消除半衰期t1/2为(5.954
±
4.962)h。以梯形法计算,血药浓度
‑ꢀ
时间曲线下面积auc(0
‑
24)为(137.4
±
95.98)mg/l*h,auc(0
‑
∞)为(165.99
ꢀ±
98.529)mg/l*h,体内滞留时间mrt为(2.266
±
0.507)h。
[0150]
文献报道的洛伐他汀学药浓度的检测方法主要有hplc
‑
uv法、lc
‑
ms法,其中,hplc
‑
uv紫外检测法灵敏度较低,且最低检测限较高,使用时无法准确测定血药浓度,lc
‑
ms中采用选择性离子检测(sim)模式,准确度较低,误差较大。本次实验采用安捷伦6420三重四极杆质谱检测仪,应用 lc
‑
ms
‑
ms中多反应监测(mrm)模式,可以同时准确定量待测物中洛伐他汀和内标物辛伐他汀的含量,专属性与选择性均较高。在分子离子的选择上,在此实
验条件下,洛伐他汀和辛伐他汀的[m+na]+均比[m+h]+峰响应值高,且更为稳定,因此选择[m+na]+峰为定量峰。辛伐他汀为洛伐他汀的同系物,采用辛伐他汀作为内标物,可以解决质谱检测器信号相对不稳定的问题。
[0151]
基于实验一至实验三可知,本实验通过对大鼠进行实验,对欣源片的降血脂、溶血栓的药理作用进行研究验证;通过对比格犬进行实验,对欣源片在体内的生物利用度进行考察;研究表示:欣源片具有向好的辅助降血脂的作用,同时在体内滞留时间短。
[0152]
对于本领域技术人员而言,显然发明不限于上述示范性实施例的细节,而且在不背离发明的精神或基本特征的情况下,能够以其他的具体形式实现发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
[0153]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1