一种检测干扰素IFNβ诱导表达的荧光报告细胞及其构建方法
一种检测干扰素ifn
β
诱导表达的荧光报告细胞及其构建方法
技术领域
1.本发明属于生物技术领域,具体涉及一种检测干扰素ifnβ诱导表达的荧光报告细胞及其构建方法。
背景技术:
2.在抵御病毒侵染机体的过程中,天然免疫起到了重要的作用。
3.抗病毒天然免疫信号通路起始于模式识别受体识别病毒相关病原分子模式。模式受体识别病毒后,激活信号通路转导,最终激活转录因子irf3和nf-κb入核,诱导i型干扰素的产生,促进病毒的清除。因此,阐释调节i型干扰素产生的重要机理和发现影响i型干扰素产生的重要因子是抗击病毒疾病的关键。
4.此外,能够有效激发或提高免疫力的药物,对于抗病毒的治疗而言是至关重要的。在这些药物中,能够有效诱导干扰素的产生的物质尤为重要。
5.然而,目前本领域一方面缺乏能有效诱导干扰素的产生的小分子化合物,另一方面,也缺乏筛选方法以便高效研究或筛选这类可有效诱导干扰素的物质。
6.因此,本领域迫切需要开发新的高效筛选诱导干扰素的药物的方法。
技术实现要素:
7.本发明的目的是提供一种可高效筛选诱导干扰素的药物的方法。
8.在本发明第一方面,提供了一种基因工程化的人胚肾细胞,所述人胚肾细胞的基因组中整合有外源的编码荧光蛋白的报告基因,并且所述的报告基因与所述人胚肾细胞的内源的干扰素ifnβ启动子操作性连接,从而可在所述内源的干扰素ifnβ启动子驱动下转录所述报告基因,并使得所述的人胚肾细胞表达所述的荧光蛋白。
9.在另一优选例中,所述的基因工程化的(genetically engineered)人胚肾细胞不表达干扰素ifnβ(即干扰素ifnβ被敲除)。
10.在另一优选例中,所述的报告基因是通过crispr/cas技术敲入人胚肾细胞的基因组。
11.在另一优选例中,通过将外源的编码荧光蛋白的报告基因敲入人胚肾细胞的基因组中干扰素ifnβ基因的预定位点,从而使得内源的干扰素ifnβ被敲除。
12.在另一优选例中,所述的预定位点是干扰素ifnβ启动子的直接下游(immediately downstream)。
13.在另一优选例中,所述的预定位点是位于干扰素ifnβ启动子的下游且位于干扰素ifnβ的第一外显子序列的上游。
14.在另一优选例中,所述的人胚肾细胞为293细胞。
15.在另一优选例中,所述的基因工程化的人胚肾细胞,通过crispr/cas技术,将外源的编码荧光蛋白的报告基因敲入293细胞的基因组。
16.在另一优选例中,所述的基因工程化的人胚肾细胞,所述基因工程化的人胚肾细
胞保藏在中国典型培养物保藏中心,其保藏号为cctcc no:c2020115,名称为人胚肾细胞293-ifnβ-gfp。
17.在本发明第二方面,提供了一种筛选ifnβ激活剂的方法,包括以下步骤:
18.(a)提供测试组和空白对照组,其中,所述的测试组包括一测试培养体系,所述测试培养体系含有:本发明第一方面所述的基因工程化的人胚肾细胞和待筛选的物质;
19.所述的空白对照组包括一空白对照培养体系,所述空白对照培养体系含有所述的基因工程化的人胚肾细胞但不含有所述的待筛选的物质,并且所述测试组和空白对照组的实验条件相同;和
20.(b)观察所述测试组中所述荧光蛋白的表达量e1,并与空白对照组中荧光蛋白的表达量e0相比;其中,如果表达量e1显著高于表达量e0,则提示所述的待筛选的物质是ifnβ表达激活剂。
21.在另一优选例中,所述的基因工程化的人胚肾细胞为人胚肾细胞293-ifnβ-gfp(cctcc no:c2020115)。
22.在另一优选例中,所述方法还包括:
23.(c)对于步骤(b)中确定的ifnβ激活剂,进一步通过细胞学实验或动物学实验,验证其对ifnβ表达的促进程度。
24.在另一优选例中,如果表达量e1≤表达量e0,则提示所述的待筛选的物质不是ifnβ表达激活剂。
25.在另一优选例中,所述的“显著高于”指e1与e0之比(e1/e0)≥2,较佳地≥5,更佳地≥10。
26.在另一优选例中,所述的表达量通过测定荧光蛋白的荧光来确定。
27.在另一优选例中,如果所述测试组中所述荧光蛋白的表达增强(即e1/e0≥2),则所述待测物质是ifnβ激活剂。
28.在另一优选例中,所述的ifnβ激活剂是诱导或促进ifnβ表达的激活剂。
29.在另一优选例中,所述的待筛选的物质包括小分子化合物。
30.在另一优选例中,所述方法还包括:
31.在步骤(a)中,还提供阳性对照组,所述阳性对照培养体系含有所述的基因工程化的人胚肾细胞并含有一阳性对照品,并且阳性对照组和所述测试组的实验条件相同;以及
32.在步骤(b)中,观察所述阳性对照组中所述荧光蛋白的表达量e2,并与阳性对照组中荧光蛋白的表达量e2与所述表达量e1和/或表达量e0进行比较。
33.在另一优选例中,所述的表达量e1和表达量e2之比(e1/e2)越大,则提示所述待筛选的物质对ifnβ表达的上调作用越大。
34.在另一优选例中,所述的表达量e0和表达量e2无显著差别,则提示实验出现错误(即实验质量不合格)。
35.在本发明第三方面,提供了一种试剂盒,所述的试剂盒含有本发明第一方面所述的基因工程化的人胚肾细胞以及说明书。
36.在另一优选例中,所述的说明书中记载了本发明第二方面所述的筛选ifnβ激活剂的方法。
37.在另一优选例中,所述的试剂盒还包括:阳性对照品,所述的阳性对照品为诱导或
促进ifnβ表达的物质。
38.在另一优选例中,所述的阳性对照品包括麦帕克林。
39.在本发明第四方面,提供了一种制备基因工程细胞的方法,所述方法包括以下步骤:
40.(a)提供一可表达内源干扰素的哺乳动物体细胞;
41.(b)在grna的引导下,通过基因编辑方法,将用于表达外源的编码荧光蛋白的的表达盒整合在所述体细胞的基因组中并位于干扰素ifnβ启动子下游,从而获得经基因编辑的体细胞,其中,所述的表达盒中外源的编码荧光蛋白的报告基因与所述体细胞的内源的干扰素ifnβ启动子操作性连接,从而可在所述内源的干扰素ifnβ启动子驱动下转录所述报告基因;
42.(c)对步骤(b)获得的经基因编辑的体细胞,通过核酸检测进行鉴定,从而获得整合位点正确的所述的基因工程细胞。
43.在另一优选例中,所述方法还包括:(d)对步骤(c)获得的基因工程细胞,进一步测定其在阳性对照品(如麦帕克林)存在情况下,外源的荧光蛋白的表达情况。
44.在另一优选例中,所述的基因编辑是基于cas9的基因编辑。
45.在另一优选例中,所述的哺乳动物体细胞为人细胞。
46.在另一优选例中,所述的哺乳动物体细胞为人胚肾细胞,较佳地为293细胞。
47.在另一优选例中,所述的grna靶向所述的干扰素ifnβ启动子区域的直接下游。
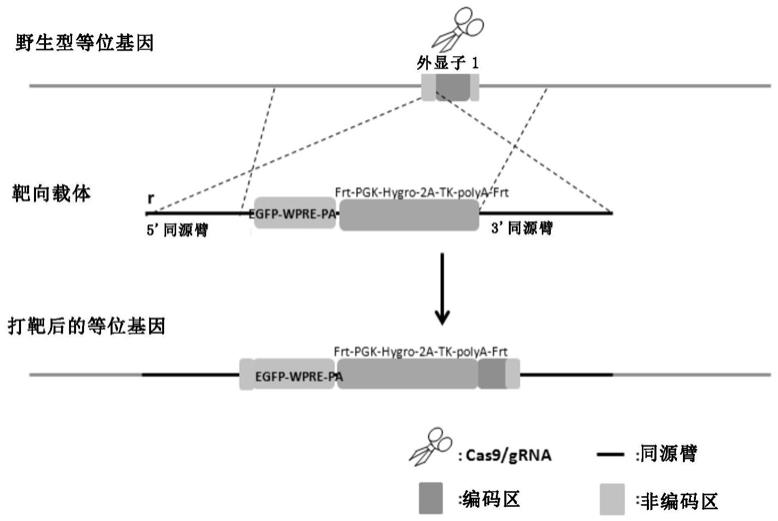
48.在另一优选例中,所述的grna靶向一预定位点,所述的预定位点是位于干扰素ifnβ启动子的下游且位于干扰素ifnβ的第一外显子序列的上游。
49.在另一优选例中,所述方法包括:
50.(s1)构建sgrna重组质粒,测序鉴定获得正确的sgrna重组质粒,其中,sgrna表达质粒表达cas核酸酶;
51.(s2)构建靶向ifnβ基因的打靶载体ifnβ-gfp-pa,该打靶载体依次包括ifnβ基因的上游同源臂,egfp-wpre-pa报告基因表达框,frt-pgk启动子,hygro-2a-tk-polya-frt抗性筛选片段,ifnβ基因的下游同源臂;
52.(s3)利用(s1)和(s2)所述的重组质粒分别转染293细胞;和
53.(s4)筛选并挑出基因组中整合有所述报告基因并能转录所述报告基因的基因工程化的人胚肾细胞。
54.在另一优选例中,所述的基因工程细胞为人胚肾细胞293-ifnβ-gfp(cctcc no:c2020115)。
55.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
56.图1显示了人胚肾细胞293-ifnβ-gfp构建策略示意图。其中,egfp-wpre-polya为本发明敲入的报告基因表达框;frt-pgk-hygro-2a-tk-polya-frt序列为原始质粒上携带的元件。
57.图2显示了人胚肾细胞293-ifnβ-gfp同源重组载体质粒图谱。
58.图3显示了人胚肾细胞293-ifnβ-gfp同源重组载体酶切鉴定电泳图,其中理论条带大小为9207b、4278bp、1796bp,m为1kb的dna分子标记。
59.图4显示了本发明人胚肾细胞293-ifnβ-gfp同源重组细胞株的鉴定策略示意图。其中,egfp-wpre-polya为本发明敲入的报告基因表达框;frt-pgk-hygro-2a-tk-polya-frt序列为原始质粒上携带的元件;i为5'同源臂-f引物(seq id no:1),ii为5'同源臂-r引物(seq id no:2);iii为3'同源臂-f引物(seq id no:3),iv为3'同源臂-r引物(seq id no:4);5'臂同源重组阴性克隆的pcr产物为7.0kb;3'臂同源重组阴性克隆的pcr产物为6.9kb;测序鉴定5'臂同源重组阳性克隆的pcr产物(5.4kb)的片段1、2;测序鉴定3'臂同源重组阳性克隆的pcr产物(3.3kb)的片段3、4。
60.图5显示了编号为3、4、6、17的同源重组阳性人胚肾细胞293-ifnβ-gfp的pcr鉴定电泳图,wt为野生型对照,m为1kb的dna分子标记。其中a图显示了5'同源臂鉴定结果;b图显示了3'同源臂鉴定结果。
61.图6显示了本发明的人胚肾细胞pcr阳性鉴定产物中5'同源臂的片段1测序反应与目的序列的比对结果,其中query为目的序列(人胚肾细胞293-ifnβ-gfp重组dna序列),subject为测序结果,红色(或深色)下划线碱基为5'同源臂的部分序列。
62.图7显示了本发明的人胚肾细胞pcr阳性鉴定产物中5'同源臂的片段2测序反应与目的序列的比对结果,其中query为目的序列(人胚肾细胞293-ifnβ-gfp重组dna序列),subject为测序结果,红色(或深色)下划线碱基为5'同源臂的部分序列,蓝色(或浅色)下划线碱基为敲入的部分序列。
63.图8显示了本发明的人胚肾细胞pcr阳性鉴定产物中3'同源臂的片段3测序反应与目的序列的比对结果,其中query为目的序列(人胚肾细胞293-ifnβ-gfp重组dna序列),subject为测序结果,蓝色(或浅色)下划线碱基为敲入的部分序列。
64.图9显示了本发明的人胚肾细胞pcr阳性鉴定产物中3'同源臂的片段4测序反应与目的序列的比对结果,其中query为目的序列(人胚肾细胞293-ifnβ-gfp重组dna序列),subject为测序结果,红色(或深色)下划线碱基为3'同源臂的部分序列。
65.图10显示了人胚肾细胞293-ifnβ-gfp在不同刺激后的gfp表达情况(比例尺=500μm)。图中分别显示了对照组(no treatment)、聚肌胞苷酸(poly(i:c))、仙台病毒感染(sev)在相差显微镜的观察结果(dic)和荧光显微镜的观察结果(gfp)。
66.图11显示了人胚肾细胞293-ifnβ-gfp在不同刺激后的gfp表达情况(比例尺=500μm)。图中分别显示了对照组(pcdna3)、天然免疫相关蛋白rig-i-n、线粒体抗病毒信号蛋白mavs在相差显微镜的观察结果(dic)和荧光显微镜的观察结果(gfp)。
具体实施方式
67.本发明人通过广泛而深入的研究,首次开发了一种可高效、快速、准确地筛选诱导干扰素表达的促进剂的方法。具体地,本发明人经过大量筛选,开发了一种遗传工程化的细胞系,该细胞系可对在培养体系中可能存在诱导干扰素表达的测试物质可作出快速、高效而准确的响应,并于便于高通量大规模筛选促进或诱导细胞表达干扰素(尤其是ifnβ)。在此基础上完成了本发明。
68.具体地,本发明人基于crispr/cas9靶向基因编辑技术建立了一种特定的遗传工程化的细胞,即人胚肾细胞293-ifnβ-gfp。该细胞是利用crispr/cas9系统在人胚肾细胞293中ifnβ基因的特定位点定点敲入egfp表达框而制备的。本发明的遗传工程化的细胞是荧光报告细胞,在接受刺激并激活tbk1/irf3下游通路后可诱导细胞表达荧光信号。因此适用于探索天然免疫中影响ifnβ转录激活的未知因子,以便进行药物分子筛选。
69.术语
70.如本文所用,术语“本发明的细胞”、“本发明的遗传工程化的细胞”、“本发明的人胚肾细胞”“人胚肾细胞293-ifnβ-gfp”可互换使用,指本发明第一方面中所述的细胞。本发明的细胞是在人源hek293细胞中ifnβ基因的特定位点定点敲入egfp表达框,从而作为ifnβ转录激活相关的荧光报告细胞。
71.天然免疫
72.在环境中存在各种各样的病原微生物。宿主的免疫系统针对病原微生物进化出了一套完善的防御体系。作为该防御体系的基础及第一道防线,天然免疫,又称固有免疫或者先天免疫,具有重要作用。
73.天然免疫信号通路起始于宿主细胞的模式识别受体(pattern-recognition receptors,prrs)对病原微生物的相关分子模式(pathogen associated molecular patterns,pamps)的识别。目前,已报道的prrs主要有四大类,它们分别是toll样受体(toll-like receptors,tlrs)、rig-i样受体(rig-i-like receptors,rlrs)、nod样受体(nod-like receptors,nlrs),以及最近发现的几种dna受体(如dai、aim2、ifi16、ddx41、cgas)。绝大多数单链rna病毒和部分双链rna病毒都受到rig-i样受体的监控,例如流感病毒、冠状病毒、以及埃博拉病毒等。dna病毒可受到dna受体如cgas的监控。这些模式识别受体识别病毒后,通过信号转导激活下游的蛋白质激酶tbk1/ikkβ。蛋白质激酶tbk1/ikkβ能够进一步激活转录因子nf-κb和irf3,使其进入细胞核共同诱导i型干扰素ifn和促炎症因子的表达。这些细胞因子以及趋化因子进一步调控其他免疫细胞并激活补体系统。随后,巨噬细胞和树突状细胞还能够进一步处理加工抗原,通过抗原递呈来激活获得性免疫,促使淋巴细胞行使功能,从而快速地清除病原体。
74.报告基因
75.本发明所用的术语“报告基因”具有本领域普通技术人员熟知的含义,即编码可被检测的蛋白质或酶的基因,换言之,其表达产物非常容易被鉴定的基因,例如荧光素酶报告基因。
76.在优选例中,本发明所用的报告基因是编码荧光蛋白,包括绿色荧光蛋白、红色荧光蛋白、黄色荧光蛋白等各种不同荧光蛋白的基因。
77.crispr/cas系统
78.crispr/cas系统(clustered regularly interspaced short palindromic repeats/crispr-associated protein)是原核生物中一种抵抗外源基因侵入的获得性免疫防御机制。由细菌和古生菌在抵御外来病毒和噬菌体入侵的过程中不断进化而来。该系统能够整合外援侵入宿主的dna片段到crispr位点,然后通过相应的crispr rnas(crrnas)引导cas核酸内切酶对外源dna序列进行切割,从而抵抗病毒或者噬菌体的入侵。crispr/cas基因簇由一系列cas蛋白(cas1、cas2、cas4和效应蛋白如cas9、cpf1等)的编码基因和一
段crispr序列组成,
79.crispr序列由一段前导序列(leader)、众多短而保守的重复序列区(repeat)和间隔区(spacer)组成。重复序列区含有回文序列,能够形成发卡结构。而间隔区就是被宿主俘获的外源dna序列。这些被俘获的外源dna序列相当于免疫系统的“黑名单”,当这些外源的遗传物质再次入侵宿主时,细菌开始转录crispr,形成初级转录产物pre-crrna,再由核糖核酸酶或cas蛋白在重复序列位点内切割形成成熟的crrna,与特异的crispr效应蛋白形成核糖核蛋白复合体,识别并切割能与crrna互补配对的外源dna,造成双链断裂,引发宿主细胞的自我修复。
80.根据cas基因的组成和效应蛋白的数量,crispr被分为了2类5型,共16种亚型。1类为利用多个效应蛋白复合物干扰靶基因的crispr/cas系统,包括ⅰ、ⅲ和ⅳ型;2类为利用单一的效应蛋白干扰靶基因的crispr/cas系统,包括ⅱ型和
ⅴ
型。目前研究和利用最广泛的为2类ⅱ型,即为crispr/cas9系统。该系统2013年在哺乳动物细胞中成功实现了基因编辑。ⅱ型系统可以通过crrna的引导利用单个cas9核酸酶对dna靶位点进行精确充分地切割。该系统操作简单,实验周期短,效率高,且广泛适用于多个物种。该系统需要设计一段特殊的引导rna,即sgrna(single guide rna),sgrna的序列设计是在基因组序列中的pam(ngg)区的一段20nt左右核苷酸序列。在sgrna的引导下,cas9蛋白可以对基因组实现定点切割,引起dna双链断裂,激活细胞的非同源末端连接(non-homologous end joining,nhej)或同源重组(homologous recombination,hr)两种修复机制,从而实现基因的敲除、随机的片段缺失或插入,或者利用特定的模板修复,从而实现对基因组的永久性修饰。
81.ifnβ表达激活剂
82.本发明所用的术语“ifnβ表达激活剂”指能够激活ifnβ表达的物质,尤其是小分子化合物。
83.一种代表性的激活剂是聚肌胞苷酸poly(i:c),它是合成型的双链rna(dsrna)的类似物,活化抗病毒模式识别受体tlr3、rig-i/mda5和pkr,从而诱导多条炎症通路(包括nf-κb,irf)介导的信号途径,能够激活干扰素i型ifns(尤其是ifnβ)的表达。
84.本发明的主要优点包括:
85.(a)本发明首次提供了一种人胚肾细胞293-ifnβ-gfp荧光报告细胞,可以高效、快速、准确地筛选诱导干扰素表达的激活剂;
86.(b)本发明的人胚肾细胞293-ifnβ-gfp荧光报告细胞可以与高通量荧光分析技术结合,提供了一种筛选诱导干扰素的药物的方法。
87.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
88.材料和试剂
89.(a)引物序列
90.5'同源臂鉴定所用引物序列:
91.表1:
92.名称序列(5'-3')seq id no:5'同源臂-ftctccctgttccaatcacctctaa15'同源臂-rgaccgggcactttctatgatttgt2
93.3'同源臂鉴定所用引物序列:
94.表2:
95.名称序列(5'-3')seq id no:3'同源臂-fgttcattctcctggctgtgtttg33'同源臂-rgatatgggaagggggaaggtg4
96.细胞培养基(dmem)购于hyclone公司,胎牛血清(fbs)购于吉泰依科赛公司,琼脂糖购于biowest公司,限制性内切酶购于neb公司,pcr试剂购于takara公司,dna分子标记generuler 1kb购于thermo fisher scientific公司。
97.实施例1:人胚肾细胞293-ifnβ-gfp的构建
98.1.1细胞培养
99.人胚肾细胞293(hek293)购于atcc。在37℃和5%co2培养箱中培养单细胞层。在含10%fbs、100u/ml青霉素和100μg/ml链霉素的dmem培养基中培养细胞。
100.1.2 dna载体构建
101.1.2.1靶向ifnβ基因位点的sgrna的dna载体构建
102.将合成的互补sgrna序列退火后连接到crsipr/cas9载体上。sgrna序列为:
103.sgrna1:acaacaggagagcaatttgg(seq id no:5);
104.sgrna2:agcacaacaggagagcaatt(seq id no:6)。
105.1.2.2人胚肾细胞293-ifnβ-gfp打靶载体质粒构建
106.在人胚肾细胞293(hek293)中ifnβ基因的特定位点定点敲入egfp表达框,从而构建本发明的人胚肾细胞,细胞构建策略的示意图如图1所示。
107.利用人胚肾细胞293基因组dna,通过pcr扩增得到5'同源臂(seq id no:7)、3'同源臂序列(seq id no:8)。egfp报告基因序列如seq id no:9所示。原有的wpre元件及frt-pgk-hygro-2a-tk-polya-frt序列均为原始质粒上携带的序列。其中wpre为土拨鼠肝炎病毒转录后调控序列,具有增强转录本翻译的效应。通过重叠pcr将所有元件顺序连接。通过infusion的克隆构建方法构建细胞打靶载体,该载体包含3.0kb 5'同源臂、egfp-wpre-pa、frt-pgk-hygro-2a-tk-polya-frt、3.0kb 3'同源臂。in-fusion克隆构建载体的方式参照takara公司in-hd cloning plus试剂盒说明书。
108.构建的人胚肾细胞293-ifnβ-gfp同源重组载体质粒图谱如图2所示。
109.通过sacii酶酶切鉴定人胚肾细胞293-ifnβ-gfp同源重组载体质粒。
110.实验结果如图3所示,酶切鉴定的电泳结果的条带大小为9207b、4278bp、1796bp,与理论条带大小相符合。
111.1.3细胞转染及筛选
112.将上述构建好的质粒转染人胚肾细胞293。以合适的细胞密度接种平板,培养16-24h。分别将质粒和转染试剂用opti-mem培养基稀释,室温静置5min。按照dna(g):2000(μl)为1:2的量混合两种稀释液。充分吹打混匀,室温静置15min。将
转染混合物逐滴加入已经提前将培养基换置为opti-mem培养基的细胞中,培养6h。弃去含有转染混合物的上清,换置为正常培养基培养36-48h。消化转染后的细胞并以20%融合度铺板。将培养基换为含有100μg/ml潮霉素的正常培养基,筛选48h-72h。扩大培养所得细胞,通过分96孔板挑选出单克隆细胞。
113.实验共获得抗性人胚肾293细胞克隆144个。
114.实施例2:hek293-ifnβ-gfp细胞的验证
115.2.1pcr检测和电泳鉴定
116.抽提抗性细胞克隆的基因组dna,通过长片段pcr的方式筛选同源重组阳性克隆。
117.通过正向引物5'tctccctgttccaatcacctctaa 3'(seq id no:1)和反向引物5'gaccgggcactttctatgatttgt 3'(seq id no:2)鉴定同源重组克隆的5'同源臂。5'臂同源重组阳性克隆能够扩增出5.4kb片段,阴性克隆应扩增出7.0kb片段;
118.通过正向引物5'gttcattctcctggctgtgtttg 3'(seq id no:3)和反向引物5'gatatgggaagggggaaggtg 3'(seq id no:4)鉴定同源重组克隆的3'同源臂。其中,3'臂同源重组阳性克隆应扩增出3.3kb片段,阴性克隆应扩增出6.9kb片段。
119.实验结果如图5所示,通过dna凝胶电泳分析,同源重组阳性克隆的5'同源臂的pcr鉴定能够扩增出大小为7.0kb和5.4kb的两条带,同源重组阳性克隆的3'同源臂的pcr鉴定能够扩增出大小为3.3kb的一条带。通过pcr检测和电泳鉴定获得的4个双臂同源重组阳性克隆的编号为3、4、6、17。
120.2.2阳性克隆的测序验证
121.对2.1中获得的同源重组阳性克隆的pcr鉴定产物进行测序。
122.共进行了4个测序反应,细胞鉴定策略示意如图2所示。
123.5'同源臂鉴定的pcr产物测序共进行了2个测序反应,分别标注为:1、2。1、2测序反应与目的序列的比对结果如图6和图7所示。
124.图6和7表明,5'同源臂的片段1和片段2的测序结果与目的序列的比对结果一致。
125.3'同源臂鉴定的pcr产物测序共进行了2个测序反应,分别标注为:3、4。3、4测序反应与目的序列的比对结果如图8和9所示。
126.图8和9表明,3'同源臂的片段3和片段4的测序结果与目的序列的比对结果一致。
127.以上实验结果表明,同源重组阳性克隆中,egfp表达框通过同源重组插入ifnβ基因的基因位点。
128.实施例3:人胚肾细胞293-ifnβ-gfp表型验证
129.为了明确本发明的细胞能否响应ifnβ的刺激,将同源重组人胚肾细胞293-ifnβ-gfp铺板,利用lipo2000转染天然免疫相关蛋白rig-i-n或线粒体抗病毒信号蛋白mavs质粒(0.5μg/ml),转染24-48h后,利用荧光显微镜活细胞观察gfp表达。
130.由图11可以看出,在人胚肾细胞293-ifnβ-gfp中过表达天然免疫相关蛋白rig-i-n或线粒体抗病毒信号蛋白mavs,与空白对照(转染pcdna3空质粒)相比,有明显的绿色荧光信号,本发明的细胞中gfp的表达量明显上调。
131.实验结果表明细胞中的ifnβ信号通路完整。本发明的重组细胞在天然免疫信号通路关键的下游tbk1-irf3通路激活后,能诱导绿色荧光蛋白gfp的表达。
132.将同源重组的人胚肾细胞293-ifnβ-gfp铺板,用50ha units/ml浓度的仙台病毒
sev感染细胞。将含有仙台病毒sev的培养基加入本发明的人胚肾细胞293-ifnβ-gfp上清中,培养24h,利用荧光显微镜活细胞观察gfp表达。将同源重组人胚肾细胞293-ifnβ-gfp铺板,利用lipo2000转染试剂转染聚肌胞苷酸poly(i:c)(1μg/ml),转染24-48h后,利用荧光显微镜活细胞观察gfp表达。
133.由图10可以看出,经poly(i:c)和sev处理的测试组与空白对照(no treatment)相比,有明显的绿色荧光信号,本发明的细胞中gfp的表达量明显上调。
134.综上实验结果表明,本发明的细胞中绿色荧光的强度可以反应细胞中ifnβ的表达水平,进而筛选ifnβ表达激活剂。
135.讨论
136.基于全基因组的高通量crispr/cas9筛选成为各类生命科学研究领域探究未知生物学过程的重要的工具。因此发明人期望利用全基因组筛选找到影响细胞i型干扰素产生的未知因素。
137.然而目前缺少筛选天然免疫中i型干扰素转录激活剂的方法。本发明中检测i型干扰素ifnβ诱导表达的荧光报告细胞能够结合荧光流式分选和高通量荧光分析技术,进行全基因组的药物分子筛选,从而找到诱导i型干扰素转录的激活剂。
138.菌种保藏
139.本发明的人胚肾细胞293-ifnβ-gfp(与保藏名称相同)已于2020年6月23日保藏在中国典型培养物保藏中心,地址:中国武汉市武汉大学,保藏号:cctcc no:c2020115。
140.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1