一种验证沉默PHD2能够增强BM-MSCs旁分泌效果的试验方法与流程
一种验证沉默phd2能够增强bm-mscs旁分泌效果的试验方法
[0001]
本研究得到国家自然科学基金(no.81300279、81741067)、广东省自然科学基金(no.2016a030313815、2017a030313464)、广东省科学技术项目(no.2015a020212029),广州市科学技术项目(no.201707010419、201804010050)、广东省中医药局科研项目(no.20201009、20201010)、高水平医院建设项目(登峰计划)(no.dfjh201803、kj012019099)资助。
技术领域
[0002]
本发明属于生物技术领域,具体涉及一种验证沉默phd2能够增强bm-mscs旁分泌效果的试验方法。
背景技术:
[0003]
nec(necrotizing enterocolitis)是新生儿最常见的胃肠道急重症,见于7%-10%的早产儿,死亡率高达20-50%,nec确切发病机制未明,目前尚无理想的治疗方法,20%-40%病例需要手术切除坏死肠道,幸存者常需面临短肠综合征等终身伴随的后遗症。
[0004]
虽然进行了长达几十年的研究,nec仍然是早产儿发病和死亡的主要病因。
[0005]
干细胞疗法可能是治疗nec最有前景的方法之一。干细胞抑制炎症和组织修复的能力引起了人们对治疗nec的极大兴趣,有报道称,干细胞可修复不同类型的小肠损伤。干细胞的修复作用不仅表现在干细胞迁移和植入受损组织,更重要的是,干细胞还分泌多种效应分子,如生长因子、免疫调节因子、含rna的胞外囊泡(evs)等,以促进组织的恢复。
[0006]
虽然骨髓间充质干细胞疗法可能是干细胞移植的一种可行的替代方案,但干细胞移植往往因为嫁接效率低和潜在的肿瘤发生率受阻,因此在其临床应用之前必须解决的一个主要问题是旁分泌物质中的活性因子浓度过低。研究已经表明,间充质干细胞(mscs)释放的旁分泌因子不足以修复缺血性损伤和/或小肠粘膜损伤。解决该问题的一种方法是对mscs的关键基因进行修饰,以增强mscs中活性因子的分泌。现有技术中曾尝试修饰akt、血管内皮生长因子(vegf)、碱性成纤维细胞生长因子(bfgf)和胰岛素样生长因子(igf-1)等基因以增强msc旁分泌的效果,但多项临床研究还表明单一的血管生成因子的表达可能不足以促进血管新生并修复组织损伤。
技术实现要素:
[0007]
针对现有技术的缺陷,本发明提供了一种验证沉默phd2能够增强bm-mscs旁分泌效果的试验方法,以验证沉默phd2能够以及如何增强骨髓间充质干细胞旁分泌的效果。
[0008]
本发明提供了一种验证沉默phd2能够增强bm-mscs旁分泌效果的试验方法,试验方法包括:
[0009]
第一步、制备phdmsc-cm与msc-cm:
[0010]
1)将大鼠phd2
·
shrna构建到慢病毒基因转移载体pgcsil-gfp上,在感染复数(moi)为10下,用含shphd2-gfp的慢病毒转染bm-mscs,通过检测gfp荧光及phd2蛋白表达确
定稳定转染的bm-mscs,运用流式细胞仪进行细胞分选富集,然后进一步培养,培养后将其在新的无血清基础培养基中再培养48小时,将细胞与培养基分离后,得到含有bm-mscs高效表达旁分泌物质的基础phdmsc-cm;
[0011]
2)将未转染phd2
·
shrna的bm-mscs在新的无血清基础培养基中培养48小时,将细胞与培养基分离后,得到含有bm-mscs正常表达旁分泌物质的msc-cm;
[0012]
第二步、获取实验nec幼鼠:
[0013]
选取定时孕鼠,于妊娠第21天co2麻醉下剖宫产获得幼鼠,进行诱导nec,得到实验nec损伤鼠,随机分成实验组和对照组;
[0014]
第三步、实验验证:
[0015]
对对照组的nec损伤鼠以腹腔注射的方式注射超滤浓缩后的msc-cm,分别在造模开始第1天、第4天、第7天处死部分nec损伤鼠,对收集样本的结构和功能进行检查、比对;同时对于未处死的实验对象,观察其7天存活情况,并行生存分析。
[0016]
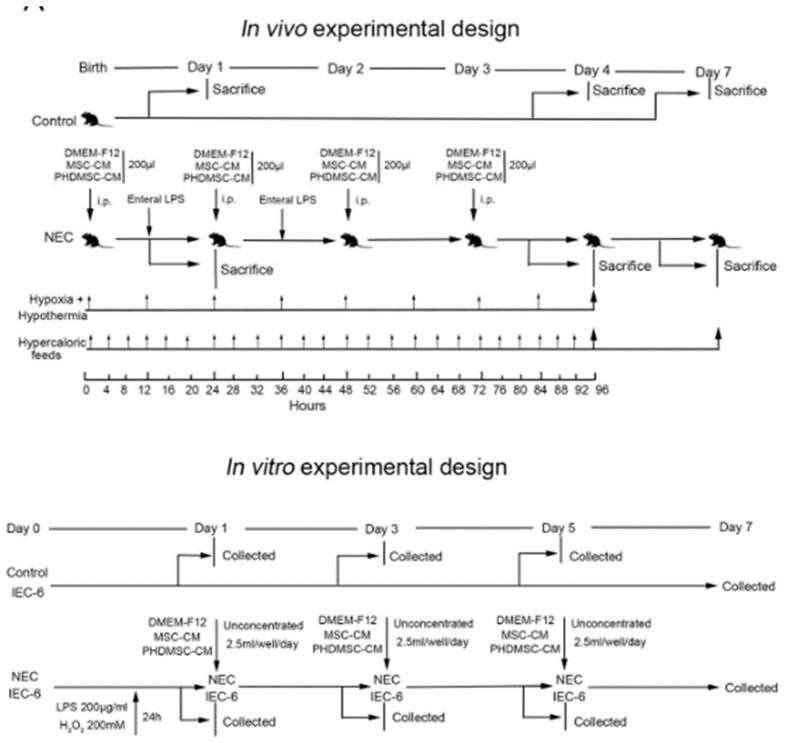
对实验组的nec损伤鼠以腹腔注射的方式注射超滤浓缩后的phdmsc-cm,分别在造模开始第1天、第4天、第7天处死部分nec损伤鼠,对收集样本的结构和功能进行检查、比对;同时对于未处死的实验对象,观察其7天存活情况,并行生存分析;
[0017]
对phdmsc-cm及msc-cm中的旁分泌物质进行检测,比对;
[0018]
第四步、处理数据。
[0019]
根据本发明的另一种具体实施方式,通过第四步,相较于对照组,实验组的nec鼠肠道结构及功能损伤明显减轻,其发病率和生存率得到明显改善,且检测phdmsc-cm中的旁分泌物质较msc-cm明显增加,得出沉默phd2能够增强bm-mscs旁分泌效果的结论。
[0020]
根据本发明的另一种具体实施方式,在第二步中,诱导nec的方式包括但不限于灌胃喂养高热量配方、低氧、低温和lps灌胃。
[0021]
根据本发明的另一种具体实施方式,在第三步中,建立基础对照组,对基础对照组的nec损伤鼠以腹腔注射的方式注射dmem-f12基础培养基,分别在造模开始第1天、第4天、第7天处死nec损伤鼠,对收集组织样本的结构和功能进行检查、比对,同时对于未处死的实验对象,观察其7天存活情况,并行生存分析。
[0022]
根据本发明的另一种具体实施方式,第三步中,对所使用的msc-cm、phdmsc-cm进行超滤浓缩50倍处理,并控制截留分子量为5kda。
[0023]
根据本发明的另一种具体实施方式,第三步实验验证还包括体外实验过程:
[0024]
1)获取大鼠肠上皮iec-6细胞,并进行nec损伤造模;
[0025]
2)将nec损伤iec-6细胞与msc-cm共培养,在造模开始后第1、3、5、7天检测、记录iec-6细胞的增殖和凋亡情况;
[0026]
3)将nec损伤iec-6细胞与phdmsc-cm共培养,在造模开始后第1、3、5、7天检测、记录iec-6细胞的增殖和凋亡情况;
[0027]
4)将nec损伤iec-6细胞与dmem-f12基础培养基,在造模开始后第1、3、5、7天检测、记录iec-6细胞的增殖和凋亡情况。
[0028]
根据本发明的另一种具体实施方式,第一步中的phdmsc-cm中至少含有4000~4500pg/ml的igf-1,msc-cm中至少含有1000~1200pg/ml的igf-1。
[0029]
根据本发明的另一种具体实施方式,第一步中的phdmsc-cm至少含有500~600pg/
ml的tgf-β2,msc-cm至少含有60~75pg/ml的tgf-β2。
[0030]
根据本发明的另一种具体实施方式,第一步中新的无血清基础培养基为dmem-f12培养基。
[0031]
本发明具备以下有益效果:
[0032]
本发明通过设置实验组与对照组进行数据验证,相较于对照组,实验组的nec鼠肠道结构及功能损伤明显减轻,其发病率和生存率得到明显改善,且检测phdmsc-cm中的旁分泌物质较msc-cm明显增加,得出沉默phd2能够增强bm-mscs旁分泌效果的结论。
[0033]
下面结合附图对本发明作进一步的详细说明。
附图说明
[0034]
图1显示了用shphd2-gfp慢病毒转导的bm-mscs特异性降低phd2表达;其中,图1a显示了所建立的体内和体外实验流程,图1b显示了用含有gfp或shphd2-gfp载体的慢病毒转染bm-mscs,图1c显示了shphd2能特异性降低phd2蛋白表达,但不影响phd1和phd3蛋白表达,图1d流式细胞术分析显示phdmsc对cd29、cd44呈阳性反应,而对cd34、cd45呈阴性反应,表明基因转染过程没有改变msc的表型;
[0035]
图2显示了phdmsc-cm通过减少肠道结构和功能损害来改善nec大鼠的生存率和发病率,其中图2a、2b分别显示了phdmsc-cm治疗后显著提高了nec大鼠存活率、降低了nec的发病率的情况,图2c显示了phdmsc-cm治疗后nec幼鼠的出生后生长迟缓现象明显改善并出现了体重增加的情况,图2d显示了phdmsc-cm治疗的nec幼鼠回肠损伤明显减轻的情况(从左到右依次为:大体观、显微镜下、电镜下);图2e、2f显示了phdmsc-cm治疗后nec鼠损伤肠通透性(血浆d-乳酸水平)和肠动力(亚甲基蓝迁移率)得到明显改善的情况;
[0036]
图3显示了phdmsc-cm在体内和体外减少nec大鼠肠上皮细胞凋亡情况,其中,图3a显示了在生后第4天,phdmsc-cm而非msc-cm能够降低nec大鼠肠道tunel阳性细胞数量,图3b、3c、3d分别显示了与phdmsc-cm共培养而非msc-cm能保护损伤iec-6细胞免于凋亡的情况(第3天),图3e显示了与dmem-f12组相比phdmsc-cm共培养后第3、5、7天均能显著降低iec-6细胞凋亡情况;
[0037]
图4显示了phdmsc-cm在体内和体外增加大鼠肠上皮细胞的增殖情况,其中,图4a显示了phdmsc-cm组在第4天的肠道pcna阳性细胞数量显著高于msc-cm组和nec损伤组,图4b显示了phdmsc-cm组在第1、4、7天肠道的pcna阳性细胞数量均高于msc-cm组和nec损伤组,图4c、4d分别显示了在第3天与phdmsc-cm的共培养显著增加了lps/h2o2损伤iec-6细胞中pcna阳性细胞的数量;图4e、4f显示了在第3天phdmsc-cm而非msc-cm能显著增加lps/h2o2损伤iec-6细胞周期s期细胞比例;图4g显示在第3、5、7天、对比dmem-f12,phdmsc-cm显著增加lps/h2o2损伤iec-6细胞周期s期细胞比例;
[0038]
图5显示了phdmsc-cm促进nec大鼠肠道干细胞的再生情况,其中,图5a、5b分别显示了在出生第4天经phdmsc-cm治疗后,nec损伤鼠肠道中lgr5阳性细胞数量明显增加,图5c是lgr5蛋白印迹分析结果,即在第4天,经phdmsc-cm治疗后nec损伤鼠肠道中lgr5表达增加,图5d是lgr5实时定量pcr结果,显示在出生后1、4、7天,对比dmem-f12及msc-cm,phdmsc-cm能明显增加nec大鼠肠道lgr5mrna的表达;
[0039]
图6是显示phdmsc-cm在全身和黏膜水平下调nec大鼠的炎症反应情况,其中,图6a
是基因芯片结果,即显示了phdmsc-cm治疗组中10种血清细胞因子显著增加,图6b是大鼠血清中6种抗炎和促炎因子水平,显示了用phdmsc-cm而非msc-cm治疗能显著减少nec大鼠血清中的促炎细胞因子和增加抗炎细胞因子;图6c是大鼠肠组织中6种抗炎和促炎因子水平,显示了用phdmsc-cm而非msc-cm治疗能显著减少小肠粘膜中的促炎细胞因子和增加抗炎细胞因子,图6d显示了在第4天,phdmsc-cm治疗后nec幼鼠肠系膜淋巴结(mln)中cd4+foxp3+treg细胞的数量显著增加;
[0040]
图7显示了沉默phd2通过nf-κb途径增强bm-mscs旁分泌对nec治疗的影响,其中,图7a、7b显示了基因芯片的结果,即与msc-cm(>2.0x)相比,phdmsc-cm中27种细胞因子显著增加,图7c显示了elisa测定条件培养基中7个细胞因子浓度变化情况,图7d显示了对细胞因子进行中和或是应用外源性细胞因子对lps/h2o2损伤iec6增殖/凋亡,nec损伤鼠7天生存率的影响,图7e显示了蛋白质印迹结果,即沉默phd2显著增强hif-1α的表达并且该表达可被shhif-1α阻断,图7e显示了沉默phd2增加了ikkβ的磷酸化并进一步增加了iκbα的磷酸化和降解,图7f、图7g显示了核转位(图7f)和nf-κb的dna结合活性(图7g),图7h显示了bay117082能阻断沉默phd2诱导的关键细胞因子(igf-1和tgf-β2)的升高,图7i-7j显示了nf-κb抑制剂(dn-iκbα)对bm-mscs旁分泌介导对nec鼠肠上皮细胞治疗作用的影响,即dn-iκbα阻断了phdmsc-cm对小肠上皮细胞增(增殖细胞核抗原阳性细胞数)、凋亡(tunel阳性细胞数)和生存益处情况,图7k是chip测定引物设计原理图,图7l是chip测定结果,图7m显示了igf-1及tgf-β2在大鼠肠组织的含量情况,图7n显示了来源于lps刺激msc的条件培养基对nec的凋亡及增殖的影响,图7o显示了不同预刺激时间下,lps诱导对msc旁分泌功能的影响;
[0041]
图8是本发明实验过程的示意图;
[0042]
图9是染色质免疫沉淀(chip)测定过程中所采用的特异性引物。
具体实施方式
[0043]
本示例提供了一种验证沉默phd2能够增强bm-mscs旁分泌效果的试验方法,试验方法包括:
[0044]
第一步、制备phdmsc-cm与msc-cm:
[0045]
1)将大鼠phd2
·
shrna构建到慢病毒基因转移载体pgcsil-gfp上,在感染复数(moi)为10下,用含shphd2-gfp的慢病毒转染bm-mscs,通过检测gfp荧光及phd2蛋白表达确定稳定转染的bm-mscs,运用流式细胞仪进行细胞分选富集,然后进一步培养,培养后将其在新的dmem-f12培养基中再培养48小时,将细胞与培养基分离后,得到含有bm-mscs高效表达旁分泌物质的基础phdmsc-cm;
[0046]
2)将未转染phd2
·
shrna的bm-mscs在新的dmem-f12培养基中培养48小时,将细胞与培养基分离后,得到含有bm-mscs正常表达旁分泌物质的msc-cm;
[0047]
第二步、获取实验nec幼鼠:
[0048]
选取定时孕鼠,于妊娠第21天co2麻醉下剖宫产获得幼鼠,进行诱导nec,得到实验nec损伤鼠,随机分成实验组、对照组与基础对照组;
[0049]
第三步、实验验证:
[0050]
对对照组的nec损伤鼠以腹腔注射的方式注射超滤浓缩后的msc-cm,分别在造模
开始第1天、第4天、第7天处死部分nec损伤鼠,对收集样本的结构和功能进行检查、比对;同时对于未处死的实验对象,观察其7天存活情况,并行生存分析。
[0051]
对实验组的nec损伤鼠以腹腔注射的方式注射超滤浓缩后的phdmsc-cm,分别在造模开始第1天、第4天、第7天处死部分nec损伤鼠,对收集样本的结构和功能进行检查、比对;同时对于未处死的实验对象,观察其7天存活情况,并行生存分析;
[0052]
对phdmsc-cm及msc-cm中的旁分泌物质进行检测,比对;
[0053]
建立基础对照组,对基础对照组的nec损伤鼠以腹腔注射的方式注射dmem-f12基础培养基,分别在造模开始第1天、第4天、第7天处死nec损伤鼠,对收集组织样本的结构和功能进行检查、比对,同时对于未处死的实验对象,观察其7天存活情况,并行生存分析。
[0054]
第四步、处理数据。
[0055]
相较于对照组,实验组的nec鼠肠道结构及功能损伤明显减轻,其发病率和生存率得到明显改善,且检测phdmsc-cm中的旁分泌物质较msc-cm明显增加,得出沉默phd2能够增强bm-mscs旁分泌效果的结论。
[0056]
本示例中诱导nec的方式包括但不限于灌胃喂养高热量配方、低氧、低温和lps灌胃。
[0057]
本示例中,对所使用的msc-cm、phdmsc-cm进行超滤浓缩50倍处理,并控制截留分子量为5kda。
[0058]
此外,本示例实验验证还包括体外实验过程:
[0059]
1)获取大鼠肠上皮iec-6细胞,并进行nec损伤造模;
[0060]
2)将nec损伤iec-6细胞与msc-cm共培养,在造模开始后第1、3、5、7天检测、记录iec-6细胞的增殖和凋亡情况;
[0061]
3)将nec损伤iec-6细胞与phdmsc-cm共培养,在造模开始后第1、3、5、7天检测、记录iec-6细胞的增殖和凋亡情况;
[0062]
4)将nec损伤iec-6细胞与dmem-f12基础培养基,在造模开始后第1、3、5、7天检测、记录iec-6细胞的增殖和凋亡情况。
[0063]
下面详细阐述实验的过程以及数据分析过程,其中下述实验中所使用的实验方法如无特殊说明,均为常规方法,下述实验中所用的材料、试剂等,如无特殊说明,均可从商业途径得到:
[0064]
动物
[0065]
采用中山大学实验动物中心提供的定时孕鼠sprague-dawley,于妊娠第21天co2麻醉下剖宫产。动物是按照规范的动物使用标准处理的,动物实验也得到了动物保护和使用委员会的批准。动物分组由计算机随机分配,研究者在对动物实验时对干预手段并不知情。
[0066]
细胞
[0067]
所需细胞有bm-mscs(可用现有技术中的多种方式获取,本次实验采用发明人之前的公开方式获取,记录在pre-activation of mesenchyma lstem cells with tnf-α,il-1βand nitric oxide enhances its paracrine effects on radiation-induced intestina linjury.scientific reports 5,8718(2015)),未转化的大鼠肠上皮iec-6细胞(crl-1592,第13代)购自attc,培养基为dmem-h,10%胎牛血清,1%盘尼西林/链霉素,培
养条件为37℃恒温孵育箱(5%co2),实验中使用的iec-6细胞代数在第20代或之前。所有细胞已通过支原体检测。
[0068]
实验nec模型
[0069]
采用建立良好的方案诱导nec,通过灌胃喂养高热量配方、低氧、低温和口服lps诱导nec。没有使用统计方法来确定样本量,但是发明人的样本量与先前研究中报道的相似。在1,4,7天处死大鼠并收集组织样本进行结构和功能检查,或在整个7天实验过程内监测其生存状态。在体外研究中,用lps(200μg/ml)和h2o2(0.2mm)处理iec-6细胞24小时,并在暴露后1,3,5,7天进行观察。
[0070]
条件培养基的制备与处理
[0071]
为了在骨髓间充质干细胞中敲除phd-2的短发夹rna(shrna),将大鼠phd2(genbank id:xm_008772679)shrna构建到慢病毒基因转移载体pgcsil-gfp(genechem co.,ltd.,china)中。在moi为10下,用含gfp或shphd2-gfp的慢病毒感染bm-mscs。通过检测gfp荧光和phd2蛋白表达确定稳定转染的bm-mscs,并用facs aria ii(bd biosciences)进行细胞分选富集,用于进一步培养和制备条件培养基。hif-1α(genbank id:xm_006240196)shrna的感染方式与慢病毒phd2shrna相似。从骨髓间充质干细胞(bm-mscs)制备条件培养基。用含有gfp(gfp-msc)或shphd2-gfp载体(phdmsc)的慢病毒转导bm-mscs,在新的无血清dmem-f12中培养48h。1ml非浓缩条件培养液大约相当于2
×
105bm-mscs的分泌量。然后收集条件培养基并分别浓缩为msc-cm和phdmsc-cm。条件培养基随后通过超滤浓缩50倍,截留量为5kda(milliporea,billerica,ma),并在-20℃下储存以供进一步使用。除非另有说明,在体内实验中使用浓缩条件培养基(前0-3天:100μl/动物/12h),在体外使用六孔板实验中使用非浓缩条件培养基(2.5ml/孔/天)。
[0072]
为了确定igf-1或tgf-β2是否可以替代nec模型中的phdmsc-cm,给幼鼠(5~10g)注射180ng重组大鼠igf-1(abcam,cambridge,uk)和25ng重组大鼠tgf-β2(ls-g11803,lsbio,seattle,usa),其大致相当于igf-1或tgf-β2的含量为每天两次,连续4天,8次给药的800μl phdmsc-cm。
[0073]
对于中和实验,收集条件培养基,并与对照igg,igf-1(1μg/ml;upstate biotechnology)、bfgf(0.5μg/ml;r&d systems,minneapolis,mn)、vegf(0.5μg/ml;r&d systems,minneapolis,mn)、tgf-β1(0.5μg/ml;r&d systems,minneapolis,mn),tgf-β2(0.5μg/ml;r&d systems,minneapolis,mn)的单个中和抗体或联合孵育30min。
[0074]
免疫组化
[0075]
于出生后1,4,7天处死大鼠,收集末端回肠,固定于10%中性缓冲福尔马林中12h,然后脱水,石蜡包埋。制作4mm切片进行h&e等染色。采用caplan等人描述的分级标准,通过相差显微镜检查组织切片对肠粘膜损伤进行分级。
[0076]
肠道形态学改变被分级为:0,正常组织;1,绒毛顶端细胞脱落;2,绒毛中部坏死;3,整个绒毛坏死;4,透壁坏死。损伤等级达到2-4被认为符合nec改变。5个隐窝的阳性细胞数以每节100个隐窝评分,并报告为均值
±
标准差(mean
±
sd)。每组3只大鼠。
[0077]
流式细胞术
[0078]
用兔抗鼠cd29-fitc、cd34-fitc、cd44-fitc和cd45-fitc(bd bioscience,franklin lake,nj,usa)鉴定bm-mscs表型。对于细胞周期检测和细胞死亡,根据发明人之
前描述的程序,通过流式细胞术(bd bioscience,franklin lake,nj,usa)分析了iec-6细胞。对于细胞内染色,也进行了肠系膜淋巴结染色。
[0079]
细胞因子芯片
[0080]
根据制造商的说明,使用基于raybioh biotin标签的小鼠抗体芯片1(raybiotech,norcross,ga,usa)对非浓缩条件培养基细胞因子或血液样本细胞因子进行分析。为了证实结果,用elisa检测非浓缩条件培养基,血清样品和肠道样本中选定的细胞因子。
[0081]
肠道通透性和肠道动力
[0082]
为评价肠屏障的通透性,采用酶分光度法测定血浆d-乳酸浓度。为了评估正常nec的大鼠的肠道运动,采用亚甲基蓝染料迁移试验。
[0083]
电子显微术
[0084]
4天后处死大鼠。肠管标本用2.5%戊二醛固定2小时后用1%oso4固定,包埋于epon812中。为了对比,风干切片用醋酸铀酰染色。使用zeiss电子显微镜(em 902,zeiss,jena,german)进行成像。
[0085]
tunel染色
[0086]
在活体研究中,大鼠在出生后1,4,7天被处死。收集小肠标本,用末端脱氧核苷酸转移酶dutp缺口末端标记(tunel)法(原位细胞死亡检测试剂盒;roche applied science,indianapolis,in)进行凋亡组织病理学分析。在每个切片观察100个隐窝,计算5个隐窝中的tunel阳性细胞数量,报告为平均值
±
标准差。每组使用三只小鼠。在体外研究中,在每个视野中检测到的tunel阳性细胞的数量报告为平均值
±
标准差(至少4个孔)。
[0087]
定量实时pcr法
[0088]
使用lightcycler 480(roche applied science,indianapolis,in)中的premix extaqtm(takara)进行定量pcr。lgr5的实时pcr引物如下:5
‘-
tgc cct cca acc tca gcg tct t-3’(正向),5
‘-
agg cct gcg aat gct ccc tt-3’(反向)。pcr周期为95℃,持续30s,随后40个周期为95℃,持续10s,60℃,持续30s。反应分三次进行,并根据β-肌动蛋白(标准化对照)进行单独分析,使用2-δδct法计算。此后转录表达水平的数据表示为相对于阴性对照细胞的倍数差异。
[0089]
蛋白质印迹
[0090]
于出生后1,4,7天处死大鼠,取材并制备肠段。使用1:1000稀释度的β-肌动蛋白抗体(abcam,cambridge,united kingdom)作为对照。
[0091]
核蛋白提取物和emsa
[0092]
采用电泳迁移率变化法(emsa)检测nf-κb。bm-mscs的核酸提取物通过低渗裂解法和高盐提取法制备。emsa用凝胶转移分析系统(promega,madison,wi)进行。在一个典型的实验中,用核提取物孵育nf-κb共性寡核苷酸探针(5
‘-
agt tga ggg gac ttt ccc agg c-3’)(promega)末端放射标记[γ-32p]atp(3000ci/mmol;perkin-elmer life technology,waltham,ma)和t4多核苷酸激酶(promega),按照产商说明加入100μg/m l poly di-dc,10mm tris/hcl(ph 7.5),50mm nacl,0.5mm edta,0.5mm dtt,1mm mgcl2和4%甘油。孵育后,样品在含有0.5
×
tbe运行缓冲液的4%天然聚丙烯酰胺凝胶上电泳,并通过放射自显影显示。在一些实验中,在添加核提取物之前,在反应混合物中加入100倍摩尔过量的未标记
竞争物。bay11-7082(sigma,5μm)和pcmv-iκbα-m(iκbα的显性阴性形式)(clontech,mountain view,ca))被用于抑制nf-κb的活化。
[0093]
染色质免疫沉淀(chip)测定
[0094]
用alggen-promo程序预测igf-1启动子中4个nf-κb结合位点和tgf-β2启动子中2个nf-κb结合位点。根据制造商的说明,使用ez芯片试剂盒(millipore,bedford,ma)对igf-1/tgf-β2启动子区进行芯片分析。简单地说,在室温下,phdmsc与1%甲醛交联10分钟。为了剪切染色质,将整个细胞提取液重新悬浮在0.45ml溶解缓冲液中,然后进行超声波处理。对于ip,使用抗nf-κb p65和抗nf-κb p50抗体(abcam,cambridge,ma)。使用ez芯片套件中提供的柱纯化ip和输入dna,然后放大。采用特异性引物对(图9)进行pcr扩增小鼠igf-1和tgf-β2启动子片段。所有芯片分析重复三次或三次以上。
[0095]
统计分析
[0096]
数据使用spss 17.0软件(spss inc.,chicago,il,usa)进行分析,用shapiro-wilk法检验后符合常态数据分布的数据用均值
±
sd表示。采用t检验、单因素方差分析和bonferroni事后检验确定统计学意义。采用kaplan-meier法分析动物存活曲线。p<0.05的统计值被认为是显著的。
[0097]
本发明将将拥有众多靶基因的上游转录因子作为调控对象。作为氧依赖基因,脯氨酰羟化酶结构域蛋白2(proly lhydroxylase 2,phd2)基因调控参与细胞存活和炎症的两种关键转录因子,缺氧诱导因子-1α(hypoxia-inducible transcription factor-1α,hif-1α)和核因子-κb(nuclear factor-κb nf-κb)。phd2是hif-1α的负性调节因子,常氧时phd2能迅速降解hif-1α,缺氧时phd2活性降低,增强hif-1α的稳定性。此外,缺氧时phd2活性降低还能增强iκb活性,激活nf-κb。既往已有研究表明,抑制phd2能增强干细胞igf-1、angiopoietin-1等多种活性因子的分泌。
[0098]
鉴于phd2在干细胞旁分泌中的作用,发明人用含shrna慢病毒转染mscs并降低phd2的表达,检查沉默phd2能否以及如何增强骨髓间充质干细胞(bm-mscs)对nec的旁分泌效应。
[0099]
结果:
[0100]
1)、在bm-mscs中慢病毒转染shphd2-gfp能特异性敲低phd2表达
[0101]
为了评估msc-cm在nec中的治疗机制,发明人建立了体内和体外实验系统(图1a)。用含有gfp或shphd2-gfp载体的慢病毒转染bm-mscs(图1b),shphd2能特异性降低phd2蛋白表达,不影响phd1和phd3蛋白表达(图1c)。通过facs富集转染成功的bm-mscs,然后在培养中扩增。用于进一步制备phdmsc-cm。
[0102]
为了鉴定bm-mscs和phdmsc的表型,采用流式细胞术鉴定表面标志物。与发明人之前研究中的bm-mscs表型类似,流式细胞术显示phdmsc对干细胞标记cd29,cd44呈阳性,而对造血谱系标记cd34,cd45呈阴性(图1d),表明基因转移过程没有改变msc的表型。
[0103]
2)、phdmsc-cm通过减少肠道结构与功能的损伤来改善nec大鼠的死亡率和发病率
[0104]
发明人首先观察了msc-cm对nec幼鼠的发病率和存活率的影响。与nec幼鼠相比,phdmsc-cm治疗后显著提高了存活率,降低了nec的发病率(图2a、图2b),且治疗组方面没有显著性别差异(图2g)。msc-cm治疗组的平均生存时间和nec发生率均低于nec损伤组,但两组间无显著性差异(p>0.05)。此外,nec幼鼠出生后7天内发育严重受阻。然而,phdmsc-cm
治疗后显著改善了nec幼鼠的出生后生长迟缓现象和并出现了体重增加(图2c)。
[0105]
发明人随后观察了msc-cm对小肠上皮结构和功能的影响。对照组幼鼠未出现明显损伤,而dmem-f12和msc-cm处理的nec幼鼠回肠远端有明显损伤,伴有扩张,严重出血和变色。与nec幼鼠相比,phdmsc-cm治疗的幼鼠的回肠损伤明显减少(图2d)。苏木精伊红(he)染色显示出生后第4天后nec损伤组和msc-cm治疗组绒毛完全破坏和穿壁坏死(3级或4级)。然而,phdmsc-cm组小肠组织形态学有明显改善,未见明显损伤和坏死(0级,图2d)。电镜中显示nec损伤组和msc-cm治疗组紧密连接间隙增宽,点状晶体结构模糊或消失,毗邻上皮细胞分离,微绒毛因遭到破坏而变得稀疏,长度及排列不规整,而phdmsc-cm组细胞紧密连接间隙完整紧密,相应结构完整,表明phdmsc-cm组细胞微结构得到明显改善(图2d)。phdmsc-cm对肠道损伤的改善也反映在肠道功能上。nec损伤组肠蠕动功能(亚甲基蓝迁移率)和肠渗透功能(血浆d-乳酸水平)较正常对照组严重,但在phdmsc-cm治疗后上述指标得到明显改善(图2e-2f)。虽然上述指标在msc-cm治疗后也较nec损伤组有所改善,但两组间差异未达到统计学意义(p>0.05)。
[0106]
3、phdmsc-cm在体内和体外减少肠上皮细胞凋亡
[0107]
本研究以小肠组织切片中tunel阳性肠细胞核的数量作为凋亡程度的评价标准。与正常对照组相比,nec损伤4天后,nec幼鼠的tunel阳性细胞数量增加了约10倍,尤其是在隐窝区域损伤严重(图3a),表明位于隐窝的小肠上皮干细胞(iscs)损伤严重。这一发现与nino等人观察到的nec中隐窝底部的iscs显著凋亡相一致。与nec损伤组相比,phdmsc-cm治疗后1,4,7天的小肠上皮细胞凋亡程度在nec模型中均明显降低。虽然msc-cm组的细胞凋亡也趋于减少,但未发现统计学差异。
[0108]
为了排除phdmsc-cm对细胞凋亡的抑制作用是通过对免疫系统的间接影响来实现,发明人评估了phdmsc-cm在体外对lps/h2o2损伤的iec-6细胞的影响。通过tunel染色评估,发现与phdmsc-cm共培养,而非msc-cm,能保护lps/h2o2损伤iec-6细胞免于凋亡(图3b)。与这些结果一致,annexin v和pi双染也表明,与dmem-f12组及msc-cm组相比,phdmsc-cm共培养后第3、5、7天均能显著降低iec-6细胞的凋亡(图3c-e)。
[0109]
4、phdmsc-cm在体内和体外促进小肠上皮细胞增殖
[0110]
发明人以小肠切片中pcna阳性肠细胞的数量作为增殖程度的评估标准。phdmsc-cm组在出生后1、4、7天的pcna阳性细胞数量显著高于msc-cm组和nec损伤组(图4a-4b),尤以隐窝区域细胞更为明显。与phdmsc-cm的共培养也显著增加了lps/h2o2损伤iec-6细胞中pcna阳性细胞的数量(图4c-4d)。此外,从第3天开始,phdmsc-cm共培养,而非msc-cm,能显著增加iec-6细胞周期s期细胞比例(图4e-4g)。
[0111]
5、phdmsc-cm能促进nec肠上皮干细胞再生
[0112]
发明人进一步评估了phdmsc-cm对lgr5+iscs的影响,lgr5+iscs是维持肠上皮细胞稳态的关键增殖细胞。既往多项研究表明,nec中lgr5+iscs的凋亡显著增加,导致肠上皮再生及修复受阻。在本示例中,lgr5+iscs的表达在nec损伤后3天非常分散,只有1-2个lgr5阳性细胞位于小肠隐窝的最底部。相反,经phdmsc-cm治疗后,lgr5阳性细胞数量明显增加(图5a-5b)。这些结果通过蛋白印迹分析(图5c)和实时定量pcr(图5d)证实,在出生后1,4和7天后显示出明显的差异。这些结果与发明人之前发现的phdmsc-cm抑制肠隐窝区域中的细胞凋亡,促进隐窝区域细胞增殖一致,表明phdmsc-cm可能通过抑制lgr5+isc凋亡,促进
lgr5+isc增殖,从而加速小肠上皮细胞再生。
[0113]
6、phdmsc-cm能下调nec小肠黏膜及全身炎症反应
[0114]
为了研究msc-cm的免疫调节作用对nec炎症水平的影响,发明人首先使用抗体芯片同时监测90个因子,并分析msc-cm或phdmsc-cm治疗后nec幼鼠的血清炎症细胞因子变化。与msc-cm治疗组(>2.0x)相比,phdmsc-cm治疗组中10种血清细胞因子显著增加,如bfgf、vegf、血小板衍生生长因子(pdgf)-aa、转化生长因子β1(tgf-β1)、白细胞介素(il)-10等。此外,17种细胞因子显著降低,如激活素a(activin a)、细胞间粘附分子1(icam-1)、e-选择素、il-1β、il-4、il-6、肿瘤坏死因子α(tnf-α)、干扰素-γ(ifn-γ)(图6a)。发明人进一步选择了6个与炎症密切相关的因子进行elisa验证。与msc-cm相比,phdmsc-cm能显著降低nec幼鼠血清中activin a,il-1β,il-6和tnf-α的表达,提高血清中tgf-β1和il-10的浓度,从而显示出全身水平的抗炎状态(图6b)。与在血清中观察到的全身抗炎状态相似,用phdmsc-cm而非msc-cm治疗能显著减少小肠粘膜中的促炎细胞因子和增加抗炎细胞因子(图6c)。炎症水平的下调和il-10水平的升高促使发明人进一步研究phdmsc-cm对treg细胞的影响。如图6c所示,将nec损伤组和phdmsc-cm组进行对比,phdmsc-cm治疗后显著增加了nec幼鼠肠系膜淋巴结(mln)中cd4
+
foxp3
+
treg细胞的数量。(图6d)。
[0115]
7、沉默phd2能诱导bm-mscs分泌谱的变化
[0116]
为了研究这些修复差异效应的可能原因,发明人首先使用蛋白质芯片观察沉默phd2前后bm-mscs分泌谱的变化,同时分析msc-cm和phdmsc-cm中90个小鼠细胞因子的变化。与msc-cm(>2.0x)相比,phdmsc-cm中27种细胞因子显著增加(图7a-7b)。这些细胞因子按其功能可分为三类:第一类含有促进再生的生长因子,包括碱性成纤维细胞生长因子(bfgf)、血管内皮生长因子(vegf)、β-神经生长因子(β-ngf)、肝素和睫状神经营养因子(cntf);第二类包括趋化因子和基质金属蛋白酶(mmps),如c-c趋化因子受体4型(ccr4),趋化因子(c-x-c基序)配体2(cxcl-2),趋化因子(c-c基序)配体20(ccl-20),组织金属蛋白酶抑制剂(timp)-2/3和基质金属蛋白酶(mmp)-2/8,可促进mscs或免疫细胞向特定部位的转运;第三类含有免疫调节因子,如tgf-β1/2/3。
[0117]
目前的研究发现igf-1,hgf(igf-1和hgf未包括在细胞因子芯片中的90个靶细胞因子中)促进肠上皮细胞和iscs的再生。本示例随后使用elisa进一步确认了在phdmsc-cm中il-10、igf-1和hgf的水平,以及在phdmsc-cm中筛选的4种其他生长因子(bfgf、vegf、tgf-β1和tgf-β2)。在phdmsc-cm中,bfgf,vegf,igf-1,tgf-β1和tgf-β2的浓度分别为556.91
±
72.85pg/ml,753.53
±
109.47,4195.47
±
159.57,596.52
±
89.32pg/ml和512.76
±
45.91pg/ml。这些浓度比使用msc-cm时高出3-10倍(图7c)。虽然elisa结果也证实了phdmsc-cm中存在hgf和il-10,但它们的水平在phdmsc-cm和msc-cm之间没有明显的统计学差异。
[0118]
8、igf-1和tgf-β2在phdmsc-cm介导的nec修复中起关键作用
[0119]
由于vegf,bfgf,igf-1,tgf-β1和tgf-β2在phd沉默后显著升高,且研究表明这些细胞因子在nec修复中起积极作用,发明人进一步研究了phdmsc-cm对nec的修复益处是否与这些细胞因子有关。当加入针对这些细胞因子的单个中和抗体时,phdmsc-cm对iec-6的凋亡和增殖的作用被单独的igf-1或tgf-β2的抗体部分抑制,并且进一步被igf-1和tgf-β2的联合中和所阻断。类似地,igf-1+tgf-β2的抗体可阻断phdmsc-cm对nec幼鼠的修复作用,
使其存活率从61.2%增加到25%。此外,联合输注igf-1和tgf-β2对小肠增殖/凋亡和存活率的保护作用与phdmsc-cm相似(图7d),同时,发明人发现经phdmsc-cm治疗后,igf1及tgf-β2在nec鼠肠道中表达增多了(图7m),这表明igf-1和tgf-β2在phdmsc-cm介导的nec修复中起着关键作用。
[0120]
9、沉默phd2的bm-mscs保护性旁分泌作用依赖于nf-κb通路
[0121]
通过研究证明了phd2能通过hif-1α和nf-κb通路影响mscs的旁分泌。为了明确沉默phd2前后mscs旁分泌物差异的机制,发明人首先观察了沉默phd2前后这两条通路的变化。沉默phd2显著增强hif-1α的表达,该表达可被shhif-1α阻断(图7e)。沉默phd2增加了ikkβ的磷酸化,进一步增加了iκbα的磷酸化和降解(图7e),从而增强了核转位(图7f)和nf-κb的dna结合活性(图7g),这可以被nf-κb抑制剂bay11-7082或iκbα的显性阴性突变体(dn-iκbα)所阻断。bay117082能阻断沉默phd2诱导的关键细胞因子(igf-1和tgf-β2)的升高(图7h)。此外,dn-iκbα阻断了phdmsc-cm对小肠上皮细胞增殖(增殖细胞核抗原阳性细胞数)、凋亡(tunel阳性细胞数)和生存益处(图7i-7j)。虽然发明人还观察到shhif-1α显著减弱了沉默phd2诱导的vegf升高(数据未显示),但shhif-1α没有减弱phdmsc-cm对nec的修复作用。另外,来源于lps(nf-κb激动剂)预刺激msc的条件培养基能够改善lps/h2o2损伤iec6的细胞凋亡及增殖(图7n).这表明沉默phd2对bm-msc分泌物修复nec产生的旁分泌效应是nf-κb依赖性的。
[0122]
为了进一步探究nf-κb介导关键分子分泌的分子机制,发明人证实了igf-1和tgf-β2的mrna在使用lps刺激mscs后明显增加了(图7o)。
[0123]
为了进一步证实nf-κb与igf-1和tgf-β2启动子的结合,发明人进行了芯片分析。用alggen-promo程序预测igf-1启动子中的4个nf-κb结合位点和tgf-β2启动子中的2个nf-κb结合位点(图7k)
[0124]
芯片检测显示igf-1和tgf-β2启动子的预测位点与nf-κb p50结合(图7l)。这些结果表明nf-κb的激活可能通过与igf-1和tgf-β2基因启动子结合而直接调控igf-1和tgf-β2的转录和分泌。
[0125]
讨论:
[0126]
本研究证实了沉默phd2增强了bm-msc的旁分泌效应进而增强对nec修复作用,并证明:
[0127]
1)在nec模型中,phdmsc-cm,而非msc-cm,能通过调节上皮再生和炎症水平,提高存活率,促进nec的结构和功能恢复;
[0128]
2)通过与igf-1和tgf-β2基因启动子结合,激活nf-κb,增加其分泌关键因子igf-1和tgf-β2,从而提供优越的治疗效果。
[0129]
发明人的研究中有几个重要的发现:
[0130]
第一个是发明人观察了msc-cm对nec的作用和机制。到目前为止,几乎没有使用msc-cm治疗nec的报道,只有一项研究表明来自羊水干细胞(afs)的旁分泌物质可能对nec具有类似于afs的修复作用。在本发明中,发明人发现phdmsc-cm,而不是msc-cm,可通过影响肠上皮细胞/干细胞的凋亡和增殖来调节细胞内稳态,部分由于其对treg细胞的免疫调节而使炎症环境向抗炎方向倾斜,从而改善nec损伤,这提示phdmsc-cm具有与mscs移植相媲美的能力。常规msc-cm和afs-cm之间nec的治疗差异可能是由于其旁分泌谱的差异所致。
研究表明,afs旁分泌物质中含有种类更多浓度更高的生长因子,从而更实质性地促进皮肤血管的再生和成熟。
[0131]
其次,为了解释phdmsc-cm和msc-cm在nec治疗上的差异,发明人监测了沉默phd2后mscs旁分泌的变化。通过使用抗体芯片和中和抗体,igf-1和tgf-β2被鉴定为phdmsc-cm介导的nec修复的关键介质。联合输注这两种关键介质几乎可以复制phdmsc-cm对nec的保护作用,这为临床应用nec提供了一种新的策略。发明人还观察到igf-1和tgf-β2是phdmsc-cm介导的nec修复所必需的,这与先前观察到的igf-1和tgf-β2可能在nec修复中起关键作用是一致的。例如,igf-1增加了新生幼鼠肠道蛋白质含量、肠细胞迁移率和近端小肠酶活性,而早产儿长时间低血清igf-1浓度过低与nec的发生有关。nec体内实验已经证实,外源性使用igf-1能够通过减轻细胞凋亡及肠道炎症反应来提高nec鼠生存率及降低nec发病率。tgf-β2是牛奶和初乳中重要的抗炎蛋白,在人乳汁中含量较高,而配方奶早产儿肠道中存在tgf-β2缺乏,在nec早产儿中更为明显.据文献报道,在人发育过程中的肠道,tgf-β2能够抑制巨噬细胞炎症因子表达及粘膜炎症反应,表明肠内使用tgf-β2能够在nec损伤鼠中修复肠道损伤,这些发现均支持了igf-1和tgf-β2联合治疗可促进nec修复这一观点。
[0132]
最后,发明人探讨了增强phdmsc旁分泌潜能的具体机制。phd2被认为是细胞中关键的氧传感器和调控hif-1α主要的脯氨酸羟化酶。多项研究已经表明,沉默phd2通过增加hif-1α的稳定性来增强移植干细胞的存活和分泌旁分泌因子,从而修复组织损伤。在本发明中,虽然发明人观察到shphd2通过hif-1α促进msc分泌vegf,但hif-1α沉默并不减弱phdmsc-cm对nec的保护作用,表明其旁分泌作用不依赖于hif-1α。nf-κb途径是phd2促进血管生成的重要途径。激活nf-κb途径不仅增强mscs的活性,而且促进各种旁分泌因子的分泌。发明人的研究表明,沉默phd2能诱导nf-κb激活可能是通过增强ikkβ活性,从而降低iκbα,而阻断nf-κb通路不仅显著抑制了关键因子的分泌,而且逆转了phdmsc-cm的保护作用。芯片分析进一步表明nf-κb p50能与igf-1和tgf-β2启动子结合。总之,发明人的数据表明,沉默phd2诱导的nf-κb的激活主要通过与igf-1和tgf-β2基因启动子的结合直接诱导igf-1和tgf-β2的分泌。
[0133]
phd2是一种在各种类型的细胞中广泛表达的基因。沉默phd2增强成纤维细胞和心肌细胞中旁分泌因子的分泌,从而促进组织修复。因此,沉默phd2不仅显著增强了bm-mscs的旁分泌能力,而且还增强了其他细胞的旁分泌能力。虽然phd2在基因治疗方面具有广阔的前景,但其安全性可能会限制其在临床实践中的进一步应用。多项研究表明,phd2的下调促进了肿瘤血管生成,从而可能促进肿瘤的发生和转移。虽然其他报告证实下调phd2,长达1.5年未观察到肿瘤发生的证据,但不能排除抑制phd2导致肿瘤发生的可能性。在目前的研究中,发明人在体外使用phd2修饰的干细胞来提供对nec的旁分泌保护作用,避免了上述安全问题,这为nec治疗甚至其他类型的组织损伤提供了一个可行的选择。
[0134]
总之,本研究表明沉默phd2显著增强了骨髓间充质干细胞(bm-mscs)对nec细胞的旁分泌保护作用,这一作用依赖于nf-κb机制。未来的工作应侧重于潜在的临床应用(例如优化cm的质量、剂量、时间和递送策略),以便开发适合nec的创新。
[0135]
虽然本发明以较佳实施例揭露如上,但并非用以限定本发明实施的范围。任何本领域的普通技术人员,在不脱离本发明的发明范围内,当可作些许的改进,即凡依照本发明所做的同等改进,应为本发明的范围所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1