一种细胞膜纳米囊泡过滤收集装置的制作方法
本申请属于医疗设备技术领域,具体涉及一种细胞膜纳米囊泡过滤收集装置专利申请事宜。
背景技术:
在生物制药领域,纳米级别的微囊泡作为一种新型的药物载体,是当今新型药物载体研究的热点。其主要原因在于,囊泡可以携带多种具有生理治疗或检测作用的蛋白质、dna、rna和脂质等物质,因此基于囊泡携载功能可以开发新型诊断工具,也可作为靶向药物递送系统和疫苗载体加以应用,因此是当前医疗载体研究应用的热点。
生物体中,生物膜的主体是由磷脂和蛋白质定向排列组成的封闭双分子层囊泡结构。囊泡(也称之为微囊泡)可以认为是一种具有类生物膜结构的膜体性质细胞器,因此,囊泡的最主要应用之一即是模拟生物膜。在生命科学界,囊泡作为细胞膜最好的模拟体系受到人们极大的关注。现有技术中,由磷脂双分子层组成的单室或多室囊泡(即脂质体),是目前研究最多的靶向药物载体,而细胞膜囊泡则是一类细胞起源的的膜性结构,在细胞间通讯和信号传导中发挥着重要的作用。
就囊泡获得而言,囊泡的来源多样,可由细胞、红细胞、干细胞等细胞中提取。而常用的纳米囊泡制备设备及方法主要有如下几种:
(1)脂质体挤出器,一类小型的手推式挤出仪,通过手动挤压产生一定的压力,从而将样品通过聚碳酸酯膜与不锈钢微孔滤板,从而获得粒径分布较为均一的囊泡;但这种方式获得的囊泡粒径大小与挤出压力及滤膜的孔径高度相关,而且由于仪器小型且昂贵,以及聚碳酸酯膜不能反复使用且易堵膜,操作繁琐等缺陷,因此只适用于少量囊泡样品制备应用,无法规模化应用(例如avantipolarlipids,其制备量每次仅为1ml左右);
(2)离心机,利用高速(甚至超速)离心或密度梯度离心方式来分离获得纯化的囊泡,这种方式所制备的囊泡产品纯度虽然较高,但由于需要昂贵的超速离心设备,加上离心时间较长以及制备量较少,因此,也无法实际产业化应用;
(3)囊泡提取试剂盒,针对小批量囊泡样品制备,现有技术中也有部分商品化试剂盒可以应用,仅需通过简单操作和常规离心机即可从样本内中获取,但应用效果表明,这种利用试剂盒提取的囊泡具有纯度低、提取量较少缺陷,加上试剂盒成本较高,因此也无法产业化实际用于囊泡制备。
基于上述实际情况,如能开发、设计一种具有较高产量的、可以产业化应用的囊泡制备装置,可为相关医疗技术的改进和囊泡应用奠定一定技术基础。
技术实现要素:
本申请目的在于提供一种基于细胞膜形成的纳米囊泡过滤收集装置,从而为囊泡作为药物载体的应用奠定一定技术基础。
本申请所采取的技术方案详述如下。
一种细胞膜纳米囊泡过滤收集装置,用来收集基于细胞膜所形成的纳米囊泡,由:膜过滤系统、循环反应系统和囊泡收集系统组成;
所述膜过滤系统包括:一个用于盛放过滤膜件的过滤罐体,和罐体内部设置的可拆卸的过滤膜件(与圆柱形的过滤罐体相适配,过滤膜件可采用卷式有机膜元件);
所述过滤罐体,罐体一端端壁开设有原液进口,对应另一端端壁开设有溢液出口;罐体两端至少一端端口可开合设计,并配套有可以紧密密封的罐盖,从而便于置入或取出过滤膜件;同时,罐体远离原液进口的一端端面中部设计有囊泡滤出口,过滤后含有囊泡的滤液由此囊泡滤出口流出;
所述过滤膜件为一个围绕中心管所设置的由若干层有机膜构成(具体例如采用卷式有机膜元件卷设而成)的用于过滤的构件;
所述中心管,管壁上设有均有布设的微滤孔;优选设计中,中心管对接罐体上的囊泡滤出口,从而便于过滤后含有囊泡滤出液的排出;
所述有机膜具体例如采用聚偏氟乙烯材质(圆筒形、直径4cm情况下,具体采用7圈,膜孔径为0.15µm~0.2µm)的微滤膜,过滤精度为0.03~0.15μm;
所述循环反应系统,包括:通过连接管道分别与过滤罐上原液进口、溢液出口连接的循环反应器,同时循环反应器与原液进口的连接管道上设有压滤动力装置(具体例如采用压力泵),以确保循环反应器内待过滤液能够顺利进入过滤罐体内;
实际设计中,与压滤动力装置的连接管路上设计有压力表,从而便于观察和记录管道压力,并可以此作为调节压滤动力装置动力大小的依据;
而为确保囊泡过滤收集效果(如为确保囊泡粒径的一致性、囊泡含量等),实际设计中,循环反应器与囊泡滤出口通过连接管道连接,从而可以回收初步过滤后囊泡滤出液,以便进行进一步的过滤,从而提高囊泡过滤收集效果;
实际设计中,循环反应器与过滤罐体的原液进口的连接管路上、循环反应器与过滤罐的溢液出口的连接管路上、循环反应器与囊泡滤出口的连接管路上、以及循环反应器与压滤动力装置之间的连接管路上,可分别设计安装阀门,以便维修或控制相关管路内液体流动;
所述囊泡收集系统,包括通过连接管道与囊泡滤出口连接的囊泡盛放容器,所述囊泡盛放容器可与循环反应器一体化设计,从而节约整体设备空间;具体设计中,囊泡盛放容器底部可设计有样品排放口,从而便于排空囊泡盛放容器内所收集的囊泡;实际设计中,囊泡盛放容器与囊泡滤出口的连接管道上、样品排放口的前端可分别设计安装有阀门,从而便于控制何时收集或排空囊泡液。
具体规格方面,过滤罐罐体采用圆柱形设计,长度可设置为40cm,罐体内壁直径可设计为6cm;过滤膜件中部的中心管直径为1.2cm;
原液进口可设计在距离罐体顶部4.5cm处,溢液出口可设计在距离罐体底部4.5cm处,罐体材质可采用不锈钢材料制备而成,从而便于清洗。
利用所述细胞膜纳米囊泡过滤收集装置的细胞膜纳米囊泡收集方法,包括如下步骤:
(一)细胞的培养与收集
首先,将细胞培养、扩增后,收集细胞,清洗后,用pbs或含有治疗用药物的pbs温育后进行重悬,以此溶液作为微囊泡原液备用;
(二)过滤收集纳米囊泡
首先,以超纯水作为待处理液,利用过滤收集装置进行处理,以充分清洗过滤收集装置;
随后,再以灭菌后pbs作为待处理液,利用过滤收集装置进行处理,以使装置内环境保持适于后续微囊泡挤压、过滤和收集;
再后,将步骤(一)微囊泡原液转移至循环反应器中,通过调节阀门的开启、以及调节挤压囊泡的流速和压力大小,来收集所要的样品;
收集mda-mb-231细胞的细胞膜纳米囊泡时,压力控制在0.2mpa-0.8mpa,循环时间控制在8-15min,用于制备30nm-150nm的囊泡;
最后,将所收集的囊泡直接应用或者4℃保存备用。
装置的具体运行过程为:
将待处理的囊泡处理原液注入到循环反应器中,启动压滤动力装置,此时,囊泡处理原液随管道进入罐体内,而在持续进入液体压力作用下,囊泡处理原液在经过滤膜件层层过滤后(无法通过过滤膜件的大分子物质则最终通过溢液出口返回至循环反应器内;实际运行中,为确保过滤效果,经初步过滤后滤液也可重新进行循环反应器内,以对原液进行重复挤压、过滤,从而提高囊泡得率。需要解释的是,由于各条连接管道上均设计有阀门,因此,通过阀门开关的调节,即可较好调节循环时机和循环次数。实际应用中,收集最终囊泡成品前,经过5-15分钟的反复挤压、过滤,可得到30nm-150nm的囊泡液),最终经中心管表面所设的微滤孔汇总进入中心管内,并最终经囊泡滤出口进入囊泡盛放容器内。
采用本申请所提供的细胞膜纳米囊泡过滤收集装置,可以用于不同来源囊泡(例如脂质体、红细胞、干细胞等)制备,利用外压式压力将原液在膜组件内进行过滤,而通过调节泵压、流速、循环时间等参数调整,可使囊泡产量、产率较高,对于确保后续应用具有较好的技术意义。
附图说明
图1是本发明的整体结构示意图;
图2是本发明的膜过滤装置剖面图
图3为不同压力循环时间下所获得的囊泡制备量比较图;
图4为囊泡tae透射电镜图;
图5为马尔文高灵敏纳米粒度分析仪检测的囊泡粒度图;
图6为荧光染过的纳米囊泡(nv)侵染细胞图;
图7为细胞杀伤试验增值与活性图。
具体实施方式
下面将结合附图,对本申请技术方案进一步详细解释说明如下。
实施例1
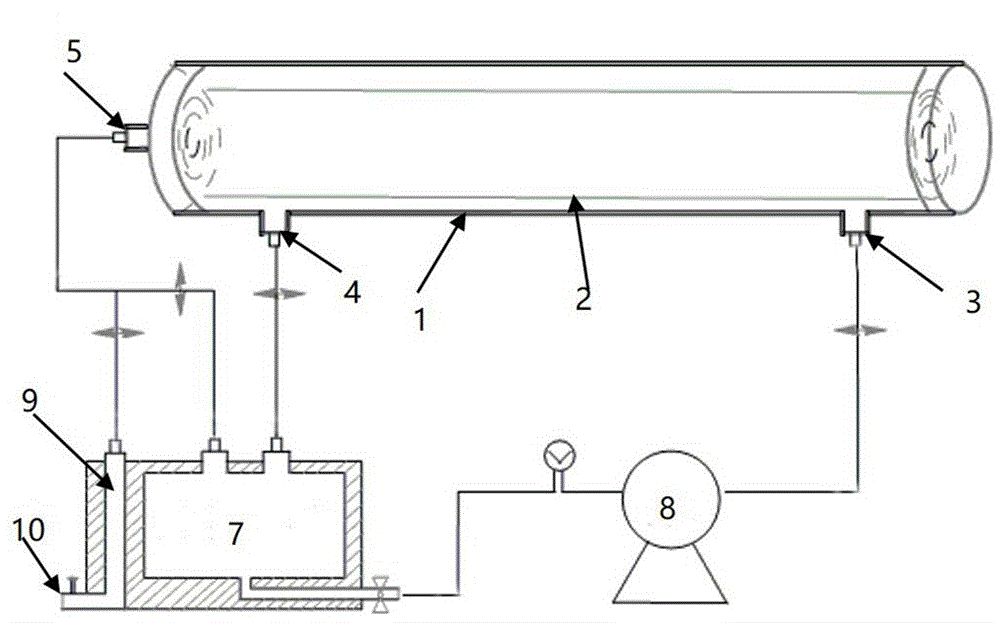
如图1、图2所示,本申请所提供的细胞膜纳米囊泡过滤收集装置,用来收集细胞膜纳米囊泡,由:膜过滤系统、循环反应系统和囊泡收集系统组成;
所述膜过滤系统包括:一个用于盛放过滤膜件的过滤罐体1,和罐体内部设置的可拆卸的过滤膜件2(与圆柱形的过滤罐体1相适配,过滤膜件2可采用卷式有机膜元件);
所述过滤罐体1,罐体一端端壁开设有原液进口3,对应另一端端壁开设有溢液出口4;罐体1两端至少一端端口可开合设计,并配套有可以紧密密封的罐盖,从而便于置入或取出过滤膜件2;同时,罐体远离原液进口3的一端端面中部设计有囊泡滤出口5,过滤后含有囊泡的滤液由此囊泡滤出口5流出;
所述过滤膜件2为一个围绕中心管6所设置的由若干层有机膜构成(具体例如采用卷式有机膜元件卷设而成)的用于过滤的构件;
所述中心管6,管壁上设有均有布设的微滤孔;优选设计中,中心管6对接罐体1上的囊泡滤出口5,从而便于过滤后含有囊泡滤出液的排出;
所述有机膜具体例如采用聚偏氟乙烯材质的微滤膜(例如采用郑州贝贝生物科技有限公司产品),过滤精度为0.03~0.15μm;
所述循环反应系统,包括:通过连接管道分别与过滤罐上原液进口3、溢液出口4连接的循环反应器7,同时循环反应器7与原液进口3的连接管道上设有压滤动力装置8(具体例如采用压力泵),以确保循环反应器7内待过滤液能够顺利进入过滤罐体1内;
实际设计中,与压滤动力装置8的连接管路上设计有压力表,从而便于观察和记录管道压力,并可以此作为调节压滤动力装置8动力大小的依据;
而为确保囊泡过滤收集效果(如为确保囊泡粒径的一致性、囊泡含量等),实际设计中,循环反应器7与囊泡滤出口5通过连接管道连接,从而可以回收初步过滤后囊泡滤出液,以便进行进一步的过滤,从而提高囊泡过滤收集效果;
实际设计中,循环反应器7与过滤罐体1的原液进口3的连接管路上、循环反应器7与过滤罐1的溢液出口4的连接管路上、循环反应器7与囊泡滤出口5的连接管路上、以及循环反应器7与压滤动力装置8之间的连接管路上,可分别设计安装阀门,以便维修或控制相关管路内液体流动;
所述囊泡收集系统,包括通过连接管道与囊泡滤出口5连接的囊泡盛放容器9,所述囊泡盛放容器可与循环反应器一体化设计,从而节约整体设备空间;具体设计中,囊泡盛放容器9底部可设计有样品排放口10,从而便于排空囊泡盛放容器9内所收集的囊泡;实际设计中,囊泡盛放容器9与囊泡滤出口5的连接管道上、样品排放口10的前端可分别设计安装有阀门,从而便于控制何时收集或排空囊泡液。
具体规格方面,过滤罐罐体1采用圆柱形设计,长度可设置为40cm,罐体内壁直径可设计为6cm;
原液进口3可设计在距离罐体顶部4.5cm处,溢液出口4可设计在距离罐体底部4.5cm处,罐体材质可采用不锈钢材料制备而成,从而便于清洗。
装置的具体运行过程为:
将待处理的囊泡处理原液注入到循环反应器7中,启动压滤动力装置8,此时,囊泡处理原液随管道进入罐体1内,而在持续进入液体压力作用下,囊泡处理原液在经过滤膜件2层层过滤后(无法通过过滤膜件2的大分子物质则最终通过溢液出口4返回至循环反应器7内;实际运行中,为确保过滤效果,经初步过滤后滤液也可重新进行循环反应器7内,以对原液进行重复挤压、过滤,从而提高囊泡得率。需要解释的是,由于各条连接管道上均设计有阀门,因此,通过阀门开关的调节,即可较好调节循环时机和循环次数。实际应用中,收集最终囊泡成品前,经过5-15分钟的反复挤压、过滤,可得到30nm-150nm的囊泡液),最终经中心管6表面所设的微滤孔汇总进入中心管6内,并最终经囊泡滤出口5进入囊泡盛放容器9内。
具体应用时,循环反应器7中可容纳足够多的原囊泡处理液,通过外压式泵入过滤膜件2来大量机电一体化制备囊泡;另一方面,针对不同的原液可采用不同的泵压、流速和循环时间,从而适用分离纯化脂质体、红细胞、干细胞、细胞微囊泡等不同需要。而且由于可以循环运行,反复多次挤压,从而使产出囊泡得率最佳,并且循环装置具有不易堵塞、便于清洗、一体化操作、操作简便易行、耗材成本低、价格低廉等优点,从而便于相关产业化或临床推广应用。
实施例2
利用实施例1所具体设计的纳米囊泡过滤收集装置,以mda-mb-231细胞为例,发明人进行了具体囊泡收集,具体收集方法、收集步骤简要介绍如下。
(一)细胞的培养与收集
首先,将盛有冻存的mda-mb-231细胞(人乳腺癌细胞,也简称231细胞)的冻存管在37℃水浴锅中速溶以使细胞复苏,随后,1000g离心10min,倒掉上层培养基,将底部细胞用新的含有10%胎牛血清的dmem培养基重悬,并转移至培养皿中,37℃、5%co2细胞培养箱中培养以使细胞进一步恢复活力并增殖;
培养过程中,每次待细胞生长至占培养皿表面90%面积左右时进行传代培养,连续传代培养不少于5次,以确保细胞活力;
传代培养结束后,待细胞再次长满培养皿时,胰酶消化后再用培养基(含有10%胎牛血清的dmem培养基)终止消化;
1000g离心10min收集细胞,用pbs(ph=7.4)清洗后,将细胞重悬于500ml含有0.5μg/ml阿霉素的pbsbuffer缓冲液中,37℃水浴锅中温育30min,此溶液作为载药微囊泡原液备用;
(二)过滤收集纳米囊泡
首先,以超纯水作为待处理液,利用过滤收集装置进行处理,以充分清洗过滤收集装置;
随后,再以灭菌的ph=7.4的pbs作为待处理液,利用过滤收集装置进行处理,以使装置内环境保持ph=7.4;
再后,将步骤(一)中500ml载药微囊泡原液转移至循环反应器7中,通过调节阀门的开启、以及控制管路上的开关大小来调节挤压囊泡的流速和压力大小,来收集所要的样品;
经过0.22um孔径的过滤装置过滤后,最高可收集到480ml较纯的囊泡过滤液;对此过滤液,利用bca试剂盒法在酶标仪562nm波长处测量囊泡浓度,浓度越高制备效率越高。
不同压力、不同循环时间下所获得的囊泡制备质量结果如图3所示。可以看出,在压力为0.5mpa,循环时间为10min时,囊泡浓度最高,说明制备效果最佳;
最后,将所收集的囊泡直接应用或者4℃保存备用(可保存2-3周)。
进一步地,对于上述分离所得囊泡形态和具体尺寸(仅以压力0.5mpa,循环10min的某批次囊泡为例)进行了初步检测,具体过程简介如下。
取样品10μl于铜网上静置1分30秒,然后用吸水纸在侧面将多余液体吸干;
避光条件下,将10ul醋酸双氧铀滴到上述铜网上,染色30秒后再用吸水纸吸干多余液体;
将上述制样完成的铜网轻轻放置到避光盘中,干燥2小时,随后进行tae透射电镜镜检。
所制备囊泡的tae透射电镜图如图4所示。可以看出,所制备囊泡形态为杯托状椭圆形。
另一方面,对所制备囊泡,取样后利用马尔文高灵敏纳米粒度分析仪zetasizer(nanos90)检测纳米粒度分布情况,结果如图5所示。
可以看出,本申请所制备囊泡的主要直径为124nm,囊泡范围在30nm-150nm之间,属于典型的纳米级囊泡。
从上述结果可以总结看出,从囊泡制备结果而言,压力一般控制在0.2mpa-0.8mpa,循环时间一般控制在8-15min,在此参数范围内的囊泡制备效率是较好的,而且所制备囊泡主要集中于30nm-150nm之间。
现有技术中,利用小型的手推式挤出仪例如avantipolarlipids脂质体挤出设备一次仅可制备小体积(大约1ml)囊泡,而且制备过程中,囊泡原处理液需要通过固定孔径的聚碳酸酯膜被机械分解为较小的囊泡,进而容易堵塞,不仅制备量小,而且需要依次从大到小调换不同孔径的膜来达到挤出小囊泡的目的,过程繁琐。
而通过上述本申请所制备囊泡效果数据比对可以看出,利用本申请所提供的过滤收集装置进行制备时,不仅操作简便(仅需通过低压连续循环挤出囊泡即可),而且具有时间短、效率高、不易堵塞、便于清洗优点,尤其是,实际制备中,单次制备量可达1l,原高于现有小型化设备,对于促进囊泡的临床应用具有十分重要的应用意义。
实施例3
以实施例2所制备囊泡(压力0.5mpa,循环10min的某批次囊泡)为例,发明人进一步进行了癌细胞的杀伤实验,具体实验过程简介如下。
(一)囊泡的侵染实验
具体实验过程为:
首先,将231细胞以2x105铺板于3ml细胞培养皿中,待细胞贴壁后用于侵染;取1ml囊泡,加入10μl绿色荧光探针染料dio(郑州贝贝生物科技有限公司产品),37℃水浴锅避光孵育30min;
随后,将孵育后样品在透析袋(截留分子量1000kd)中4℃避光透析24h;
再后,将透析完成且荧光染色过的囊泡,通过0.22μm孔径的过滤器过滤并收集,避光保存;并加入到上述贴壁后的细胞培养皿中,荧光显微镜每隔一小时观察一次;
囊泡侵染细胞结果如图6所示,左侧为231细胞白场下的细胞形态,为典型的梭状贴壁细胞,右侧为荧光场下的细胞形态,可见大部分荧光染过的囊泡已经侵染进入细胞。
(二)细胞杀伤实验
将231细胞(人乳腺癌细胞)铺板于96孔板中,待细胞贴壁生长后,将实施例2所制备的载阿霉素囊泡对细胞进行转染;
作为对照,同时以pbs、未载药的纳米囊泡(参考前述操作进行制备即可)进行对照实验。
利用cck8试剂盒检测纳米囊泡(nv)对癌细胞增殖与活性的影响,结果如图7所示。
可以看出,随着时间的延长,与对照组相比,细胞增殖逐渐减弱,36h后细胞存活率较低,载药微囊泡表现出明显的杀伤效果。这进一步说明本申请囊泡过滤装置不仅适用于未携载药物成分空囊泡,对于携载药物后的囊泡仍然具有较好的分离收集作用,这也为后续的囊泡的临床应用奠定了技术基础。
总体上,本申请所提供的细胞分泌的纳米囊泡过滤收集装置,可以适用于不同来源(脂质体、红细胞,干细胞等)的微囊泡的大量制备,而且由于相关设备小型化、一体化设计,相较于现有离心设备的大型化、高成本,使得本申请对于相关医疗及科研机构而言,具有较好的实用价值。
- 还没有人留言评论。精彩留言会获得点赞!