一种具有抑制肿瘤转移活性的多肽分子、制备方法及其应用与流程
1.本发明涉及生物医药领域,尤其涉及一种抑制肿瘤转移活性的多肽分子,适 用于多种肿瘤的抗转移治疗。
背景技术:
2.抑制肿瘤转移是肿瘤治疗的关键。目前大部分抗肿瘤药物作用机制集中在杀 灭肿瘤细胞,抑制肿瘤生长,逆转肿瘤耐药性等方面,针对肿瘤转移的药物相对 较少,已有的抑制转移的药物效果还不能令人满意。发展抗肿瘤转移的药物仍是 迫切需要解决的问题。
3.血行转移,淋巴转移及局部侵犯是肿瘤转移的主要途径。血行转移 (hematogenous metastasis)是大多数肉瘤、肝癌、肺癌、肾癌、甲状腺滤泡癌、 恶性黑色素瘤和绒癌的主要转移方式。此外通过淋巴途径的肿瘤细胞通常也能够 进入血液循环。因此抑制肿瘤血行转移途径对于肿瘤转移治疗具有重要意义。
4.血行途径是重要的肿瘤转移途径,其过程是一个复杂的多因素干预的过程, 而且是肿瘤与周围环境的双向作用,涉及繁多的细胞与分子间相互作用。血行转 移过程分为三个阶段:前期,原发病灶诱导血管生成及肿瘤细胞突破基质层进入 血液循环。中期,肿瘤细胞随血液循环游走。后期,肿瘤细胞渗透血管壁到达转 移位点。血行转移后期,肿瘤细胞跨过血管内皮到达转移靶点部位实现转移。进 入循环的肿瘤细胞大部分能够被清除,其转移效率很大程度上取决于快速和有效 通过血管内皮从血流中逃脱。研究表明肿瘤细胞的这种外渗类似于白细胞跨内皮 迁移。但是此前一直不清楚肿瘤细胞如何与内皮细胞相互作用及此过程中分子作 用机制。2016年马克斯-普朗克心肺研究所strilic b等在nature杂志上报道肿 瘤细胞表面表达淀粉样前体蛋白(app)与血管内皮细胞表面的死亡受体(dr6) 相互作用,诱导内皮细胞程序性坏死(necroptosis),使其跨越血管壁到达靶器 官。这一研究成果阐明了肿瘤细胞突破血管壁的新机制。
5.目前作用于血行途径药物的治疗机制主要针对血行转移前期,即抑制原发肿 瘤部位新生血管生长,降低肿瘤细胞的运动能力等方面,可以分为以下两类:
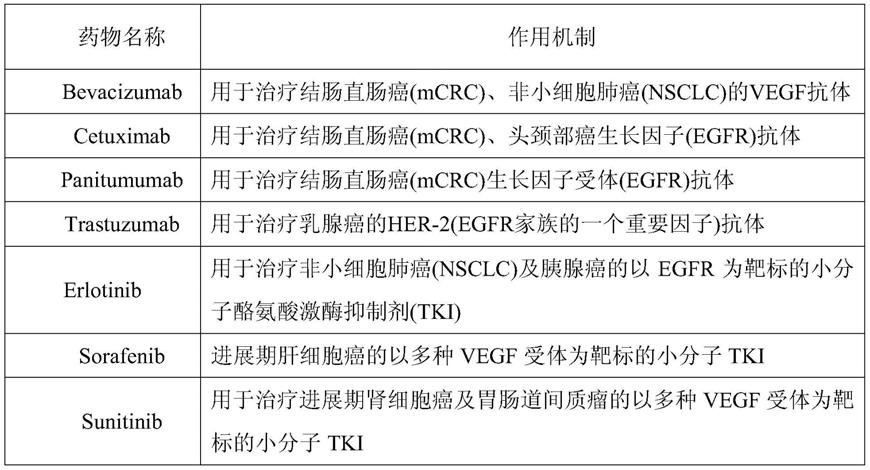
6.(1)肿瘤新生血管抑制剂
7.阻止肿瘤新生血管生长能够切断肿瘤组织营养物质的供应,有效抑制实体瘤 的生长,同时也切断了肿瘤细胞由原发病灶流向远端组织的通路。针对这一机制, 已发展出许多药物靶点及上市药物,如vegfr2抑制剂,vegf抗体,整合素受体 αvβ3及αvβ5抑制剂,egfr抑制剂,egf抗体等等。此类抑制剂数量庞大结构功 能多样,其中许多成为上市药物,如下表所示。然而,paez-ribes和ebos等在 cancer cell杂志上报道,临床前实验研究中根据治疗情况的不同抗血管生成的治 疗会增加肿瘤侵袭和扩散的可能性。抑制vegf活性后,代偿性旁路途径就会活 化。血浆蛋白g-csf、plgf和sdf1的水平升高,可促进肿瘤细胞的浸润和转移。 因此通过抑制新生血管生长来阻止肿瘤血行转移尚不能够有效阻断肿瘤转移。
8.下表代表性抑制肿瘤新生血管药物:
[0009][0010]
(2)金属蛋白酶抑制剂
[0011]
细胞外基质(cell-extracellular matrix,ecm)是存在于细胞与细胞之间的多种蛋白 质和非蛋白成分,是细胞赖以生存的微环境,ecm的降解被认为是肿瘤血管生 成和癌细胞浸润、转移的开始。肿瘤细胞能产生大量分解酶(金属蛋白酶类mmps、 组织蛋白酶、纤溶酶原激活剂、纤溶酶等)将其降解,形成局部通道促进迁移。 目前研究较多的是基质金属蛋白酶抑制剂。根据结构特征分类,目前已发展出了 7大类抑制剂,异羟肟酸多肽类似物(pepmimetichydroxamates-based inhibitors), 新一代羟肟酸类(hydroxamates-based inhibitors),硫醇类(thiol-based inhibitors), 嘧啶类(pyrimidine-based inhibitors),羟基吡喃酮类(hydroxyprone-based inhibitors), 二膦酸盐类(phosphorus-based inhibitors)及四环素衍生物类(tetracycline-based inhibitors)抑制剂。mmp抑制剂是一类被广泛深入研究的抗肿瘤转移药物,然而 这类化合物也存在一些缺陷如选择性不高,毒副作用较大等。这使得mmp抑制 剂在临床实验中还没有取得理想结果。寻找高选择性及良好成药性的mmp抑制 剂还在继续努力过程中。如下是基质金属蛋白酶抑制剂:
[0012]
技术实现要素:
[0013]
本发明提供一种能够阻断肿瘤细胞从血液循环中逃逸的活性分子,该活性分 子具有较长的半衰期和极低的毒性,为抑制肿瘤转移治疗提供新方案。
[0014]
为解决上述技术问题,本发明提供如下技术方案:
[0015]
一种具有抑制肿瘤转移活性的多肽分子,分子结构式是:
[0016]
进一步的,本发明还提出了一种具有抑制肿瘤转移活性的多肽分子的制备方 法,步骤如下:
[0017]
首先,噬菌体展示技术得到24条与dr6具有一定结合力的先导多肽。采用 微量热泳动实验、细胞黏附实验、共培养实验对先导多肽进行生物活性验证,经 筛选得到4条结合力较强的dr6多肽:ahp-03,ahp-10,ahp-12,ahp-13。其 与dr6蛋白的结合常数(kd)分别为:688.5
±
11.20nm,527.8
±
12.09nm, 321.8
±
11.24nm,457.3
±
11.56nm。
[0018]
先导多肽序列均有l型氨基酸组成,l型氨基酸极易被体内的蛋白酶识别降 解,代谢稳定性较差。为了提高多肽稳定性,将l型氨基酸全部替换为d型氨基 酸。因此,得到8条d型多肽:ahp-d-03,ahp-d-10,ahp-d-12,ahp-d-13, ahp-dri-03,ahp-dri-10,ahp-dri-12,ahp-dri-13。利用相同的方法进行筛选, 得到结合力最强,稳定性较高的d型dr6多肽:ahp-dri-12。其与dr6蛋白的 结合常数(kd)位:225.19
±
4.30nm。
[0019]
采用多臂peg链连接不同数量药物分子能够形成“多价效应”增强药物对 靶点的结合能力。该方法已被广泛用于药物研究中,其中研究及应用的较多的为 4臂和8臂peg链。基于这些思想,采用4臂peg修饰ahp-dri-12,在延长 dr6多肽抑制剂半衰期的同时进一步增强活性。ahp-dri-12修饰巯基后与4臂 peg连接得到peg-tahp-dri。利用上述方法进行生物活性的验证,其与dr6结合 力分别为51.12
±
11.56nm。
[0020]
进一步的,本发明所述具有抑制肿瘤转移活性的多肽分子的应用,是具有抑 制肿瘤细胞(胆囊癌,黑色素瘤,肺癌)诱导血管内皮细胞坏死,阻止肿瘤细胞 经过血流透过血管壁转移的应用。
[0021]
本发明的技术效果如下:
[0022]
1.本发明提供了一系列全新序列结构的、对dr6死亡受体有抑制作用的多 肽分子,并对多肽做了结构改变以及peg修饰,保护这些多肽分子中经过缺失、 插入或置换一个或几个氨基酸且与所述多肽分子具有相同生物学功能的由所述 多肽分子衍生的分子。
[0023]
2.本发明所述的多肽分子具有dr6死亡受体结合活性,具有抑制肿瘤细胞 (胆囊癌,黑色素瘤,肺癌)诱导血管内皮细胞坏死,阻止肿瘤细胞经过血流透 过血管壁,实现肿瘤转移的过程。这些多肽分子具有潜在抑制肿瘤血行转移效果。
附图说明
[0024]
图1为24条先导多肽生物活性验证结果;
[0025]
图2为8条d肽生物活性验证结果;
[0026]
图3为核磁1h谱验证四臂peg与dr6多肽成功连接;
[0027]
图4为为体外抑制肿瘤转移效果;
[0028]
图5为体内抗转移效果。
具体实施方式
[0029]
一、利用噬菌体展示得到先导多肽及多肽合成
[0030]
1)、测定噬菌体滴度
[0031]
(1)接种er2738单菌落于5-10ml lb培养基中,摇床培养至对数中期 (od600~0.5)
[0032]
(2)当菌落生长时,微波炉融化上层琼脂,分成3ml等份于灭菌试管中, 每个噬菌体稀释度一管。保存于45℃备用。
[0033]
(3)37℃预温lb/iptg/xgal平板,每个噬菌体稀释度取一个平板备用。在 lb中准备10倍系列稀释的噬菌体。
[0034]
(4)当菌体培养物达对数中期,分成200μl等份于微量离心管中,每个噬 菌体稀释度一管。每管加入10μl不同稀释度的噬菌体,快速震荡混匀,室温温 育1-5min。
[0035]
(5)将上述溶液加入45℃预温的上层琼脂培养管中,每次一管,快速混匀, 立即倾注于37℃预温的lb/iptg/xgal平板上。适当倾斜平板将上层琼脂均匀铺开。 待平板冷却5min后,倒置于37℃培养过夜。
[0036]
(6)检查平板,计数有~102个噬菌斑的平板上的斑数。然后用此数目乘以 稀释因子即得到每10μl噬菌体的空斑形成单位(pfu)滴度。
[0037]
只有当噬菌体的感染复数moi(multiplicity of infection)值远低于1时(即细 胞过量时),噬菌斑的数量才会随着加入噬菌体的量而呈线性增加。正因如此, 建议检测噬菌体贮液的滴度时,在感染前进行稀释,而不是在高moi值的情况 下稀释被感染的细胞。低moi值有助于确保每个噬菌斑仅含一个dna序列。
[0038]
2)、淘选:
[0039]
(1)准备100μg/ml的dr6蛋白溶液(溶于0.1m ph 8.6的nahco3)。96 孔板每板加入1.5ml上述溶液,反复旋转直到表面完全湿润。在增湿容器(如: 排列有湿纸巾的可封口塑料盒)中4℃轻微震荡,孵育过夜。平板可在此容器中 4℃贮存备用。
[0040]
(2)次日,挑er2738单克隆(噬菌体滴度测定时铺的板)于10ml lb液体 培养基中。
37℃剧烈震荡培养。倒掉每板中的包被液,每孔加满封阻液,4℃作 用至少1小时。除去封阻液。再用tbst(tbs+0.1%[v/v]tween-20)缓冲液快速洗 板6次。每次均旋转以使板或孔的底部及边缘均被洗到,倾去缓冲液。用1ml 的tbst缓冲液稀释4
×
10
10
的噬菌体(即10μl的原始文库),然后加到已包被好 的板上,室温温和摇动10-60min。根据所研究的分子间相互作用,用1ml适当 的洗脱缓冲液洗脱结合的噬菌体。室温温和摇动10-60min,将洗脱液吸入另一 干净微量离心管中。按上述程序测定少量(~1μl)洗脱物的滴度。剩余洗脱物应 当被扩增:将洗脱物加入到20ml er2738培养物中(菌体应当处于对数前期), 37℃剧烈摇动培养4.5小时。将培养物转入离心管中,然后,4℃10,000rpm离 心10min。上清液转入另一离心管中,再离心。将上清的上部80%转入新鲜管中, 加入1/6体积的peg/nacl。让噬菌体4℃沉淀至少60min,过夜。
[0041]
(3)次日。4℃10,000rpm离心peg沉淀15min。倒掉上清液,再短暂离 心,吸去残留上清液。沉淀物重悬于1ml tbs中,悬液转入微量离心管中,4℃ 离心5min使沉淀。上清转入另一新鲜微量离心管,用1/6体积的peg/nacl再沉 淀。冰上孵育15-60min。4℃离心10min,弃上清,再短暂离心,吸去残余上 清。沉淀物重悬于200μl tbs,0.02%nan3中。离心1min,沉淀任何残余的不溶 物。上清转入新鲜管中。此即为扩增后的洗脱物。根据上述方法用lb/iptg/xgal 平板滴定扩增后的洗脱物。4℃贮存。
[0042]
(4)再包被一个板准备第二轮淘选时用。
[0043]
(5)次日。计数板上蓝斑数确定滴度。用这个值来计算相应于1-2
×
10
11
pfu 的加入量。如果滴度太低,接下来的几轮淘选可用低至109pfu的噬菌体加入量 进行试验。进行第二轮淘选:用第一轮淘选扩增的洗脱物中1-2
×
10
11
pfu的噬菌 体量重复步骤(2)(3),在清洗步骤中将tween的浓度增至0.5%(v/v)。在 lb/iptg/xgal平板上测定第二轮淘选所得洗脱物扩增后的滴度。
[0044]
(6)再包被一个板准备第三轮淘选时用.
[0045]
(7)进行第三轮淘选:用第二轮淘选扩增的洗脱物中2
×
10
11
pfu的噬菌体 量重复步骤(2),清洗步骤中同样用0.5%(v/v)的tween。在lb/iptg/xgal平板上 测定第三轮淘选所得洗脱物未扩增时的滴度。第三轮洗脱物不必再扩增。滴度测 定时得到的噬菌斑可做测序用:只要注意平板培养时间不要超过18小时,培养 时间过长容易出现缺失。其余洗脱物4℃贮存。挑er2738单克隆于lb-tet培养 基中培养过夜(不要接种稀释后的铺板培养物)。
[0046]
3)噬菌斑的扩增
[0047]
(1)将er2738过夜培养物按1:100稀释接种于lb培养基,分1ml到培养 管中。每个要鉴定的克隆一管。一般情况下,由第三轮淘选物中取10个克隆便 足以检测结合肽中的共有序列。
[0048]
(2)用灭菌牙签或吸头,挑一蓝色噬菌斑到上述1ml培养管中。注意:要 从总量不到100个噬菌斑的平板上挑选,以便保证每个被挑的噬菌斑仅含一个 dna序列。
[0049]
(3)37℃摇床培养4.5-5hrs(不要过长)。
[0050]
(4)培养物转入微量离心管中,离心30sec。上清转入以新鲜管中,再离 心。用移液器将80%的上清转入新鲜离心管,此即为扩增噬菌体贮液,可以4℃ 贮存几个星期而对滴度影响不大。长期贮存应用灭菌甘油1:1稀释后,-20℃贮存。
[0051]
4)测序。得到每个噬菌斑中的序列。
[0052]
5)多肽合成
[0053]
(1)采用boc保护固相多肽合成法合成。将pam-氨基酸-boc树脂(或mbha 树脂)用dmf溶胀15min,三氟乙酸(tfa)脱保护两次,每次1min,将boc 保护氨基酸溶解在0.5m的hbtu(溶剂为dmf)中,室温反应15min,dmf洗 涤,tfa脱除boc保护,按照氨基酸序列依次反应,反应完成后,用20%的哌啶 dmf溶液脱除cho(含有w的氨基酸序列)保护基两次,每次15min。tfa 脱boc保护后,用氟化氢将多肽从树脂上切割下来,冰乙醚沉淀后砂芯漏斗抽滤 得到多肽粗品。用50%乙腈(含0.1%tfa)溶解后,制备液相纯化、冻干后得多 肽。
[0054]
(2)hplc检测纯度,ms质谱鉴定。
[0055]
筛选得到的多肽序列如表1所示。经hplc检测,合成多肽纯度均在95%以 上。表1为24条先导多肽序列及与dr6结合力。
[0056]
表1
[0057][0058][0059]
二、生物活性鉴定
[0060]
1)微量热泳动测定多肽与dr6蛋白的结合力常数
[0061]
(1)用red-tris-nta 2nd generation dye标记dr6蛋白。将等体积(200nm) dr6蛋白与(100nm)染料混合,室温孵育30min后,4℃,15000g离心。
[0062]
(2)准备12个pcr管,在管2-12中分别加入10ul pbs-t。
[0063]
(3)在管1中加入20ul的多肽溶液(20um),转移10ul管1中的溶液到 管2并充分混合。转移10ul管2中中的溶液到管3并充分混合。重复该操作。 管12中多余的10ul溶液丢弃。
[0064]
(4)向每个孔中添加10ul标记的dr6蛋白,混合均匀。最终目标蛋白浓 度为50nm。此浓度应用于计算kd值。
[0065]
(5)利用毛细管上样,测定kd值。
[0066]
如表一所示。peptide-3,peptide-10,peptide-12,peptide-13的kd值在nm 级别,分别为。
[0067]
2)huvec与肿瘤细胞共培养观察肿瘤细胞诱导内皮细胞程序性坏死
[0068]
(1)huvec细胞以1
×
105细胞/孔接种于6孔板中,37℃,5%co2胞培养箱 孵育24h。
[0069]
(2)gfp标记b16f10、sgc-996、llc1细胞,以2
×
104细胞/孔加到上述6 孔板中。37℃,5%co2细胞培养箱共培养24h.
[0070]
(3)用hoechst33342,ethd-iii染色试剂盒染色,荧光显微镜观察。
[0071]
3)细胞黏附实验
[0072]
(1)dr6蛋白(溶解于pbs,50nm)以50ul每孔包被96孔板,37℃,2h 温育后,4℃静置过夜。
[0073]
(2)次日pbs轻洗,再用1%bsa封闭,37℃,2h。pbs轻洗。
[0074]
(3)细胞重悬于培养液中配成单细胞悬液,调整浓度为3
×
105,每孔接种 100ul。细胞培养箱中孵育1h。弃去培养液,pbs轻柔洗去未粘附细胞。用4% 多聚甲醛室温固定30min,洗去,用5%结晶紫50ul/孔染色10min,pbs轻洗, 33%醋酸脱色。bio-rad酶标仪,590nm,测吸光值。
[0075]
24条dr6多肽生物活性鉴定结果如图1所示。peptide-3,10,12,13表现出较 高的生物活性。
[0076]
三、多肽的结构改造
[0077]
1)d肽的合成。d型氨基组成的多肽不容易被蛋白酶的降解。因此,为了 提高dr6多肽的稳定性,peptide-3,10,12,13中的l型氨基酸全部替换为d 型氨基酸,序列如表2所示。表2为8条d肽序列及与dr6结合力;按 照上述方法进行d肽生物活性的鉴定,结果如图2所示,其中dpeptide-12’, d
peptide-13’的生物活性最高。
[0078]
表2
[0079][0080]
2)四臂peg修饰多肽。多肽链上接一个半胱氨酸,四臂peg末端分别修饰 马来酰亚胺。四臂peg和相应比例多肽(摩尔比=1:8)溶于适量体积ph=8、 0.1m的pbs中。室温搅拌
反应4h,置于分子量3500的透析袋透析24h, 冻干。如图3所示,核磁1h谱显示,多肽成功与四臂peg连接。生物活 性鉴定结果如图4所示。
[0081]
四、多肽抗转移功能的实验
[0082]
1)体外抗转移的实验
[0083]
实验分组为:空白对照组、多肽处理组、zvad处理组、nec-1处理组
[0084]
(1)跨内皮迁移实验:2
×
105huvec细胞0.1ml加到24孔板transwell上室, 下室加入1ml培养基,37℃,5%co2培养,每两天更换培养基,利用evom电 阻测定仪,每天测量跨内皮电阻,当teer阻值>200ωcm2时,细胞长成具有紧 密连接的内皮细胞单层。加入2
×
105gfp-tcs,经不同试剂处理后过夜。荧光显 微镜观察24孔板中细胞。
[0085]
(2)共培养实验:huvec细胞以1
×
105细胞/孔接种于6孔板中,37℃,5%co2胞培养箱孵育24h。gfp-tcs以2
×
104细胞/孔加到上述6孔板中。经不同试剂处 理后,37℃,5%co2细胞培养箱共培养24h。用hoechst33342,ethd-iii染色试 剂盒染色,荧光显微镜观察。
[0086]
如图5所示,peptide具备较好的体外抗转移活性。
[0087]
2)体内抗转移实验
[0088]
实验分组为:空白对照组、多肽处理组
[0089]
将100ulpbs中的gfp-b16f10(2
×
105)注入小鼠尾静脉。在注射b16f10之 前和之后24小时,静脉内给小鼠静脉注射pbs,多肽(20um)。每2天给一次 药,共7次。15天后,处死小鼠并用pbs和4%多聚甲醛灌注。观察不同组小 鼠肺部的转移结节。如图5所示,d肽和四臂peg修饰肽均表现出抑制肿瘤转移 效果,peg修饰肽的抑制效果最强。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1