一株生防贝莱斯芽孢杆菌ZHX-12及其应用的制作方法
一株生防贝莱斯芽孢杆菌zhx-12及其应用
技术领域
[0001]
本发明属于生物技术领域,尤其涉及菌株及其应用领域,具体涉及一种对多种植物病原菌具有广谱抗性的贝莱斯芽孢杆菌zhx-12的分离鉴定及其在促进花生生长和防治花生致病真菌上的应用。
背景技术:
[0002]
花生是世界上食物、饲料和食用油的重要来源之一,花生很容易感染病害,特别是由真菌引起的土传病害,包括花生冠腐病、白绢病等。花生冠腐病由aspergillus niger危害果仁、子叶和茎基部,以茎基部为主侵染引起。该病害可在感染花生种子中存活并通过种子传播,储藏期潮湿的种仁易受病菌感染,种子带菌率高达90%以上。土壤带菌是另一种重要初侵染源,病菌可在土壤中存活1~2年。近些年来,由于重茬和抗病品种的匮乏导致病原菌连年累积,导致病害发生越发严重,病害一般会造成缺苗10%,严重的在50%以上。白绢病由齐整小核菌属真菌(sclerotium rolfsii)引起,一般地块发病率在10%左右,重达30%以上,花生减产50~100%。杀菌剂是控制植物病原体的主要途径,但是基于对人类健康和环境问题的考虑,寻找化学农药的替代品引起了人们的关注,在这其中,使用微生物控制植物病害就是一个很好的选择。
[0003]
贝莱斯芽孢杆菌在自然界中广泛分布,具有快速生长和稳定的良好特性,易于分离和培养,对人类和动物无害,不污染环境,其代谢产物丰富,具有广谱抗菌活性和较强的抗应激能力,因此该细菌在农业、环境和发酵工业等许多领域发挥着越来越重要的作用。近年来,国内外科学家相继从植物根际土壤、养殖池塘、深海、大曲分离得到大量的贝莱斯芽孢杆菌,并通过研究发现许多贝莱斯芽孢杆菌菌株在促进植物生长、拮抗病原菌及白酒酿造等方面发挥一定的作用,具有十分重要的理论研究与实践应用价值,但迄今还未有贝莱斯芽孢杆菌应用于花生病害防治的。
技术实现要素:
[0004]
本发明的目的在于解决现有技术中存在的化学农药在防治花生病虫害方面的种种弊端,提出了一株生防贝莱斯芽孢杆菌zhx-12及其应用,在花生上应用贝莱斯芽孢杆菌,借助生防菌株,提高花生对冠腐病、白绢病等花生病原菌的抗性。该方法属于生物防治的范畴,安全、快速、有效,有利于花生的绿色健康生产,为花生病害的综合防治提供技术支撑,同时可以促进花生生长,抑制花生黄曲霉菌及其毒素含量。
[0005]
本发明的技术方案是:
[0006]
一株生防贝莱斯芽孢杆菌zhx-12,所述菌株zhx-12保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为cgmcc no.20375。
[0007]
进一步的,所述菌株zhx-12的16s rdna序列如seq id no:1所示;其gyrb基因序列如seq id no:2所示。
[0008]
所述的生防贝莱斯芽孢杆菌zhx-12在防治花生冠腐病菌、花生网斑病菌、花生轮
斑病菌、花生根腐病菌、花生白绢病菌和花生纹枯病菌上的应用。
[0009]
进一步的,所述生防贝莱斯芽孢杆菌zhx-12的应用形式为菌株zhx-12的菌悬液、无菌发酵液、挥发性气体、以及有菌发酵液中的任一种。
[0010]
所述的生防贝莱斯芽孢杆菌zhx-12促进花生生长的应用。
[0011]
进一步的,采用菌株zhx-12的有菌发酵液浸泡花生种子一段时间后播种,在播种的同时接种一定量的发酵液。
[0012]
所述的生防贝莱斯芽孢杆菌zhx-12抑制花生黄曲霉菌及其毒素含量的应用。
[0013]
进一步的,所述生防贝莱斯芽孢杆菌zhx-12在抑制花生黄曲霉菌及其毒素含量的应用形式为菌株zhx-12的菌悬液、无菌发酵液、挥发性气体中的任一种。
[0014]
生物材料样品保藏信息:
[0015]
菌株zhx-12为贝莱斯芽孢杆菌(bacillus velezensis),保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏地址:中国,北京朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏日期:2020年07月16日,保藏编号cgmcc no.20375。
[0016]
本发明的有益效果:
[0017]
本发明所提供的贝莱斯芽孢杆菌zhx-12对花生病原菌有明显的抑制作用,可以作为潜力生防菌株,将贝莱斯芽孢杆菌应用于花生病害防治,提高了花生对冠腐病、白绢病、网斑病菌、轮斑病菌、根腐病菌和花生纹枯病菌的抗性,同时能够显著促进花生的生长和产量。经试验验证,贝莱斯芽孢杆菌zhx-12还能够抑制花生黄曲霉菌及其毒素含量。采用本发明贝莱斯芽孢杆菌zhx-12的应用方法属于生物防治的范畴,安全、快速、有效,有利于花生的绿色健康生产,为花生病害的综合防治提供技术支撑。
附图说明
[0018]
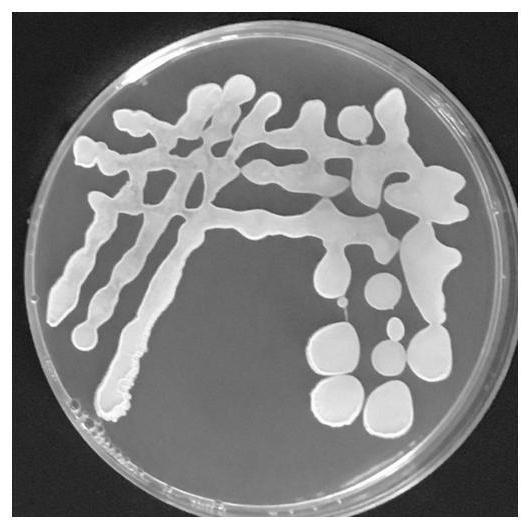
图1为菌株zhx-12的菌落形态图;
[0019]
图2为菌株zhx-12基于16s rdna和gyrb基因构建的系统发育树;
[0020]
图3为菌株zhx-12菌悬液对靶标病原菌的拮抗作用;
[0021]
图4为菌株zhx-12发酵液对3种病原菌抑菌能力的测定;
[0022]
图5为菌株zhx-12挥发性气体对3种病原菌抑菌能力的测定;
[0023]
图6为菌株zhx-12对其他供试花生病原菌的抑制作用;
[0024]
图7为菌株zhx-12有菌发酵液对花生冠腐病的防治效果;
[0025]
图8为菌株zhx-12有菌发酵液对花生白绢病的防治效果;
[0026]
图9为菌株zhx-12有菌发酵液对花生生长的影响;
[0027]
图10为菌株zhx-12对花生黄曲霉菌生长的影响;
[0028]
图11为菌株zhx-12悬浮液对花生黄曲霉毒素含量的影响。
具体实施方式
[0029]
下面将结合具体实施例对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有做出创造性劳动的前提下,所获得的所有其他实施例,都属于本发明保护的范围。
[0030]
为了进一步理解本发明,下面结合实施例对本发明进行详细说明。
[0031]
若未特别指明,本发明实施例中所用的实验材料、试剂和仪器等均可市售获得,若未具体指明,实施例中所用的技术手段均为本领域技术人员所熟知的常规手段。
[0032]
实施例1贝莱斯芽孢杆菌zhx-12的分离鉴定
[0033]
1、菌株zhx-12的筛选和分离:
[0034]
样品为取自于花生连作田的病、健株根际周围距离地表6cm深处的土壤,4℃保存。
[0035]
步骤包括:
[0036]
(1)称取上述土壤样品10g加到90ml无菌水中,28℃、140rpm振荡15min,静置5 min,取上清液,采用10倍系列稀释法,依次稀释到10-2
、10-3
、10-4
和10-5
,每个浓度吸取 100μl分别涂于lb固体培养基上,每个浓度重复3次,28℃暗培养。
[0037]
(2)待培养基上出现细菌菌落时,喷施花生冠腐病菌(aspergillus niger)孢子悬浮液,培养2d后,选取周围出现明显抑菌圈的菌落,用抑菌环挑取单菌落,在la固体培养基上进行纯化培养。
[0038]
(3)最终,挑选出一株抑菌圈超过2cm的菌株,菌体呈淡黄色,菌落粗糙,不透明,命名为zhx-12,菌株形态图见图1。
[0039]
(4)菌株zhx-12单菌落用lb液体培养基摇菌后,加入甘油,于-80℃保存。
[0040]
2、菌株zhx-12的菌种鉴定:
[0041]
根据提取细菌基因组的试剂盒“transgenbacteria genomic dna kit”提取 zhx-12的基因组dna。分别利用16s rdna通用引物9f(5
’ꢀ-
gagtttgatcctggctcag-3’)(seq id no:3)和1542r(5
’-
agaaaggaggtgatccagcc-3’)(seq id no:4),gyrb基因引物f(5
’ꢀ-
gaagtcatcatgaccgttctgc-3’)(seq id no:5)和r(5
’ꢀ-
agcagggtacggatgtgcgagcc-3’)(seq id no:6)对菌株zhx-12的基因组进行pcr 扩增,pcr产物送生工生物(上海)有限公司测序。
[0042]
测定序列结果表明菌株zhx-12的16s rdna序列全长为1439bp,序列如seq id no: 1所示;gyrb基因序列全长为1084bp,序列如seq id no:2所示。所获得的序列提交到 genbank数据库进行blast分析比对,并结合16s rdna序列和gyrb基因序列用mega6.06 软件构建如图2所示的系统发育树,结果表明,菌株zhx-12与贝莱斯芽孢杆菌bacillusvelezensis cp047157的相似性达到97%,说明菌株zhx-12为贝莱斯芽孢杆菌。
[0043]
实施例2贝莱斯芽孢杆菌zhx-12对花生冠腐病菌、网斑病菌和轮斑病菌菌丝生长的抑制作用
[0044]
(一)菌株zhx-12菌悬液对3种花生病原菌菌丝生长的抑制作用
[0045]
1、花生冠腐病菌:用牙签挑取菌株zhx-12的单菌落放入盛有20ml lb培养基的三角瓶中,28℃振荡培养14h,制备浓度为od
420
=0.3的菌悬液。吸取10μl菌悬液,接种于直径为9cm的pda固体培养基中央,待菌液充分吸收后,28℃恒温培养24h。向pda培养基中均匀喷施od
420
=0.3的花生冠腐病菌的孢子悬浮液,以不喷孢子悬浮液作为对照。25℃恒温培养,8d左右,对抑菌圈大小进行统计、拍照(见图3a、3b)。图3a为花生冠腐病菌的对照组,图3b为花生冠腐病菌的对峙效果;结果发现菌株zhx-12对花生冠腐病菌有显著的拮抗活性,抑菌圈大小为28.67
±
1.03mm。
[0046]
2、花生网斑病菌:同理制备菌株zhx-12浓度为od
420
=0.3的菌悬液,备用。在平板
中央接入直径为5mm的病原菌的菌饼,菌饼两侧约22mm处各接种10μl菌株zhx-12的菌悬液,以不接种菌悬液作为对照,25℃恒温黑暗培养,5d左右,对抑菌情况进行统计,并计算抑菌率(%)=(对照菌落增长直径-处理菌落增长直径)/对照菌落增长直径
×
100。图3c 为花生网斑病菌的对照组,图3d为花生网斑病菌的对峙效果;结果发现,菌株zhx-12对花生网斑病菌具有显著的抑菌效果,菌丝生长抑制率为67.26%。
[0047]
3、花生轮斑病菌:同理制备菌株zhx-12浓度为od
420
=0.3的菌悬液,同时准备花生轮斑病菌浓度为od
420
=0.3的孢子悬浮液,备用。吸取10μl孢子悬浮液,接种于直径为9cm 的pda固体培养基中央,距离平板中心两侧约22mm处各接种10μl菌株zhx-12的菌悬液,以不接种菌悬液作为对照,25℃恒温黑暗培养,4d左右,对抑菌情况进行统计,并计算抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径
×
100。图3e为花生轮斑病菌的对照组,图3f为花生轮斑病菌的对峙效果;结果发现菌株zhx-12对花生轮斑病菌具有显著的抑菌效果,菌丝生长抑制率为66.21%。
[0048]
(二)菌株zhx-12无菌发酵液对3种花生病原菌菌丝生长的抑制作用
[0049]
用牙签挑取菌株zhx-12的单菌落放入盛有100ml lb培养基的三角瓶中,28℃振荡培养36h,高速离心后收集上清液,用0.22μm滤膜过滤得到无菌发酵液。将无菌发酵液以1:10 的比例与加热冷却至约50℃的pda培养基混合倒平板,在平板中央接入直径为5mm花生网斑病菌的菌饼,或10μl孢子悬浮液(花生冠腐病菌或花生轮斑病菌,od
420
=0.3),以添加等量lb培养基的平板作为对照,每个处理设6个重复,25℃培养,分别于5d、5d、7d后对花生网斑病菌、花生轮斑病菌、花生冠腐病菌菌落直径进行测量。
[0050]
结果发现,如图4所示,同相应对照相比,菌株zhx-12的无菌发酵液极显著的降低了花生冠腐病菌、花生网斑病菌和花生轮斑病菌菌丝的生长(其中,图4a为菌株zhx-12发酵液对花生冠腐病菌的抑菌能力,图4b为对花生网斑病菌的抑制,图4c为对花生轮斑病菌的抑制;**表示在p<0.01水平下,差异极显著),菌丝生长抑制率分别为20.11%、49.13%和 41.52%。
[0051]
(三)菌株zhx-12挥发性气体对3种花生病原菌菌丝生长的抑制作用
[0052]
用牙签挑取菌株zhx-12的单菌落放入盛有20ml lb培养基的三角瓶中,28℃振荡培养 14h,制备浓度为od
420
=0.3的菌悬液。于二分格培养皿的一侧倒入lb培养基,另一侧倒入等体积的pda培养基。lb培养基一侧均匀涂布50μl菌悬液,pda培养基侧中间位置接种直径为5mm花生网斑病菌的菌饼或10μl孢子悬浮液(花生冠腐病菌或花生轮斑病菌, od
420
=0.3),涂布50μl无菌水作为对照组,每个处理设6个重复,分别于3d、3d、5d后对花生冠腐病菌、花生网斑病菌、花生轮斑病菌菌落直径进行测量。结果发现,如图5所示,菌株zhx-12的挥发性气体极显著的降低了花生冠腐病菌、花生网斑病菌、花生轮斑病菌菌丝的生长(其中,图5a为菌株zhx-12挥发性气体对花生冠腐病菌的抑菌能力,图5b为对花生网斑病菌的抑制,图5c为对花生轮斑病菌的抑制;**表示在p<0.01水平下,差异极显著),菌丝生长抑制率分别为14.52%、17.88%和16.76%。
[0053]
实施例3贝莱斯芽孢杆菌zhx-12对花生根腐病菌、花生白绢病菌和花生纹枯病菌的抑菌作用
[0054]
1、花生根腐病菌(茄类镰孢菌fusarium solani和尖孢镰孢菌fusarium oxysporum):制备菌株zhx-12浓度为od
420
=0.3的菌悬液,吸取10μl,接种于直径为9cm的
12的有菌发酵液能够极显著增加晋花10号植株的鲜重和干重,比对照组分别增加 26.03%和22.54%。
[0064]
实施例6贝莱斯芽孢杆菌zhx-12对花生黄曲霉菌及其毒素含量的影响
[0065]
1、菌株zhx-12对花生黄曲霉菌生长的影响:
[0066]
参照花生冠腐病菌的方法,进行菌株zhx-12的菌悬液、无菌发酵液和挥发性气体对花生黄曲霉菌生长的影响实验,如图10所示,结果发现菌悬液对黄曲霉的抑菌圈直径为2.23
ꢀ±
0.05cm,无菌发酵液和挥发性气体的菌丝生长抑制率分别为4.75%、34.07%,其中挥发性气体使黄曲霉菌颜色变淡(见图10,图中,a、c、e为对照组,b、d、f分别为菌株zhx-12 的菌悬液、无菌发酵液和挥发性气体对花生黄曲霉菌生长的影响)。
[0067]
2、菌株zhx-12对花生黄曲霉毒素含量的影响:
[0068]
(1)将大米用灭菌水浸泡18h后,沥水,称取20g分装到灭菌的锥形瓶中,再加入6ml 的灭菌水,高温灭菌(121℃,15min)。待灭菌后的大米冷却到室温,处理一:将1ml黄曲霉菌孢子悬浮液和50μlzhx-12菌悬液接种到灭菌的大米上;处理二:将1ml黄曲霉菌孢子悬浮液和10μlzhx-12菌悬液接种到灭菌的大米上;阴性对照组大米不加菌悬液,用灭菌水代替孢子悬浮液;阳性对照组大米仅添加孢子悬浮液。25℃黑暗培养7d后,将样品冷冻干燥,用粉碎机粉碎后过20目筛,用黄曲霉毒素总量elisa试剂盒(北京华安麦科生物有限公司)检测样品中黄曲霉毒素含量。
[0069]
(2)将花生品种中花6号种子用粉碎机粉碎后,称取20g分装到灭菌的锥形瓶中,再向锥形瓶中加入6ml的灭菌水,高温灭菌(121℃,15min)。待灭菌后的花生碎冷却到室温,处理一:将1ml黄曲霉菌孢子悬浮液和50μl zhx-12菌悬液接种到灭菌的花生碎上;处理二:将1ml黄曲霉菌孢子悬浮液和10μlzhx-12菌悬液接种到灭菌的花生碎上;阴性对照组花生碎不加菌悬液,用灭菌水代替孢子悬浮液;阳性对照组花生碎仅添加孢子悬浮液。25℃黑暗培养7d后,将样品冷冻干燥,过20目筛,用黄曲霉毒素总量elisa试剂盒(北京华安麦科生物有限公司)检测样品中黄曲霉毒素含量。
[0070]
(3)用酶标仪(imark
tm
,bio-rad,usa)测量波长450nm参考波长630nm双波长测定微孔板每孔的od值。用ridasoftwin.net软件分析数据,根据标准品曲线计算每个样品中黄曲霉毒素的浓度。样品中黄曲霉毒素含量增加量=样品中黄曲霉毒素含量
–
阴性对照组黄曲霉毒素含量,黄曲霉毒素降解率(%)=(阳性对照组黄曲霉毒素增加量-处理组黄曲霉毒素增加量)/阳性对照组黄曲霉毒素增加量
×
100。
[0071]
结果发现,如图11所示(图中不同大写字母表示在p<0.01水平下,差异极显著),10μl 和50μl zhx-12菌悬液对大米中黄曲霉毒素降解率分别为75.63%和99.56%,而对花生中黄曲霉毒素降解率分别为55.03%和90.94%,可见zhx-12菌悬液能够极显著的降低黄曲霉毒素含量,同时菌体多的比菌体少的降低黄曲霉毒素含量的效果更好。
[0072]
上述说明仅为本发明的优选实施例,并非是对本发明的限制,凡在本发明的内容范围内所做出的任何修改、等同替换、改型等,均应包含在本发明的专利保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1