一种有活性的落叶松增强子、获取及鉴定方法与流程
1.本发明涉及生物技术,特别涉及一种有活性的落叶松增强子、获取及鉴定方法。
背景技术:
2.落叶松是松科落叶松属的一种落叶乔木。它具有耐贫瘠、抗干旱等特征,在北方山地也能快速生长。因此是我国山区主要种植的树种之一,也是造纸和景观绿化的主要树种。增强子是一类顺式调控元件,能够远距离促进目标基因的转录。增强子通过启动子来实现增强转录的作用。增强子序列并不保守,方向也不固定,这为增强子预测工作带来一定的难度。落叶松中增强子的挖掘与鉴定,对于落叶松功能基因组的研究提供重要的证据支持。
技术实现要素:
3.发明目的:本发明目的是提供有活性的落叶松增强子。
4.本发明另一目的是提供所述有活性的落叶松增强子的获取方法及鉴定方法。
5.技术方案:本发明提供一种有活性的落叶松增强子,dna序列如seq id no.1。
6.进一步地,包括如下步骤:用特异引物以日本落叶松的基因组dna为模板,扩增得到560bp的扩增产物,即得。
7.进一步地,所述特异引物序列如下:
8.正向:5
’‑
ggaatatgattaaagataaggaggtgttgatatttccagg
‑3’
;
9.反向:5
’‑
ctgtcaaacactgatagtttaaccctaacttcctcaatga
‑3’
。
10.进一步地,所述的有活性的落叶松增强子的获取方法,落叶松rna
‑
seq:落叶松rna
‑
seq:将落叶松针叶和诱导培养的落叶松愈伤组织分别进行转录组测序,利用无参考基因组方法拼装转录本,之后结合蛋白质数据库,对表达转录本进行注释;atac
‑
seq:将诱导培养的落叶松愈伤组织进行atac
‑
seq测序,获得基因组开放染色质序列,组蛋白chip
‑
seq:将诱导培养的落叶松愈伤组织进行h3k27ac chip
‑
seq测序,获得h3k27ac在基因组中的富集区域序列,整合测序数据,通过拼装获得落叶松序列seq id no.2,该序列中包括一个转录本,增强子位于开放染色质区域,与h3k27ac富集相关,可激活远端基因的表达,将其转录本远端具有开放染色质和h3k27ac的序列并扩增(引物如上),最终获得seq id no.1。
11.所述的有活性的落叶松增强子的鉴定方法,包括如下步骤:
12.(1)将增强子dna序列seq id no.1插入mini35s启动gfp载体中,构建lkenh1增强子载体;
13.(2)正对照载体采用camv35s
‑
gfp,mini35s启动gfp载体为负对照;
14.(3)落叶松原生质体的制备与转化;
15.(4)转化后对增强子活性进行荧光验证。
16.进一步地,所述载体的构建方法:使用限制性内切酶saci将mini35s启动gfp载体线性化,后用无缝连接试剂盒将其与增强子序列片段连接,转化至大肠杆菌dh5α中,筛选阳性转化子,得到lkenh1增强子载体。
17.鉴定原理:根据增强子可远距离促进转录的特征,mini35s启动子单独不能启动的报告基因gfp表达,当该载体中连入有功能的增强子后,其可以促进荧光蛋白转录,从而观察到荧光。
18.有益效果:本发明提供了落叶松增强子序列,本质是dna分子,560bp,能够促进转录,同时提供了快捷的鉴定方法。
附图说明
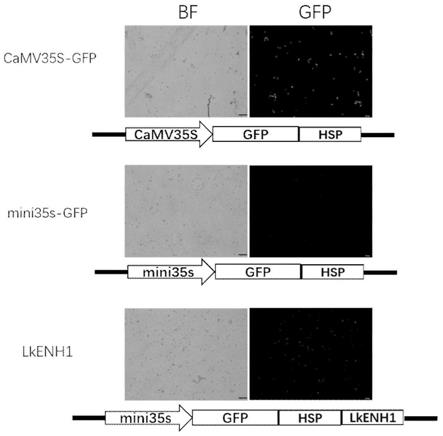
19.图1:camv35s
‑
gfp载体是正对照载体示意图(上),载体结构为camv35s启动gfp表达;mini35s启动gfp载体为负对照载体(中);落叶松增强子lkenh1检测载体示意图和原生质体活性检测结果(下)。
具体实施方式
20.本实施例的增强子获取及鉴定方法如下:
21.1.lkenh1的获取方法
22.(1)落叶松rna
‑
seq:将生长30天的落叶松针叶和诱导培养14天的落叶松愈伤组织分别进行转录组测序,利用无参考基因组方法拼装转录本,之后结合蛋白质数据库,对表达转录本进行注释。atac
‑
seq:将诱导培养14天的落叶松愈伤组织进行atac
‑
seq测序,获得基因组开放染色质序列。组蛋白chip
‑
seq:将诱导培养14天的落叶松愈伤组织进行h3k27ac chip
‑
seq测序,获得h3k27ac在基因组中的富集区域序列。本研究整合测序数据,通过拼装获得一段长片段(2346bp,seq id no.2)的落叶松序列。在这段序列中包括一个转录本,其表达量较高,fpkm值为0.6046。由于增强子位于开放染色质区域,并且与h3k27ac富集高度相关,能够激活远端基因的表达。将其转录本远端具有开放染色质和h3k27ac的序列并扩增(引物如下),最终获得lkenh1(seq id no.1)。
23.(2)设计序列特异性引物,制备如下引物:
24.正向:5
’‑
ggaatatgattaaagataaggaggtgttgatatttccagg
‑3’
;
25.反向:5
’‑
ctgtcaaacactgatagtttaaccctaacttcctcaatga
‑3’
。
26.用以上引物以日本落叶松的基因组dna为模板,扩增得到560bp的扩增产物。经测序,扩增产物的核苷酸序列如seq id no.1的自5’端第一位
‑
560位所示。
27.2.检测
28.将seq id no.1所示的片段插入mini35s启动gfp载体中的saci酶切位点处,构建lkenh1检测载体(如图1所示)。
29.3.落叶松原生质体制备
30.(1)愈伤准备。取无菌培养14天左右生长良好的落叶松愈伤组织。
31.(2)酶解。将愈伤组织用锋利刀片切成细小的块状,并转入盛有10ml酶解液的培养皿中,置于60rpm转速的摇床上25℃黑暗条件下酶解。
32.(3)过滤。将粗酶液通过预先用2ml w5 washing buffer润洗过的孔径40μm的细胞筛进行过滤,去除酶解不充分的杂质。
33.(4)提纯。将过滤过的细胞酶解液转移到两个15ml离心管中,每管6ml细胞酶解液,用装有长针头的注射器吸取16ml 0.55m蔗糖,每管细胞酶解液底部加入8ml 0.55m蔗糖,注
意:加蔗糖时,针头伸入底部,推动注射器,随着液面升高,缓慢上移注射器,动作要轻柔,防止对原生质体细胞造成破坏。1000g离心5min。
34.(5)清洗。取50ml离心管一个,加入10ml washing buffer,置于试管架上。用装有长针头的注射器吸取8ml washing buffer,再将针头伸到上步离心后的中间细胞层,慢慢吸取该层的所有原生质体,然后小心转移至盛有10ml washing buffer的50ml离心管中。轻弹混匀,100g室温离心5min。
35.(6)重复清洗一次。移除上清,沿壁慢慢加入10ml washing buffer,轻弹混匀,100g离心2min。
36.(7)重悬。去掉上清,加入5ml washing buffer,注意沿壁缓慢加入,轻弹混匀,使细胞保持悬浮。
37.(8)计数。吸取100μl细胞用于计数,取10μl细胞置于细胞计数板进行计数,如果细胞数目太多可采用mgg稀释后再进行计数。
38.(9)细胞稀释。根据计数结果取适量细胞悬浮液进行离心,然后用mgg buffer重悬细胞,最终将细胞稀释至1
×
106个/ml,用于原生质体转化。
39.4.落叶松原生质体的转化:
40.(1)质粒的准备。采用质粒小提试剂盒(tiangen,cat#dp
‑
106)提取以下质粒:mini35s
‑
gfp,lkenh1和camv35s
‑
gfp。确保其浓度尽量在500ng/μl以上,整个过程最好为无菌操作。质粒置于
‑
20℃冰箱冻存。使用前以离心机最高转速进行离心10min处理,使杂质沉淀于离心管底部,避免因杂质影响原生质体转化的效率。处理好的质粒用mgg buffer稀释到实验所需质粒浓度,稀释后充分混匀备用。
41.(2)peg介导的转化。将上述准备好的质粒(mini35s
‑
gfp,lkenh1和camv35s
‑
gfp)中加入200μl制备好的原生质体细胞,轻弹混匀。然后,每管加入210
‑
230μl 40%peg(peg加入量与质粒体积相关,确保等体积加入),轻弹混匀,直至细胞均匀悬浮于peg当中,从第一管加入peg开始计时,计时20min。从第一管加入到最后一管加入的时间尽量控制在5min以内。
42.(3)清洗。加入peg反应20min后,每管加入1ml w5 washing buffer,终止反应,轻轻颠倒混匀,250g离心5min。
43.(4)重复清洗一次。用枪轻轻吸掉上清,重新加入800μl washing buffer,轻轻颠倒混匀,150g离心5min,轻轻吸掉上清。
44.(5)细胞重悬与培养。取40mm培养皿加入2ml w5 buffer,再取培养皿中的w5 buffer重悬离心管中的细胞,并全部转移至培养皿中,25℃黑暗培养,两天后在显微镜下观察荧光。
45.5.荧光显微镜观察
46.使用荧光显微镜进行观察。所有的荧光实验至少重复三次。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1