真菌微生物组作为标志物在制备治疗筛查和肺癌诊断中的应用的制作方法
本发明属于微生物组或肺癌技术领域,具体涉及一种真菌微生物组作为标志物在制备治疗筛查和肺癌诊断中的应用。
背景技术:
目前对癌症发生发展的分子基础的研究主要集中于人类基因组序列或结构的改变,但最新研究表明不同癌症类型和特定微生物组之间存在密切关联;然而这种关联的程度及其变化,以及其对癌症诊断、预后和治疗所产生的影响尚不清楚。人体内各个部位有不同的微生物菌群组成,个体间菌群差异也较大,并随着人体健康状态、年龄等动态变化,微生物菌群稳态对于人体健康和免疫状态至关重要,菌群失调可能影响机体的免疫应答状态,造成炎症反应甚至炎症风暴,影响机体正常代谢过程,增加个体对肿瘤或其他疾病的易感性,导致癌症发生,甚至加速癌症进展,缩短生存期。肺脏是与大气环境相连通的器官,具有非常复杂的微生物菌群,从一定程度上讲,相关微生物菌群组成及其动态变化可能与肺癌发生发展存在相关性,或可用于指示人体健康状态,作为肺癌发生发展的诊断评估的指示靶标。肺癌患者的呼吸道微生物群存在一定的相似性,但肺癌患者是否具有特异性的肺部微生物群目前尚未全部阐明。且关于肺癌或肺炎患者微生物菌群的研究较少,迄今仍处于起步阶段,尚未见有报道用于临床或申请的肺癌筛查的真菌菌群谱,开发肺癌特异性生物标志物可为肺癌的预防、筛查和预后提供新的证据。
微生物抗肿瘤治疗可成为肺癌患者常规治疗外的潜在新手段,进一步阐明人体微生物组在肺癌发生发展中的具体作用,或许能为肺癌的发病机制以及诊断、治疗提供新的研究线索,未来需要更多深入的研究从微生物组角度,尤其是真菌微生物以及真菌组与细菌组互作出发,来阐明肺癌相关机制。
从微生物组出发研究肺癌相关机制是一个全新的视角,目前的研究仅为微生物组与肺癌之间相互作用提供了初步的证据,仍有诸多问题亟待解决。
a.菌落结构可能受基因、饮食、药物以及其他外界环境因素的影响,存在明显的个体间差异。尽管吸烟会影响口、咽部等上呼吸道微生物组成,但对下呼吸道基本没有影响。然而关于下呼吸道微生物组与肺癌的研究正处在起步阶段,尚没有明确的结论;
b.微生物组是细菌和真菌互作所形成的动态平衡体系,但是目前的微生物组研究大多集中在细菌,所得结果缺乏实验验证,而且很难全面代表疾病状态下的微生物组客观状态;
c.相较于传统的抗肿瘤治疗手段,微生物治疗已初步崭露头角,但特异性微生物菌落应用于肺癌治疗的相关机制仍需要进一步研究;
d.目前肺癌微生物组学研究样本量均较小,需要多中心合作以获得具有统计学意义的大样本数据;
e.目前的样本收集、dna提取和微生物组分析流程参差不齐,需要建立标准化的样本收集与处理流程,以减少因采样标准差异而造成的实验结果偏倚;
f.需要注意标本类型的异质性(肺肿瘤组织、痰、psb和bal样本等)可影响研究结果;
g.如何优化采样技术并避免临床样本的污染也是当前面临的问题之一。
未来,更多的研究成果将进一步阐明稀少微生物组尤其是真菌与肺癌的关系,这些机理将为肺癌发生和发展机制、微生物标志物早期筛查、精准和个体化治疗方案等方面提供新颖的见解。
技术实现要素:
针对现有技术中的不足,本发明的目的是提供一种真菌微生物组作为标志物在制备治疗筛查和肺癌诊断中的应用,具体涉及一种个体粪便、组织和肺泡灌洗液样本中真菌菌群平衡关系指标的测序方法,即真菌菌群的dna测序获得真菌种类和数量的特征,并以肺癌特异性富集的真菌的数量和比值特征为基础进行肺癌的诊断。此外,通过检测目标样本的序列变异和丰度,可以探究人体微生物的多样性及群落组成差异。
为达到上述目的,本发明的解决方案是:
一种真菌微生物组作为标志物在制备治疗筛查和肺癌诊断中的应用,所述真菌微生物组选自聚多曲霉、白色念珠菌和马拉色菌中的一种以上。
进一步地,真菌微生物组通过提取粪便、组织和肺泡灌洗液中的dna,进行its测序和宏基因组测序。
进一步地,组织包括肺部肿瘤组织和肺部癌旁组织。
进一步地,its测序的过程为:
(1)、抽提粪便、组织和肺泡灌洗液中的dna;
(2)、进行pcr扩增和建库;
(3)、利用琼脂糖凝胶电泳进行检测;
(4)、利用测序仪进行测序。
进一步地,步骤(2)中,pcr扩增时,引物中上游引物序列为seqidno.1,下游引物序列为seqidno.2。
进一步地,宏基因组测序的过程为:
(1)、抽提粪便、组织和肺泡灌洗液中的dna,并利用琼脂糖凝胶电泳进行检测;
(2)、处理基因组dna使其片段化;
(3)、扩增测序dna并进行比对;
其中,组织为上述的肺部肿瘤组织和肺部癌旁组织。
进一步地,真菌微生物组中聚多曲霉富集在肿瘤组织,白色念珠菌富集在肿瘤组织和癌旁组织,马拉色菌富集在肺泡灌洗液。
本发明的真菌微生物组还可以在试剂盒中应用。
由于采用上述方案,本发明的有益效果是:
第一、本发明首次通过分析同一个肺腺癌患者的粪便、组织和肺泡灌洗液样本中真菌菌群的宏基因组dna测序结果获得真菌种类和数量的特征,并以肺癌特异性富集的真菌的数量和比值特征为基础,从而更准确地筛查和辅助诊断肺癌。
第二、本发明的真菌微生物组中聚多曲霉更容易定植在肺癌病人的肿瘤微环境中,马拉色菌在肿瘤病人的bal中含量非常丰富,白色念珠菌主要富集在肿瘤组织和癌旁组织中,在bal中丰度相对较低;因此,上述菌群与肺癌发生发展关系非常密切,有望作为肺癌筛查的重要指标,通过这些靶标菌种的检测实现肺癌的尽早发现和干预,此外,相关容易富集在肿瘤组织中的菌落有望作为生物靶标科学地进行癌症的治疗。
附图说明
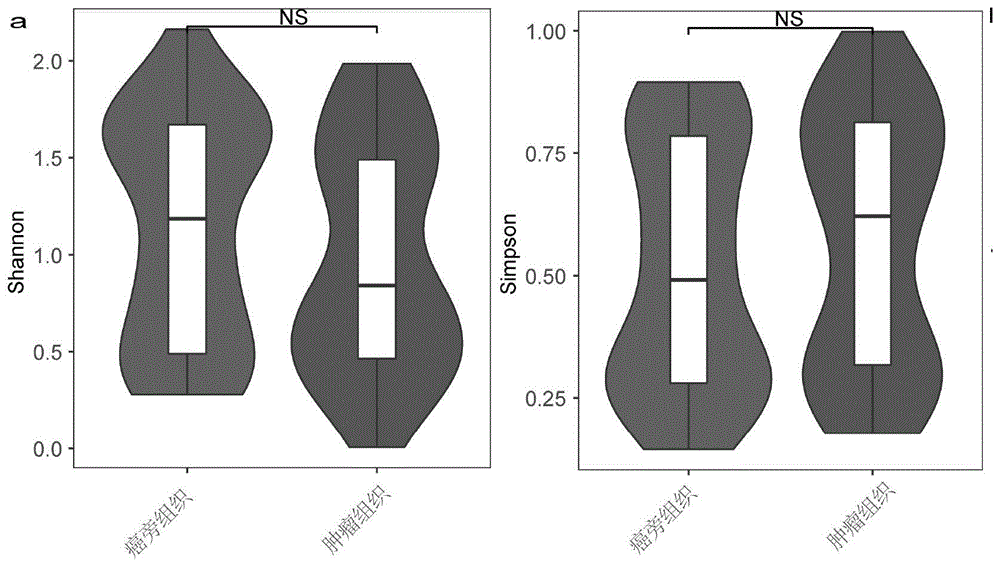
图1为本发明的实施例1中肺腺癌病人肿瘤组织和癌旁组织的its测序分析结果图(1a.癌旁组织和肿瘤组织微生物组的alpha多样性分析,1b.癌旁组织和肿瘤组织微生物组物种丰度分析,1c.癌旁组织和肿瘤组织微生物组beta多样性分析,1d.pg1肿瘤组织、pg2肿瘤组织与癌旁组织的担子菌门/子囊菌门物种多样性比例变化,1e.pg1肿瘤组织微生物组lefse分析,1f.肿瘤组织与癌旁组织微生物组中的真菌互作分析)。
图2为本发明的实施例2中肺腺癌luad患者的真菌菌群的宏基因组测序分析结果图(2a.肺腺癌患者的采样部位及样本微生物组真菌/细菌丰富度比例分析,2b.肺腺癌患者不同部位(肺泡灌洗液、粪便、组织)标本微生物组的多样性和丰度分析,2c.肺腺癌患者不同部位标本微生物组beta多样性分析,2d.肺腺癌患者不同部位(肺泡灌洗液(非肿瘤侧、肿瘤侧)、组织(癌旁、肿瘤)、粪便)标本微生物组丰度分析,2e.肺腺癌患者不同部位标本的微生物组基因通路分析,2f.肺腺癌患者不同部位标本微生物组的真菌-细菌互作分析)。
图3为本发明的实施例2中样品eggnog数据库功能注释结果图。
图4为本发明的实施例3中luad患者的肺部真菌菌群的宏基因组测序结果图(4a.癌旁组织和肿瘤组织中真菌/细菌比例,4b.癌旁组织和肿瘤组织中担子菌/子囊菌比例,4c.肿瘤组织和癌旁组织以及癌和癌旁灌洗液(肿瘤侧肺泡灌洗液、非肿瘤侧肺泡灌洗液)中真菌微生物组的丰度分析,4d.肿瘤组织和癌旁组织以及健康侧和癌侧灌洗液(肿瘤侧肺泡灌洗液、非肿瘤侧肺泡灌洗液)中真菌微生物组的alpha多样性分析,4e.肿瘤组织和癌旁组织以及癌和癌旁灌洗液中真菌微生物组的beta多样性分析,4f.肿瘤组织和癌旁组织以及健康侧和癌侧灌洗液中差异物种分析,4g.肿瘤组织和癌旁组织中富集物种与基因通路的相关性分析)。
图5为本发明的实施例3中肿瘤组织和bal样本中真菌微生物组丰度分析图。
图6为本发明的实施例3中肿瘤组织和癌旁组织中真菌菌群丰度与信号通路相关性分析图。
具体实施方式
为了填补目前肺癌标本中真菌微生物组分析的空白,为肺癌的临床诊断和预防提供新的微生物标志物。另外,近期的研究发现,肠道菌群及其代谢产物形成的多样化和复杂的肠道生态环境深刻地影响肠内稳态和疾病状态。本发明前期分别收集了肺腺癌病人的癌组织(肿瘤组织)和癌旁组织、肺泡灌洗液和粪便标本,通过构建新型真菌微生物组dna提取方法,从组织、粪便和肺泡灌洗液中提取真菌微生物组dna,同时运用its测序和宏基因组进行真菌微生物组分析,目的在鉴定可靠的真菌标志物,促进肺癌的早期筛查和早期诊断;从而降低临床上非小细胞肺癌患者的发病率和死亡率,延长生存时间,提高生活质量,为肺癌的筛查、预防和诊断提供新的思路。
本发明基于对真菌与特定类型癌症之间关联的了解,经过严格的筛选和分类,对微生物组进行深入研究,利用组织、肺泡灌洗液、粪便样本中的微生物dna序列,发现和鉴定能够有效区分癌症组织与正常组织、癌侧肺泡灌洗液与健康侧肺泡灌洗液、癌症病人与炎性患者粪便样本,并对癌症类型和临床分期进行分类。深入分析来自肺癌患者机体的样本能帮助建立肺癌与微生物遗传特性之间的关联。
具体地,
一、样本人群和排除标准
经病理诊断为肺腺癌(luad)或非恶性结节(nmn)的患者。对于luad患者,选择
ⅰa至ⅲa期。排除具有既往癌症史,其他重大全身或呼吸系统疾病史,慢性病毒感染(例如hiv,b型或c型肝炎),手术前细菌感染以及接受免疫抑制治疗的患者(例如化学疗法,口服类固醇等)或排除术前经其他与癌症相关的治疗的患者。
选择ⅰa至ⅲa期肺癌的患者,这些患者年龄超过50岁,需要进行医学上必要的手术治疗。排除经病理诊断为非luad的患者,有既往癌症史、其他重大全身或呼吸系统疾病史、慢性病毒感染(例如hiv,b型或c型肝炎)、在手术前六周内使用细菌感染或使用抗生素以及进行免疫抑制治疗(例如化口服类固醇等)或手术前经其他与癌症相关的治疗的患者。所有受试者都被告知研究的性质。
二、信息和生物样本收集
通过面对面询问收集有关招募患者的基线信息。
手术前将粪便样品收集在无菌容器中。大便立即保持在-20℃,并在24h内在-80℃冷冻。支气管镜检查室的工作人员协助收集了bal样品。支气管镜检查之前,患者通过雾化器进行局部麻醉(利多卡因),然后用咪达唑仑和芬太尼镇静。支气管镜被楔入患者的鼻腔,然后移入肺部。按照标准化规程在肺的两侧进行支气管肺泡灌洗,并使用约30ml的0.9%无菌生理盐水从每位患者中采集10ml的bal。如果患者右上叶有肺肿块,则先在左上叶进行支气管肺泡灌洗,然后再在右上叶进行支气管肺泡灌洗。将bal立即保持在-20℃,并在24h内在-80℃冷冻。
在手术切除后的20min之内将肺组织样本在液氮中速冻,并在24h内于-80℃冷冻。在切除和收集样本时,外科医生和病理学家会聚在手术室中,以确保从肿瘤和远离肿瘤的其他区域(约3-5cm)中正确取样组织,而不会对参与者造成不利影响。
三、dna提取
1.肺组织
将组织样品悬浮在500μl无菌pbs中,并通过涡旋和超声处理进行预处理,然后在56℃下用蛋白酶k(2.5μg/ml;thermofisher)处理过夜。按照制造商的说明(mobiolaboratories),使用qiagenqiampdnastoolminikit(qiagen)从肺组织样品中纯化总微生物基因组dna。使用nanodrop2000分光光度计(thermofisher)对dna的浓度和纯度进行定量,并保存在-20℃下。
2.bal和粪便
根据说明书使用qiagenqiampdnastoolminikit(qiagen)用于bal和粪便样本的dna提取。
四、its测序和宏基因组测序
1.its测序
在真核生物rdna中,18srdna和28srdna转录间隔序列称为its,位于18s和5.8s之间的为its1区,位于5.8s和28s之间的为its2区。18s、5.8s和28s的基因序列在大多数生物中趋于保守,物种间变化小,而转录间隔区its1和its2作为非转录区,在进化过程中承受的自然选择压力较小,能容忍更多的变异,在绝大多数的真核生物中表现出了极为广泛的序列多态性,可用于真菌分类鉴定。
表1its测序引物设计
dna抽提:完成基因组dna抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组dna;
pcr扩增:按指定测序区域,合成带有barcode的特异引物。为保证后续数据分析的准确性及可靠性,需满足两个条件,1)尽可能使用低循环数扩增;2)保证每个样本扩增的循环数一致。随机选取具有代表性的样本进行预实验,确保在最低循环数中使绝大多数样本能够扩增出浓度合适的产物。采用transstartfastpfudnapolymerase(transgenap221-02)在abi
pcr反应体系(20μl)如下:
5×fastpfubuffer............................................4μl
2.5mmdntps.................................................2μl
forwardprimer(5μm).........................................0.8μl
reverseprimer(5μm).........................................0.8μl
fastpfupolymerase..........................................0.4μl
bsa.........................................................0.2μl
templatedna................................................10ng
补ddh2o至...................................................20μl
pcr反应参数:
a.1×(3min,95℃)
b.循环数×(30s,95℃;30s,退火温度为55℃;45s,72℃)
c.10min,72℃降至10℃,至停止。
每个样本做3次重复,将同一样本的pcr产物混合后用2%琼脂糖凝胶电泳检测,使用axyprepdna凝胶回收试剂盒(axygen公司)切胶回收pcr产物,tris-hcl洗脱;2%琼脂糖电泳检测。
荧光定量:参照电泳初步定量结果,将pcr产物用quantifluortm-st蓝色荧光定量系统(promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
miseq文库构建:
1)通过pcr将illumina官方接头序列添加至目标区域外端;
2)使用凝胶回收试剂盒切胶回收pcr产物;
3)tris-hcl缓冲液洗脱,2%琼脂糖电泳检测;
4)氢氧化钠变性,产生单链dna片段。
试剂:truseqtmdnasampleprepkit。
miseq测序:
1)dna片段的一端与引物碱基互补,固定在芯片上;
2)以dna片段为模板,芯片上固定的碱基序列为引物进行pcr合成,在芯片上合成目标待测dna片段;
3)变性、退火后,芯片上dna片段的另一端随机与附近的另外一个引物互补,也被固定住,形成“桥(bridge)”;
4)pcr扩增,产生dna簇;
5)dna扩增子线性化成为单链。
6)加入改造过的dna聚合酶和带有4种荧光标记的dntp,每次循环只合成一个碱基;
7)用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;
8)将“荧光基团”和“终止基团”化学切割,恢复3'端粘性,继续聚合第二个核苷酸;
9)统计每轮收集到的荧光信号结果,获知模板dna片段的序列。
数据分析:数据通过illuminamiseqpe300检测平台获得测序信息,序列数据可以在illumina基因组计算环境basespacesequencehub中安全地传输、分析和存储。对生成的fastq序列文件进行拼接、质控和统计后进行otu聚类及嵌合体过滤,然后对样本进行α-多样性分析、β-多样性分析、物种组成分析、丰度分析、样本间差异分析、相关性分析等。
2.宏基因组测序
样品dna提取:使用qiagenkit完成基因组dna抽提,使用1%琼脂糖凝胶电泳检测抽提的基因组dna。
dna片段化:使用covarism220处理基因组dna,片段化长度约300bp。
构建pe文库:使用illuminakapahyper文库构建试剂盒,连接“y”字形接头;使用磁珠筛选去除接头自连片段;利用pcr扩增进行文库模板的富集;氢氧化钠变性,产生单链dna片段。
桥式pcr:dna片段的一端与引物碱基互补,固定在芯片上;另一端随机与附近的另外一个引物互补,也被固定住,形成“桥”;使用cbottruseqpeclusterkitv3-cbot-hs进行pcr扩增,产生dna簇;dna扩增子线性化成为单链。
illuminahiseq测序:使用truseqsbskitv3-hs(200cycles)加入改造过的dna聚合酶和带有4种荧光标记的dntp,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3'端粘性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板dna片段的序列。高通量测序得到的原始图像数据文件,经图像处理后的碱基识别分析转化为原始测序序列。
数据分析与质控:使用trimmomatic(version0.36,bolger,a.m.,2014)去除接头;设置4bp窗口,碱基平均质量值阈值15,切掉低于15的窗口;分别从reads的起始端及末端开始切除质量值低于20的碱基;去除长度低于30的序列(参数:illuminaclip:truseq3-se:2:30:12,slidingwindow:4:15,minlen:30,leading:20,trailing:20)。如果样品来源宿主(人:版本号grch38.91或动物的粪便),且该宿主本身的基因组已被发表,则通过bowtie2软件(version2.3.4.1,默认参数)将reads比对宿主dna序列,并去除比对相似性高的污染reads。
随后对样本进行物种注释分析、基于物种的α-多样性分析、基于物种的β-多样性分析、基于物种的组间差异分析和相关性分析等。
实施例1:
肺腺癌病人的癌组织与癌旁组织的its测序结果:
为解析肺腺癌病人的真菌微生物组结构,本实施例首先对肺腺癌病人来源的癌组织(肿瘤组织)与癌旁组织进行测序,结果显示,癌组织与癌旁组织的香农指数并无显著差异(图1a),并且癌旁组织的丰富度要显著高于癌组织(图1b)。主成分分析结果进一步验证癌组织与癌旁组织含有明显不同的真菌菌群(图1c),其中癌旁组织的担子菌/子囊菌比率与pg1肺癌组织相似,但是比pg2肺癌组织显著减少,且该比率在pg1和pg2中与癌旁组织相比上升趋势明显(图1d)。此外,pg1肺癌组织中常富集曲霉菌属(图1e)。而且,曲霉菌属(aspergillus)在癌组织中与菌属(亚隔孢壳属didymella、镰刀菌fusarium、枝孢菌cladosporium、青霉菌penicillium)等呈现负相关性(图1f),但是在癌旁组织中却呈现正相关性,该结果揭示曲霉菌属在癌组织中与其他菌群呈竞争关系,具有竞争性的优势,因此曲霉菌属有可能在肺癌进展过程中发挥了重要作用。
实施例2:
为了深入分析肺癌患者不同部位的真菌微生物组结构并鉴定其中特异性的曲霉菌种,收集了20个未经处理的肺腺癌病人的癌组织、癌旁组织、肺泡灌洗液和粪便标本,通过提取微生物组dna并进行宏基因组测序(图2a),发现肺腺癌病人的肺部组织和bal比肠道的真菌微生物组的香农指数和菌群丰度更高(图2b)。然后验证了肺部和肠道真菌微生物组的相关性,pca结果分析显示肺部和肠道菌群独立聚类,具有明显的特征(图2c)。与肠道相比,进一步观察到肺中真菌的α多样性降低和不同比例的群落组成(图2c-2d)。耶氏肺孢子菌(pneumocystisjiroveci)在肿瘤组织和癌旁组织、肿瘤侧bal和非肿瘤侧bal中广泛存在;限制性马拉色菌(malasseziarestricta)富集在bal中,其中在肿瘤侧bal中更丰富,在肿瘤组织中相对较少;白色念珠菌(candidaalbicans)主要富集在肿瘤组织和癌旁组织中,在bal中富集度较低;聚多曲霉(aspergillussydowii)主要富集在肺癌病人的肿瘤组织和肿瘤侧bal中,在癌旁和非肿瘤侧bal中富集度较低。这表明真菌微生物群的改变与肺部的肿瘤发生发展存在密切联系,肿瘤的发生导致微生物菌群比例和组成发生改变,肿瘤微环境可能更适合某些菌群(例如聚多曲霉)的定植和生长,而马拉色菌等其他菌在肿瘤病人中占比增高,但更容易定植和富集在bal和癌旁组织中。每个病人不同部位的样品的eggnog模块的组成和比例也根据其在人体中的不同位置(即肺腺癌患者不同部位单个病例的相对丰度分析)和特征而有所不同(图3)。为进一步阐明不同部位主要基因功能和信号通路的差异,发现与溶酶体,核糖体和rna降解有关的途径在肺组织中显著丰富,而与脂肪酸生物合成,脂肪酸代谢,甲烷代谢等有关的途径富含肠道微生物组(图2e)。此外,在细菌和真菌界之间,这些位点之间显示出不同的相互作用,在肠道菌群中呈正相关的真菌和细菌,在肺组织或bal中则可能呈负相关关系(图2f)。根据以上结果,发现局部微环境决定了特定的微生物群,而肺组织则具有相对独立的微生物环境。
实施例3:
为了研究肺部不同位置真菌菌群是否存在差异,对来自luad患者的肿瘤组织、癌旁组织及两侧bal(即肿瘤侧肺泡灌洗液、非肿瘤侧肺泡灌洗液)的微生物群进行了水平分析,即肺腺癌患者组织和灌洗液中的真菌微生物组结构变化。如图4a所示,真菌/细菌比例在肿瘤组织中比肿瘤侧bal中更高,即真菌在肿瘤组织中比在bal中富集程度更高。在bal和肿瘤组织中,真菌菌群均以子囊菌和担子菌菌为主(图5)。此外,bal中的担子菌/子囊菌比例要比组织中的高(图4b)。α多样性分析显示,病人肺组织中bal和肺组织之间真菌菌群香农指数和丰富度存在显着差异,非肿瘤侧bal和肿瘤侧bal之间也存在显著差异(图4c-4d),pcoa证实了luad患者的肿瘤组织和bal中的真菌菌群存在显著区别(图4e)。与癌旁组织中的其他物种相比,聚多曲霉在肿瘤组织和肿瘤侧bal中显著增加,说明该菌更容易富集在肿瘤微环境中;黄孢原毛平革菌相对丰度也有所增加;马拉色菌更多地富集在bal中,在肿瘤组织内丰富度相对较低;而白色念珠菌与之相反,主要富集在肿瘤组织和癌旁组织中,bal中丰富度相对较低,这可能与白色念珠菌与宿主共生能力和对细胞侵袭性较强有关;根内球囊霉分布与白色念珠菌较为类似,在肿瘤组织或癌旁组织中相对丰度较高;耶氏肺孢子菌在肿瘤组织或bal中含量都非常丰富(图4f)。与cgmp-pkg信号通路相关的通路在肿瘤组织中显著富集,而与f氨基糖和核苷酸糖代谢相关的通路在肿瘤邻近组织微生物组中富集并与聚多曲霉呈正相关(图4g和图6)。
故本发明首次通过肺腺癌患者的粪便、组织和肺泡灌洗液样本中真菌菌群的dna测序结果获得真菌种类和数量的特征,并以肺癌特异性富集的真菌的数量和比值特征为基础,从而更准确地筛查和辅助诊断肺癌。聚多曲霉更容易定植在肺癌病人的肿瘤微环境中,马拉色菌在肿瘤病人的bal中含量非常丰富,白色念珠菌主要富集在肿瘤组织和癌旁组织中,在bal中丰度相对较低;此外,发现与溶酶体、核糖体和rna降解有关的途径在肺组织中显著丰富,而与脂肪酸生物合成,脂肪酸代谢,甲烷代谢等有关的途径在肠道微生物组丰富;在肺部肿瘤组织中cgmp-pkg信号通路表达丰富,氨基糖和核糖代谢途径表达降低,而在肺部癌旁组织中两者趋势则相反。上述菌群和信号通路表达情况(尤其是cgmp-pkg信号、氨基糖和核苷酸糖等信号通路)与肺癌的发生发展关系非常密切,有望作为肺癌筛查的重要指标,通过这些靶标菌种的检测实现疾病的尽早发现和尽早干预。此外,相关容易富集在肿瘤组织中的菌落有望作为生物靶标科学地进行癌症的治疗。
另外,本发明的真菌微生物组的应用场景如下:
本发明的真菌微生物组在患者体内具有异质性,能够对特定的疗法产生不同反应。这些不同使我们能鉴定出很多重要的生物标志物,进而对不同类型的病人施以精准干预手段。
1.通过检测人体共生微生物,可以预测不同患者对免疫检查点阻断癌症疗法的反应性。
2.微生物不仅可作为免疫治疗的预测指标,还有望作为调控免疫反应的靶点。
3.用微生物组图谱构建一个可用于预测健康状态的指数。
4.可以将粪便菌群中生物标志物筛查和临床检测指标相结合,减少非入侵性测试,或可减少结直肠癌检查与治疗中的副作用、提高治疗效果。
上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
序列表
<110>上海交通大学医学院
<120>真菌微生物组作为标志物在制备治疗筛查和肺癌诊断中的应用
<141>2020-12-15
<160>2
<170>siposequencelisting1.0
<210>1
<211>60
<212>dna
<213>人工序列()
<400>1
acacaccgcccgtcgctactgcatcgatgaagaacgcagcgtccctgccctttgtacaca60
<210>2
<211>40
<212>dna
<213>人工序列()
<400>2
tcctccgcttattgatatgctttcgctgcgttcttcatcg40
- 还没有人留言评论。精彩留言会获得点赞!