巯基乙烯化合物的制备方法与流程
1.本发明属于有机合成领域,具体涉及巯基乙烯化合物的制备方法。
背景技术:
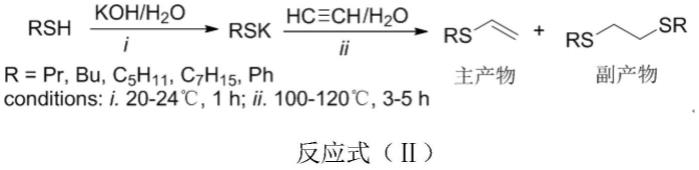
2.巯基乙烯化合物广泛存于在许多天然产物中,是许多具有生物活性的化合物中普遍存在的结构单元。同时也在有机合成中扮演重要的角色,在有机合成中是一个十分重要的合成子。乙烯基硫醚和其衍生物还可以被用作制备作有机光电材料,例如制备有机二阶非线性光学材料。在20世纪初,reppe研究了碱参与下醇与乙炔的亲核加成反应,进一步研究发现氮亲核试剂和硫亲核试剂也可以发生反应。(见反应式(ⅰ))
[0003][0004]
但该类反应需要使用当量的碱,且反应条件苛刻,通常需要100~160℃,以及10~15个大气压的乙炔。并且在生成巯基乙烯产物的同时,二硫化合物也会作为副产物少量生成(russian chemical bulletin,international edition,vol.62,no.2,pp.438-440,february,2013)(见反应式(ⅱ))。
[0005][0006]
因此至目前为止,缺少一种更温和条件下制备巯基乙烯化合物的方法。
技术实现要素:
[0007]
本发明的目的是为了克服现有技术的不足,提供一种巯基乙烯化合物的制备方法,该方法可以在更低的温度和乙炔气氛下进行。
[0008]
本发明上述目的通过如下技术方案予以实现:
[0009]
包括将硫醇化合物r-sh与乙炔在光催化剂、溶剂存在下,经光照反应生成所述巯基乙烯化合物;
[0010]
所述r为被氨基、硝基、羟基、2,4-二烷基、2,4,6-三烷基或全氟取代的苯基,或者是被一个或多个氨基或羟基取代的c
1-6
烷基;所述氨基可以保护基或没有保护基;
[0011]
所述被氨基或羟基取代的c
1-6
烷基还可以带有任意数量的取代基,所述取代基独立选自直链或支链c
1~6
烷基、卤素、直链或支链c
1~6
烷氧基、氰基、氨基、硝基、羟基、酯基、羰基、羧基、c
3~10
环烷基、c
3~10
杂环基、c
6~14
的芳基、c
5~12
的杂芳基中的一个或多个。反应方程
式如反应式(ⅲ)所示:
[0012][0013]
本发明涉及一个竞争反应,而发明人发现,在本发明所述的r下,对硫原子(反应位点)产生较大的位阻,以巯基乙烯化合物为主产物。
[0014]
更优选地,所述r为被氨基、硝基、羟基、2,4-二烷基、2,4,6-三烷基或全氟取代的苯基,或者是被一个或多个氨基或羟基取代的c
1-4
烷基。
[0015]
更优选地,所述r为被氨基、硝基、羟基、2,4-二烷基、2,4,6-三烷基或全氟取代的苯基,或者是被一个或多个氨基或羟基取代的c
2-3
烷基。
[0016]
更优选地,所述取代基独立选自直链或支链c
1~4
烷基、直链或支链c
1~4
烷氧基、氨基、羟基、酯基或羰基中的一个或多个。
[0017]
所述保护基指为使氨基受到保护不参与反应,而在氨基上引入的基团,引入后可方便脱去。常见的保护基包括但不限于苄氧羰基、叔丁氧羰基、笏甲氧羰基、烯丙氧羰基、三甲基硅乙氧羰基、甲氧/乙氧羰基、邻苯二甲酰基、对甲苯磺酰基、三氟乙酰基、三苯甲基、2,4-二甲氧基苄基、对甲氧基苄基、苄基等等。
[0018]
优选地,所述保护基选自叔丁氧羰基、苄氧羰基、笏甲氧羰基、烯丙氧羰基、对甲苯磺酰基、三氟乙酰基、乙酰基、对甲氧基苄基或苄基。
[0019]
更优选地,所述保护基选自叔丁氧羰基或三氟乙酰基。
[0020]
取代基定义和一般术语
[0021]
本发明使用的术语“芳基”,表示含有6-14个环原子,或6-10个环原子的单环、双环和三环的碳环体系,其中,至少
ー
个环体系是芳香族的,其中每一个环体系包含3-7个原子组成的环,且有一个或多个附着点与分子的其余部分相连。术语“芳基”可以和术语“芳香环”交换使用。芳基的实例可以包括苯基,茚基,萘基、菲和蔥等等。所述芳基可以独立任选地被一个或多个本发明所描述的取代基所取代。
[0022]
本发明使用的术语“烷基”,表示含有1至10个碳原子,饱和的直链、支链或环状的一价烃基基团,其中,所述烷基基团可以任选地被一个或多个本发明描述的第一取代基所取代。在一实施方案中,烷基基团含有1-6个碳原子:在又
ー
实施方案中,烷基基团含有1-4个碳原子;还在一实施方案中,烷基基团含有2-3个碳原子。所述的烷基基团可以独立地未被取代或被一个或多个本发明所描述的第一其它取代基所取代。
[0023]
术语“卤素”指氟、氯、溴、碘。
[0024]
术语“烷氧基”表示烷基基团通过氧原子与分子其余部分相连,其中烷基基团具有如本发明所述的含义。所述的烷氧基基团可以独立地未被取代或被一个或多个本发明所描述的第一其它取代基所取代。实施例包括但不限于,甲氧基、乙氧基等等。
[0025]
术语“环烷基”表示以碳原子作为环原子的,由3-10个碳原子组成的,单价或多价的饱和单环,双环或三环体系。在部分实施方案中,环烷基由3-10个碳原子组成;在另一实施方案中,环烷基由3-8个碳原子组成;在部分实施方案中,环烷基由3-6个碳原子组成。所述环烷基基团可以独立地未被取代或被一个或多个本发明所描述的第一其它取代基所取
代。这样的实例包括,但并不限于,环丙基,环丁基,环戊基,环己基,环庚基,环辛基,环壬基,环癸基,环十一烷基,环十二烷基,等等。
[0026]
术语“杂环基”指包含3-10个环原子的饱和或部分不饱和的单环、双环或三环,其中至少
ー
个环原子选自氮、硫和氧原子。杂环基-ch
2-基团可以任选地被-c(=0)-替代,环的硫原子可以任选地被氧化成s-氧化物,环的氮原子可以任选地被氧化成n-氧化合物。杂环基的实例包括但不限于:环氧乙烷基,氮杂环丁基,氧杂环丁基,硫杂环丁基,吡咯烷基,2-吡咯啉基,3-吡咯啉基,吡唑烷基,咪唑啉基,咪唑烷基,四氢呋喃基,二氢呋喃基,四氢噻吩基,二氢噻吩基,1,3-二氧环戊基,二硫环戊基,四氢吡喃基,二氢吡喃基,2h-吡喃基,4h-吡喃基,四氢噻喃基,哌啶基,吗啉基,硫代吗啉基等等。所述的杂环基可以任选地被一个或多个本发明所描述的第一其它取代基所取代。
[0027]
术语“杂芳基”表示含有5-12个环原子,或5-10个环原子,或5-6个环原子的单环、双环和三环体系,其中至少
ー
个环体系是芳香族的,且至少
ー
个环体系包含一个或多个杂原子,其中每一个环体系包含5-7个原子组成的环,且有一个或多个附着点与分子其余部分相连。术语“杂芳基”可以与术语“杂芳环”或“杂芳族化合物”交换使用。杂芳基基团的实例包括,但并不限于,2-呋喃基,3-呋喃基,n-咪唑基,2-咪唑基4-咪唑基,5-咪唑基,3-异恶唑基,4-异恶唑基,5-异恶唑基,2-恶唑基,4-恶唑基,5-恶唑基,n-吡咯基,2-吡咯基,3-吡咯基,2-吡啶基,3-吡啶基,4-吡啶基,2-嘧啶基,4-嘧啶基,5-嘧啶基,等等。
[0028]
术语“杂原子”指氧、硫、氮、磷和硅,包括氮、硫和磷的任何氧化态的形式;伯、仲、叔胺和季铵盐的形式;或者杂环中氮原子上的氢被取代的形式。
[0029]
术语“酯基”指-c(=o)o-。所述的酯基基团可以与本发明所描述的取代基相连,形成对应的酯基取代基。酯基基团的实例包括,但并不限于,甲酯,乙酯,丙酯,丁酯,等等。
[0030]
更具体地,作为发明可以制得的巯基乙烯化合物,部分列举如下:
[0031]
[0032]
所述光催化剂可以是常见的有机的或者无机的光催化剂。优选地,所述有机光催化剂为金属铱联吡啶类催化剂、金属钌联吡啶类催化剂、有机染料催化剂、吖啶盐类催化剂、咔唑类催化剂或吡喃类催化剂中的一种或几种。
[0033]
作为具体可以选择的示例,常见的金属铱联吡啶类催化剂包括但不限于[ir(ppy)2(dtbbpy)]pf6、{ir[df(cf3)ppy]2bpy}pf6、{ir[df(cf3)ppy]2(dtbbpy)}pf6、{ir[df(cf3)ppy]2(phen)}pf6、{ir[dfcf3ppy]2(bpy)}pf6、{ir[dfppy]2(bpy)}pf6、{ir[dfppy]2(dtbbpy)}pf6、{ir[p-fppy]2(bpy)}pf6、{ir[p-fppy]2(dtbpy)}pf6、{ir[4-t-bu-phenyl-4-t-bu-py]2(dtbpy)}pf6、{ir[df(me)ppy]2(dtbbpy)}pf6、ir(ppy)2(dtbbpy)pf6、{ir[df(f)ppy]2(dcf3)}pf6、[ir(ppy)2(bpy)]pf6、ir[p-f(me)ppy]2(dtbbpy)pf6、{ir[d(
t-bu)(cf3)ppy]2(dtbbpy)}cl、{ir[d(
t-bu)(cf3)ppy]2(dtbbpy)}pf6、fac-ir(ppy)3、fac-ir(dfppy)3、fac-ir[d-f(p-t-bu)ppy]3、fac-ir(p-cf3ppy)3、fac-ir(p-fppy)3、fac-ir(p-t-bu-ppy)3、fac-ir(d-fppy)3、fac-ir(3-t-bu-ppy)3、fac-ir[(3-t-bu-phenyl)-4-t-bu-py)]3。
[0034]
更优选地,所述金属铱联吡啶类催化剂更优选为[ir(ppy)2(dtbbpy)]pf6、、{ir[df(cf3)ppy]2(dtbbpy)}pf6、{ir[p-fppy]2(bpy)}pf6、{ir[d(
t-bu)(cf3)ppy]2(dtbbpy)}cl、{ir[d(
t-bu)(cf3)ppy]2(dtbbpy)}pf6、fac-ir(ppy)3、fac-ir(p-cf3ppy)3、fac-ir(p-fppy)3、fac-ir(3-t-bu-ppy)3。
[0035]
作为具体可以选择的示例,常见的金属钌联吡啶类催化剂包括但不限于ru(bp)3c
12
、ru(bpy)3(bf4)2、ru(bpy)3(pf6)2、ru(bpz)3(pf6)2、ru(bpm)3c
12
、ru(bpm)3(pf6)2、ru(phen)3(pf6)2、ru(bpy)2(5-amino-phen)(pf6)2、ru(phen)(bpy)2(pf6)2、ru(bpy)2(phen-5-nh2)(pf6)2、ru(bpz)3(cl)2。
[0036]
更优选地,所述金属钌联吡啶类催化剂更优选为ru(bpy)3(bf4)2、ru(bpy)3(pf6)2、ru(bpm)3(pf6)2、ru(phen)(bpy)2(pf6)2、ru(bpz)3(cl)2。
[0037]
作为具体可以选择的示例,常见的有机染料催化剂包括但不限于荧光素、四碘荧光素、曙红y(eosin y)、曙红b(eosin b)、亚甲基蓝、玫瑰红、偶氮宝石红、罗丹明6g、溶剂红43、亚甲兰。
[0038]
更优选地,所述有机染料催化剂更优选为四碘荧光素、曙红y(eosin y)、曙红b(eosin b)、亚甲基蓝、罗丹明6g。
[0039]
作为具体可以选择的示例,常见的吖啶盐类催化剂包括但不限于10-(3-磺丙基)-n-对甲苯磺酰基-n-(3-羧丙基)吖啶-9-甲酰胺、9-均三甲苯基-10-苯基吖啶四氟硼酸盐、9-均三甲苯基-10-苯基吖啶盐酸盐、9-均三甲苯基-10-苯基吖啶高氯酸盐、9-均三甲苯基-2,7-二甲氧基-10-苯基吖啶四氟硼酸盐、9-均三甲苯基-3,6-二甲氧基-10-苯基吖啶四氰硼酸盐、9-均三甲苯基-1,3,6,8-四甲氧基-10-苯基吖啶四氟硼酸盐、9-均三甲苯基-2,7-二甲基-10-苯基吖啶-10-四氯硼酸盐、9-均三甲苯基-10-苯基吖啶六氯酸盐、9-均三甲苯基-10-甲基吖啶四氟硼酸盐、9-均三甲苯基-2,7,10-三甲基吖啶-10-四氟硼酸盐、9-均三甲苯基-2,7,10-三甲基吖啶高氯酸盐、9-均三甲苯基-3,6-二叔丁基-10-甲基吖啶-10-四氟硼酸盐、9-均三甲苯基-3,6,-二叔丁基-10-苯基吖啶-10-四氯硼酸盐。
[0040]
更优选地,所述吖啶盐类催化剂更优选为9-均三甲苯基-10-苯基吖啶四氟硼酸盐、9-均三甲苯基-10-苯基吖啶高氯酸盐、9-均三甲苯基-10-甲基吖啶四氟硼酸盐、9-均三甲苯基-3,6,-二叔丁基-10-苯基吖啶-10-四氯硼酸盐。
[0041]
作为具体可以选择的示例,常见的咔唑类催化剂包括但不限于4czipn、4czpn-bu、4czpn-ph、4cztpn-bu、4cztpn-ph、4czpn、4cztpn、2czpn。
[0042]
更优选地,所述咔唑类催化剂更优选为4czipn、4czpn-ph、4cztpn-bu、4czpn、4cztpn。
[0043]
作为具体可以选择的示例,常见的吡喃类催化剂包括但不限于2,4,6-三苯基吡喃四氟化硼盐、氯化2,4,6-三苯基吡喃嗡。
[0044]
优选地,所述光照的光源为自然光源或人工光源。
[0045]
优选地,所述光照的光为波长范围在200~800nm的单色光或混合光。
[0046]
当所述光为单色光时,更优选为紫光、蓝光、青光、绿光、黄光、橙光或红光。进一步地,更优选为紫光或蓝光。
[0047]
优选地,在反应过程中还加入碱性添加剂。
[0048]
优选地,所述碱性添加剂为有机碱或无机碱。
[0049]
更优选地,所述碱性添加剂更优选为叔丁醇钠(c4h9ona)、叔丁醇钾(c4h9ok)、叔丁醇锂(c4h9oli)、三乙胺(tea)、n,n-二异丙基乙胺(dipea)、乙醇钾(c2h5ok)、吡啶(pyridine)、二氮杂双环(dbu)、四甲基胍(tmg)、碳酸氢钠(nahco3)、碳酸钾(k2co3)、碳酸铯(cs2co3)、氢氧化钾(koh)、碳酸氢钾(khco3)、磷酸钾(k3po4)或磷酸钠(na3po4)中的一种或多种。
[0050]
更优选地,所述碱性添加剂优选为三乙胺、n,n-二异丙基乙胺、吡啶或碳酸铯。
[0051]
优选地,本发明中,硫醇化合物、光催化剂、碱性添加剂的摩尔比优选为1:0.0001~0.5:0~2。
[0052]
更优选地,本发明中,硫醇化合物、光催化剂、碱性添加剂的摩尔比优选为1:0.001~0.5:0.1~1。
[0053]
更优选地,本发明中,硫醇化合物、光催化剂、碱性添加剂的摩尔比优选为1:0.005~0.2:0.25~1。
[0054]
本发明中,乙炔可以由乙炔压力容器提供或者由碳化钙现场生成。上述压力容器指用于收集、储存的容器,如气球、气囊、球胆、气体采样袋、气罐、钢瓶等。
[0055]
当乙炔采用由碳化钙现场生成时,可以根据碳化钙的添加量来计算乙炔的用量,
[0056]
优选地,此时,所述硫醇化合物、乙炔、光催化剂、碱性添加剂的摩尔比优选为1:0.5~100:0.0001~0.5:0~2。
[0057]
更优选地,所述硫醇化合物、乙炔、光催化剂、碱性添加剂的摩尔比更优选为1:1~10:0.001~0.5:0.1~1。
[0058]
更优选地,,所述硫醇化合物、乙炔、光催化剂、碱性添加剂的摩尔比更优选为1:3~10:0.005~0.2:0.25~1。
[0059]
当乙炔由压力容器提供时,优选所述压力容器中乙炔的压力范围为1~15atm。
[0060]
更优选地,优选所述压力容器中乙炔的压力范围更优选为1~5atm。
[0061]
更优选地,优选所述压力容器中乙炔的压力范围更优选为1~3atm。
[0062]
优选地,所述反应的温度优选为10~60℃。更优选地,所述反应的温度更优选为20~30℃。
[0063]
优选地,所述反应的时间为0.5~48小时。更优选地,所述反应的时间更优选为2~
132.32,-132.90,-132.92,-132.95,-149.59,-149.72,-149.76,-149.81,-159.74,-159.75,-159.87,-159.90,-159.91,-159.95,-160.04,-160.08;
[0090]
实施例6
[0091][0092]
以2,6-二甲基苯硫酚代替实施例1中的4-氨基苯硫酚,其余过程与实施例1相同,经柱层析分离(洗脱剂石油醚/乙酸乙酯=50/1)得2,6-二甲基苯基乙烯基硫醚(ii-6)(59mg,72%)。
[0093]1h nmr(400mhz,cdcl3)δ7.15(dt,j=14.9,7.4hz,3h),6.27(dd,j=16.3,9.8hz,1h),5.04(d,j=9.8hz,1h),4.57(d,j=16.4hz,1h),2.45(s,6h);
13
c nmr(101mhz,cdcl3)δ143.47,131.32,129.15,128.30,109.17,21.54;
[0094]
实施例7
[0095][0096]
以2,4,6-三异丙基苯硫酚代替实施例1中的4-氨基苯硫酚,其余过程与实施例1相同,经柱层析分离(洗脱剂石油醚/乙酸乙酯=120/1)得2,4,6-三异丙基苯基乙烯基硫醚(ii-7)(83mg,63%)。
[0097]1h nmr(400mhz,cdcl3)δ7.07(s,2h),6.35(dd,j=16.3,9.8hz,1h),5.04(d,j=9.8hz,1h),4.58(d,j=16.3hz,1h),3.65(dq,j=13.7,6.9hz,2h),3.10
–
2.79(m,1h),1.26(t,j=5.8hz,6h),1.21(d,j=6.9hz,12h);
13
c nmr(101mhz,cdcl3)δ153.25,150.49,134.07,123.96,121.98,109.38,34.35,31.61,31.58,29.74,24.36,23.94;
[0098]
实施例8
[0099][0100]
以4-羟基苯硫酚代替实施例1中的4-氨基苯硫酚,其余过程与实施例1相同,经柱层析分离(洗脱剂石油醚/乙酸乙酯=5/1)得4-乙烯巯基苯酚(ii-8)(28mg,37%)。
[0101]1h nmr(400mhz,cdcl3)δ7.35(d,j=7.8hz,1h),6.85(d,j=7.8hz,1h),6.49(dd,j=16.5,9.7hz,1h),5.26(d,j=9.7hz,1h),5.14(d,j=16.6hz,1h);
13
c nmr(101mhz,cdcl3)δ155.68,134.36,133.57,123.76,116.36,112.81,100.00;
[0102]
实施例9
[0103][0104]
以半胱氨酸甲酯代替实施例1中的4-氨基苯硫酚,其余过程与实施例1相同,经柱层析分离(洗脱剂石油醚/乙酸乙酯=90/1)得浅黄液体n-(叔丁氧羰基)-s-乙烯基半胱氨酸甲酯(ii-9)(83mg,61%)。
[0105]1h nmr(400mhz,cdcl3)δ6.29(dd,j=16.7,9.9hz,1h),5.35(s,1h),5.25(dd,j=13.2,7.2hz,2h),4.59(d,j=19.4hz,1h),3.77(s,3h),3.23
–
3.09(m,2h),1.46(s,9h);
13
c nmr(126mhz,cdcl3)δ170.05,167.40,154.10,130.62,112.16,84.49,78.89,51.17,33.67,31.78,27.28;
[0106]
实施例10
[0107][0108]
以半胱氨酸乙酯代替实施例1中的4-氨基苯硫酚,其余过程与实施例1相同,经柱层析分离(洗脱剂石油醚/乙酸乙酯=90/1)得浅黄液体n-(叔丁氧羰基)-s-乙烯基半胱氨酸乙酯(ii-10)(90mg,66%)。
[0109]1h nmr(400mhz,cdcl3)δ6.28(dd,j=16.6,10.3hz,1h),5.22(t,j=11.9hz,2h),4.55(s,1h),4.20(q,j=6.6hz,2h),3.14(dt,j=13.3,9.9hz,2h),1.44(s,9h),1.28(t,j=7.1hz,3h);
13
c nmr(101mhz,cdcl3)δ170.47,155.03,131.77,112.92,80.06,61.69,53.40,34.59,28.26,14.05;
[0110]
实施例11
[0111][0112]
以(2,2,2-三氟乙酰基)半胱氨酸甲酯代替实施例1中的4-氨基苯硫酚,其余过程与实施例1相同,经柱层析分离(洗脱剂石油醚/乙酸乙酯=90/1)得n-(2,2,2-三氟乙酰基)-s-乙烯基半胱氨酸甲酯(ii-11)(63mg,49%)。
[0113]1h nmr(400mhz,cdcl3)δ7.18(s,1h),6.23(dd,j=16.6,9.8hz,1h),5.29(dd,j=13.2,8.1hz,2h),4.97
–
4.83(m,1h),3.82(s,3h),3.26(qd,j=14.5,4.6hz,2h);
13
c nmr(101mhz,cdcl3)δ169.25,(157.45,157.07,156.69,156.31),156.88,(q,j=152hz,2j
cf
)130.85,119.45,114.57,(119.80,116.94,114.08,111.22),115.51(q,j=1140hz,1j
cf
),(53.17,53.14),(d,j=12hz,3j
cf
)52.60,33.38;
[0114]
实施例12
[0115][0116]
以叔丁基(2-巯基乙基)氨基甲酸酯代替实施例1中的4-氨基苯硫酚,其余过程与实施例1相同,经柱层析分离(洗脱剂石油醚/乙酸乙酯=5/1)得叔丁基(2-(乙烯基硫代)乙基)氨基甲酸酯(ii-12)(16mg,16%)。
[0117]
1h nmr(400mhz,cdcl3)δ6.30(dd,j=16.7,10.1,2.2hz,1h),5.27
–
5.20(m,2h),4.99(s,1h),3.34(d,j=4.1hz,2h),2.83(d,j=6.2hz,2h),1.43(s,9h);13cnmr(101mhz,cdcl3)δ155.75,131.33,112.06,79.47,39.71,31.71,28.37;
[0118]
实施例13
[0119][0120]
以3-巯基丙烷-1,2-二醇代替实施例1中的4-氨基苯硫酚,其余过程与实施例1相同,经柱层析分离(洗脱剂石油醚/乙酸乙酯=3/1)得3-(乙烯基硫基)丙烷-1,2-二醇(ii-13)(13mg,20%)。
[0121]1h nmr(400mhz,cdcl3)δ6.35(dd,j=16.7,10.0hz,1h),5.36
–
5.12(m,2h),3.98
–
3.86(m,1h),3.78(dd,j=11.3,2.6hz,1h),3.61(dd,j=11.2,6.1hz,1h),3.12(s,1h),2.86(ddd,j=21.4,13.8,6.3hz,2h),2.70(s,1h);
13
c nmr(101mhz,cdcl3)δ131.55,112.65,70.47,65.18,35.04,32.94;
[0122]
实施例14
[0123]
往25ml干燥的三口瓶中加入磁力搅拌子、催化剂{ir[d(t-bu)(cf3)ppy]2(dtbbpy)}cl(2.7mg,0.0025mmol)和4-氨基苯硫酚(63mg,0.5mmol,1.0eq.)。用氮气置换容器内气体三次。加入碳化钙(1.5mmol,96mg,1.5eq.)、四氢呋喃(5ml)、n,n-二异丙基乙胺(16mg,0.125mmol,0.25eq.)和水(0.5ml)。密封反应在420~430nm光照下25℃反应24小时。反应结束后加入水(5ml),乙酸乙酯(10ml*3)萃取。有机相经饱和食盐水洗,硫酸钠干燥后旋干。产物核磁产率为8%。
[0124]
实施例15
[0125]
往25ml干燥的三口瓶中加入磁力搅拌子、催化剂{ir[d(t-bu)(cf3)ppy]2(dtbbpy)}cl(2.7mg,0.0025mmol)和4-氨基苯硫酚(63mg,0.5mmol,1.0eq.)。用氮气置换容器内气体三次。加入碳化钙(5mmol,320mg,1.5eq.)、四氢呋喃(5ml)、n,n-二异丙基乙胺(16mg,0.125mmol,0.25eq.)和水(0.5ml)。密封反应在420~430nm光照下25℃反应24小时。反应结束后加入水(5ml),乙酸乙酯(10ml*3)萃取。有机相经饱和食盐水洗,硫酸钠干燥后旋干。产物核磁产率为13%。
[0126]
其他实施例
[0127]
以4-氨基苯硫酚为原料,制备4-乙烯巯基苯胺(ii-1),改变部分条件,其余操作同实施例1,具体结果如表1所示:
[0128]
表1光催化剂、碱性添加剂和溶剂对反应的影响
[0129]
[0130]
[0131][0132]
以4-氨基苯硫酚为原料,制备4-乙烯巯基苯胺(ii-1),改变部分条件,其余操作同实施例1,具体结果如表2所示:
[0133]
表2压力、温度、时间、光源对产率的影响
[0134]
实施例时间乙炔压力温度光照波长nm产率%661h1atm2543010672h1atm2543015688h1atm25430226912h1atm25430367048h1atm25430507112h1atm10430227212h1atm30430367312h1atm60430427412h1atm25300247512h1atm25530467612h1atm25590337712h1atm2570031788h3atm2543029798h5atm2543036808h10atm25430508112h1atm25白光38
[0135]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1