用于类固醇的1,2-脱氢的微生物的生物技术优化的制作方法
用于类固醇的1,2
‑
脱氢的微生物的生物技术优化
1.本发明涉及一种经基因修饰的细菌及其工业应用,特别是在类固醇的1,2
‑
脱氢中。
2.类固醇的1,2
‑
脱氢(也称为δ1
‑
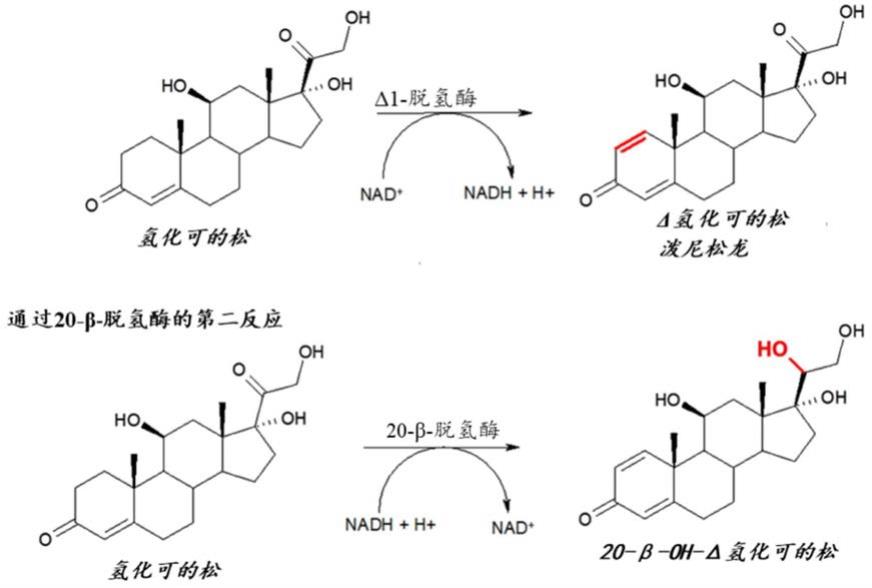
脱氢)可以通过用具有适当酶系统的细菌进行生物转化来进行。例如,转化可以由类诺卡氏菌科(nocardioidaceae)微生物催化,所述微生物制备并且用作细菌悬浮液或细菌悬浮液细胞裂解后的上清液。不幸的是,所述微生物还表达一种酶,所述酶催化在类固醇分子上的第二(不需要的)反应,所述第二反应是20位的酮基的还原并且导致产生此处称为“20
‑
oh杂质”的副产物。这两个反应在下文中以氢化可的松为例进行了示意。
3.通过δ1
‑
脱氢酶的主要反应
[0004][0005]
酶20β
‑
hsdh(20
‑
β
‑
羟基类固醇脱氢酶)已被鉴定为是此副反应的原因,所述酶导致20位的类固醇的酮还原。
[0006]
本发明诸位发明人现在已经鉴定出负责副反应活性的基因并且基因工程改造出没有这种活性的微生物。当用于类固醇转化时,它不再产生不需要的副产物,并且根据本发明的所述基因工程微生物可以直接用于类固醇转化而无需任何潜在的一个或多个成熟步骤。还可以省略用于纯化产物以去除不需要的副产物的另外步骤。生物转化产物可以在生产后直接使用。总之,这导致更高的产物产率、更高的产物质量和更简单的生产方法。
技术实现要素:
[0007]
因此,本发明的第一方面涉及一种经基因修饰的细菌,其中与相应的未修饰细菌相比,编码20β
‑
hsdh的基因的表达降低或受到抑制,其中所述相应的未修饰细菌具有δ1
‑
脱氢酶活性和20
‑
β
‑
脱氢酶活性。
[0008]
如本文所用,术语“相应的未修饰细菌”表示与随后经受基因修饰的未修饰细菌相同的细菌菌株。
[0009]
术语“细菌”意指原核微生物。未修饰细菌具有20β
‑
hsdh活性和δ1
‑
脱氢酶活性。在一个实施方案中,所述细菌来自选自以下的目:放线菌目(actinomycetale)、梭菌目(clostridiale)、气单胞菌目(aeromonadale)、巴斯德氏菌目(pasteurellale)、芽孢杆菌目(bacillale)、乳杆菌目(lactobacillale)、双歧杆菌目(bifidobacteriale)和红蝽杆菌目(coriobacteriale)。在一个优选的实施方案中,所述细菌来自放线菌目。例如,所述细菌可以是类诺卡氏菌科(nocardiodiaceae)的,诸如简单类诺卡氏菌(nocardioides simplex);链霉菌科(streptomycetaceae)的,诸如白色链霉菌(streptomyces albus);或分支杆菌科(mycobacteriaceae)的,诸如鸟型结核分支杆菌(mycobacterium avium)并且特别是鸟型结核分支杆菌副结核亚种(mycobacterium avium subsp.paratuberculosis)map4。在一个具体实施方案中,所述细菌来自类诺卡氏菌科,优选类诺卡氏菌属(nocardioides),并且最优选地,所述细菌是简单类诺卡氏菌。
[0010]
术语“来自类诺卡氏菌科的细菌”意指来自此家族的具有20β
‑
hsdh活性和δ1
‑
脱氢酶活性的任何细菌,例如像多形态放线菌属(actinopolymorpha)、气微菌属(aeromicrobium)、弗林德斯菌属(flindersiella)、韩国生工菌属(kribbella)、大理石雕菌属(marmoricola)、微白霜菌属(micropruina)、木米亚菌属(mumia)、诺卡氏菌属、脂肪杆菌属(pimelobacter)、propionicicella、propionicimonas、腾格里菌属(tenggerimyces)、或嗜热梨囊鞭菌属(thermasporomyces)的细菌。优选地,所述来自类诺卡氏菌科的细菌是简单类诺卡氏菌(以前称为简单节杆菌(arthrobacter simplex)或简单棒状杆菌(corynebacterium simplex)或简单脂肪杆菌(pimelobacter simplex))。优选地,所述细菌是简单类诺卡氏菌atcc6946。其他优选的细菌包括黄色弗莱德门氏菌(friedmanniella flava)(分类法id:1036181)、friedmanniella sagamiharensis(分类法id:546874)、独岛类诺卡氏菌(nocardioides dokdonensis)fr1436(分类法id:1300347)、连城类诺卡氏菌(nocardioides lianchengensis)(分类法id:1045774)、耐冷类诺卡氏菌(nocardioides psychrotolerans)(分类法id:1005945)、四川类诺卡氏菌(nocardioides szechwanensis)(分类法id:1005944)、科伊尔棒状杆菌(corynebacterium coyleae)(分类法id:53374)、corynebacterium glyciniphilum aj 3170(分类法id:1404245)、柯氏棒状杆菌(corynebacterium kroppenstedtii)dsm 44385(分类法id:645127)、corynebacterium lowii(分类法id:1544413)、corynebacterium spheniscorum(分类法id:185761)、居瘤胃棒状杆菌(corynebacterium vitaeruminis)dsm 20294(分类法id:1224164)、海气微菌(aeromicrobium marinum)dsm 15272(分类法id:585531)、藤黄类诺卡氏菌(nocardioides luteus)(分类法id:1844)、corynebacterium halotolerans yim 70093=dsm 44683(分类法id:1121362)、马里斯棒状杆菌(corynebacterium maris)dsm 45190(分类法id:1224163)、corynebacterium riegelii(分类法id:156976)。
[0011]
术语“基因”意指dna序列,所述dna序列编码或对应于包含一种或多种蛋白质或酶的全部或部分的特定氨基酸序列,并且可能或可能不包含调控dna序列,诸如启动子序列,其决定例如表达基因的条件。特别地,术语基因可以旨在是编码蛋白质的基因组序列,即包
含调节子、启动子、内含子和外显子序列的序列。
[0012]
如本文所用,术语“编码20β
‑
hsdh的基因”对应于编码任何细菌的20β
‑
hsdh的基因。优选地,编码20β
‑
hsdh的基因与序列seq id no:1具有至少60%的同一性,更优选地它与序列seq id no:1具有多于70%、75%、80%、85%、90%、95%并且最优选多于99%的同一性。根据一个实施方案,编码20β
‑
hsdh的基因与序列seq id no:3具有至少60%的同一性,更优选地它与序列seq id no:3具有多于70%、75%、80%、85%、90%、95%并且最优选多于99%的同一性。
[0013]“与参考序列具有至少x%同一性的基因”的意图是核酸的序列与参考序列的差异在于参考序列在其全长上每100个核苷酸有多达100
‑
x个核苷酸改变。换言之,为了获得与参考序列具有至少x%同一性的序列的核酸,主题序列中多达100
‑
x%的核苷酸可以被插入、缺失或被另一种氨基酸或核苷酸取代。
[0014]
与参考序列“至少60%、70%、75%、80%、85%、90%、95%或99%相同”的核酸序列可以包含与参考序列相比一个或多个突变,诸如一个或多个缺失、一个或多个插入和/或一个或多个取代。在取代的情况下,取代优选对应于沉默取代或导致翻译的氨基酸序列中的保守取代的取代。
[0015]
用于比较两个或更多个序列的同一性的方法在科学界是众所周知的。例如,可以使用wisconsin sequence analysis package 9.1版中可用的程序,例如程序bestfit和gap来确定两个序列之间的同一性百分比。bestfit使用smith和waterman的“局部同源性”算法,并且找到两个序列之间的最佳单一相似性区域。用于确定序列之间的同一性的其他程序也是本领域已知的,例如needle程序,其基于needleman和wunsch算法,描述于needleman和wunsch(1970)j.mol biol.48:443
‑
453中,其中例如将以下参数用于多核苷酸序列比较:比较矩阵:dnafull;空位开头罚分=10,空位延长罚分=0.5,结尾空位罚分:假,结尾空位开头罚分=10,结尾空位延长罚分=0.5。
[0016]
术语“经基因修饰的”意指遗传物质(例如,dna、rna、cdna)的任何可检测变化,或此类变化的任何过程、机制或结果。这包括其中基因的结构(例如,dna序列)发生改变的基因突变、从任何突变过程产生的任何基因或dna、以及由经修饰的基因或dna序列表达的任何表达产物(例如,蛋白质或酶)。通常,通过将受试者表达的核酸或多肽的序列与对照群体中表达的相应核酸或多肽的序列进行比较来鉴定所述受试者中的突变。
[0017]
术语“编码20β
‑
hsdh的基因的表达降低或受到抑制”意指信使rna(mrna)和/或由编码20β
‑
hsdh的基因编码的蛋白质的表达水平的降低或抑制。与未修饰细菌相比,编码20β
‑
hsdh的基因的表达可以降低至少75%、80%、85%、90%或95%。优选地,编码20β
‑
hsdh的基因的表达降低100%,因此对应于表达的抑制。
[0018]
基因或核酸的表达水平可以通过本领域技术人员众所周知的方法测量,所述方法特别包括基于直接杂交的测定和基于扩增的测定。
[0019]
与未修饰细菌相比,编码20β
‑
hsdh的基因的表达可以通过此基因的失活或缺失来降低或抑制。在一个具体实施方案中,编码20β
‑
hsdh的基因发生突变,并且优选被截短。
[0020]
优选地,经基因修饰的细菌不包含任何外源dna。
[0021]
用于基因的失活、缺失或截短的实验室方法是本领域众所周知的。
[0022]
如本文所意,当编码20β
‑
hsdh的基因是突变和/或截短的时,它可能不编码全功能
20β
‑
hsdh蛋白,而是编码在相同条件下测量的活性低于相应天然20β
‑
hsdh蛋白的活性的20β
‑
hsdh蛋白,特别是编码的20β
‑
hsdh蛋白质可能没有活性。
[0023]
根据本发明的经基因修饰的细菌优选具有δ1
‑
脱氢酶活性,但与所述未修饰细菌相比具有降低的或没有20
‑
β
‑
脱氢酶活性。
[0024]
因此,如在本技术中显而易见的,本发明涉及一种经基因修饰的细菌,其中:
[0025]
‑
相应的未修饰细菌具有δ1
‑
脱氢酶活性和20
‑
β
‑
脱氢酶活性,
[0026]
‑
至少一个基因修饰诱导降低或抑制的编码20
‑
β
‑
羟基类固醇脱氢酶(20β
‑
hsdh)的基因的表达,以及
[0027]
‑
优选地,所述经基因修饰的细菌保持其δ1
‑
脱氢酶活性。
[0028]
优选地,根据本发明的经基因修饰的细菌具有δ1
‑
脱氢酶活性,但由于基因修饰,与所述未修饰细菌相比具有降低的或没有20
‑
β
‑
脱氢酶活性。
[0029]
本发明的第二方面涉及一种用于生产根据本发明的经基因修饰的细菌的方法,其包括:
[0030]
a)提供具有δ1
‑
脱氢酶活性和20
‑
β
‑
脱氢酶活性的细菌;以及
[0031]
b)将所述编码20β
‑
hsdh的基因失活或缺失。
[0032]
根据本发明的用于生产经基因修饰的细菌的方法的步骤b可以包括编码20β
‑
hsdh的基因的突变、截短或缺失。突变或截短可以通过本领域技术人员已知的任何方法并且优选通过编码20β
‑
hsdh的基因的双交叉来实现。
[0033]
优选地,所获得的经基因修饰的细菌不包含任何外源dna。
[0034]
在另一方面,本发明涉及一种用于生产1,2
‑
脱氢类固醇的方法,其包括:
[0035]
a)提供未1,2
‑
脱氢的类固醇;
[0036]
b)在足以获得1,2
‑
脱氢类固醇的条件下使所述未1,2
‑
脱氢的类固醇与根据本发明所述的细菌或其提取物接触。
[0037]
优选地,在根据本发明的用于生产1,2
‑
脱氢类固醇的方法中使用的未1,2
‑
脱氢的类固醇是皮质类固醇。
[0038]
在一个具体实施方案中,在所述方法中使用的未1,2
‑
脱氢的类固醇是孕酮、睾酮、雄烯二酮或这些分子的衍生物,它们含有类固醇支架,所述支架含有在1,2位之间未脱氢的六个碳原子的环a。
[0039]
在一个具体实施方案中,未1,2
‑
脱氢的类固醇是:
[0040]
‑
11β17,21
‑
三羟基孕
‑4‑
烯
‑
3,20
‑
二酮(氢化可的松),并且所述方法用于生产11β,17α,21
‑
三羟基
‑
1,4
‑
孕甾二烯
‑
3,20
‑
二酮(泼尼松龙);或
[0041]
‑
17α,21
‑
二羟基
‑4‑
孕烯
‑
3,11,20
‑
三酮(可的松),并且所述方法用于生产17α,21
‑
二羟基
‑
1,4
‑
孕甾二烯
‑
3,11,20
‑
三酮(强的松);或
[0042]
‑
孕
‑4‑
烯
‑
3,20
‑
二酮,并且所述方法用于生产孕甾
‑
1,4
‑
二烯
‑
3,20
‑
二酮;或
[0043]
‑
11β,17,21
‑
三羟基
‑
6α
‑
1,4
‑
孕烯
‑
3,20
‑
二酮(6
‑
甲基
‑
氢化可的松),其用于生产11β,17α,21
‑
三羟基
‑
6α
‑
甲基
‑
1,4
‑
孕甾二烯
‑
3,20
‑
二酮(6
‑
甲基泼尼松龙);或
[0044]
‑
9,11
‑
脱氢脱氧可的松,并且所述方法用于生产1,2
‑
9,11
‑
脱氢脱氧可的松;或
[0045]
‑
9,11
‑
脱氢脱氧可的松
‑
17,21
‑
二乙酸酯,并且所述方法用于生产1,2
‑
9,11
‑
脱氢脱氧可的松;或
[0046]
‑
9,11
‑
16,17
‑
脱氢脱氧可的松
‑
21
‑
乙酸酯,并且所述方法用于生产1,2
‑
9,11
‑
16,17
‑
脱氢脱氧可的松
‑
21
‑
乙酸酯;或
[0047]
‑
16
‑
α
‑
甲基氢化可的松,并且所述方法用于生产16
‑
α
‑
甲基泼尼松龙。
[0048]
在一个实施方案中,所述用于生产1,2
‑
脱氢类固醇的方法的步骤b)是用根据本发明的细菌提取物完成的。所述提取物优先具有δ1
‑
脱氢酶活性,并且优先具有降低的或没有20
‑
β
‑
脱氢酶活性。特别地,此类提取物可以通过以下方式获得:细胞裂解根据本发明所述的细菌,并且任选地将细胞裂解产物分级以便浓缩δ1
‑
脱氢酶活性或促进δ1
‑
脱氢酶活性的纯化。
[0049]
所述用于生产1,2
‑
脱氢类固醇的方法可以进一步包括回收和纯化所述1,2
‑
脱氢类固醇。
[0050]
优选地,所述用于生产1,2
‑
脱氢类固醇的方法不包括消除20β
‑
脱氢类固醇的步骤。确实,如果编码20β
‑
hsdh的基因的表达显著降低,则此步骤可能是不必要的。
[0051]
此外,所述用于生产1,2
‑
脱氢类固醇的方法可以包括将1,2
‑
脱氢类固醇配制成药物组合物。
[0052]
在另一方面,本发明涉及根据本发明的细菌或其提取物用于从未1,2
‑
脱氢的类固醇生产1,2
‑
脱氢类固醇的用途。
[0053]
所述提取物优先具有δ1
‑
脱氢酶活性,并且优先具有降低的或没有20
‑
β
‑
脱氢酶活性。特别地,此类提取物可以通过以下方式获得:细胞裂解根据本发明所述的细菌,并且任选地在将细胞裂解产物分级后浓缩δ1
‑
脱氢酶活性或促进δ1
‑
脱氢酶活性的纯化。
[0054]
优选地,所述未1,2
‑
脱氢的类固醇是皮质类固醇。
[0055]
在一个具体实施方案中,未1,2
‑
脱氢的类固醇是孕酮、睾酮、雄烯二酮或这些分子的衍生物,它们含有类固醇支架,所述支架含有在1,2位之间未脱氢的六个碳原子的环a。
[0056]
在一个具体实施方案中,未1,2
‑
脱氢的类固醇是:
[0057]
‑
11β17,21
‑
三羟基孕
‑4‑
烯
‑
3,20
‑
二酮(氢化可的松),并且产生11β,17α,21
‑
三羟基
‑
1,4
‑
孕甾二烯
‑
3,20
‑
二酮(泼尼松龙);或
[0058]
‑
17α,21
‑
二羟基
‑4‑
孕烯
‑
3,11,20
‑
三酮(可的松),并且产生17α,21
‑
二羟基
‑
1,4
‑
孕甾二烯
‑
3,11,20
‑
三酮(强的松);或
[0059]
‑
孕
‑4‑
烯
‑
3,20
‑
二酮,并且产生孕甾
‑
1,4
‑
二烯
‑
3,20
‑
二酮;或
[0060]
‑
11β,17,21
‑
三羟基
‑
6α
‑
1,4
‑
孕烯
‑
3,20
‑
二酮(6
‑
甲基
‑
氢化可的松),并且产生11β,17α,21
‑
三羟基
‑
6α
‑
甲基
‑
1,4
‑
孕甾二烯
‑
3,20
‑
二酮(6
‑
甲基泼尼松龙);或
[0061]
‑
9,11
‑
脱氢脱氧可的松,并且产生1,2
‑
9,11
‑
脱氢脱氧可的松;或
[0062]
‑
9,11
‑
脱氢脱氧可的松
‑
17,21
‑
二乙酸酯,并且产生1,2
‑
9,11
‑
脱氢脱氧可的松;或
[0063]
‑
9,11
‑
16,17
‑
脱氢脱氧可的松
‑
21
‑
乙酸酯,并且产生1,2
‑
9,11
‑
16,17
‑
脱氢脱氧可的松
‑
21
‑
乙酸酯;或
[0064]
‑
16
‑
α
‑
甲基氢化可的松,并且产生16
‑
α
‑
甲基泼尼松龙。
[0065]
如本文所用,术语“药物组合物”是指1,2
‑
脱氢类固醇与其他化学组分诸如生理上合适的载体和赋形剂的制剂。所述药物组合物的目的是促进将所述1,2
‑
脱氢类固醇施用于生物体。
[0066]
本发明的药物组合物可以通过本领域众所周知的方法,例如借助常规混合、溶解、制粒、研磨、粉碎、糖衣丸制造、磨细、乳化、包囊、包埋或冻干方法来制造。
[0067]
典型地,药物组合物可以包含本发明的1,2
‑
脱氢类固醇和药学上可接受的载体。
[0068]
将通过以下附图和实施例进一步说明本发明。
附图说明
[0069]
图1:通过双交叉的基因失活的示意图。使两侧有两个同源肩(包含方块的框)以及安普霉素抗性基因和β
‑
葡萄糖醛酸酶基因(包含竖线和波浪线的箭头)的截短形式的目的基因(包含字母“t”的箭头)的质粒与细菌的染色体接触,并且所述同源肩之一与染色体中的相应序列重组(步骤1)。此步骤导致形成中间单交叉构建,将全质粒整合到基因组中(用虚线圈出)。菌株于是含有目的基因的两个变体,并且展现出对安普霉素的抗性和β
‑
葡萄糖醛酸酶活性。经过若干轮培养(步骤2),使两个剩余的同源肩彼此相互作用(虚线)并且发生双交叉(步骤3)。然后,所获得的菌株仅含有截短形式的所述基因(包含字母“t”的箭头)。
[0070]
图2:在用简单类诺卡氏菌(n.simplex)从氢化可的松生产泼尼松龙的经典方法后获得的产物的hplc
‑
色谱图。箭头指向20
‑
oh泼尼松龙杂质。
[0071]
图3:在用简单类诺卡氏菌的双交叉突变体nosim5169从氢化可的松生产泼尼松龙的经典方法后获得的产物的hplc
‑
色谱图。箭头指向通常观察到20
‑
oh泼尼松龙杂质的位置。
[0072]
序列表:
[0073]
seq id no:1对应于简单类诺卡氏菌nosim5169的序列。
[0074]
seq id no:2对应于简单类诺卡氏菌nosim3735的序列。
[0075]
seq id no:3对应于鸟型结核分支杆菌副结核亚种map4的20β
‑
hsdh的基因的序列。
实施例
[0076]
分析简单类诺卡氏菌的基因组,发现20β
‑
hsdh的两个可能基因,称为nosim5169(对应于序列seq id no:1)和nosim3735(对应于序列seq id no:2)。它们都与负责鸟型结核分支杆菌副结核亚种map4(对应于序列seq id no:3)的20β
‑
hsdh的基因序列共享相似性。
[0077]
1.质粒构建(nosim5169)
[0078]
如下构建用于使nosim5169失活的质粒:通过pcr扩增大小为2.0和1.7kbp的同源肩。用于扩增一个肩的引物含有xbai和ecorv限制性位点,并且用于第二个同源肩的引物被设计为含有ecorv和ecori限制性位点。
[0079]
随后将肩克隆到第一质粒中。
[0080]
为了获得新的第二质粒,将潮霉素抗性基因平端克隆到ecorv限制性位点中。
[0081]
没有潮霉素抗性基因的质粒被命名为“第二质粒
‑
hyg”。
[0082]
2.用于简单类诺卡氏菌的电穿孔方法
[0083]
所述方案基于针对节杆菌属(arthrobacter)所描述的程序(zhang等人,2011)。用于制备电感受态细胞的优化程序如下:将简单类诺卡氏菌细胞接种到20ml的lb+ph(lb代表
溶源性肉汤,并且ph代表磷霉素)中,并且培养直至达到静止期。然后将来自预培养物的1%接种物接种到新鲜的lb培养基中并且培养直到光密度在600nm处接近0.4
‑
0.5。然后添加氨苄青霉素(ap)和甘氨酸至最终浓度分别为30μg/l和5g/l,并且继续培养。3h后,将培养物置于冰上并且通过离心(4500rpm,6min,4℃)收获。在冰冷的电穿孔缓冲剂(0.5m山梨糖醇,10%甘油)中洗涤3次后,通过离心将细胞浓缩100倍。最后,将悬浮液分配成60μl等分试样并且储存在冰上(此方案用于生成简单类诺卡氏菌nosim5169
‑
hyg)。
[0084]
可替代地,可以应用用于白色链霉菌(s.albus)atcc 21838的方案(izumikawa等人,2003)。在这种情况下,可以修改所述用于制备电感受态细胞的程序以适于简单类诺卡氏菌生理学:将来自简单类诺卡氏菌的静止期预培养物的1%接种物接种到新鲜的lb+ph培养基中并且进行培养。当光密度在600nm处接近0.4
‑
0.5时,通过离心(4500rpm,6min,4℃)收获培养物,并且用无菌冰冷水洗涤3次。然后将菌丝体悬浮在25ml冷电穿孔缓冲剂(10%蔗糖,15%甘油)中并且补充溶菌酶(0.5mg/ml)。在37℃下孵育20min后,通过离心收集细胞并且在电穿孔缓冲剂中浓缩100倍。最后,将悬浮液分配成60μl等分试样并且储存在冰上。
[0085]
在两种情况下优化的电穿孔程序如下:将电感受态细胞与500ng dna(由大肠杆菌(e.coli)gb2005制备)混合,并且将混合物转移到预冷冻的电穿孔小槽(0.1cm电极)中。使混合物经受使用eppendorf pulser以2.1kv/cm的单脉冲。电脉冲后立即将细胞悬液转移到含有800μl室温恢复培养基(soc)的eppendorf管中,并且在30℃下以850rpm振荡孵育12h。为了选择转化细胞,将连续稀释的细菌涂布在含有安普霉素(am)的lb琼脂板上。对于每组实验,通过省略质粒dna的添加进行阴性对照。
[0086]
3.单交叉突变体(nosim5169)
[0087]
用第二质粒电穿孔简单类诺卡氏菌菌株后,获得单交叉转化株并且将其贴在lb+am+x
‑
gluc琼脂板上(示意图参见图1)(x
‑
gluc代表一水合物,x
‑
glca)。在安普霉素上生长以及进行β
‑
葡萄糖醛酸酶(gus)(例如,myronovskyi等人,2011)反应的能力证实转化株是单交叉突变体。此后,将突变体接种在100ml lb+ph培养基中,并且在28℃、200rpm下孵育48h。
[0088]
4.双交叉突变体(nosim5169)
[0089]
然后将1ml培养物转移到新鲜的lb+ph培养基中,并且在相同条件下孵育另外48h。将此步骤重复若干次。最后一次孵育后,制备在lb+x
‑
gluc琼脂板上的突变体的系列稀释液。
[0090]
将没有展现出gus活性的突变体转移到新的lb+x
‑
gluc上并且再次检查。gus活性的不存在意指在这些突变体中发生了双交叉并且它们失去了质粒骨架。
[0091]
将通过第二测试的突变体在lb中培养,分离其gdna,并且然后使用与简单类诺卡氏菌染色体dna同源的引物通过pcr进行分析。
[0092]
5.不含外来dna的双交叉突变体(nosim5169)
[0093]
代替第二质粒,使用“第二质粒
‑
hyg”进行转化。抗生素抗性基因(潮霉素抗性)的存在可以促进进一步鉴定双交叉突变体。然而,这种抗性基因恰好在简单类诺卡氏菌的基因组中无活性。
[0094]
因此,双交叉后,获得的突变体应该不含任何外源dna,并且将可用于进一步的工业应用(图1)。
[0095]
将“第二质粒
‑
hyg”引入简单类诺卡氏菌后,获得安普霉素抗性菌落。
[0096]
将此突变体在lb+ph培养基中经过6次培养,并且然后进行在lb+x
‑
gluc上对培养物的系列稀释。
[0097]
将获得的不能在安普霉素上生长并且没有gus活性的菌落暴露于通过pcr的进一步分析。通过使用与相邻于nosim5169的简单类诺卡氏菌gdna区域同源的两个引物进行扩增。
[0098]
6.nosim3735的失活
[0099]
对于具有失活nosim3735的菌株的构建,不能应用先前描述的方法,因为在nosim3735上游的dna区域无法通过pcr进行其扩增。为了克服这一挑战,将含有简单类诺卡氏菌组片段的粘粒文库进行排序和测序。
[0100]
为了使nosim3735失活,从含有所述基因的粘粒文库中鉴定出适当的粘粒(通过康斯坦茨的gatc biotech对大约1500个粘粒进行桑格(sanger)测序),并且在大肠杆菌中使用λ介导的重组将所述基因替代为氯霉素(cm)抗性基因cat(例如murphy,1998)。然后通过bamhi核酸内切酶消化经修饰的粘粒。以这种方式,获得了片段混合物,并且其中一个片段含有cat基因而不是nosim3735,其两侧有两个3
‑
kb肩以与简单类诺卡氏菌基因组进行同源重组。通过琼脂糖凝胶电泳分离片段,并且将7
‑
8kb级分纯化并且连接到bamhi线性化质粒中。为了选择含有具有cat基因的构建体的突变体,将lb+am+cm用作生长培养基。通过pcr和测序分析获得的突变体。将获得的质粒之一进一步用于nosim3735的失活。
[0101]
根据先前适配于nosim5169的失活的方案进行失活(参见第2点及以下)。
[0102]
将此突变体在lb+ph培养基中经过若干次培养,并且然后在lb+x
‑
gluc上对培养物进行系列稀释。
[0103]
将获得的不能在安普霉素上生长并且没有gus活性的菌落暴露于通过pcr的进一步分析。通过使用与相邻于nosim3735的简单类诺卡氏菌gdna区域同源的两个引物进行扩增。
[0104]
7.对氢化可的松使用nosim3735和nosim5169
[0105]
将克隆用于从氢化可的松生产泼尼松龙的经典方法。
[0106]
简而言之,将氢化可的松与在四氢呋喃中的甲萘醌溶液混合。然后将此悬浮液混合在调节至ph 8.0的磷酸盐缓冲剂中。然后添加细菌悬浮液。在30℃搅拌下孵育后,通过添加磷酸终止反应。通过hplc测量和分析泼尼松龙的增加。
[0107]
通过waters
‑
xbrigde rp18
‑
柱使用水/乙腈梯度作为流动相获得hplc
‑
色谱图(色谱图在图2
‑
3中示出)。
[0108]
可替代地,实现了20
‑
oh
‑
副产物的产生的活性测定。将泼尼松龙悬浮在ph 8.0的磷酸盐缓冲剂中,并且与细菌悬浮液一起孵育。60min后,通过添加磷酸终止反应。然后通过hplc测量20
‑
oh酮还原产物的潜在增加。
[0109]
nosim5169的截短允许完全抑制20β
‑
hsdh活性并且因此获得不含20
‑
oh杂质的泼尼松龙(图3)。
[0110]
nosim3735基因被敲除,但菌株显示出与野生型菌株相同的反应,通过敲除此基因无法关闭不需要的副反应。
[0111]
参考文献列表:
[0112]
izumikawa,m.;murata,m.;tachibana,k.;ebizuka,y.and fujii,i.(2003):cloning of modular type i polyketide synthase genes from salinomycin producing strain of streptomyces albus.bioorganic&medicinal chemistry 11:3401
‑
3405.
[0113]
murphy,k.c.(1998):use of bacteriophageλrecombination functions to promote gene replacement in escherichia coli.j.bacteriol.180:2063
‑
2071.
[0114]
myronovskyi,m.;welle,e.;fedorenko,v.and luzhetskyy,a.(2011):glucuronidase as a sensitive and versatile reporter in actinomycetes.applied and environmental microbiology,aug.2011,5370
‑
5383.
[0115]
zhang,h.;li,y.;chen,x.;sheng,h.and an,l.(2011):optimization of electroporation conditions for arthrobacter with plasmid part2,journal of microbiological methods,84:114
‑
120.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1