细胞结构体及细胞结构体的制造方法
1.本发明涉及细胞结构体及细胞结构体的制造方法,特别是涉及在细胞间具有血管网的细胞结构体及在细胞间具有血管网的细胞结构体的制造方法。
背景技术:
2.作为人工地制作模仿生物体组织的结构体的方法,例如已知有下述方法等:一种制造三维组织体的方法(专利文献1),其包含将由含有胶原的被膜涂敷的细胞三维地配置而形成三维组织体的工序;一种立体性细胞组织的制造方法(专利文献2),其包含下述工序:将细胞与阳离子性物质和细胞外基质成分混合而得到混合物,从得到的混合物中收集细胞,在基材上形成细胞集合体。另外,本发明者们还提出了下述方法(专利文献3):通过使经片段化的外源性胶原与细胞接触,以较少的细胞数制造厚度为1mm以上的尺寸大的三维组织体。期待上述这样的三维组织体作为实验动物的替代品、移植材料等的用途。
3.现有技术文献
4.专利文献
5.专利文献1:国际公开第2015/072164号
6.专利文献2:国际公开第2017/146124号
7.专利文献3:国际公开第2018/143286号
技术实现要素:
8.发明所要解决的课题
9.根据上述三维组织体的制造方法,能够制作具有厚度的三维组织体。然而,关于制作如生物体组织那样在细胞间形成有血管网的脂肪组织的方法尚未可知。
10.因此,本发明的目的在于提供一种在细胞间具有血管网的细胞结构体及在细胞间具有血管网的细胞结构体的制造方法。
11.用于解决课题的手段
12.即,本发明例如涉及以下的各发明。
13.〔1〕一种细胞结构体,其是包含经片段化的细胞外基质成分和细胞且在细胞间具有血管网的细胞结构体,其中,
14.所述细胞至少包含脂肪细胞和血管内皮细胞。
15.〔2〕根据〔1〕所述的细胞结构体,其中,上述血管网形成于上述脂肪细胞间。
16.〔3〕根据〔1〕或〔2〕所述的细胞结构体,其中,上述脂肪细胞包含成熟脂肪细胞。
17.〔4〕根据〔1〕~〔3〕中任一项所述的细胞结构体,其中,上述经片段化的细胞外基质成分的平均长度为100nm以上且400μm以下。
18.〔5〕根据〔1〕~〔4〕中任一项所述的细胞结构体,其中,细胞结构体中的细胞外基质成分含有率以上述细胞结构体的干燥重量为基准为0.01~90质量%。
19.〔6〕根据〔1〕~〔5〕中任一项所述的细胞结构体,其中,上述经片段化的细胞外基质
成分包含胶原。
20.〔7〕根据〔1〕~〔6〕中任一项所述的细胞结构体,其还包含纤维蛋白。
21.〔8〕根据〔1〕~〔6〕中任一项所述的细胞结构体,其为移植用。
22.〔9〕一种在细胞间具有血管网的细胞结构体的制造方法,其包含下述工序:
23.使经片段化的细胞外基质成分与细胞接触的接触工序,其中,细胞(i)至少包含脂肪细胞、干细胞和血管内皮细胞、或(ii)至少包含脂肪干细胞和血管内皮细胞,和
24.对经片段化的细胞外基质所接触的细胞进行培养的培养工序。
25.〔10〕根据〔9〕所述的方法,其中,上述细胞包含脂肪细胞、脂肪干细胞和血管内皮细胞。
26.〔11〕根据〔9〕或〔10〕所述的方法,其中,上述脂肪细胞包含成熟脂肪细胞。
27.〔12〕根据〔9〕~〔11〕中任一项所述的方法,其中,上述接触工序中的上述经片段化的细胞外基质成分的量相对于1.0
×
106cells的细胞为0.1~100mg。
28.〔13〕根据〔9〕~〔12〕中任一项所述的方法,其中,上述接触工序中的干细胞与血管内皮细胞的细胞数之比为100/1~1/100。
29.〔14〕根据〔9〕~〔13〕中任一项所述的方法,其中,上述经片段化的细胞外基质成分包含胶原。
30.〔15〕根据〔9〕~〔14〕中任一项所述的方法,其在上述接触工序或上述接触工序后且培养工序前还包含添加纤维蛋白原的工序。
31.〔16〕一种非人模型动物,其具有〔1〕~〔8〕中任一项所述的细胞结构体作为移植物。
32.〔17〕一种非人模型动物的制造方法,其包含将〔1〕~〔8〕中任一项所述的细胞结构体移植到非人动物的工序。
33.〔18〕一种具有血管结构的细胞结构体的移植方法,其包含将〔1〕~〔8〕中任一项所述的细胞结构体移植到动物的工序。
34.〔19〕一种细胞结构体,其是包含经片段化的细胞外基质成分和细胞、在细胞间具有血管网、且在不粘附于支撑体的状态下集合成块状的细胞结构体,其中,所述细胞至少包含脂肪细胞和血管内皮细胞。
35.〔20〕根据〔19〕所述的细胞结构体,其为大致球体状。
36.〔21〕一种在细胞间具有血管网的细胞结构体的制造方法,其包含下述工序:
37.使经片段化的细胞外基质成分与细胞接触的接触工序,其中,细胞(i)至少包含脂肪细胞、干细胞和血管内皮细胞、或(ii)至少包含脂肪干细胞和血管内皮细胞,和
38.对经片段化的细胞外基质所接触的细胞进行培养的培养工序,
39.其中,上述培养工序包含将上述经片段化的细胞外基质所接触的细胞在不粘附于支撑体的状态下进行培养的工序。
40.〔22〕根据〔21〕所述的方法,其中,上述培养工序包含将上述经片段化的细胞外基质所接触的细胞从支撑体分离的工序。
41.〔23〕一种细胞组织,其包含多个〔19〕或〔20〕所述的细胞结构体,上述血管网在多个细胞结构体间连接。
42.〔24〕一种细胞组织的制造方法,其包含对多个〔19〕或〔20〕所述的细胞结构体进行
悬浮培养的工序。
43.〔25〕一种非人模型动物的制造方法,其包含将多个〔19〕或〔20〕所述的细胞结构体移植到非人动物的工序。
44.〔26〕根据〔25〕所述的方法,其中,将细胞结构体移植到非人动物后,生长30天以上。
45.〔27〕根据〔26〕所述的方法,其中,将细胞结构体移植到非人动物后,生长90天以上。
46.〔28〕一种抑制或促进脂肪组织的代谢的药剂的效果的评价方法,其使用了〔1〕~〔8〕、〔19〕及〔20〕中任一项所述的细胞结构体。
47.〔29〕根据〔28〕所述的方法,其中,包含下述工序:
48.向细胞结构体给予抑制或促进脂肪组织的代谢的药剂的给予工序,和
49.根据给予了上述药剂的细胞结构体中的代谢的变化,评价药剂的效果的评价工序。
50.〔30〕根据〔29〕所述的方法,其中,上述评价工序包含将下述变化作为指标进行评价的工序:
51.葡萄糖和/或脂肪酸的摄入的变化、和/或
52.所摄入的葡萄糖和/或脂肪酸的释放的变化。
53.〔31〕一种抑制或促进脂肪组织的代谢的药剂的筛选方法,其使用了〔1〕~〔8〕、〔19〕及〔20〕中任一项所述的细胞结构体。
54.〔32〕根据〔31〕所述的方法,其包含下述工序:
55.测定给予了药剂的细胞结构体中的代谢的工序,和
56.将给予了药剂的细胞结构体中的代谢与未给予药剂的细胞结构体中的代谢进行比较,在给予了药剂的细胞结构体中的代谢较低时,选择上述药剂作为抑制脂肪组织的代谢的药剂的候选物质的工序;
57.或者包含下述工序:
58.测定给予了药剂的细胞结构体中的代谢的工序,和
59.将给予了药剂的细胞结构体中的代谢与未给予药剂的细胞结构体中的代谢进行比较,在给予了药剂的细胞结构体中的代谢较高时,选择上述药剂作为促进脂肪组织的代谢的药剂的候选物质的工序。
60.〔33〕根据〔32〕所述的方法,其中,细胞结构体中的代谢的比较通过将下述作为指标来进行:
61.葡萄糖和/或脂肪酸的摄入、和/或
62.所摄入的葡萄糖和/或脂肪酸的释放。
63.发明效果
64.根据本发明,能够简便地制造在细胞间具有血管网的细胞结构体。
附图说明
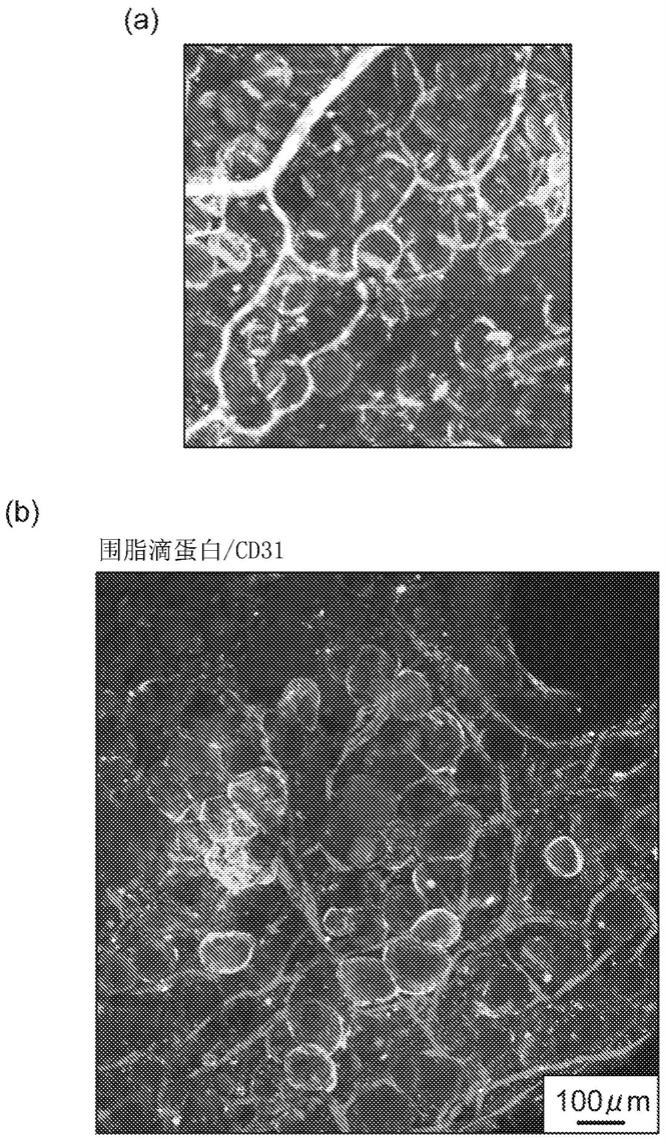
65.图1是表示利用围脂滴蛋白染色及cd31染色的(a)生物体组织及(b)试验例2的细胞结构体的观察结果的照片。
66.图2是将试验例2的细胞结构体中的血管的分支数与生物体组织中的血管的分支数进行比较的图表。
67.图3是表示利用围脂滴蛋白染色及cd31染色的试验例3的细胞结构体的观察结果的照片。
68.图4是表示利用cd31染色的试验例4的细胞结构体的观察结果的照片。
69.图5是表示利用cd31染色的试验例5的细胞结构体的观察结果的照片。
70.图6是表示利用围脂滴蛋白染色及cd31染色的试验例6的细胞结构体的观察结果的照片。
71.图7是表示试验例7的要点的图。左液滴中的圆表示成熟脂肪细胞、白色菱形表示adsc、灰色短棒表示huvec。
72.图8是表示利用尼罗红染色及cd31染色的试验例7的具有血管网的细胞球的荧光观察结果的照片。(b)是进一步放大(a)的细胞球中的一个而成的图。
73.图9是表示利用cd31染色的具有血管网的细胞球的观察结果的照片。
74.图10是表示通过试验例7的方法制作的细胞球在培养7天后的平均直径(n=12细胞球/量)的图表。
75.图11是表示利用尼罗红染色及cd31染色的通过试验例8的方法制作的细胞组织的荧光观察结果的照片((a)、(b)是部分放大照片)及在亮视野中观察平板上凝聚的细胞球的照片(c)。
76.图12是表示利用围脂滴蛋白染色及dapi染色的试验例9的从移植部位在30天后采集的组织的荧光观察结果的照片。a:sft表示从移植了通过脂肪抽吸从人的大腿(生物体组织)得到的脂肪组织的部位采集的组织,c:3dvft表示试验例9的从移植了(1)的细胞球的部位采集的组织。图12的上排表示在亮视野中观察到的结果,中排表示利用围脂滴蛋白染色的结果,下排表示dapi染色的结果。
77.图13是表示利用cd31染色及dapi染色的试验例9的从移植部位在90天后采集的组织的荧光观察结果的照片。a:sft表示从移植了通过脂肪抽吸从人的大腿(生物体组织)得到的脂肪组织的部位采集的组织,c:3dvft表示试验例9的从移植了(1)的细胞球的部位采集的组织。图13的上排表示在亮视野中观察的结果,中排表示利用cd31染色的结果,下排表示dapi染色的结果。
78.图14是表示孵育后10分钟、30分钟、60分钟、120分钟、150分钟的时间点的细胞结构体的荧光观察结果的照片。
79.图15表示包含形成第7天和第14天的血管内皮细胞的细胞结构体(b)及不含血管内皮细胞的组织体(a)中的60分钟后的荧光强度的比较。col i是指使用了使用胶原i型而制作的scmf,而col i+iii是指使用了使用胶原i型和iii型的混合物而制作的scmf。
80.图16表示将不含血管内皮细胞的组织体孵育20分钟、45分钟、70分钟、90分钟、135分钟的时间点的荧光强度的比较。
81.图17(a)的图表表示试验例11中的将不含血管内皮细胞的组织体孵育20分钟、45分钟、70分钟和90分钟的时间点的荧光强度(葡萄糖摄入量)的比较。(b)的图表表示该试验例12中的将不含血管内皮细胞的组织体孵育5分钟、30分钟及60分钟的时间点的荧光强度(脂肪酸摄入量)的比较。
82.图18表示将包含血管内皮细胞的细胞结构体(b)和不含血管内皮细胞的组织体(a)分别孵育0分钟、5分钟、30分钟、60分钟的时间点的荧光强度的比较。
83.图19表示第2次孵育后的葡萄糖的释放量(a)、及脂肪酸的释放量(b)的比较。
具体实施方式
84.以下,对用于实施本发明的方式详细地进行说明。但是,本发明并不限定于以下的实施方式。
85.[细胞结构体]
[0086]
本实施方式的细胞结构体包含经片段化的细胞外基质成分和至少包含脂肪细胞和血管内皮细胞的细胞、且在细胞间具有血管网。
[0087]
人工制作的具有厚度的三维组织体难以在不存在血管的状态下维持,需要从外部供给氧等。与此相对,本实施方式的细胞结构体由于如生物体组织那样在细胞间形成有血管网,因此可期待能够长期维持。另外,还可期待在移植到哺乳类等时变得容易植入。
[0088]
在本说明书中,“细胞结构体”是指细胞介由细胞外基质成分三维地配置的细胞的集合体(块状的细胞集团),其是通过细胞培养而人工制作的集合体。对细胞结构体的形状没有特别限制,例如可举出片状、球体状、大致球体状、椭圆体状、大致椭圆体状、半球状、大致半球状、半圆状、大致半圆状、长方体状、大致长方体状等。在此,生物体组织包含吸汗腺、淋巴管、皮脂腺等,构成比细胞结构体更复杂。因此,能够容易地区分细胞结构体和生物体组织。另外,细胞结构体可以在粘附于支撑体的状态下集合成块状,也可以在不粘附于支撑体的状态下集合成块状。通过使用多个在不粘附于支撑体的状态下集合成块状的细胞结构体,如后所述,能够高效地制造在多个细胞结构体间连接有血管网的细胞组织。
[0089]
(细胞)
[0090]
在本说明书中,“细胞”没有特别限定,例如可以是人、猴、狗、猫、兔、猪、牛、小鼠、大鼠等哺乳类动物来源的细胞。细胞的来源部位也没有特别限定,可以是骨、肌肉、内脏、神经、脑、骨、皮肤、血液等来源的体细胞,也可以是生殖细胞。此外,细胞可以是干细胞,或者也可以是原代培养细胞、传代培养细胞及细胞株细胞等培养细胞。
[0091]
在本说明书中,“干细胞”是指具有自我复制能力及多分化能力的细胞。在干细胞中,包含具有分化为任意的细胞瘤的能力的多能性干细胞、和具有分化为特定的细胞瘤的能力的组织干细胞(也称为成体干细胞)。作为多能性干细胞,例如可举出胚胎干细胞(es细胞)、体细胞来源es细胞(nt es细胞)及人工多能性干细胞(ips细胞)。作为组织干细胞,例如可举出间充质干细胞(例如脂肪干细胞、骨髓来源干细胞)、造血干细胞及神经干细胞。作为脂肪干细胞,例如可举出人脂肪干细胞(adsc)。
[0092]
在本实施方式的细胞结构体中,细胞至少包含脂肪细胞和血管内皮细胞。
[0093]
在本说明书中,“脂肪细胞”是指除了脂肪干细胞以外的所有脂肪细胞。脂肪细胞包括成熟脂肪细胞和脂肪干细胞中不包括的脂肪细胞,脂肪细胞优选包含成熟脂肪细胞,更优选脂肪细胞的总细胞数中的90%以上为成熟脂肪细胞,进一步优选全部为成熟脂肪细胞。脂肪细胞例如可以使用从皮下脂肪组织及心包膜来源的脂肪组织等采集的细胞,也可以对所采集的细胞(例如脂肪干细胞)进行分化诱导后使用。脂肪细胞没有特别限定,在将由脂肪细胞构建的脂肪组织最终建立在生物体的特定部位的组织进行利用的情况下,优选
使用与该部位的组织对应的组织来源的脂肪细胞。
[0094]
作为表示脂肪细胞的成熟度的指标,可以使用脂肪滴的大小。所谓脂肪滴是储存甘油三酯(中性脂肪)、胆固醇等脂质的细胞内细胞器,通过上述脂质类被磷脂单层膜包覆而具有液滴样的形状。另外,在上述磷脂的表面观察到脂肪组织特有的蛋白(围脂滴蛋白等)的表达。成熟的脂肪细胞的脂肪滴的大小间存在差异,但例如当脂肪滴的大小的平均值为20μm以上时,可以视为脂肪细胞一定程度地成熟即为成熟脂肪细胞。
[0095]
脂肪细胞的含有率相对于细胞结构体中的总细胞数,例如可以为5%以上、10%以上、15%以上、20%以上、25%以上、或30%以上,且可以为95%以下、90%以下、80%以下或75%以下。
[0096]
在本说明书中,“血管内皮细胞”是指构成血管内腔表面的扁平状细胞。作为血管内皮细胞,例如可举出人脐带静脉来源的血管内皮细胞(huvec)。
[0097]
血管内皮细胞的含有率相对于细胞结构体中的总细胞数,例如可以为5%以上、10%以上、15%以上、20%以上、25%以上或30%以上,且可以为95%以下、90%以下、80%以下、或75%以下。
[0098]
在本实施方式中,细胞至少包含脂肪细胞和血管内皮细胞,但也可以包含除脂肪细胞和血管内皮细胞以外的细胞。作为除脂肪细胞和血管内皮细胞以外的细胞,例如可举出成纤维细胞、软骨细胞、成骨细胞等间充质细胞、大肠癌细胞(例如人大肠癌细胞(ht29))、肝癌细胞等癌细胞、心肌细胞、上皮细胞(例如人牙龈上皮细胞)、淋巴管内皮细胞、神经细胞、树突状细胞、肝细胞、粘附性细胞(例如免疫细胞)、平滑肌细胞(例如主动脉平滑肌细胞(arota
‑
smc))、胰岛细胞、角化细胞(例如人表皮角化细胞)等。
[0099]
本实施方式的细胞结构体中的脂肪细胞与血管内皮细胞的细胞数之比(脂肪细胞/血管内皮细胞)没有特别限制,例如可以为100/1~1/100、可以为50/1~1/50、可以为20/1~1/1、可以为10/1~1/1、可以为8/1~1/1、可以为7/1~1.2/1、可以为6/1~1.5/1、可以为5/1~2/1、可以为3/1~2/1。
[0100]
(细胞间的血管网)
[0101]
本实施方式的细胞结构体在细胞间具有血管网。“在细胞间具有血管网”是指与生物体组织同样地具有分支的血管以包围细胞的方式在细胞与细胞之间延伸的结构。关于是否形成有与生物体组织同样的血管网,例如可以基于生物体组织中的血管的分支数和/或血管的分支间的长度和/或血管的直径的多样性来判断。例如,在细胞结构体中的血管的分支数的平均值相对于生物体组织中的血管的分支数的平均值为80%以上且150%以下、85%以上且130%以下、或90%以上且120%以下的情况下,可以判断为与生物体组织中的血管的分支数类似。另外,例如在细胞结构体中的血管的分支数的平均值为2.5以上且4.5以下、或3.0以上且4.2以下的情况下,可以判断为与生物体组织中的血管的分支数类似。例如,在细胞结构体中的血管的分支间的长度的平均值相对于生物体组织中的血管的分支间的长度的平均值为80%以上且150%以下、85%以上且130%以下、以及90%以上且120%以下的情况下,可以判断为与生物体组织中的血管的分支间的长度类似。在生物体组织中,观察到粗的血管以及细的血管这两种。因此,例如在与生物体组织同样地观察到直径较粗的血管(例如10μm以上且小于25μm)和较细的血管(例如超过0μm且小于10μm)这两种的情况下,可以判断为具有与生物体组织中的血管的直径同样的多样性。另外,例如在分布有超过
0μm且小于25μm的血管直径整体的60%以上、70%以上或80%以上的情况下,可以判断为具有与生物体组织中的血管的直径同样的多样性。本实施方式的细胞结构体优选在脂肪细胞间具有血管网。在该情况下,不仅具有血管网,被血管包围的脂肪细胞也优选与生物体组织接近。例如,在本实施方式的细胞结构体中的脂肪细胞的脂肪滴的大小的平均值为20μm~180μm或100μm~180μm的情况下,可以判断为细胞结构体具有与生物体组织中的脂肪细胞同样的脂肪细胞。在对上述生物体组织及细胞结构体进行比较时,以相同的条件(例如每一定体积,如果是图像分析,则每一定面积、每一定样品等)对生物体组织和细胞结构体进行比较。
[0102]
(经片段化的细胞外基质成分)
[0103]
在本说明书中,“细胞外基质成分”是由多个细胞外基质分子形成的细胞外基质分子的集合体。细胞外基质是指生物中存在于细胞外的物质。作为细胞外基质,只要不对细胞的生长及细胞集合体的形成造成不良影响,就可以使用任意的物质。作为具体例,可举出胶原、弹性蛋白、蛋白多糖、纤连蛋白、透明质酸、层粘连蛋白、波连蛋白、细胞粘合素、巢蛋白和纤维蛋白等,但并不限定于这些。细胞外基质成分可以单独使用其中的1种,也可以组合使用。细胞外基质成分例如可以包含胶原成分,也可以是胶原成分。本实施方式中的细胞外基质成分优选为存在于动物细胞外的物质、即动物的细胞外基质成分。需要说明的是,只要不对细胞的生长及细胞集合体的形成造成不良影响,细胞外基质分子可以是上述的细胞外基质分子的修饰体及突变体,也可以是化学合成肽等多肽。
[0104]“片段化”是指使细胞外基质成分的集合体成为更小的尺寸。经片段化的细胞外基质成分可以包含经解纤的细胞外基质成分。经解纤的细胞外基质成分是通过施加物理性的力而对上述的细胞外基质成分进行解纤而得到的成分。例如,解纤是在不切断细胞外基质分子内的键的条件下进行的。
[0105]
将胶原成分等细胞外基质成分片段化的方法没有特别限制,可以通过施加物理性的力而进行片段化。将细胞外基质成分片段化的方法例如可以是将块状的细胞外基质成分细细破碎的方法。细胞外基质成分可以在固相中进行片段化,也可以在水性介质中进行片段化。例如,也可以通过超声波式均化器、搅拌式均化器、及高压式均化器等施加物理性的力而将细胞外基质成分片段化。在使用搅拌式均化器的情况下,可以将细胞外基质成分直接均化,也可以在生理盐水等水性介质中进行均化。另外,通过调整进行均化的时间、次数等,也可以得到毫米尺寸、纳米尺寸的经片段化的细胞外基质成分。
[0106]
经片段化的细胞外基质成分的直径及长度可通过利用电子显微镜对各经片段化的细胞外基质成分进行分析而求出。
[0107]
经片段化的细胞外基质成分的平均长度可以为100nm以上且400μm以下,也可以为100nm以上且200μm以下。在一个实施方式中,从容易形成厚的组织的观点出发,经片段化的细胞外基质成分的平均长度可以为5μm以上且400μm以下,可以为10μm以上且400μm以下,也可以为100μm以上且400μm以下。在另一实施方式中,经片段化的细胞外基质成分的平均长度可以为100μm以下,可以为50μm以下,可以为30μm以下,可以为15μm以下,可以为10μm以下,也可以为1μm以下,且可以为100nm以上。经片段化的细胞外基质成分整体中,大部分的经片段化的细胞外基质成分的平均长度优选在上述数值范围内。具体而言,经片段化的细胞外基质成分整体中,优选50%以上的经片段化的细胞外基质成分的平均长度在上述数值
范围内,更优选95%的经片段化的细胞外基质成分的平均长度在上述数值范围内。经片段化的细胞外基质成分优选为平均长度在上述范围内的经片段化的胶原成分。
[0108]
经片段化的细胞外基质成分的平均直径可以为50nm~30μm、可以为4μm~30μm、也可以为5μm~30μm。经片段化的细胞外基质成分优选为平均直径在上述范围内的经片段化的胶原成分。
[0109]
经片段化的细胞外基质成分的平均长度及平均直径可通过利用光学显微镜等测定各经片段化的细胞外基质成分并进行图像分析而求出。在本说明书中,“平均长度”是指所测定的试样的长度方向的长度的平均值,“平均直径”是指所测定的试样的与长度方向正交的方向的长度的平均值。
[0110]
在细胞外基质成分为胶原成分的情况下,经片段化的细胞外基质成分也称为“片段化胶原成分”。“片段化胶原成分”是指将纤维性胶原成分等胶原成分片段化而得到的物质,其维持有三重螺旋结构。片段化胶原成分的平均长度优选为100nm~200μm,更优选为22μm~200μm,更进一步优选为100μm~200μm。片段化胶原成分的平均直径优选为50nm~30μm,更优选为4μm~30μm,更进一步优选为20μm~30μm。
[0111]
经片段化的细胞外基质成分中的至少一部分可以在分子间或分子内交联。细胞外基质成分可以在构成细胞外基质成分的细胞外基质分子的分子内或分子间交联。
[0112]
作为进行交联的方法,例如可举出通过施加热、紫外线、放射线等进行的物理交联、利用交联剂、酶反应等进行的化学交联等方法,其方法没有特别限定。从不妨碍细胞生长的观点出发,优选物理交联。交联(物理交联及化学交联)可以是介由共价键的交联。
[0113]
在细胞外基质成分包含胶原成分的情况下,交联可以在胶原分子(三重螺旋结构)之间形成,也可以在由胶原分子形成的胶原细纤维之间形成。交联可以是利用热进行的交联(热交联)。热交联例如可以通过使用真空泵在减压下进行加热处理来实施。在进行胶原成分的热交联的情况下,细胞外基质成分可以通过胶原分子的氨基与同一或其他胶原分子的羧基形成肽键(
‑
nh
‑
co)而交联。
[0114]
通过使用交联剂,也可以使细胞外基质成分交联。交联剂例如可以为能够使羧基与氨基交联的交联剂、或者能够使氨基彼此交联的交联剂。作为交联剂,例如从经济性、安全性及操作性的观点出发,优选醛类、碳二亚胺类、环氧化物类和咪唑系交联剂,具体而言,可举出戊二醛、1
‑
乙基
‑3‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐、1
‑
环己基
‑3‑
(2
‑
吗啉基
‑4‑
乙基)碳二亚胺磺酸盐等水溶性碳二亚胺。
[0115]
交联度的定量可以根据细胞外基质成分的种类、进行交联的手段等适当选择。交联度可以为1%以上、2%以上、4%以上、8%以上、或12%以上,且可以为30%以下、20%以下、或15%以下。通过使交联度在上述范围内,细胞外基质分子能够适度地分散,并且干燥保存后的再分散性良好。
[0116]
在细胞外基质成分中的氨基用于交联的情况下,交联度可以基于非专利文献2等中记载的tnbs法进行定量。基于tnbs法的交联度也可以在上述的范围内。基于tnbs法的交联度是细胞外基质所具有的氨基中用于交联的氨基的比例。在细胞外基质成分包含胶原成分的情况下,优选通过tnbs法测定的交联度在上述范围内。
[0117]
交联度也可以通过对羧基进行定量来计算。例如,在不溶性于水的细胞外基质成分的情况下,也可以通过tbo(甲苯胺蓝o)法进行定量。通过tbo法得到的交联度也可以在上
述的范围内。
[0118]
以上述细胞结构体(干燥重量)为基准,细胞结构体中的细胞外基质成分含有率可以为0.01~90质量%、优选为10~90质量%、优选为10~80质量%、优选为10~70质量%、优选为10~60质量%、优选为1~50质量%、优选为10~50质量%、更优选为10~30质量%、更优选为20~30质量%。
[0119]
在此,“细胞结构体中的细胞外基质成分”是指构成细胞结构体的细胞外基质成分,可以来源于内源性细胞外基质成分,也可以来源于外源性细胞外基质成分。
[0120]“内源性的细胞外基质成分”是指由细胞外基质产生细胞产生的细胞外基质成分。作为细胞外基质产生细胞,例如可举出上述的成纤维细胞、软骨细胞、成骨细胞等间充质细胞。内源性细胞外基质成分可以为纤维性,也可以为非纤维性。
[0121]“外源性的细胞外基质成分”是指从外部供给的细胞外基质成分。本实施方式的细胞结构体包含作为外源性的细胞外基质成分的经片段化的细胞外基质成分。外源性的细胞外基质成分与作为来源的动物种的内源性的细胞外基质成分可以相同也可以不同。作为来源的动物种,例如可举出人、猪、牛等。另外,外源性的细胞外基质成分也可以是人工的细胞外基质成分。
[0122]
在细胞外基质成分为胶原成分的情况下,外源性的细胞外基质成分也称为“外源性胶原成分,”是指从外部供给的胶原成分。“外源性胶原成分”是由多个胶原分子形成的胶原分子的集合体,具体地可举出纤维性胶原、非纤维性胶原等。外源性胶原成分优选为纤维性胶原。上述纤维性胶原是指成为胶原纤维主成分的胶原成分,例如可举出i型胶原、ii型胶原、iii型胶原。上述纤维性胶原可以使用市售的胶原,作为其具体例,可举出日本ha m株式会社制的猪皮来源的i型胶原。作为外源性的非纤维性胶原,例如可举出iv型胶原。
[0123]
在外源性的细胞外基质成分中,所来源的动物种可以与细胞不同。另外,在细胞包含细胞外基质产生细胞的情况下,在外源性的细胞外基质成分中,所来源的动物种可以与细胞外基质产生细胞不同。即,外源性的细胞外基质成分可以是异种细胞外基质成分。
[0124]
即,在细胞结构体包含内源性细胞外基质成分及经片段化的细胞外基质成分的情况下,构成上述细胞结构体的细胞外基质成分含有率是指内源性细胞外基质成分和经片段化的细胞外基质成分的合计量。上述细胞外基质含有率可以根据所得到的细胞结构体的体积和经脱细胞化的细胞结构体的质量来计算。
[0125]
例如,在细胞结构体所包含的细胞外基质成分为胶原成分的情况下,作为对细胞结构体中的胶原成分量进行定量的方法,例如可举出以下那样的对羟基脯氨酸进行定量的方法。在溶解有细胞结构体的溶解液中混合盐酸(hcl),在高温下孵育规定的时间后恢复至室温,将离心分离后的上清液稀释至规定的浓度,由此制备样品。将羟基脯氨酸标准溶液与样品同样地进行处理后,阶段性地进行稀释而制备标准溶液。对样品和标准溶液分别用羟基脯氨酸分析缓冲液和检测试剂进行规定的处理,测定570nm的吸光度。通过将样品的吸光度与标准溶液进行比较来计算胶原成分量。需要说明的是,也可以将细胞结构体直接悬浮在高浓度的盐酸中,将溶解后的溶解液离心分离而回收上清液,用于胶原成分定量。另外,溶解的细胞结构体可以为直接从培养液中回收的状态,也可以在回收后进行干燥处理、在除去了液体成分的状态下使其溶解。但是,在将直接从培养液中回收的状态的细胞结构体溶解而进行胶原成分定量的情况下,由于预测因细胞结构体所吸收的培养基成分和实验手
法的问题所引起的培养基残留的影响,细胞结构体重量的测量值会发生偏差,因此从稳定地测量结构体的重量和每单位重量中所占的胶原成分量的观点出发,优选以干燥后的重量为基准。
[0126]
作为对胶原成分量进行定量的方法,更具体而言,例如可举出以下方法。
[0127]
(样品的制备)
[0128]
将进行了冷冻干燥处理的细胞结构体的总量与6mol/l hcl混合,用加热块在95℃下孵育20小时以上后,恢复至室温。以13000g离心分离10分钟后,回收样品溶液的上清液。在后述的测定中,用6mol/l hcl进行适当稀释以使结果收束在标准曲线的范围内后,用100μl的超纯水稀释200μl,由此制备样品。样品使用35μl。
[0129]
(标准溶液的制备)
[0130]
在螺口试管中加入125μl的标准溶液(1200μg/ml醋酸溶液)和125μl的12mol/l hcl进行混合,用加热块在95℃下孵育20小时后,恢复至室温。以13000g离心分离10分钟后,用超纯水稀释上清液,制作300μg/ml的s1,将s1阶段性地稀释,制作s2(200μg/ml)、s3(100μg/ml)、s4(50μg/ml)、s5(25μg/ml)、s6(12.5μg/ml)、s7(6.25μg/ml)。也准备仅有4mol/hcl 90μl的s8(0μg/ml)。
[0131]
(分析)
[0132]
将35μl的标准溶液和样品分别加入到平板(quickzyme total collage n assay试剂盒附带、quickzyme biosciences公司)中。将75μl的分析缓冲液(上述试剂盒附带)加入到各孔中。用密封件封闭平板,摇动20分钟,同时在室温下进行孵育。剥离密封件,将75μl的检测试剂(detection reag ent:reagent a:b=30μl:45μl,上述试剂盒附带)加入到各孔中。用密封件封闭平板,通过摇动混合溶液,在60℃下孵育60分钟。在冰上充分冷却,剥离密封件,测定570nm的吸光度。通过将样品的吸光度与标准溶液进行比较来计算胶原成分量。
[0133]
细胞结构体中所占的胶原成分也可以通过其面积比或体积比来确定。“通过面积比或体积比来确定”是指,例如在使细胞结构体中的胶原成分为能够通过已知的染色方法(例如使用了抗胶原抗体的免疫染色、或马松三色染色)等与其他组织结构物区别的状态的基础上,使用肉眼观察、各种显微镜和图像分析软件等,计算胶原成分在整个细胞结构体中所占的存在区域的比率。在通过面积比确定的情况下,并不限定是通过细胞结构体中的怎样的截面或表面来确定面积比,例如在细胞结构体为球状体等的情况下,可以通过从其大致中心部通过的剖视图来确定。
[0134]
例如,在通过面积比确定细胞结构体中的胶原成分的情况下,其面积的比例以上述细胞结构体整体的面积为基准为0.01~99%,优选为1~99%,优选为5~90%,优选为7~90%,优选为20~90%,更优选为50~90%。“细胞结构体中的胶原成分”如上所述。构成细胞结构体的胶原成分的面积的比例是指将内源性胶原成分和外源性胶原成分合起来的面积的比例。胶原成分的面积的比例例如可以将所得到的细胞结构体用马松三色染色,作为蓝色染色的胶原成分的面积与从细胞结构体的大致中心部通过的截面的整体面积的比例来计算。
[0135]
细胞结构体在胰蛋白酶的浓度为0.25%、温度为37℃、ph为7.4、反应时间为15分钟的条件下进行胰蛋白酶处理后的残留率优选为70%以上,更优选为80%以上,更进一步
优选为90%以上。这样的细胞结构体在培养中或培养后不易发生由酶引起的分解,是稳定的。上述残留率例如可以根据胰蛋白酶处理前后的细胞结构体的质量来计算。
[0136]
上述细胞结构体在胶原酶的浓度为0.25%、温度为37℃、ph为7.4、反应时间为15分钟的条件下进行胶原酶处理后的残留率可以为70%以上,更优选为80%以上,更进一步优选为90%以上。这样的细胞结构体不易在培养中或培养后发生由酶引起的分解,是稳定的。
[0137]
上述细胞结构体的厚度优选为10μm以上,更优选为100μm以上,进一步优选为1000μm以上。这样的细胞结构体是更接近生物体组织的结构,适合作为实验动物的替代品和移植材料。对细胞结构体的厚度的上限没有特别限制,例如可以为10mm以下,可以为3mm以下,可以为2mm以下,可以为1.5mm以下,也可以为1mm以下。
[0138]
在此,“细胞结构体的厚度”在细胞结构体为片状或长方体状的情况下,是指与主面垂直的方向的两端的距离。在上述主面存在凹凸的情况下,厚度是指上述主面的最薄部分的距离。
[0139]
另外,在细胞结构体为球体状或大致球体状的情况下,厚度是指其直径。另外,在细胞结构体为椭圆体状或大致椭圆体状的情况下,厚度是指其短径。在细胞结构体为大致球体状或大致椭圆体状且表面存在凹凸的情况下,厚度是指从细胞结构体的重心通过的直线与上述表面交叉的2点间的距离中的最短的距离。
[0140]
(纤维蛋白)
[0141]
本实施方式的细胞结构体可以包含纤维蛋白。纤维蛋白是凝血酶作用于纤维蛋白原而从aα链、bβ链的n末端释放a链、b链而产生的成分。纤维蛋白是聚合物,一般不溶于水。纤维蛋白是通过使纤维蛋白原与凝血酶接触而形成的。
[0142]
[细胞结构体的制造方法]
[0143]
本实施方式的在细胞间具有血管网的细胞结构体的制造方法包含下述工序:使经片段化的细胞外基质成分与细胞接触的接触工序、和对经片段化的细胞外基质所接触的细胞进行培养的培养工序。上述接触工序中,细胞(i)至少包含脂肪细胞、干细胞和血管内皮细胞、或(ii)至少包含脂肪干细胞和血管内皮细胞。
[0144]
(接触工序)
[0145]
在本实施方式的制造方法中,接触工序是使经片段化的细胞外基质成分与细胞接触的工序。
[0146]
接触工序中的细胞(i)至少包含脂肪细胞、干细胞和血管内皮细胞、或(ii)至少包含脂肪干细胞和血管内皮细胞。关于细胞和各细胞,如上所述。(i)中,可以包含除脂肪细胞、干细胞和血管内皮细胞以外的细胞,(iii)中,可以包含除脂肪干细胞和血管内皮细胞以外的细胞。(i)中的干细胞优选为脂肪干细胞。另外,脂肪细胞优选包含成熟脂肪细胞。
[0147]
经片段化的细胞外基质成分通过分散在水性介质中,可容易地在水性介质中与细胞接触,可促进细胞结构体的形成。
[0148]
在接触工序中,在水性介质中使细胞外基质成分与细胞接触。作为接触工序,可举出将含有经片段化的细胞外基质成分的水性介质与含有细胞的水性介质混合的方法、向含有经片段化的细胞外基质成分的水性介质中添加细胞的方法、在含有细胞的培养液中加入含有细胞外基质成分的水性介质的方法、向含有细胞外基质成分的水性介质中加入细胞的
方法、在预先准备的水性介质中分别加入细胞外基质成分和细胞的方法等方法,但并不限于这些。
[0149]
另外,使细胞与经片段化的细胞外基质成分接触的顺序也没有特别限制,例如在上述(i)的情况下,可以在向含有经片段化的细胞外基质成分的水性介质中添加干细胞和血管内皮细胞后添加脂肪细胞,可以按照干细胞、血管内皮细胞、脂肪细胞的顺序添加到含有经片段化的细胞外基质成分的水性介质中,可以与干细胞、血管内皮细胞和脂肪细胞同时添加到含有经片段化的细胞外基质成分的水性介质中,可以在含有干细胞、血管内皮细胞和脂肪细胞的水性介质中添加含有经片段化的细胞外基质成分的水性介质。上述各添加后可以通过搅拌等进行混合,也可以不混合。另外,在接触工序中,也可以包含在使经片段化的细胞外基质成分与细胞接触后孵育一定时间的工序。
[0150]
接触工序也可以在水性介质中形成细胞层后进行。即,接触工序也可以通过在水性介质中形成细胞层后使细胞外基质成分与其接触来进行。通过在使细胞层与细胞外基质成分接触前形成,能够制作下层部的细胞密度高的细胞结构体。
[0151]
经片段化的细胞外基质成分可以通过上述方法得到。经片段化的细胞外基质成分可以通过将细胞外基质成分在水性介质中进行片段化来得到。即,本实施方式的制造方法可以具备在接触工序前将细胞外基质成分在水性介质中进行片段化的工序(片段化工序)。水性介质可以与上述的含有经片段化的细胞外基质成分的水性介质相同。
[0152]
经片段化的细胞外基质成分可以是上述例示过的成分,也可以含有经片段化的胶原成分。
[0153]
本实施方式的制造方法在片段化工序前还可以具备对细胞外基质成分进行加热而使细胞外基质成分中的至少一部分交联的工序,在片段化工序后且接触工序前还可以具备对细胞外基质成分进行加热而使细胞外基质成分中的至少一部分交联的工序。
[0154]
在进行交联的工序中,对细胞外基质成分进行加热时的温度(加热温度)和时间(加热时间)可以适当确定。加热温度例如可以为100℃以上,可以为200℃以下,也可以为220℃以下。加热温度具体而言,例如可以为100℃、110℃、120℃、130℃、140℃、150℃、160℃、170℃、180℃、190℃、200℃、220℃等。加热时间(在上述加热温度下进行保持的时间)可以根据加热温度适当设定。例如在100℃~200℃下进行加热的情况下,加热时间可以为6小时以上且72小时以下,更优选为24小时以上且48小时以下。在进行交联的工序中,可以在不存在溶剂的条件下进行加热,另外也可以在减压条件下进行加热。
[0155]
本实施方式的制造方法在片段化工序后可以具备将经片段化的细胞外基质成分干燥的干燥工序。
[0156]
在干燥工序中,对经解纤的细胞外基质成分进行干燥。干燥例如可以通过冷冻干燥法实施。在解纤工序后,通过进行干燥工序,从包含片段化细胞外基质成分及水性介质的液体中除去水性介质。所谓除去水性介质,并不是指在经断片化的细胞外基质成分中没有附着任何水分,而是指通过上述通常的干燥方法,常识性地能够达到的程度的不附着水分。
[0157]
干细胞的含有率相对于接触工序中的总细胞数,可以为5%以上、10%以上、15%以上、20%以上、25%以上、或30%以上,且可以为95%以下、90%以下、80%以下、或75%以下。
[0158]
血管内皮细胞的含有率相对于接触工序中的总细胞数,可以为5%以上、10%以
上、15%以上、20%以上、25%以上、或30%以上,且可以为95%以下、90%以下、80%以下、或75%以下。
[0159]
接触工序中的细胞外基质成分的浓度可以根据目标细胞结构体的形状、厚度、培养器的尺寸等适当确定。例如,接触工序中的水性介质中的细胞外基质成分的浓度可以为0.1~90质量%,也可以为1~30质量%。
[0160]
接触工序中的经片段化的细胞外基质成分的量例如相对于1.0
×
106cells的细胞,可以为0.1~100mg、0.5~50mg、0.8~25mg、1.0~10mg、1.0~5.0mg、1.0~2.0mg、或1.0~1.8mg,也可以为0.7mg以上、1.1mg以上、1.2mg以上、1.3mg以上或1.4mg以上,且可以为7.0mg以下、3.0mg以下、2.3mg以下、1.8mg以下、1.7mg以下、1.6mg以下或1.5mg以下。
[0161]
在接触工序中,细胞外基质成分与细胞的质量比(细胞外基质成分/细胞)优选为1/1~1000/1,更优选为9/1~900/1,进一步优选为10/1~500/1。
[0162]
接触工序中的干细胞与血管内皮细胞的细胞数之比(干细胞/血管内皮细胞)没有特别限制,例如可以为100/1~1/100、可以为50/1~1/50、可以为20/1~1/1、可以为10/1~1/1、可以为8/1~1/1、可以为7/1~1.2/1、可以为6/1~1.5/1、可以为5/1~2/1、可以为3/1~2/1。
[0163]
在接触工序、或接触工序后且培养工序前也可以包含添加纤维蛋白原和/或凝血酶的工序。在添加纤维蛋白原和凝血酶这两者的情况下,例如可以同时添加纤维蛋白原和凝血酶,也可以在先添加纤维蛋白原之后添加凝血酶。添加纤维蛋白原和/或凝血酶的时机没有特别限制,例如可以添加到含有干细胞、血管内皮细胞、脂肪细胞及细胞外基质成分的水性介质中,也可以添加到含有干细胞、血管内皮细胞及细胞外基质成分的水性介质中。另外,例如也可以在含有干细胞、血管内皮细胞及细胞外基质成分的水性介质中添加纤维蛋白原后添加脂肪细胞,然后添加凝血酶。通过添加纤维蛋白原和/或凝血酶,能够抑制在后述的培养工序中可能发生的皱缩,容易控制细胞结构体的形状和大小。另外,由于能够使细胞与细胞外基质成分的悬浮液凝胶化,因此在将该悬浮液滴加到培养器(支撑体)后,能够容易地从培养器剥离。另外,在细胞包含成熟的脂肪细胞的情况下,由于成熟的脂肪细胞内部的脂肪滴的影响,脂肪细胞浮游,脂肪细胞和其他细胞有可能在不均匀的状态下被培养,但通过使悬浮液凝胶化,可维持各细胞及细胞外基质成分均匀混合的状态,容易维持细胞与细胞外基质成分接近的状态。
[0164]
在接触工序后且培养工序前还可以包含使水性介质中的细胞外基质成分与细胞一起沉降的工序。通过进行这样的工序,细胞结构体中的细胞外基质成分和细胞的分布变得更均匀。作为具体的方法,没有特别限制,例如可举出对包含细胞外基质成分和细胞的培养液进行离心操作的方法。
[0165]
(培养工序)
[0166]
在本实施方式的制造方法中,培养工序是对经片段化的细胞外基质所接触的细胞进行培养的工序。
[0167]
对经片段化的细胞外基质所接触的细胞进行培养的方法没有特别限制,可以根据所培养的细胞的种类通过适当的培养方法进行。例如,培养温度可以为20℃~40℃,也可以为30℃~37℃。培养基的ph可以为6~8,也可以为7.2~7.4。培养时间可以为1天~2周,也可以为1周~2周。
[0168]
经片段化的细胞外基质所接触的细胞的培养中使用的培养器(支撑体)没有特别限制,例如可以是孔插件、低吸附平板、具有u字或v字等底面形状的平板。可以将上述细胞在粘附于支撑体的状态下进行培养,也可以将上述细胞在不粘附于支撑体的状态下进行培养,也可以在培养中途从支撑体分离而进行培养。在将上述细胞在不粘附于支撑体的状态下进行培养的情况下、或在培养中途从支撑体分离而进行培养的情况下,优选使用抑制细胞对支撑体的粘附的具有u字或v字等底面形状的平板、低吸附平板。
[0169]
培养基没有特别限制,可以根据所培养的细胞的种类选择合适的培养基。作为培养基,例如可举出eagle’s mem培养基、dmem、modified eagle培养基(mem)、minimum essential培养基、rpmi、及glutamax培养基等。培养基可以是添加有血清的培养基,也可以是无血清培养基。培养基可以是混合两种培养基而成的混合培养基。
[0170]
培养工序中的培养基中的细胞密度可以根据目标细胞结构体的形状、厚度、培养器的尺寸等适当确定。例如,培养工序中的培养基中的细胞密度可以为1~108cells/ml,也可以为103~107cells/ml。另外,培养工序中的培养基中的细胞密度也可以与接触工序中的水性介质中的细胞密度相同。
[0171]
通过本实施方式的制造方法制造的细胞结构体在培养中的收缩率优选为20%以下,更优选为15%以下,进一步优选为10%以下。上述收缩率例如可以通过以下的式子计算。式中,l1表示培养后第1天的细胞结构体的最长部分的长度,l3表示培养后第3天的细胞结构体中的对应部分的长度。
[0172]
收缩率(%)={(l1
‑
l3)/l1}
×
100
[0173]
在上述的例子中,根据培养后第1天的细胞结构体和培养第3天的细胞结构体计算收缩率,但也可以根据包含培养结束的时间点的培养期间的任意时间点的细胞结构体计算收缩率。例如,可以根据培养后第1天的细胞结构体和培养第2天的细胞结构体计算,可以根据培养后第1天的细胞结构体和培养第5天的细胞结构体计算,也可以根据培养后第1天的细胞结构体和培养第8天的细胞结构体计算。
[0174]
上述培养工序(以下也表示为“第一培养工序,”另外将最初的接触工序也表示为“第一接触工序”)后,可以包含进一步使细胞接触的工序(第二接触工序)、对细胞进行培养的工序(第二培养工序)。第二接触工序及第二培养工序中的上述细胞可以与第一接触工序及第一培养工序中使用的细胞为同种,也可以为不同种。通过第二接触工序及第二培养工序,能够制作双层结构的细胞结构体。另外,通过进一步反复包含接触工序和培养工序,能够制作多层的细胞结构体,还能够制作更复杂的接近生物体的组织。
[0175]
根据本实施方式的制造方法,能够制造在细胞间具有血管网的细胞结构体。在细胞间具有血管网的细胞结构体如上所述。
[0176]
上述培养工序也可以包含在将上述经片段化的细胞外基质所接触的细胞在不粘附于支撑体的状态下进行培养的工序。由此,能够制造在不粘附于支撑体的状态下集合成块状的细胞结构体。在上述经片段化的细胞外基质所接触的细胞粘附于支撑体的情况下,上述培养工序可以包含将上述经片段化的细胞外基质所接触的细胞从支撑体分离的工序。在上述培养工序中,通过在上述经片段化的细胞外基质所接触的细胞从最初不粘附于支撑体的情况下直接进行培养,能够制造在不粘附于支撑体的状态下集合成块状的细胞结构体。
[0177]
将上述经片段化的细胞外基质所接触的细胞从支撑体分离的方法没有特别限制,例如可以使用低粘附性的支撑体,通过追加培养液而将细胞从支撑体分离,可以利用器具等直接将细胞物理性地从支撑体分离,可以通过施予振动而将细胞从支撑体分离,也可以使用在表面涂布有响应热和光等刺激而将支撑体与细胞的结合脱离的功能性材料的支撑体,通过施予刺激而将细胞从支撑体分离。对于通过追加培养液而将细胞从支撑体分离时的培养液,可以使用上述例示过的培养基等。
[0178]
在培养工序中,作为将上述经片段化的细胞外基质所接触的细胞从最初在不粘附于支撑体的状态下进行培养的方法,例如可举出下述方法:使包含上述经片段化的细胞外基质所接触的细胞的悬浮液凝胶化,逐渐滴加到培养液中进行培养的方法,以及在高粘度的溶剂中将上述经片段化的细胞外基质所接触的细胞的形状一定程度地固定后,仅除去溶剂而转移至培养容器的方法。
[0179]
在上述培养工序中,将上述经片段化的细胞外基质所接触的细胞从支撑体分离的时机没有特别限制,例如可以在培养开始后的1天~7天进行,可以在1小时~24小时进行,可以在1分钟~60分钟进行,可以在5分钟~30分钟进行,也可以在10分钟~20分钟进行。
[0180]
将所述经片段化的细胞外基质所接触的细胞从支撑体分离后的培养期间没有特别限制,可以为1天以上,可以为1天~21天,可以为3天~14天,也可以为7天~14天。
[0181]
[细胞组织及其制造方法]
[0182]
使用多个上述的在不粘附于支撑体的状态下集合成块状的细胞结构体、即“包含经片段化的细胞外基质成分和细胞、在细胞间具有血管网、且在不粘附于支撑体的状态下集合成块状的细胞结构体(其中,上述细胞至少包含脂肪细胞和血管内皮细胞),”能够制造上述血管网在多个细胞结构体之间连接的细胞组织。
[0183]
上述细胞组织的制造包含对多个不粘附于支撑体的上述细胞结构体进行悬浮培养的工序。由于多个上述细胞结构体在悬浮培养的过程中相互粘附,血管网在细胞结构体之间连接,因此能够简单地制造血管网相连的大的细胞组织。所使用的细胞结构体的数量和大小可以根据细胞组织的用途、细胞组织所期望的大小等适当选择。另外,关于悬浮培养中使用的培养基(培养液)的种类、培养的条件,也可以适当选择,例如可以在上述(培养工序)中例示过的那样的培养基、条件下进行。
[0184]
[细胞结构体的用途]
[0185]
如上所述,本实施方式的细胞结构体如生物体组织那样在细胞间形成有血管网,在移植到哺乳类等动物时可期待变得容易植入,因此能够作为移植用。移植中使用的细胞结构体可以是1个,也可以是多个。在多个的情况下,例如可以使用1个~1000个、10个~500个、或50个~200个。
[0186]
作为移植对象的动物没有特别限制,例如可以是哺乳类,可以是人,也可以是猴、狗、猫、兔、猪、牛、小鼠以及大鼠等非人动物。
[0187]
本实施方式的移植方法包含将本实施方式的具有血管结构的细胞结构体移植到动物的工序。在进行移植之前,可以进一步包含准备要移植的动物的工序和/或通过上述方法制作细胞结构体的工序。移植方法没有特别限制,可以根据移植对象等通过适当公知的外科方法等进行。作为外科方法,例如可举出切开移植对象的皮肤、直接移植到皮肤下,通过注射器等注入到移植对象的皮肤下。所移植的细胞结构体可以是1个,也可以是多个,另
外也可以是包含多个细胞结构体的细胞组织。细胞结构体或细胞组织可以使用从培养基中采集的细胞结构体或细胞组织,也可以根据移植的形态等,使用使细胞结构体或细胞组织例如适当地凝胶化
‑
半凝胶化而成的物质(例如纤维蛋白凝胶),也可以使用多个细胞结构体分散的分散液。另外,可以将在从培养基中采集的多个在不粘附于支撑体的状态下集合成块状的细胞结构体中添加纤维蛋白而成的物质用于移植。包含脂肪细胞的本实施方式的细胞结构体例如可应用于外伤、因肿瘤摘出而产生的软组织缺损以及乳房切除等后的组织重建。
[0188]
移植的细胞结构体的血管网与移植对象的移植部位周边的移植对象自身的血管连接。在使用了多个在不粘附于支撑体的状态下集合成块状的细胞结构体的情况下,多个细胞结构体间也有血管网连接。通过移植多个在不粘附于支撑体的状态下集合成块状的细胞结构体,在移植对象中形成的脂肪组织在多个细胞结构体间有血管网连接,并且也与移植对象自身的血管连接,因此植入性更优异。
[0189]
本实施方式的制造非人模型动物的方法包含将本实施方式的细胞结构体移植到非人动物的工序。在进行移植之前,可以进一步包括准备要移植的非人动物的工序和/或通过上述的方法制作细胞结构体的工序。移植方法如上所述,所移植的细胞结构体可以是1个,也可以是多个,另外也可以是包含多个细胞结构体的细胞组织。本实施方式的制造非人模型动物的方法可以包含将细胞结构体移植到非人动物后,例如生长7天以上、30天以上或90天以上的工序。本实施方式的非人模型动物可用于将用于动物实验而得到的数据换算为人。为了制造非人模型动物,优选使用抑制了对移植物(移植片)的排斥的非人动物,例如免疫力降低或免疫缺陷的非人动物。非人模型动物例如可以用作与脂肪组织相关的炎症性疾病等病理学体内模型,或者用作针对糖尿病、肥胖等的药品的筛选以及针对橘皮组织(cellul ite)、肥胖等的化妆品的分析筛选。
[0190]
本实施方式的细胞结构体自身也可以用作实验动物的替代品、移植材料等,作为具体例,可以应用于如上所述的组织重建、病理学体内模型、药品的筛选(药剂的评价)、化妆品的分析筛选等。
[0191]
[药剂的效果的评价方法及筛选方法]
[0192]
如上所述,本实施方式的细胞结构体与生物体组织同样地具有分支的血管以包围细胞的方式在细胞与细胞之间延伸的结构。因此,使用本实施方式的细胞结构体,能够评价抑制或促进脂肪组织的代谢的药剂的效果,或者筛选药剂。
[0193]
作为本发明的一个实施方式,提供一种抑制或促进脂肪组织的代谢的药剂的效果的评价方法,其使用了细胞结构体并包含下述工序:向细胞结构体给予抑制或促进脂肪组织的代谢的药剂的给予工序,和根据给予了上述药剂的细胞结构体中的代谢的变化,评价药剂的效果的评价工序。根据本实施方式,能够有效地评价抑制或促进脂肪组织的代谢的药剂的效果。
[0194]
在给予工序中,将抑制或促进脂肪组织的代谢的药剂给予细胞结构体。药剂可以是已知抑制或促进脂肪组织的代谢的药剂,也可以是不知可抑制或促进脂肪组织的代谢的药剂。
[0195]
作为抑制脂肪组织的代谢的药剂,例如可举出胰岛素、tnfα抑制剂。已知胰岛素促进脂肪酸、葡萄糖的摄入。另外,已知脂肪细胞在生物体内主要介由fatp
‑
1和fatp
‑
4的转运
蛋白摄入脂肪酸,但tnfα可抑制这些转运蛋白的功能,抑制脂肪酸的摄入。作为促进脂肪组织的代谢的药剂,例如可举出芹菜素、细胞松弛素b、异丙肾上腺素。已知脂肪细胞在生物体内主要介由glut
‑
1和glut
‑
4的转运蛋白摄入葡萄糖,但芹菜素和细胞松弛素b可抑制这些转运蛋白的功能,抑制葡萄糖的摄入。另外,已知儿茶酚胺促进所摄入的脂肪酸或葡萄糖的释放,因此人工合成的儿茶酚胺即异丙肾上腺素可作为脂肪酸或葡萄糖的释放促进剂发挥功能。抑制或促进脂肪组织的代谢的药剂可以是除上述以外的脂肪酸和/或葡萄糖摄入促进剂或抑制剂、脂肪酸和/或葡萄糖释放促进剂或抑制剂。
[0196]
抑制或促进脂肪组织的代谢的药剂的给予可以通过使用含有上述药剂的培养基作为培养细胞结构体的培养基来实施,也可以通过在培养细胞结构体的培养基中添加上述药剂来实施。
[0197]
给予抑制或促进脂肪组织的代谢的药剂的细胞结构体可以由培养了1天以上的细胞结构体构成,可以由培养了5天以上的细胞结构体构成,可以由培养了6天以上的细胞结构体构成,可以由培养了7天以上的细胞结构体构成,可以由培养了更多天数的细胞结构体构成,也可以由培养了7天以上且14天以下的期间的细胞结构体构成。
[0198]
在评价工序中,通过给予了药剂的细胞结构体中的代谢的变化来评价药效。药效可以将细胞结构体中的代谢、例如葡萄糖和/或脂肪酸的摄入的变化、和/或所摄入的葡萄糖和/或脂肪酸的释放的变化作为指标来进行评价。通过将脂肪组织中的除葡萄糖和脂肪酸以外的代谢物的变化作为指标,也能够评价脂肪组织中的其他代谢系统。细胞结构体中的代谢的变化例如可以是细胞结构体中的每单位时间的葡萄糖和/或脂肪酸的摄入量的变化、和/或细胞结构体中的每单位时间的葡萄糖和/或脂肪酸的释放量的变化。药效可以仅基于1种上述指标的变化来进行评价,也可以基于2种以上的上述指标来进行评价。代谢的变化可以通过定性的比较来评价,也可以通过定量的比较来评价。
[0199]
评价工序例如可以通过将给予了药剂的细胞结构体中的代谢与未给予药剂的细胞结构体的代谢进行比较来进行。
[0200]
评价工序可以进行多次。即,药效的评价可以在药剂给予后每隔规定的间隔进行多次。
[0201]
在评价工序中,例如,与未给予药剂的细胞结构体的代谢相比,在给予了药剂的细胞结构体中的代谢较低的情况下,评价为作为抑制脂肪组织的代谢的药剂有效,在给予了药剂的细胞结构体中的代谢较高或没有变化的情况下,可以评价为作为抑制脂肪组织的代谢的药剂无效。另外,例如与未给予药剂的细胞结构体中的代谢相比,在给予了药剂的细胞结构体中的代谢较高的情况下,评价为作为促进脂肪组织的代谢的药剂有效,在给予了药剂的细胞结构体中的代谢较低或没有变化的情况下,可以评价为作为促进脂肪组织的代谢的药剂无效。
[0202]
另外,作为本发明的一个实施方式,提供一种抑制或促进脂肪组织的代谢的药剂的筛选方法,其使用了细胞结构体。根据本实施方式,能够有效地选拔抑制或促进脂肪组织的代谢的药剂。
[0203]
抑制或促进脂肪组织的代谢的药剂的筛选方法使用了细胞结构体,并可以包含下述工序:在上述评价方法中的评价工序中,选择被评价为作为抑制或促进脂肪组织的代谢有效的药剂。
[0204]
另外,筛选方法例如可以包含下述工序:
[0205]
测定给予了药剂的细胞结构体中的代谢的工序,和
[0206]
将给予了药剂的细胞结构体中的代谢与未给予药剂的细胞结构体中的代谢进行比较,在给予了药剂的细胞结构体中的代谢较低时,选择上述药剂作为抑制脂肪组织的代谢的药剂的候选物质;
[0207]
或者包含下述工序:
[0208]
测定给予了药剂的细胞结构体中的代谢的工序,和
[0209]
将给予了药剂的细胞结构体中的代谢与未给予药剂的细胞结构体中的代谢进行比较,在给予了药剂的细胞结构体中的代谢较高时,选择上述药剂作为促进脂肪组织的代谢的药剂的候选物质。
[0210]
细胞结构体中的代谢的比较例如可以将葡萄糖和/或脂肪酸的摄入和/或所摄入的葡萄糖和/或脂肪酸的释放作为指标来进行。也可以将脂肪组织中的除葡萄糖和脂肪酸以外的代谢物的变化作为指标。细胞结构体中的代谢的比较例如可以将细胞结构体中的每单位时间的葡萄糖和/或脂肪酸的摄入量、和/或细胞结构体中的每单位时间的葡萄糖和/或脂肪酸的释放量作为指标来进行。细胞结构体中的代谢可以仅基于1种上述指标来进行比较,也可以基于2种以上的上述指标来进行比较。比较可以是定性的比较,也可以是定量的比较。
[0211]
候选物质例如可以是脂肪酸和/或葡萄糖摄入促进剂或抑制剂、脂肪酸和/或葡萄糖释放促进剂或抑制剂,也可以是除葡萄糖和脂肪酸以外的代谢物的摄入促进剂或摄入抑制剂、释放促进剂或释放抑制剂。
[0212]
细胞结构体中的代谢的比较可以进行多次。即,细胞结构体中的代谢的比较可以在药剂给予后每隔规定的间隔进行多次。
[0213]
抑制或促进脂肪组织的代谢的药剂、药剂的给予可以与上述的评价方法同样地进行。另外,关于所使用的细胞结构体等,也可以使用上述的细胞结构体。
[0214]
实施例
[0215]
<试验例1:经解纤的胶原成分的制作>
[0216]
通过在200℃下对猪皮来源的胶原i型海绵片段(日本ham株式会社制)100mg进行24小时加热,得到至少一部分交联的胶原成分(交联胶原成分)。需要说明的是,在200℃的加热前后,胶原在外观上没有确认到大的变化。将50mg的交联胶原成分放入15ml试管中,加入5ml的超纯水,使用均化器(as one公司vh
‑
10)进行6分钟的均化,由此对交联胶原成分进行解纤。
[0217]
在21℃的条件下,以10000rpm离心10分钟。抽吸上清液,将胶原料粒与5ml的新的超纯水混合,制作胶原溶液。在将装有胶原溶液的试管维持在冰上的状态下,使用超声发生器(sonics and materials公司vc50)以100v进行20秒的超声波处理,从超声发生器取出后将装有胶原溶液的试管在冰上冷却10秒,反复进行100次。进行100次超声波处理后,用孔径为40μm的过滤器过滤胶原溶液,得到含有经解纤的胶原成分(scmf)的分散液。通过利用常规方法使分散液冷冻干燥,得到干燥体形式的解纤胶原成分(scmf)。scmf的平均长度(长度)为14.8
±
8.2μm(n=20)。
[0218]
<试验例2:细胞结构体的制作及评价(1)>
[0219]
在细胞结构体的制作中使用的细胞、试剂及制作方法等如下所述。
[0220]
(细胞和胶原)
[0221]
·
用于得到原代人成熟脂肪细胞和人脂肪干细胞(adsc)的人脂肪组织(大腿来源)(由京都府立医科大学附属医院提供)
[0222]
·
人脐带静脉来源的血管内皮细胞(huvec)(lonza公司制#c
‑
2517a)
[0223]
·
解纤胶原成分(scmf)(试验1中制作的物质)
[0224]
(试剂)
[0225]
·
牛胰腺来源的胰岛素(sigma公司#i1882)
[0226]
·
牛血浆来源的凝血酶冷冻干燥粉末(sigma公司#t4648)
[0227]
·
溶组织棱状芽胞杆菌(clostridium histolyticum)来源的胶原酶i型(sigma公司#c0130)
[0228]
·
牛血浆来源的纤维蛋白原i
‑
s型(sigma公司#f8630)
[0229]
·
dmem(高葡萄糖、nacalai tesque公司)
[0230]
·
egm
‑
2mv bulletkit with growth factors(lonza公司制#c
‑
2517a)
[0231]
(培养基和各种溶液)
[0232]
·
egm
‑
2培养基:在500ml的ebm
‑
2中混合egm
‑
2supplement grow th factors,在4℃下保存。
[0233]
·
10mg/ml胰岛素储备溶液:将上述牛胰腺来源的胰岛素100mg溶解于用水稀释了的1%冰醋酸溶液(ph≤2)10ml中,等量分注到eppendorf管中,在
‑
20℃下保存。
[0234]
·
2mg/ml胶原酶溶液:预先将bsa 2.5g与dmem(0%fbs,1%抗生素)50ml混合。为了消化6孔平板全部的脂肪组织,使用将胶原酶i型26mg与dmem(0%fbs、5%bsa、1%抗生素)13ml混合并用孔径为0.2μm的过滤器过滤而得到的物质。
[0235]
·
50mg/ml的纤维蛋白原储备溶液:将50mg的纤维蛋白原称取到eppe ndorf管中,立即加入dmem(0%fbs,1%抗生素)1ml。手动摇管混合后,在37℃的水浴中放置3~5分钟,用孔径为0.2μm的过滤器过滤,等量分注到eppendorf管中后使用。
[0236]
·
202u/ml凝血酶储备溶液:将凝血酶202u称取到eppendorf管中,立即加入dmem(0%fbs,1%抗生素)1ml,在37℃的水浴中放置3~5分钟使其溶解。然后,用孔径为0.2μm的过滤器过滤,等量分注到eppend orf管中后使用。
[0237]
(制作方法)
[0238]
将人脂肪组织片段用含有5%抗生素的pbs清洗。将4~6g组织分到6孔平板的6个孔中。在2mg/ml胶原酶溶液2ml中使用剪刀和镊子细切成约1~3mm的尺寸。在37℃和230rpm下孵育1小时后,用10ml移液管混合30分钟。用孔径为500μm的铁网过滤器过滤溶解物,每1孔添加2ml的dmem,回收全部经消化的细胞后,在室温(15~25℃)下以200g离心3分钟。成熟脂肪细胞包含在上层黄色的油性层中,脂肪干细胞和血细胞包含在料粒中。使用长针及10ml注射器,对上层与下层之间的介质进行抽吸及废弃,用25ml的pbs(5%bsa、1%抗生素)对上层中所含的成熟脂肪细胞和下层中所含的脂肪干细胞和血细胞进行两次清洗。在进行清洗时,与上述同样地进行离心,由此分离为上层、下层以及上层与下层之间的介质这3层,对上层与下层之间的介质进行抽吸及废弃。进行两次清洗后,用25ml的dmem清洗。
[0239]
仅采集包含成熟脂肪细胞的上层,分注到eppendorf管中。通过hoech st染色对核
进行染色(稀释1000倍后的hoechst、染色15分钟),使用荧光显微镜,在turker burk血细胞计数器上对细胞数进行计数。
[0240]
将包含adsc的料粒悬浮于dmem 10ml中,接种于10cm培养皿内,进行传代培养。使用胰蛋白酶/edta将adsc从培养皿中分离,悬浮于dmem 1ml中,对细胞数进行计数。
[0241]
将由lonza公司购入的huvec悬浮于dmem 10ml,接种于10cm培养皿内,进行传代培养。使用胰蛋白酶/edta将huvec从培养皿中分离,悬浮于dmem 1ml中,对细胞数进行计数。
[0242]
称取1mg的scmf,添加dmem 100μl,温和地进行混合直至仅观察到scmf的小的粒子。在室温下以10000rpm离心1分钟,抽吸上清液,得到scmf粒料。将250000cells的adsc和125000cells的huvec(adsc:huvec=2:1)温和地添加到scmf粒料上,不混合,在室温下以3500rp m离心1分钟,抽吸上清液。添加0.3mg的纤维蛋白原(50mg/ml纤维蛋白原储备溶液6μl),与细胞及scmf温和地混合。进一步添加300000cel ls的成熟脂肪细胞温和地进行混合。根据需要添加少量的dmem,将总量调整为70μl。立即添加0.15u的凝血酶(202u/ml凝血酶储备溶液0.71μl),混合后,将混合物缓慢接种到放置在6孔平板上的6孔转接头上的tr answell中。
[0243]
在37℃的孵育器中孵育1小时使其凝胶化,添加含有最终浓度为10μg/ml的胰岛素的egm
‑
2培养基12ml。每2~3天更换12ml的培养基至培养第7天。
[0244]
按照以下的步骤进行细胞结构体的荧光成像。使包含所得到的细胞结构体的transwell移动至24孔平板。pbs 2ml清洗后,使用4%pfa 2ml,在4℃的条件下固定组织一晚。使用pbs 2ml清洗3次。使用0.05%trit on/pbs,在室温条件下对细胞进行7分钟的透过处理(transwell内500μl、transwell外500μl),使用pbs 2ml清洗3次。
[0245]
使用1%bsa/pbs溶液,在室温条件下对组织进行1小时的封闭处理(transwell内500μl、transwell外500μl)。抽吸bsa溶液,添加一次抗体溶液(用1%bsa/pbs溶液稀释至100倍的cd31和围脂滴蛋白)100μl(transwell内50μl、transwell外50μl)。在平板下铺设湿纸巾,用铝箔包覆,在4℃的条件下孵育一晚。使用pbs 2ml清洗3次后,添加二次抗体溶液(用1%bsa/pbs溶液稀释至200倍的alexafluor647标记抗小鼠抗cd31抗体和alexafluor488标记抗兔抗围脂滴蛋白抗体、稀释1000倍的hoechst)100μl(transwell内50μl、transwell外50μl)。在平板下铺设湿纸巾,用铝箔包覆,在室温条件下孵育2小时后,使用pbs 2ml清洗4次。
[0246]
切断transwell的膜,在含有少量pbs的玻璃底培养皿的底部直接配置凝胶,使用共聚焦激光扫描型显微镜(fv3000,奥林巴斯株式会社制)对染色后的细胞结构体以640nm(alexafluor647)及488nm(alexafluor488)观察激光激发光。
[0247]
使用电子显微镜测定所制作的细胞结构体中的脂肪滴的直径。血管的直径及血管的分支间的长度通过image j进行测定。
[0248]
图1表示具有血管网的细胞结构体的荧光观察结果(放大20倍)。(a)是直接固定了从生物体采集的脂肪组织的生物体组织,(b)是细胞结构体。细胞结构体中,确认了如生物体组织那样,以包围成熟脂肪细胞(大的圆的单眼形状的脂肪滴)的方式形成有血管网。这些血管网形成至细胞结构体的内部。脂肪滴的直径的平均值为85μm(n=50),与生物体组织中的成熟脂肪细胞的直径的平均值(72μm(n=50))接近。另外,所形成的血管与生物体组织同样地为中空,与生物体组织同样地观察到直径较粗的血管(例如10μm以上且小于25μm)和
较细的血管(例如超过0μm且小于10μm)这两者。如图2所示,可知血管的分支数也与生物体组织中的数量接近。另外,可知血管的分支间的长度的分布为0~100μm:42.5%、100~200μm:39.4%、200μm~:18.1%(n=180),接近生物体组织中的血管网的血管的分支间的长度的分布(0~100μm:61.8%、100~200μm:24.7%、200μm~:13.5%(n=180))。在试验例2中,血管的分支间的长度为50μm~100μm的比例多,该值接近成熟脂肪细胞的大小。例如如在j.silha et al.,“angiogeni cfactors areelevated in overweight and obese individuals”,international jou rnal of obesity(2005)29,1308
‑
1314等中所说明的那样,已知在生物体内的脂肪组织中,血管包围各个脂肪细胞,在脂肪细胞间形成有血管。由于血管的分支间的长度如上述那样分布,因此启示试验例2的细胞结构体能够忠实地模仿实际的生物体内的脂肪组织。
[0249]
<试验例3:细胞结构体的制作及评价(2)>
[0250]
除了使用500000cells的成熟脂肪细胞、2mg的scmf、0.6mg的纤维蛋白原以外,通过与试验例2同样的方法制作了细胞结构体,结果制作了以包围成熟脂肪细胞的方式形成有血管网的细胞结构体。图3表示与试验例2同样地染色的细胞结构体的荧光观察结果(放大10倍)。显示了即使变更成熟脂肪细胞的细胞数及scmf的量也能够制作具有血管网的细胞结构体。
[0251]
<试验例4:细胞结构体的制作及评价(3)>
[0252]
除了不使用成熟脂肪细胞、使用2mg的scmf、0.6mg的纤维蛋白原、0.3u的凝血酶以外,通过与试验例2同样的方法制作了细胞结构体,结果制作了具有血管网的细胞结构体。图4表示使用抗cd31抗体仅对血管进行了染色的细胞结构体的荧光观察结果(放大4倍)。显示了即使不使用成熟脂肪细胞也能够制作具有血管网的细胞结构体。
[0253]
<试验例5:细胞结构体的制作及评价(4)>
[0254]
除了不使用成熟脂肪细胞、使用50000cells的huvec(adsc:huv ec=5:1)、使用2mg的scmf、0.6mg的纤维蛋白原、0.3u的凝血酶以外,通过与试验例2同样的方法制作了细胞结构体,结果制作了具有血管网的细胞结构体。图5表示使用抗cd31抗体仅对血管进行了染色的细胞结构体的荧光观察结果(放大4倍)。显示了即使不使用成熟脂肪细胞并变更adsc与huvec的比例,也能够制作具有血管网的细胞结构体。
[0255]
<试验例6:细胞结构体的制作及评价(5)>
[0256]
代替成熟脂肪细胞、adsc和huvec,使用从人的大腿(生物体组织)通过脂肪抽吸而得到的脂肪组织,将接种前的总量调整至60μl,除此以外,通过与试验例2同样的方法制作了细胞结构体。对于脂肪组织,使用剪刀和镊子将所采集的3g生物体组织细切成约1~3mm的尺寸,使用10ml注射器缓慢地进行数次吹吸,由此形成液体状。从成为液体状的脂肪组织中取60μl,与scmf混合。需要说明的是,通过脂肪抽吸得到的脂肪组织中包含成熟脂肪细胞、脂肪干细胞和血管内皮细胞。图6表示通过与试验例2同样的方法染色的细胞结构体的荧光观察结果(放大10倍)。显示了即使代替成熟脂肪细胞、adsc和huvec而使用由生物体组织得到的脂肪组织,也能够制作具有血管网的细胞结构体。确认了在使用2mg scmf的情况下也同样能够制作具有血管网的细胞结构体。
[0257]
在试验例2~6中,均确认了能够制作具有血管网的细胞结构体,但若对试验例2~6进行比较,则在使用1mg scmf的情况下,与使用2mg sc mf的情况相比,存在能够制作具有
更接近生物体组织的血管网的细胞结构体的倾向。另外,adsc与huvec的比例在adsc:huvec=2:1的情况下,与adsc:huvec=5:1的情况相比,存在能够制作具有更接近生物体组织的血管网的细胞结构体的倾向。
[0258]
<比较例>
[0259]
除了不使用scmf、使用1mg纤维蛋白原、0.5u凝血酶以外,通过与试验例2同样的方法制作了细胞结构体。在所制作的细胞结构体中未观察到血管的形成。另外,除了不包含adsc以外,通过与试验例2同样的方法制作了细胞结构体。在所制作的细胞结构体中,仅观察到极少的血管的形成,未确认到包围成熟脂肪细胞的血管网的形成。
[0260]
<试验例7:细胞结构体的制作及评价(6)>
[0261]
与试验例2同样地,准备在细胞结构体的制作中使用的细胞、试剂、培养基及各种溶液。解纤胶原成分(scmf)也使用通过与试验例1同样的方法制作的成分。本试验例的大致情况如图7所示。在图7中,左液滴中的圆表示成熟脂肪细胞、白色菱形表示adsc、灰色短棒表示huvec。
[0262]
(制作方法)
[0263]
将人脂肪组织片段用含有5%抗生素的pbs清洗。将4~6g组织分到6孔平板的6个孔中。在2mg/ml胶原酶溶液2ml中使用剪刀和镊子细切成约1~3mm的尺寸。在37℃和230rpm下孵育1小时后,用10ml移液管混合30分钟。用孔径为500μm的铁网过滤器过滤溶解物,每1孔添加2ml的dmem,回收全部经消化的细胞后,在室温(15~25℃)下以200g离心3分钟。成熟脂肪细胞包含在上层黄色的油性层中,脂肪干细胞和血细胞包含在料粒中。使用长针及10ml注射器,对上层与下层之间的介质进行抽吸及废弃,用25ml的pbs(5%bsa、1%抗生素)对上层中所含的成熟脂肪细胞和下层中所含的脂肪干细胞及血细胞进行两次清洗。在进行清洗时,与上述同样地进行离心,由此分离为上层、下层以及上层与下层之间的介质这3层,对上层与下层之间的介质进行抽吸及废弃。用25ml的pbs(5%bsa、1%抗生素)进行两次清洗后,用25ml的dmem清洗。
[0264]
仅采集包含成熟脂肪细胞的上层,分注到eppendorf管中。通过hoech st染色对核进行染色(稀释1000倍后的hoechst,染色10分钟),使用荧光显微镜,在turker burk血细胞计数器上对细胞数进行计数。
[0265]
将包含adsc的料粒悬浮于dmem 10ml中,接种于10cm培养皿内,进行传代培养。使用胰蛋白酶/edta将adsc从培养皿中分离,悬浮于dmem 1ml中,对细胞数进行计数。
[0266]
将由lonza公司购入的huvec悬浮于dmem 10ml,接种于10cm培养皿内,进行传代培养。使用胰蛋白酶/edta将huvec从培养皿中分离,悬浮于dmem 1ml中,对细胞数进行计数。
[0267]
为了得到1个最终直径为约1mm的大致球体状的细胞结构体(以下也称为“细胞球”),使用16250cells的成熟脂肪细胞、13750cells的adsc、6875cells的huvec、0.06mg的scmf、0.04mg的纤维蛋白原、0.02u的凝血酶。
[0268]
称取scmf 2.4mg,添加dmem 1ml,温和地进行混合直至仅观察到scmf的小的粒子。在室温下以10000rpm离心1分钟,抽吸上清液,得到scmf粒料。将220000cells的adsc和275000cells的huvec温和地添加到scmf粒料上,在室温下以3500rpm离心1分钟,抽吸上清液。添加纤维蛋白原(50mg/ml纤维蛋白原储备溶液32μl),与细胞和scmf温和地混合。进一步添加650000cells的成熟脂肪细胞温和地进行混合。添加少量的dmem,将总量调整为200μ
l。立即添加凝血酶(202u/ml凝血酶储备溶液3.9μl),稍微混合后,在低粘附96孔平板(iwaki#4860
‑
800lp)上各孔5μl(1个细胞球的量)地逐个接种混合物(40个细胞球的量)。
[0269]
在37℃的孵育器中孵育15分钟使其凝胶化,添加含有最终浓度为10μg/ml的胰岛素的egm
‑
2培养基300μl。
[0270]
培养24小时后,转移到低粘附24孔平板(iwaki#4820
‑
800lp)中,添加2ml的上述egm
‑
2培养基,由此从平板上分离。每2~3天更换培养基至培养第7天。
[0271]
按照以下的步骤进行细胞结构体的荧光成像。使包含所得到的细胞结构体的transwell移动至24孔平板(iwaki#4820
‑
800lp)。pbs 200μl清洗后,使用4%pfa 200μl在4℃的条件下固定组织一晚。使用pbs 200μl清洗3次。为了免疫染色,使用0.05%triton/pbs 200μl,在室温条件下对细胞进行7分钟的透过处理,使用pbs 200μl清洗3次。
[0272]
使用1%bsa/pbs溶液200μl,在室温条件下对组织进行1小时的封闭处理。抽吸bsa溶液,添加一次抗体溶液(用1%bsa/pbs溶液稀释至100倍的cd31和围脂滴蛋白)100μl。在平板下铺设湿纸巾,用铝箔包覆,在4℃的条件下孵育一晚。使用pbs 200μl清洗3次后,添加二次抗体溶液(用1%bsa/pbs溶液稀释至200倍的alexafluor647标记抗小鼠抗cd31抗体和alexafluor488标记抗兔抗围脂滴蛋白抗体、稀释1000倍的hoechst)。在平板下铺设湿纸巾,用铝箔包覆,在室温条件下孵育2小时后,使用pbs 200μl清洗4次。
[0273]
在共聚焦定量图像细胞成像仪cq1(横河电机制)的成套平板上直接配置细胞球,使用上述共聚焦定量图像细胞成像仪cq1对染色后的细胞结构体以640nm(alexafluor647)及488nm(alexafluor488)观察激光激发光。
[0274]
图8表示利用尼罗红染色及cd31染色的具有血管网的细胞球的荧光观察结果。cd31染色与试验例2同样地进行,尼罗红染色通过常规方法进行。(b)照片是进一步放大(a)的细胞球中的一个而成的照片。在细胞球中,确认了如生物体组织那样,以包围成熟脂肪细胞(大的圆的单眼形状的脂肪滴)的方式形成有血管网。这些血管网形成至细胞球的内部。
[0275]
图9表示利用cd31的免疫组织染色的具有血管网的细胞球的切片的观察结果。由该结果确认了,在细胞球中,观察到较多的管腔,血管网形成至细胞结构体的内部。
[0276]
图10表示通过本试验例的方法制作的细胞球在培养7天后的平均直径(n=12细胞球/量)。5μl的细胞球的平均直径为1256μm,10μl的细胞球的平均直径为1857μm。
[0277]
<试验例8:包含多个细胞球的细胞组织的制作及评价>
[0278]
在使多个试验例7中制作的培养7天后的5μl的细胞球邻接接触的状态下,在10ml培养液中悬浮培养7天。与试验例7同样地进行染色并观察。其结果,如图11所示,多个细胞球(图11中为5个)凝聚,得到合体的细胞组织。确认了5个细胞球合体而成的细胞组织不仅在各细胞球内连接有血管网,而且在多个细胞球间也连接有血管网(图11(a)和(b))。
[0279]
<试验例9:细胞球的移植试验及评价>
[0280]
准备6只免疫缺陷小鼠,切开背部的皮肤,向切开部位分别流入以下的(1)~(3),缝合后,3只个体生长30天,3只个体生长90天。
[0281]
(1)将111个试验例7中制成的培养后的细胞球悬浮于含有2.5mg纤维蛋白原和1.25u凝血酶的溶液100μl而得到的混合物
[0282]
(2)将111个除了不使用huvec以外与(1)同样地制作的细胞球悬浮于含有2.5mg纤维蛋白原和1.25u凝血酶的溶液100μl而得到的混合物
[0283]
(3)使用在试验例6中从人的大腿(生物体组织)通过脂肪抽吸得到的脂肪组织而制作的细胞结构体(100μl)
[0284]
从生长30天后的各个体的移植部位采集组织。在移植了上述(2)的部位形成有脂肪组织,但未确认到血管网的形成。在移植了上述(3)的部位形成有脂肪组织,虽然在组织表面也稍微确认到血管网,但也确认到存在大的油滴。油滴的形成意味着脂肪细胞死亡。另一方面,在移植了使用了在试验例7中制作的细胞球的上述(1)的部位观察到在组织表面布满血管网的脂肪组织的形成。另外,在移植了上述(1)的部位的组织中,未观察到油滴的形成,并显示了移植后的植入性更为优异。
[0285]
从30天生长后的个体的上述(1)的移植部位采集组织,与试验例2同样地进行围脂滴蛋白染色和dapi染色(图12)。dapi染色通过常规方法进行。其中,a:sft表示从上述(3)的移植部位采集的组织,c:3dvft表示从上述(1)的移植部位采集的组织。图12的上排表示在亮视野中观察到的结果,中排表示利用围脂滴蛋白染色的结果,下排表示dapi染色的结果。确认了在形成于移植部位的组织中形成有成熟脂肪细胞。
[0286]
另外,从生长90天后的个体的上述(1)的移植部位采集组织,与试验例2同样地进行围脂滴蛋白染色及cd31染色(图13)。图13的上排表示在亮视野中观察到的结果,中排表示利用cd31染色的结果,下排表示dapi染色的结果。确认了在形成于移植部位的组织中,不仅形成有成熟脂肪细胞,而且还形成有血管网。
[0287]
如上所述,本实施方式的细胞结构体显示了移植后的植入性优异,适合移植用。
[0288]
<试验例10:细胞结构体的制作及葡萄糖摄入的评价>
[0289]
(细胞结构体的制作)
[0290]
除了每1组织使用成熟脂肪细胞6500cells、脂肪干细胞5500cells、血管内皮细胞2750cells、经解纤的胶原成分(scmf)0.025mg、纤维蛋白原0.015mg、凝血酶0.007u以外,按照与实验例2同样的步骤,制作被赋予了血管网的细胞结构体。
[0291]
将上述材料整理制备96孔的量,得到凝胶,每1孔地逐个接种于96孔平板。scmf使用仅使用猪皮来源的胶原i型海绵片段(日本ham株式会社制)制作的scmf、及使用猪皮来源的胶原i型海绵片段和猪皮来源的胶原iii型海绵片段的混合物(日本ham株式会社制)制作的scmf这2种。考虑上述混合物的胶原i型和胶原iii型的混合比率大概为8:2。在本试验例中,scmf使用了使用猪皮来源的胶原i型海绵片段及猪皮来源的胶原iii型海绵片段的混合物而制作的scmf。
[0292]
将接种后的细胞结构体培养至进行摄入/释放试验的日子。培养基使用不含葡萄糖和脂肪酸的dmem培养基,2天进行1次培养基的更换。
[0293]
(葡萄糖摄入的评价)
[0294]
评价葡萄糖的摄入的试验在形成细胞结构体后的第7天和第14天进行。
[0295]
在试验前,更换为不含葡萄糖的300μl的dmem培养基。将细胞结构体孵育6小时,由此将细胞结构体置于饥饿状态。将培养基更换为含有0.1mg/ml的nbd修饰葡萄糖(2
‑
脱氧
‑2‑
[(7
‑
硝基
‑
2,1,3
‑
苯并呋咱
‑4‑
基)氨基]
‑
d
‑
葡萄糖、cayman chemical公司)的dmem培养基100μl。孵育细胞结构体,在10分钟、30分钟、60分钟、120分钟、150分钟的时间点进行荧光测定。在各时间点进行测定之前,将所测定的细胞结构体的培养基更换为pbs缓冲液300μl,用平板阅读器(synergy htx、bio tek制)测定荧光,求出图像内的荧光强度的累计值。
[0296]
如图14所示,确认了将细胞结构体暴露于葡萄糖的时间越长,被摄入到结构体内的越多。另外,将形成第7天及第14天的细胞结构体的60分钟后的荧光强度的比较示于图15的(b)的图表中。各处理的样品数为4(n=4),将处理0小时时的不含nbd修饰葡萄糖的对照培养基中的葡萄糖摄入设为100%。由这些结果可知,细胞结构体的葡萄糖摄入能力维持14天以上。需要说明的是,图15的(a)的图表是使用了除了不含血管内皮细胞以外与本试验例的细胞结构体同样地制作的组织体的结果,同样地可知葡萄糖摄入能力维持14天以上。
[0297]
<试验例11:葡萄糖摄入抑制剂及促进剂的效果的评价>
[0298]
与试验例10同样地制作不含血管内皮细胞的组织体,使用形成后第7天的组织体进行评价。scmf使用了使用猪皮来源的胶原i型海绵片段和猪皮来源的胶原iii型海绵片段的混合物而制作的scmf。
[0299]
使试验例10的(葡萄糖摄入的评价)中的含有nbd修饰葡萄糖的dmem培养基中含有作为葡萄糖摄入抑制剂的芹菜素125μm或作为葡萄糖摄入促进剂的胰岛素10μg/ml。孵育组织体,在20分钟、45分钟、70分钟、90分钟、135分钟的时间点与试验例10同样地进行荧光测定。
[0300]
将结果示于图16。各处理的样品数为5(n=5),将与不包含芹菜素和胰岛素中的任一种的试验例10相同的对照培养基的葡萄糖摄入设为100%。可知通过添加芹菜素,葡萄糖的摄入量得到抑制,通过添加胰岛素,葡萄糖的摄入量增加。另外,在添加了芹菜素和胰岛素这两者的情况下,虽然葡萄糖摄入量增加,但由于与单独添加胰岛素的情况相比增加量较小,因此启示了葡萄糖摄入量的增加量受各药剂的浓度控制。
[0301]
<试验例12:葡萄糖和脂肪酸摄入促进剂的效果的评价>
[0302]
与试验例10同样地制作不含血管内皮细胞的组织体,使用形成后第7天的组织体进行评价。scmf使用了使用猪皮来源的胶原i型海绵片段及猪皮来源的胶原iii型海绵片段的混合物而制作的scmf。
[0303]
代替试验例10中的nbd修饰葡萄糖,将4μm的bodipy修饰脂肪酸(invitrogen(注册商标)bodipy(注册商标)500/510c1、c12(4,4
‑
二氟
‑5‑
甲基l
‑4‑
硼
‑
3a,4a
‑
氮杂对称引达省
‑3‑
月桂酸)、thermo fisher scientifi c公司)添加于dmem培养基,除此以外,与试验例10同样地孵育组织体后,在5分钟、30分钟及60分钟的时间点进行荧光测定。另外,向上述含有4μm的bodipy修饰脂肪酸的dmem培养基中添加胰岛素10μg/ml,同样地进行荧光测定。
[0304]
将结果示于图17。图17的(b)的图表表示本试验例12中的脂肪酸摄入量的变化。各处理的样品数为5(n=5),将与不含胰岛素的试验例10相同的对照培养基中的脂肪酸摄入设为100%。该结果显示了,通过胰岛素,不仅促进葡萄糖的摄入,还促进脂肪酸的摄入。
[0305]
图17的(a)的图表表示试验例11中的葡萄糖摄入量的变化。荧光测定在孵育组织体后的20分钟、45分钟、70分钟及90分钟的时间点进行。各处理的样品数为5(n=5),将与不含胰岛素的试验例10相同的对照培养基中的葡萄糖摄入设为100%。将(a)与(b)的图表进行比较,启示了脂肪酸与葡萄糖相比,摄入量更快达到饱和的可能性。
[0306]
<试验例13:脂肪酸摄入抑制剂的效果的评价>
[0307]
与试验例10同样地,制作包含血管内皮细胞的细胞结构体、以及不含血管内皮细胞的组织体,分别使用形成后第14天的细胞结构体和组织体进行评价。scmf使用了使用猪皮来源的胶原i型海绵断片而制作的scmf。
[0308]
代替试验例10的(葡萄糖摄入的评价)中的nbd修饰葡萄糖,使含有4μm的bodipy修饰脂肪酸的dmem培养基中含有作为脂肪酸摄入抑制剂的tnfα100ng/ml。将包含血管内皮细胞的细胞结构体和不含血管内皮细胞的组织体分别孵育,在0分钟、5分钟、30分钟、60分钟的时间点与试验例10同样地进行荧光测定。各处理的样品数为5(n=5),将与不含tnfα的试验例10相同的对照培养基中的脂肪酸摄入设为100%。
[0309]
将结果示于图18。图18的(b)的图表是使用了包含血管内皮细胞的细胞结构体的结果,(a)的图表是使用了不含血管内皮细胞的组织体的结果。可知通过添加tnfα,脂肪酸的摄入量得到抑制。
[0310]
<试验例14:葡萄糖和脂肪酸释放的评价以及脂肪酸释放促进剂的效果的评价>
[0311]
除了不含血管内皮细胞以外,与试验例10的细胞结构体同样地制作组织体,使用形成后第14天的组织体进行评价。
[0312]
为了测定被一次摄入的葡萄糖的释放量,与试验例10同样地在添加有0.1mg/ml的nbd修饰葡萄糖的dmem培养基上孵育60分钟后,再次更换为添加有nbd修饰葡萄糖的dmem培养基300μl、或添加有异丙肾上腺素2mm及nbd修饰葡萄糖的dmem培养基300μl。然后,孵育30分钟,使葡萄糖从细胞组织中释放,进行荧光测定。
[0313]
另外,同样地,为了测定被一次摄入的脂肪酸的释放量,与试验例12同样地在添加有4μm的bodipy修饰脂肪酸的dmem培养基上孵育60分钟后,再次更换为添加有bodipy修饰脂肪酸的dmem培养基300μl、或添加有异丙肾上腺素2mm及bodipy修饰脂肪酸的dmem培养基300μl。然后,孵育30分钟,使脂肪酸从细胞组织中释放,进行荧光测定。
[0314]
将结果示于图19。(a)的图表表示葡萄糖的释放量的比较,(b)的图表表示脂肪酸的释放量的比较。各处理的样品数为5(n=3),将不含异丙肾上腺素的培养基的组织体中的荧光强度设为100%,通过比较含有异丙肾上腺素的培养基的组织体的荧光强度,求出摄入量中的多少%被释放。需要说明的是,在不含异丙肾上腺素的培养基的情况下,认为30分钟的孵育的情况下摄入量没有变化那么多。
[0315]
可知在更换为含有异丙肾上腺素的培养基的情况下,孵育30分钟后摄入的葡萄糖或脂肪酸的量减少。即,显示了对于葡萄糖和脂肪酸中的任一种而言,通过添加异丙肾上腺素,释放均得到促进。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1