靶向肿瘤微环境和免疫检查点蛋白的双特异性结合分子的制作方法
1.提供了可用于治疗癌症和其他疾病的双特异性结合分子。
背景技术:
2.免疫检查点蛋白可作为免疫系统调节剂,并且是自我耐受机制的关键组成部分。抑制性免疫检查点蛋白包括:程序性细胞死亡蛋白1(pd-1);程序性细胞死亡配体1(pd-l1);腺苷a2a受体(a2ar);b7-h3(cd276);b7-h4(vtcn1),b和t淋巴细胞弱化子(attenuator)(btla);细胞毒性t淋巴细胞相关蛋白4(ctla-4,cd152);吲哚胺2,3-二氧酶(indoleamine 2,3-dioxygenase,ido);杀伤细胞免疫球蛋白样受体(killer-cell immunoglobulin-like receptor,kir);淋巴细胞激活基因3(lag3);烟碱酰胺腺嘌呤二核苷酸磷酸nadph氧化酶同功型2(nicotinamide adenine dinucleotide phosphate nadph oxidase isoform 2,nox2);t细胞免疫球蛋白结构域和黏蛋白结构域3(t-cell immunoglobulin domain and mucin domain 3,tim-3);t细胞活化的v结构域ig抑制剂(v-domain ig suppressor of t cell activation,vista);唾液酸结合免疫球蛋白型凝集素7(sialic acid-binding immunoglobulin-type lectin 7,siglec7,cd328);和唾液酸结合免疫球蛋白型凝集素9(siglec9,cd329)。
3.程序性细胞死亡蛋白1(pd-1)是在t细胞上表达的受体蛋白,可作为免疫检查点。作为免疫耐受机制的一部分,pd-1的表达在活化的t细胞上被上调。pd-1的配体是程序性细胞死亡配体1(pd-l1),pd-l1与pd-1的结合会传递抑制信号,从而减少淋巴结中抗原特异性t细胞的活化和增殖,并且减少调节性t细胞的细胞凋亡。肿瘤细胞通常过度表达pd-l1作为避免免疫监视(immune surveillance)的机制。通过结合配体或受体,抑制pd-1和pd-l1之间结合的单克隆抗体已显示出在多种癌症的患者亚群中作为单一疗法或与其他药物联用是有效的,然而在许多其他癌症中是无效或难以治疗的(refractory)。帕博利珠单抗(pembrolizumab)是一种人源化抗体(humanized antibody),于2014年首次获得fda批准,用于治疗肿瘤细胞表达升高的pd-l1的多种癌症。罗伯特(robert)等人的文献(n engl.j med.372:2521-2532(2015))纳武单抗(nivolumab)是一种全人化的抗体,于2014年首次获得fda批准,亦用于治疗多种癌症。
4.肿瘤相关巨噬细胞(tumor-associated macrophage,tam)是一类大量存在于肿瘤微环境(tumor microenvironment,tme)中的免疫细胞,并与癌症相关的炎症相关。已经显示pd-1在tam细胞上的表达减少了巨噬细胞对肿瘤细胞的吞噬作用,并赋予了肿瘤细胞“免疫性”。请参照高登(gordon)等人的文献(nature545:495(2017))。
5.白介素-1β(interleukin-1β,il-1β)是一种促炎症细胞因子,与慢性和急性炎症相关,并且在多种炎症相关疾病中扮演重要角色。亦显示出升高的il-1β程度可将tam细胞和骨髓来源抑制细胞(myeloid-derived suppressor cell,mdsc)募集至tme,并促进乳腺癌的肿瘤生长和转移。请参照郭(guo)等人的文献(sci.rep.6,36107;doi:10.1038/srep36107(2016))。在其他研究中,肺损伤(lung lesion)已显示为充满(populated with)
tam,其促肿瘤活性(pro-tumor activity)通过nlrp3炎症小体(inflammasome)的活化和il-1β的释放而被上调。请参照terlizzi等人的文献(oncotarget 7:58181(2016))。最后,il-1β已显示出可促进tam细胞的促肿瘤表现型,并且细胞因子的水平与肾细胞癌的肿瘤大小和分期相关(chittezhath等人,immunity 41:815(2014))。
6.在缺乏il-1β的小鼠中,较少的动物发展为肿瘤,并且肿瘤的发展较慢。请参照apte等人的文献(european journal of cancer,42:751(2006))。另外,显示出肺癌风险基因型il-1β-31tt导致il-1β表达增加,从而提供炎症性刺激上升的微环境,并增加了肺癌风险。请参照bhat等人的文献(meta gene 2:123(2014))。已显示il-1受体拮抗剂通过抑制血管生成因子(如vegf和il-8)可抑制转移和肿瘤增殖。请参照konishi等人的文献(oncology 68:138(2005));lewis等人的文献(j.transl.med.4:48(2006))。卡那奴单抗(canakinumab)是一种抑制il-1β活性的单克隆抗体,已被证明可以降低意外肺癌(incident lung cancer)和肺癌死亡率。请参照ridker等人的文献(lancet,390:p1833-1842,(2017))。
7.工程化的双特异性单克隆抗体是包含免疫球蛋白结构域的非天然存在的蛋白质,可以同时结合两种不同类型的抗原。双特异性抗体可以多种形式制备,并且已经用于例如癌症免疫疗法和药物递送。请参照下列文献,例如,fan等人的文献(j.hemat.oncol.8:130(2015);brinkmann和kontermann的文献(mabs 9:182(2017));以及spiess等人的文献(molecular immunology,67:95-106(2015))。
技术实现要素:
8.本案提供了一种结合蛋白,其可以包含第一结合结构域(first binding domain)和第二结合结构域(second binding domain),其中第一结合结构域特异性结合并抑制免疫检查点蛋白的活化,且其中第二结合结构域特异性结合并抑制il-β或il-1r的活性。免疫检查点蛋白可以是例如pd-1或pd-l1。第一结合结构域与第二结合结构域可包含免疫球蛋白结合结构域,例如人免疫球蛋白结合结构域。这些结合蛋白可以进一步包含特异性结合并抑制免疫检查点蛋白(例如是pd-1或pd-l1)活化的第三结合结构域,以及特异性结合并抑制il-β或il-1r的活性的第四结合结构域。第一结合结构域和第三结合结构域可以包含相同的互补决定区(cdr),第二结合结构域和第四结合结构域可以包含相同的cdr区。
9.在一实施方案中,这些蛋白质的第一结合结构域可包含:a)seq id no:1的重链cdr1;(b)seq id no:2的重链cdr2;(c)seq id no:3的重链cdr3;(d)seq id no:4的轻链cdr1;(e)seq id no:5的轻链cdr2;和(f)seq id no:6的轻链cdr3。在这种结合蛋白中,第一结合结构域可包含seq id no:37的重链可变区和seq id no:38的轻链可变区。
10.在另一实施方案中,第一结合结构域可包含:a)seq id no:7的重链cdr1;(b)seq id no:8的重链cdr2;(c)seq id no:9的重链cdr3;(d)seq id no:10的轻链cdr1;(e)seq id no:11的轻链cdr2;和(f)seq id no:12的轻链cdr3。在这种结合蛋白中,第一结合结构域可包含seq id no:39的重链可变区和seq id no:40的轻链可变区。
11.在又一实施方案中,第一结合结构域可包含:a)seq id no:13的重链cdr1;(b)seq id no:15的重链cdr2;(c)seq id no:15的重链cdr3;(d)seq id no:16的轻链cdr1;(e)seq id no:17的轻链cdr2;以及(f)seq id no:18的轻链cdr3。在这种结合蛋白中,第一结合结
构域可包含seq id no:41的重链可变区和seq id no:42的轻链可变区。
12.在又一实施方案中,第一结合结构域可包含(a)seq id no:19的重链cdr1;(b)seq id no:20的重链cdr2;(c)seq id no:21的重链cdr3;(d)seq id no:22的轻链cdr1;(e)seq id no:23的轻链cdr2;和(f)seq id no:24的轻链cdr3。在这种结合蛋白中,第一结合结构域可包含seq id no:43的重链可变区和seq id no:44的轻链可变区。
13.在另一实施方案中,第一结合结构域可包含(a)seq id no:25的重链cdr1;(b)seq id no:26的重链cdr2;(c)seq id no:27的重链cdr3;(d)seq id no:28的轻链cdr1;(e)seq id no:29的轻链cdr2;和(f)seq id no:30的轻链cdr3。在这种结合蛋白中,第一结合结构域可包含seq id no:45的重链可变区和seq id no:46的轻链可变区。
14.在又一实施方案中,第一结合结构域可包含(a)seq id no:31的重链cdr1;(b)seq id no:32的重链cdr2;(c)seq id no:33的重链cdr3;(d)seq id no:34的轻链cdr1;(e)seq id no:35的轻链cdr2;和(f)seq id no:36的轻链cdr3。在这种结合蛋白中,第一结合结构域可包含seq id no:47的重链可变区和seq id no:48的轻链可变区。
15.在任何的这些结合蛋白中,第二结合结构域可包含(a)seq id no:49的重链cdr1;(b)seq id no:50的重链cdr2;(c)seq id no:51的重链cdr3;(d)seq id no:52的轻链cdr1;(e)seq id no:53的轻链cdr2;和(f)seq id no:54的轻链cdr3。在这种结合蛋白中,第一结合结构域可包含seq id no:55的重链可变区和seq id no:56的轻链可变区。
16.本案进一步提供了结合蛋白,其中第一结合结构域是特异性结合并抑制pd-1或pd-l1活化的抗体结合结构域,并且第二结合结构域包含来自白介素-1-受体1型(il-1r1)或白介素-1-受体2型(il-1r2)的白介素-1β-结合结构域,任选地与il-1r辅助蛋白的配体结合结构域偶联。例如,这样的结合蛋白可以包含第一蛋白链以及第二蛋白链,第一蛋白链包含(a)il-1r1的白介素-1β-结合结构域,(b)结合并抑制pd-1或pd-l1的免疫球蛋白的vh结构域及(c)免疫球蛋白fc结构域,其中(a)连接于(b),(b)连接于(c);第二蛋白链包含结合pd-1或pd-l1的免疫球蛋白的vl结构域。在另一实例中,结合蛋白可包含第一蛋白链及第二蛋白链,第一蛋白链包含(a)结合并抑制pd-1或pd-l1的免疫球蛋白的vh结构域(b)il-1r1的白介素-1β-结合结构域(c)免疫球蛋白fc结构域,其中(a)连接于(b),(b)连接于(c);第二蛋白链包含结合并抑制pd-1或pd-l1的免疫球蛋白的vl结构域。在又一实例中,结合蛋白可包含两条相同的蛋白链,其中每条蛋白链包含(a)il-1r1的白介素-1β-结合结构域(b)免疫球蛋白fc结构域(c)结合并抑制pd-1或pd-l1的活化的scfv结构域,其中(a)连接于(b),(b)连接于(c)。在又一实例中,结合蛋白可包含:第一蛋白链以及第二蛋白链,第一蛋白链包含(a)il-1r1的白介素-1β-结合结构域(b)结合并抑制pd-1或pd-l1的免疫球蛋白的vl和cl结构域(c)免疫球蛋白fc结构域,其中(a)连接于(b),(b)连接于(c);第二蛋白链包含结合并抑制pd-1或pd-l1的免疫球蛋白的vh和ch1结构域。在另一实例中,结合蛋白可包含:第一蛋白链及第二蛋白链,第一蛋白链包含(a)结合并抑制pd-1或pd-l1的免疫球蛋白的vl和cl结构域(b)il-1r1的白介素-1β-结合结构域(c)免疫球蛋白fc结构域,其中(a)连接于(b),(b)连接于(c);第二蛋白链包含结合并抑制pd-1或pd-l1的免疫球蛋白的vh和ch1结构域。
17.提供了编码上述蛋白链的核酸分子以及载体,包括含有这些核酸分子的表达载体。
18.还提供了用于如上所述制备结合蛋白的方法,其中所述方法包括以下步骤:a)用含有编码第一结合结构域和第二结合结构域的核酸分子的载体转化宿主细胞;b)在允许结合蛋白合成的条件下培养宿主细胞;和c)从培养物中回收结合蛋白。宿主细胞可以包含含有编码第一结合结构域和第二结合结构域的核酸分子的载体。
19.还提供了包含如上所述的结合蛋白以及药学上可接受的赋形剂的药物组合物。
20.还提供了包含第一蛋白链、第二蛋白链和第三蛋白链的双特异性结合蛋白(“fat”结合蛋白),其中第一蛋白链包含重链及第一fab结构域(fab1),重链具有vh结构域、ch1结构域、ch2结构域和ch3结构域的重链,第一fab结构域位于ch2结构域、ch3结构域的溶剂暴露环或在ch2结构域与ch3结构域的界面上;其中第二链包含第二fab结构域,其中第三链包含第三fab结构域。在这些结合蛋白中,第二链fab结构域与第一蛋白链的vh结构域和ch1结构域结合,形成第一结合结构域,第三链fab结构域与在第一蛋白中溶剂暴露环上第一fab结构域结合,以形成第二结合结构域。在这些结合蛋白中,溶剂暴露环可以包含来自ch2结构域的氨基酸序列,例如isrtp(seq id no:57)。溶剂暴露环可包含来自ch3结构域的氨基酸序列,例如sng。溶剂暴露环可以包含来自ch2结构域和ch3结构域的界面的氨基酸序列,例如akgqp(seq id no:58)。ch1结构域可以经由抗体铰链区连接至ch2结构域。ch2结构域和ch3结构域可以包含fc区,例如来自igg1、igg2、igg3、igg4、iga、igm、ige和igd的fc区。第一蛋白链可进一步包含第一肽接头和/或第二肽接头,第一肽接头位于第一fab结构域的第一末端与ch2结构域、ch3结构域或ch2和ch3结构域的界面之间,第二肽接头位于第一fab结构域的第二末端与ch2结构域、ch3结构域或ch2和ch3结构域的界面之间。第一肽接头与第二肽接头可以是,例如,(g4s)2(seq id no:59)、(g4s)3(seq id no:60)和(g4s)4(seq id no:61)。在第一实施方案中,第一蛋白链可包含从n末端到c末端的下列多肽结构域:vh1-ch1-铰链-ch2(n-末端)-fab1-ch2(c-末端)-ch3,或在第二实施方案中,第一蛋白链可包含从n末端到c末端的下列多肽结构域:vh1-ch1-铰链-ch2-ch3(n-末端)-fab1-ch3(c-末端)。在第三实施方案中,第一蛋白链可包含从n末端到c末端的下列多肽结构域:vh1-ch1-ch2-fab1-ch3。第一结合结构域可以特异性结合pd-1或pd-l1,第二结合结构域可以特异性结合il-1β或il-1r,或者第一结合结构域可以特异性结合il-1β或il-1r,并且第二结合结构域可以与pd-1或pd-l1特异性结合。
21.在fat结合蛋白的一些实施方案中,第一结合结构域的cdr区可以选自:seq id no:1-6的cdr结构域、seq id no:7-12的cdr结构域、seq id no:13-18的cdr结构域、seq id no:19-24的cdr结构域、seq id no:25-30的cdr结构域以及seq id no:31-36的cdr结构域,第二结合结构域的cdr区可以是seq id no:49-54的cdr结构域。
22.在fat结合蛋白的其他实施方案中,第一结合结构域的cdr区可以是seq id no:49-54的cdr结构域,并且第二结合结构域的cdr区可以选自:seq id no:1-6的cdr结构域、seq id no:7-12的cdr结构域、seq id no:13-18的cdr结构域、seq id no:19-24的cdr结构域、seq id no:25-30的cdr结构域以及seq id no:31-36的cdr结构域。
23.本案提供了编码上述fat结合蛋白链的核酸分子,以及载体(vector),包括含有这些核酸分子的表达载体。
24.本案还提供了包含一种或多种fat结合蛋白和药学上可接受的载体(carrier)的药物组合物。
25.本案提供了制备fat结合蛋白的方法,所述方法包括以下步骤:a)用可以包含编码第一蛋白链、第二蛋白链和第三蛋白链的核酸分子的载体转化宿主细胞;b)在允许结合蛋白合成的条件下培养宿主细胞;以及c)从培养物中回收fat结合蛋白。载体可包含编码fat蛋白的第一蛋白链、第二蛋白链和第三蛋白链的核酸分子。
26.本案提供了治疗受试者的癌症的方法,其包括向有此需要的受试者施用如上所述的结合蛋白或药物组合物。这些方法任选地包括向受试者施用除结合蛋白之外的抗肿瘤剂。
27.在这些治疗癌症的方法中,受试者可能先前已经接受过癌症免疫疗法的治疗或已发现对所述疗法具有抗性。所述受试者可能先前已经接受过癌症免疫疗法的治疗,或者被发现对癌症免疫疗法是难治的。癌症免疫疗法可以是例如用至少一种免疫检查点抑制剂治疗。
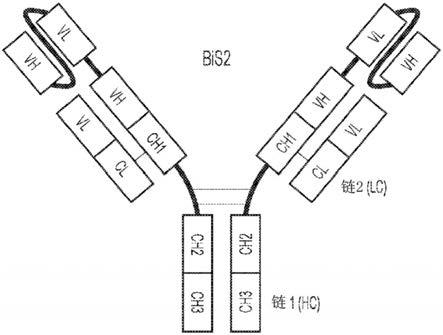
28.治疗癌症的方法还可以包括对受试者施用额外的抗肿瘤疗法,例如化学疗法、免疫疗法、生物制剂或小分子疗法、疫苗接种和/或细胞疗法。
29.本案还提供了预防或降低处于风险中的受试者的癌症风险的方法,包括向受试者施用有效量的如上所述的结合蛋白或药物组合物。所述受试者先前可能已经被诊断出患有癌症并且已经缓解,或者先前已经接受过癌症治疗。受试者由于环境暴露、使用或接触烟草、基因突变或癌症家族史而被认为处于患癌症的风险。
30.在这些癌症治疗的方法中,癌症可以是肺癌,例如小细胞肺癌,复合型小细胞肺癌和/或非小细胞肺癌。非小细胞肺癌可以是例如鳞状细胞肺癌、大细胞肺癌、肺腺癌、肺多形性癌、肺类癌,唾液腺癌或未明确分类(nos,未特指)的癌症。所述癌症可以是复合型小细胞肺癌、肺外小细胞癌、局限在淋巴结中的肺外小细胞癌或前列腺小细胞癌,或者可以是微卫星不稳定性癌症。
31.根据以下详细描述,本公开的其他目的、特征和优点将变得显而易见。然而,应当理解,根据详细描述,由于本公开的精神和范围内的各种改变和修饰对于本领域技术人员而言将是显而易见的,因此仅通过说明的方式给出了详细描述和具体实例。
附图说明
32.图1显示bis2双特异性抗体的链结构。
33.图2a显示bis3双特异性抗体的链结构。
34.图2b显示包含(a)源自il-1r1和il-1r辅助蛋白的il-1β结合结构域以及(b)抗体结合结构域的结合分子的链结构。
35.图3a显示fit-ig双特异性抗体的链结构。
36.图3b至图3e显示包含(a)源自il-1r1和il-1r辅助蛋白的il-1β结合结构域以及(b)抗体结合结构域的4个结合分子的链结构。
37.图4显示fat-ig双特异性抗体的链结构。
38.图5显示结合il-1β和pd-1的双特异性抗体的氨基酸序列。
39.图6a和图6b显示结合il-1β、il-1r、pd-1或pd-l1的已知抗体和结合分子的表格。
40.图7显示双特异性抗体在多剂量夹心测定(multiple-dose sandwich assay)中同时与细胞膜结合的pd-1和可溶性il-1β的结合,如通过流式细胞术所检测的。证明了ita系
列双特异性抗体的可变结合亲和力,并且所有结合亲和力均实质上高于对照人igg(control human igg)。
41.图8显示了双特异性抗体在多剂量夹心测定中同时与细胞膜结合的pd-1和可溶性il-1β结合,如通过流式细胞术所检测的。证明了itc、itd和ite系列双特异性抗体的可变结合亲和力,并且所有结合亲和力均实质上高于对照人igg。
42.图9a至图9c显示在多剂量夹心测定中双特异性抗体与细胞膜结合的pd-1的结合,如通过流式细胞术所检测的。证明了itb和itf系列双特异性抗体的可变结合亲和力,并且所有结合亲和力均实质上高于对照人igg。
43.图10显示双特异性抗体在多剂量夹心测定中同时与细胞膜结合的pd-1和可溶性il-1β结合,如通过流式细胞术所检测的。证明了itb和itf系列双特异性抗体的可变结合亲和力。所有结合亲和力均实质上高于对照人igg。
44.图11显示双特异性抗体在pd-1/pd-l1报告分子分析中阻断pd-1活性。证明了ita系列双特异性抗体具有可变的阻断活性。所有的阻断活性均实质上高于对照人igg。
45.图12a及图12b显示双特异性抗体在il-1β功能测定中阻断il-1β活性。证明了ita系列双特异性抗体具有可变的阻断活性。所有的阻断活性均实质上高于对照人igg。
具体实施方式
46.本案提供了双特异性结合蛋白,其包含特异性结合免疫检查点蛋白的至少一第一结合结构域和结合il-1β的至少一第二结合蛋白。免疫检查点蛋白可以是例如pd-1、pd-l1、a2ar、b7-h3(cd276)、b7-h4(vtcn1)、btla、ctla-4(cd152)、ido.kir、lag3、nox2、tim-3、vista、siglec7、(cd328)或siglec9(cd329)。有利地,检查点蛋白是pd-1或pd-l1。
47.结合蛋白同时结合检查点蛋白pd-1或pd-l1以及il-1β或il-1r,从而抑制cd8 t细胞上的pd-1与靶标细胞(例如肿瘤细胞)上的pd-l1之间的结合以及il-1β活性。以这种方式同时抑制il-1β活性和pd-1/pd-l1结合提供了改进的癌症治疗方法。第一结合结构域和第二结合结构域有利地是人类抗体可变结构域。亦提供了新颖的双特异性结合蛋白形式,其允许两种抗原特异性结合,包括但不限于检查点蛋白和细胞因子(cytokine)(例如il-1β)。亦提供了使用双特异性结合蛋白来治疗疾病(例如癌症)的方法。
48.结合结构域(binding domain)
49.在本文所述的结合蛋白中使用的结合结构域可以是特异性结合靶标蛋白的任何形式。例如,为了结合il-1β,可以使用白介素i型或ii型受体的配体结合结构域,选择性地与来自il-1受体辅助蛋白(如同利隆西普(rilonacept))的序列融合。然而,有利地,结合结构域衍生自人免疫球蛋白分子的可变结构域。具体地,结合结构域可以源自结合检查点蛋白的抗体和结合il-1β或il-1r的抗体。制备结合预选抗原的全人抗体的方法是本领域已知的。例如,人类抗体可以选自在丝状噬菌体(filamentous phage)上展示的大型抗体文库,并且通过已知的方法鉴定所选抗体的重链和轻链可变区。请参照,例如,winter等人的文献(annual review of immunology 12:433-455(1994))。然后将编码这些可变区的核酸用于构建编码本文所述的双特异性结合蛋白的基因。或者,可以使用来自已知抗体的抗体可变结构域。特别地,抗il-1β、pd-1和pd-l1的人类抗体被批准用于治疗人类的多种疾病状态中,并且来自这些抗体的可变区可用于构建本文所述的双特异性结合蛋白。合适的抗体的
实施例显示在下列表1和6中。
50.或者,可以使用本领域熟知的互补决定区移植(cdr grafting)方法,将来自具有已知特异于il-1β、il-1r、pd-1或pd-l1的抗体的cdr区插入已知的人类框架区(human framework region)。请参照,例如,威廉斯与马修斯(williams和matthews)的文献(《抗体工程》(antibody engineering)中(kontermann和d
ü
bel编辑),pp 319-339(springer,2010),“humanising antibodies by cdr grafting”)。这些cdr区可以衍生自图1所示的cdr区或表6中描述的抗体的cdr区。本领域技术人员将认识到,除了本文所述的特异性结合il-1β、il-1r、pd-1或pdl-1的抗体之外的其他抗体,那些抗体的cdr区可用于构建本文所述的结合蛋白。
51.关于il-1β,卡那奴单抗(canakinumab)是结合il-1β的fda批准的人类抗体,并且重链和轻链可变区的氨基酸序列是众所周知的。请参照rondeau等人的文献(mabs 7:1151(2015))。卡那奴单抗的整个重链和轻链可变区可用于构建本文所述的双特异性蛋白;或者,可以使用本领域众所周知的cdr移植方法将卡那奴单抗的cdr区插入替代的人类可变框架序列中。请参见,例如,winter和harris的文献(trends in pharmacological sciences 14:139-143(1993))。另一种il-1β结合抗体是文献wo1995/01997中所述的人源化sk48-e26抗体。
52.关于il-1r,anakinra是fda批准的人类白介素-1受体拮抗剂(il-1ra)的重组、非糖基化形式。与天然的人类il-1ra相比,anakinra包含额外的n末端甲硫氨酸残基。anakinra竞争性地抑制il-1α和il-1β与1型il-1受体的结合。il-1r1结合结构域可用于构建双特异性蛋白,以阻断il-1β与il-1受体的结合。可以用作合适的结合结构域的anakinra的il-1r1结合部分的序列为
[0053][0054]
关于pd-1,帕博利珠单抗(pembrolizumab)是一种人源化抗体,于2014年首次获得fda批准,用于治疗肿瘤细胞表达升高的pd-1的多种癌症。纳武单抗(nivolumab)是一种全人抗体,于2014年首次获得fda批准,也可用于治疗多种癌症。cemiplimab是一种人类抗体,于2018年首次批准用于治疗转移性皮肤鳞状细胞癌。帕博利珠单抗、纳武单抗和cemiplimab的重链和轻链可变结构域的氨基酸序列是已知的,cdr区的序列也是已知的。
[0055]
关于pd-l1,durvalumab是一种人类抗体,于2017年首次获批用于治疗转移性尿路上皮癌。atezolizumab于2016年首次获得批准,用于治疗肺癌。durvalumab和atezolizumab的重链和轻链可变结构域的氨基酸序列以及cdr区的序列都是已知的。
[0056]
帕博利珠单抗(pembrolizumab)、纳武单抗(nivolumab)、cemeplimab,atezolizumab、avelumab、durvalumab和卡那奴单抗的可变结构域和cdr区的序列显示在下列表1中。其他已知抗il-1β、pd-1和pd-l1抗体的清单如图6所示。
[0057]
表1
[0058]
[0059]
[0060][0061]
il-1受体类型具有如下序列的结合结构域:
[0062][0063]
rilonacept是一种免疫球蛋白融合蛋白,其中的结合结构域包含与i型il-1受体融合的il-1受体辅助蛋白(il-1rap)。rilonacept的il-1结合部分的序列(可以用作合适的结合结构域)为:
[0064][0065]
双特异性结合蛋白结构
[0066]
一旦选择了合适的结合结构域,就将它们并入包含至少一特异性结合il-1β或il-1r的结合结构域和至少一特异性结合检查点蛋白的结构域的形式。有利地,结合蛋白的形式是二价或多价双特异性抗体的形式,其包含免疫球蛋白可变和恒定链结构域,其被安排为包含两个不同的结合结构域,这与自然存在的二价但单特异性人类抗体的同二聚体结构(homodimeric structure)不同。
[0067]
制备双特异性抗体的方法是本领域已知的,并且描述于下列文献中,例如brinkmann和kontermann的文献(mabs 9:182(2017))和spiess等人的文献(molecular immunology,67:95-106(2015))。本文所述的双特异性结合蛋白可以是本领域已知的任何稳定的形式,适合于对受试者施用,并且包含结合il-1β或il-1r的至少一结合结构域和结合检查点蛋白的至少一结合结构域。
[0068]
本领域已知的合适的双特异性结合蛋白形式的例子包括:
[0069]
无fc(fc-less)的双特异性抗体形式包括:通过接头连接的两个scfv分子(kontermann,acta pharmacol sin 26:1-9(2005));双特异性单结构域抗体融合蛋白(weidle等人,cancer genomics proteomics 10:155-68(2013;));双体(diabody)(atwell等人,mol immunol 33:1301-12(1996));fab融合蛋白(schoonjans等人,j immunol;165:7050-7(2000)以及微型抗体(miniantibody)(pluckthun与pack,immunotechnology 3:83-105(1997)及muller等人,febs lett 432:45 49(1998));
[0070]
具有来自两种不同抗体的重链和轻链的不对称igg(suresh等人,methods enzymol;121:210-28(1986));以及
[0071]
具有不对称fc区的双特异性igg,例如使用“钮入孔(knobs into holes)”方法形成不对称的fc区(ridgway等人,protein eng;9:617-21(1996);shatz等人,mabs;5:872-81(2013));sampei等人,plos one;8:e57479(2013);spiess等人,biotechnol;31:753-8(2013);juntilla等人,cancer res.74:5561-71(2014);和sun等人,j clin invest.125):4077-4090(2015))。
[0072]
技术人员将认识到,除了上述特定形式之外,大量的双特异性抗体形式可用于构建结合il-1β或il-1r与检查点蛋白的双特异性抗体。有利地,双特异性抗体是基于2+2scfv的结构或基于2+2fab的结构,如下文更详细地描述。
[0073]
基于2+2scfv的结构
[0074]
第一个基于2+2scfv的结构是图1中所示的结构,在此称为bis2。如图1所示,bis2形式包含两条蛋白链:
[0075]
(1)重链,包含(从n末端到c末端)单链fv;单链fv包含第一vh结构域和第一vl结构域(排列为vh-vl或vl-vh,即这些结构域可以是任何顺序);第二vh结构域;ch1、ch2和ch3结构域,其中scfv结合第一靶标(分别是il-1β、il-1r或检查点蛋白);以及
[0076]
(2)包含(从n末端到c末端)第二vl结构域和cl结构域的轻链。
[0077]
bis2蛋白经由ch3结构域和ch2结构域的非共价同二聚体结合,以及重链上的ch1结构域和cl结构域与轻链上的第二vh结构域与vl结构域之间的异二聚体结合而组装。ch1和cl结构域与vh和vl结构域之间的结合形成了一个fab结构域,所述结构域结合了第二靶标(分别是检查点蛋白或il-1β/il-1r)。有利地,以与自然存在的igg分子中相同的方式,双硫键也在铰链区(hinge region)之间以及ch1和cl结构域之间形成。
[0078]
第二个基于2+2sc fv的结构是图2a中所示的结构,在此称为bis3。如图2a所示,bis3形式亦包含两条蛋白链:
[0079]
(1)重链,其包含(从n末端到c末端):第一vh结构域;ch1、ch2和ch3结构域;以及单链fv,单链fv包含第二vh结构域和第二vl结构域(其中vh和vl结构域可以是任意顺序),其中scfv结合第一靶标(分别是il-1β或检查点蛋白);
[0080]
(2)包含(从n末端到c末端)第二vl结构域和cl结构域的轻链。
[0081]
bis3蛋白亦经由ch3和ch2结构域的同二聚体结合以及重链上的ch1和cl结构域与轻链上的第二vh和vl结构域之间的异二聚体结合而组装。ch1和cl结构域与vh和vl结构域之间的结合形成了fab结构域,所述结构域结合了第二靶标(分别是检查点蛋白或il-1β/il-1r)。有利地,以与自然存在的igg分子中相同的方式,双硫键也在ch2结构域之间以及在ch1和cl结构域之间形成。
[0082]
替代的结合蛋白结构是图2b中所示的同二聚体结构,其中重链vh和ch1结构域被衍生自白介素-1受体的细胞外配体结合结构域的结合结构域所取代。所述结合结构域包含来自1型或2型il-1r的全部或部分细胞外结合结构域,选择性地缀合至来自白介素-1辅助蛋白(il-1racp)的细胞外蛋白结合结构域。il-1racp是功能性il-1受体的受体亚基,与il-1ri形成受体异二聚体。在图2b所示的结构中,结合蛋白经由ch3和ch2结构域的非共价同二聚体结合而组装。有利地,以与自然存在的igg分子中相同的方式,双硫键也在ch2结构域之间和铰链结构域之间形成。
[0083]
基于2+2fab的结构
[0084]
第一个基于2+2fab的结构是图3a中所示的结构,在本文中称为fit-ig(请参照gong等人的文献:mabs,2017,9:1118-1128(2017))。如图3a所示,fit-ig形式包含三个蛋白链:
[0085]
(1)重链,其包含(从n末端到c末端):第一vl结构域;第一cl结构域,第一vh结构域,第一ch1结构域以及ch2和ch3结构域;
[0086]
(2)轻链,其包含(从n末端至c末端):第二vl结构域和第二cl结构域;以及
[0087]
(3)fd链,其包含(从n末端到c末端):第二vh结构域和第二ch1结构域。
[0088]
在重链中,第一cl结构域可以经由肽接头(例如具有序列(ggggs)
x
(其中x为1-5)的柔性亲水接头)与第一vh结构域连接。然而,有利地,不存在接头。
[0089]
fit-ig蛋白经由以下方式组装:ch3和ch2结构域的非共价同二聚体结合;重链上的第一vh和ch1结构域与轻链上的第二vl和cl结构域之间的异二聚体结合;fd链上第一vl
和cl结构域与第二vh和ch1结构域之间的异源二聚体结合。两个相同的fab结合结构域通过重链与轻链的结合形成,两个独特(distinct)但相同的fab结构域通过重链与fd链之间的结合形成,如图3中所示。有利地,以与自然存在的igg分子中相同的方式,双硫键亦在ch2结构域之间以及铰链结构域之间形成。
[0090]
另一种2+2结合蛋白显示在图3b至图3e中,其中抗体fab结合结构域之一被衍生自白介素-1受体的细胞外配体结合结构域的结合结构域所取代。所述结合结构域包含来自1型或2型il-1r的全部或部分细胞外结合结构域,任选地缀合至来自白介素-1辅助蛋白(il-1racp)的细胞外蛋白结合结构域。il-1racp是功能性il-1受体的受体亚基,与il-1ri形成受体异二聚体。在图3b至图3e所示的结构中,结合蛋白经由ch3和ch2结构域的非共价同二聚体结合而组装;一条链上的vh和ch1结构域与第二蛋白链上的vl和cl结构域之间的异源二聚体结合。有利地,双硫键也以与自然存在的igg分子中相同的方式在ch1和cl结构域之间,ch2结构域之间以及铰链结构域之间形成。
[0091]
第二个基于2+2fab的结构是图4所示的新颖结构,在本文中称为fat-ig。如图4所示,fat-ig格式包含三个蛋白链:
[0092]
(1)重链,其包含(从n末端到c末端):第一vh结构域;第一ch1结构域,以及ch2结构域和ch3结构域;加上第一vl结构域和第一cl结构域,其中第一vl结构域和第一cl结构域位于ch2结构域、ch3结构域中的溶剂暴露环(solvent exposed loop)处,或位于ch2和ch3结构域的界面处。有利地,第一cl结构域和第一cl结构域位于ch3结构域中的溶剂暴露环处。
[0093]
(2)轻链,其包含(从n末端至c末端):第二vl结构域和第二cl结构域;和
[0094]
(3)fd链包含(从n末端到c末端):第二vh结构域和第二ch1结构域。
[0095]
在重链中,位于溶剂暴露环上的第一vl和cl经由柔性肽接头连接到ch2结构域、ch3结构域,或ch2和ch3结构域的界面。接头可具有4至25个氨基酸,并且有利地包含(ggggs)
x
单元,其中x=1至5。如下面更详细描述的,也可以使用其他接头。
[0096]
fat-ig蛋白的组装如图4所示,经由下列方式:ch3和ch2结构域的非共价同二聚体结合;重链ch1和vh结构域与轻链cl和vl结构域的异二聚体结合;以及重链cl和vl结构域与fd链ch1和vh结构域的异二聚体结合。如图4所示,通过重链与轻链的结合形成两个相同的fab结合结构域,经由重链与fd链的结合形成两个独特但相同的fab结构域。有利地,以与自然存在的igg分子相同的连接方式,双硫键亦在铰链结构域之间以及ch1和cl结构域之间形成。本领域中普通技术人员将认识到,新颖fat-ig抗体形式可用于结合任何两种所需抗原,并且不限于il-1β/il-1r和检查点蛋白。
[0097]
在上述四种特异性结合蛋白的每一种中,特异性结合il-1β/il-1r和检查点蛋白的结合结构域不对称地位于结合蛋白内,亦即,相较于当第一结合结构域结合检查点蛋白并且第二结合结构域结合il-1β/il-1r时的结构而言,当第一结合结构域结合il-1β/il-1r而第二结合结构域结合检查点蛋白时结合蛋白的结构是有所不同。因此,对于任何给定的结合结构域对(pair),四种特异性结合蛋白中的每一种可以两种替代形式存在。
[0098]
多肽接头
[0099]
可以使用接头将本文所述的双特异性结合蛋白的结构域连接成连续的蛋白链。接头可用于例如连接scfv的可变重链及轻链,或将cl/vl结构域连接成fat-ig格式的重链恒定结构域。
[0100]
合适的接头是本领域已知的,并且当存在时,有利地包含至少四个氨基酸,尽管也可以使用更长或更短的接头。所述接头有利地是柔性的、亲水的并且本身具有很少或没有二级结构。接头可能约为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45或大约50个残基的长度。如本文所述,当多个接头用于互连双特异性蛋白的部分时,接头可以相同,或具有不同的长度和/或氨基酸序列。
[0101]
接头促进所需双特异性结合蛋白结构的形成。接头可包含(gly-ser)
x
单元,其中x=1-5。如有必要,还可将谷氨酸(glutamic acid)或赖氨酸(lysine)残基置于接头序列中以增加溶解度。接头的长度可以变化以促进蛋白质折叠、靶标结合和/或表达。例如,使用本领域已知的方法,可以使用(gly-ser)
x
单位的不同倍数来改善或优化蛋白质折叠、靶标结合和/或表达。
[0102]
双特异性结合蛋白的制备
[0103]
制备双特异性结合蛋白的方法例如是无fc的双特异性抗体、具有来自两种不同抗体的重链和轻链的不对称igg及具有不对称fc区的双特异性igg,在本领域中是已知的,并在上文提供的参考文献中进行了描述。
[0104]
可以使用重组宿主细胞中的合适表达构建体(construct)产生上述特定的2+2双特异性抗体。编码重、轻和fd链的核酸可以使用例如商业基因合成供货商(例如thermo fisher(carlsbad,ca))合成制备。有利地,宿主细胞是真核细胞,并且有利地用编码n末端信号序列的序列合成每个链的基因,所述n末端信号序列使得翻译的蛋白质从宿主细胞分泌。将每条链的基因插入合适的表达载体,例如ptt5载体(durocher等人,nucleic acids res.30:e9(2002)),然后将得到的表达构建体转染(transfect)到合适宿主的培养物中,以瞬时表达。使用例如阳离子脂质将表达载体有效转染到宿主细胞中的方法是本领域已知的(请参见felgner等人的文献,proc.nat’l acad.sci usa 84:7413(1987))。将表达载体递送到细胞中的其他方法也是本领域已知的。通过将表达构建体整合至合适的宿主细胞的基因组中来制备能够稳定表达所需蛋白质的宿主细胞的方法也是已知的,使用包含哺乳动物复制起点(作为宿主细胞核中的染色体外组件)的附加型载体(episomal vector)的稳定表达的方法也是已知的。
[0105]
宿主细胞有利地是真核细胞,例如单细胞真核生物(例如酵母或其他真菌)、植物细胞(例如烟草或西红柿植物细胞)、动物细胞(例如人类细胞、猴子细胞、仓鼠细胞、大鼠细胞、小鼠细胞或昆虫细胞)或杂交瘤(hybridoma)。宿主细胞的范例包括猴肾细胞的cos-7系(atcc crl 1651)(请参照gluzman等人的文献,1981,cell 23:175)、l细胞、c127细胞,3t3细胞(atcc ccl 163),在无血清介质中生长的中国仓鼠卵巢(cho)细胞或其衍生物,例如veggie cho和相关细胞系(请参照rasmussen等人的文献,1998,cytotechnology 28:31)或dhfr缺乏的cho株dx-b11(请参照urlaub等人的文献,1980,proc.natl.acad.sci.usa 77:4216-20)、希拉细胞(hela cell)、bhk(atcc crl 10)细胞系、源自非洲绿猴肾cv1细胞系(atcc ccl 70)的cv1/ebna细胞系(请参照mcmahan等人的文献,1991,embo j.10:2821)、人类胚胎肾细胞(例如293、293ebna或msr 293)、人类表皮a431细胞、人类colo205细胞、其他转化的灵长类动物细胞系(transformed primate cell line)、正常二倍体细胞、源自原代组织体外培养的细胞株、原代外植体(primary explant)、hl-60、u937、hak或jurkat细胞。有利地,宿主细胞是cho细胞,例如cho-3e7。
[0106]
典型地,宿主细胞是可以用编码多肽的核酸转化或转染的培养细胞,然后可以在宿主细胞中表达所述多肽。“重组宿主细胞”的用语可用于表示已经用待表达的核酸转化或转染的宿主细胞。宿主细胞也可以是包含核酸但不以所需水平表达的细胞,除非将调控序列引入宿主细胞中,从而使其与核酸可操作地连接。如本文所使用的“宿主细胞”的术语不仅是指特定的个体细胞(subject cell),而且是指这种细胞的后代或潜在后代。因为某些修饰可能由于例如突变或环境影响而在后代中发生,所以这种后代实际上可能不会与亲本细胞相同,但仍包括在本文所用术语的范围内。用于真核宿主细胞生长的合适的细胞培养介质在本领域中是已知的,并且可以从例如thermo fisher(grand island,ny)商购获得。
[0107]
在合适的条件下培养宿主细胞,以使蛋白链在宿主细胞的内质网中组装,然后将双特异性结合蛋白分泌到细胞培养上清液中。通过改变用于转染宿主细胞的表达载体的相对比例,可以改善结合蛋白正确结构的组装(例如,与导致非活性蛋白形成的链的非特异性配对相反)。载体比例的这种变化也可以用来抵消,例如,与不同链相比,链之一的生产效率较低。本领域技术人员将认识到,优化载体比例的方法在本领域中是已知的。
[0108]
以合适的时间长度在合适的表达介质中培养宿主细胞之后,收集含有双特异性结合蛋白的条件介质,并使用本领域已知的方法纯化双特异性结合蛋白。例如,可以使用可包括离子交换色谱法、尺寸排阻色谱法和亲和性色谱法(例如是蛋白a亲和色谱)的方法来纯化结合蛋白。蛋白质纯化的方法例如是描述于burgess和deutscher(eds)的文献(“guide to protein purification,volume 436(methods in enzymology)2nd edition(2009))。可以使用本领域已知的方法(例如rt-hplc、sds-page及其他方法)来确认蛋白质的纯度。
[0109]
多链结合蛋白的正确组装可以通过例如非变性凝胶电泳来显示,以显示结合蛋白具有预期的分子量。sds-page可用于显示存在每个预期的蛋白链并具有预期的分子量。使用合适的抗人igg抗体的western印记可以进一步显示所测蛋白是免疫球蛋白链。
[0110]
药物组合物和施用方法
[0111]
制备双特异性结合分子并将其施用至有需要的受试者的方法是本领域技术人员已知的或容易确定的。结合分子的施用途径可以是例如口服、非口服、通过吸入或局部施用。本文所用的术语非口服包括例如静脉内、动脉内、腹膜内、肌内、皮下、直肠或阴道施用。然而,在与本文的教导兼容的其他方法中,可以将结合分子直接递送至不良细胞群体的位点,从而增加患病组织对治疗剂的暴露。
[0112]
可以以药物有效量施用结合分子以治疗疾病,例如某些类型的癌症。药物组合物可以包含药学上可接受的载体,包括例如水、离子交换剂、蛋白质、缓冲物质和盐。防腐剂和其他添加剂也可以存在。载体可以是溶剂或分散介质。下列文献描述了适用于本文揭露的治疗方法的制剂(remington's pharmaceutical sciences(mack publishing co.)第16版(1980))。
[0113]
在任何情况下,可以通过将结合分子本身或与有效量的其他活性剂在适当的溶剂中组合,然后过滤灭菌来制备无菌注射溶液。制剂也可以以药盒(kit)的形式包装和出售。这种制品可以具有标签或包装插页,表明相关的组合物可用于治疗患有或易患疾病或病症的受试者。
[0114]
非口服制剂可以是单次推注剂量(single bolus dose)、输注(infusion)或负荷推注剂量(loading bolus dose),然后是维持剂量(maintenance dose)。这些组合物可以
carcinoma,ad-scc)或鳞癌(squamous carcinoma,scc)。关于乳癌,所述癌症可以是原位癌、原位导管癌(ductal carcinoma in situ,dcis)、浸润性、浸润性导管癌(invasive ductal carcinoma,idc)、浸润性小叶癌(invasive lobular carcinoma,ilc)、三阴性乳腺癌(triple-negative breast cancer)、炎症性乳癌、血管肉瘤或乳房柏哲德氏症(paget disease of the breast)。关于卵巢癌,所述癌症可以是上皮肿瘤、良性上皮性卵巢肿瘤、交界性上皮性卵巢肿瘤、恶性上皮性卵巢肿瘤、生殖细胞肿瘤、畸胎瘤、无性细胞瘤(dysgerminoma)、内胚窦肿瘤和绒毛膜癌、原发性腹膜癌、输卵管癌或卵巢间质瘤。关于多发性骨髓瘤和癌前疾病,所述癌症可能是轻链骨髓瘤、非分泌性骨髓瘤、孤立性浆细胞瘤、髓外浆细胞瘤、意义不明单克隆球蛋白病(monoclonal gammopathy of undetermined significance,mgus)、冒烟型多发性骨髓瘤(smoldering multiple myeloma,smm)、免疫球蛋白d(igd)骨髓瘤或免疫球蛋白e(ige)骨髓瘤。
[0118]
用于治疗这些疾病的组合物的治疗有效剂量取决于许多不同因素,包括施用方式、靶标位点、患者的生理状态、患者是人还是动物、所施用的其他药物以及治疗是预防性的还是治疗性的。通常,患者是人类,但是也可以治疗非人类哺乳动物,包括转基因的哺乳动物。可以使用本领域技术人员已知的常规方法来滴定(titrate)治疗剂量以优化安全性和功效。
[0119]
至少一种结合分子的施用量可以通过本领域普通技术人员容易地确定,而无需进行过多的实验。影响施用方式和至少一种结合分子的各自量的因素包括但不限于疾病的严重程度、病史、以及其年龄、身高、体重、健康状况及正在接受治疗的个人的身体状况。类似地,要施用的结合分子的量将取决于施用方式以及受试者将接受单剂或者多剂的试剂。
[0120]
结合分子还可以用于制备用于治疗一种癌症(包括例如以上所列的癌症)的药物。
[0121]
在接受包含结合分子的药物之前,用本文所述的组合物治疗的受试者可以是未经治疗的或可以用一种或多种其他疗法(例如,至少一种其他抗癌疗法)进行预处理。受试者不必是对先前疗法或一些疗法的预处理的反应者。因此,接受包含结合分子的药物的受试者,可能已经反应、反应较差、最初有反应但是随后却没有反应、或者可能对先前疗法的预处理、或预处理包括多种疗法的一种或多种先前疗法没有反应。因此,本公开提供了治疗对其他疗法反应差或无反应的患者的方法,包括施用本文所述的结合分子。还提供了克服或预防对癌症疗法的抗性或预防或延迟复发的方法,其包括施用本文公开的结合分子或本文所述的组合物。
[0122]
即使患者先前已经用抗癌药物治疗过,本领域技术人员也可以确定所述人是否对所述药物无反应或具有抗性(refractory)。例如,对抗癌药物的无反应可能反应出罹患癌症的痛苦增加(例如,癌症/肿瘤的生长增加和/或肿瘤的大小增加,形成转移或转移增加、或转移的数量或大小的增加)。无反应也可能是肿瘤的发展或转移,例如在切除(resection)肿瘤之后,缩短疾病进展时间或增加一或多个肿瘤的大小和/或转移,例如在新辅助治疗中。基于这些参数或本领域已知的其他参数,可以确定对抗癌药物的治疗没有反应的患者组,然后可以用本文所述的结合分子治疗所述患者组。
[0123]
结合分子和包含结合分子的组合物还可用于治疗例如对另一种疗法的反应较差或无反应的患者。如本文所用,术语“无反应者”可以指不太可能对使用抗癌药物的治疗反应的个体/患者/受试者。如本文所用,“反应可能性较小”是指在用抗癌药物治疗的患者中
发生病理完全反应的可能性降低。在一些方面,患者最初可以是良好的反应者,并且在用这种抗癌药物治疗期间可以产生对治疗的抗性,导致对治疗的反应较差或无反应。
[0124]
如本文所用术语“良好反应者”是指其肿瘤在使用抗癌药治疗期间或之后(例如基于连续性的影像研究)未表现出生长、转移、转移的数量或大小的增加等的个体;是指在一段时间内(例如,初诊后约1年)未经历肿瘤生长、转移、转移的数量或大小增加等的个体,和/或经历一定寿命的个体(例如,最初诊断后大约2年或更长时间)。
[0125]
如本文所用术语“不良反应者”是指在标准疗法(例如使用抗癌药物)期间或之后不久肿瘤生长或转移,或经历可归因于肿瘤的不良临床作用的个体。术语“不良反应者”还包括在使用抗癌药物治疗期间从“良好反应者”转变为“不良反应者”的个体。
[0126]
如果受试者被评估为“无反应者”、“反应较差”或“反应可能性较小”(例如,基于癌细胞中某些生物标记物的存在),受试者可以用本文所公开的结合分子治疗。
[0127]
还提供了用于本文所述结合分子与至少一种其他疗法的共同施用的方法。结合分子和至少一种其他疗法可以在单一组合物中一起共同施用,或者可以在分开的组合物中同时或重迭时间一起共同施用。在一些方面,结合分子可以用作辅助疗法。
[0128]
结合分子还可以用于制备用于治疗患有癌症的受试者的药物,其中在已经用至少一种其他疗法治疗受试者之前施用结合分子。
[0129]
通过向受试者施用有效量的结合蛋白或含有所述结合蛋白的组合物,结合分子还可用于预防或降低受试者癌症风险的方法中。癌症可以是肺癌,并且患者可以从先前诊断和/或先前治疗的癌症中缓解。由于环境暴露、使用或接触烟草、基因突变或癌症家族史,可以认为患者有患癌症的风险。
[0130]
实施例
[0131]
在下列实施例中,结合结构域是基于人类抗体(已获得监管机构批准可用于人类)的重链和轻链可变区。“o”、“e”和“k”表示结合il-1β的结构域,而“m”和“b”表示结合pd-1的结合结构域。结合蛋白链的氨基酸序列如图5所示。
[0132]
实施例1:双特异性抗体的表达
[0133]
1.质粒制备
[0134]
合成编码结合蛋白的靶标dna序列,并将其亚克隆到ptt5载体中(durocher等人,nucleic acids res.30:e9(2002)),用于在cho-3e7细胞中表达。编码序列的氨基酸序列如图5所示。
[0135]
2.细胞培养和瞬间转染
[0136]
cho-3e7细胞在无血清freestyle
tm cho表达介质(life technologies,carlsbad,ca,usa)中生长。将细胞在回转式振荡机(vwr scientific,chester,pa)上在37℃和5%co2的条件下保持在锥形瓶(corning inc.,acton,ma)中。转染前一天,将细胞接种在康宁锥形瓶中。转染当天,将dna和转染试剂混合,然后添加到细胞培养物中,在此期间,将编码靶标抗体的重组质粒瞬间转染到cho-3e7细胞中。在第6天收集的细胞培养上清液是用于纯化。表2列出了每种抗体的重链、轻链和fd链组合以及所筛选的每种质粒比例。
[0137]
表2.每个抗体的重链(hc)、轻链(lc)和fd链(fd)组合以及质粒比例的摘要
[0138]
[0139]
[0140][0141]
3.纯化及结果
[0142]
离心细胞培养上清液,然后过滤。将过滤的上清液以1.0ml/min的速度加载到1ml monofinity a树脂预填充柱上(genscript,cat.no.l00433-11)。洗涤步骤后,洗脱抗体,然后将缓冲液更换为ph 7.2的pbs。通过标准技术进一步纯化抗体。例如,一些样品通过尺寸排阻色谱法(sec)使用superdex 200increase 10/300gl柱,或通过陶瓷羟磷灰石色谱法(ceramic hydroxyapatite chromatography)使用cht
tm
陶瓷羟磷灰石柱(bio-rad)进一步纯化。对于其他蛋白质,蛋白a亲和性色谱用于初步纯化,然后根据需要进行sec。
[0143]
在还原和非还原条件下,通过sds-page和western印记分析(使用山羊抗人类igg-hrp(genscript,cat.no.a00166))对每种表达的蛋白质进行了分析,结果表示蛋白质和组成链具有所需的分子量。使用尺寸排阻hplc评估蛋白质的纯度。
[0144]
实施例2
[0145]
使用流式细胞术分析实施例1中所述16种不同双特异性抗体中的9种与细胞表面上的pd-1的结合。使用的细胞系是cho-k1细胞(阴性对照)并表达cho-k1/pd-1。使用的抗体是无关的人类的igg(阴性对照)和市售的抗pd-1(阳性对照)。使用的二抗是山羊抗人类的
igg(h+l)ifluor 647(1μg/ml)(数据未显示)。为了证明双特异性分子与pd1和il-1β同时结合,进行了夹心式facs分析。结合曲线显示在图7中。表达pd1的cho细胞被指定浓度的双特异性抗体结合。洗去未结合的抗体,并用生物素化的il-1β(2μg/ml),然后用sa-ifluor 647(1μg/ml)进行检测。荧光强度既表示bisab固定在pd1+细胞上,又表示其同时结合il-1β的能力。抗il-1βvh/vl结合结构域与两对不同的抗pd-1vh/vl结合结构域的各种组合被格式化为bis2、bis3、fit-ig或fat-ig分子。相较于包含由seq id nos:6-12的序列定义的cdr区的抗pd-1vh/vl结合区的5个结合分子而言,在所测试的构建体(construct)中,包含由seq id no:1-6的序列定义的cdr区的抗pd-1vh/vl结合区的4个结合分子均达成更高的平均荧光强度。
[0146]
图8至图12显示了另外的结合蛋白的另外的结合数据。图8显示了在多剂量夹心测定中双特异性抗体同时与细胞膜结合的pd-1及可溶性il-1β结合的结合曲线,例如通过流式细胞术检测。显示了itc、itd与ite系列双特异性抗体的可变的结合亲和力。所有的结合亲和力均实质上高于对照人igg。
[0147]
图9显示了在多剂量夹心测定中与细胞膜结合的pd-1结合的结合曲线,例如是通过流式细胞术术检测。显示了itb和itf系列双特异性抗体的可变结合亲和力。所有结合亲和力均实质上高于对照人igg。
[0148]
图10显示了通过流式细胞术检测到的在多剂量夹心测定中同时与细胞膜结合的pd-1和可溶性il-1β结合的结合曲线。显示了itb和itf系列双特异性抗体的可变结合亲和力。所有结合亲和力均实质上高于对照人igg。
[0149]
图11显示双特异性抗体在pd-1/pd-l1报告分子分析中阻断pd-1活性。显示了针对ita系列双特异性抗体的可变阻断活性。所有的阻断活性均实质上高于对照人igg。
[0150]
图12显示双特异性抗体在il-1β功能测定中阻断il-1β活性。ita系列双特异性抗体证明了可变的阻断活性。所有的阻断活性均实质上高于对照人igg。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1