胰高血糖素制造方法与流程
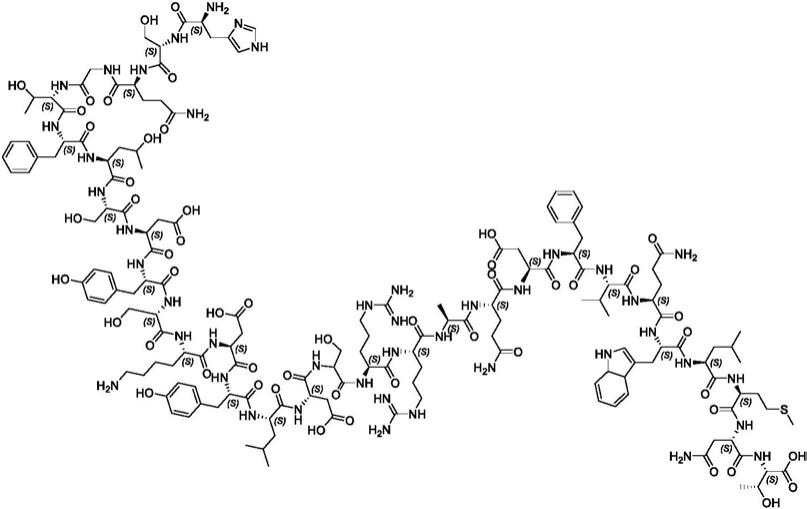
1.本发明提供了用于制备高纯度胰高血糖素和相关中间物的改进方法。
背景技术:
2.胰高血糖素为由郎格罕氏胰岛(pancreatic islet of langerhans)的α细胞分泌的多肽激素。胰高血糖素为由29个天然氨基酸(seq id no:1,胰高血糖素1-29)组成的单链肽,并且由以下所示之化学结构表示:
[0003][0004]
1923年,化学家kimball和murlin首次在胰腺提取物中发现了胰高血糖素。胰高血糖素表示在被胰岛素治疗的患者或糖尿病患者的管控中可出现的严重低血糖反应治疗。
[0005]
最早的胰高血糖素分离是从胰腺提取物中进行。从胰腺中进行提取是困难的,并且产物很大程度上被胰岛素污染。以上方法产量低,因此需要大量胰腺。此外,动物源性胰高血糖素可能会诱发某些患者的过敏反应,从而使其不适用于所述情况。
[0006]
目前,胰高血糖素是通过重组dna技术或通过使用固相肽合成(spps)产生的。几项例如us4826763或us6110703的专利描述使用重组dna技术或遗传修饰的酵母细胞进行的胰高血糖素合成。
[0007]
重组技术除了极其昂贵之外,也是一种工业上复杂的方法。其需要使用专门的设备、合成期间的改良生物体以及精心制作的分析和纯化程序。除了成本高外,生产生物分子的生物技术方法还存在可重复性低的问题。
[0008]
胰高血糖素的固相肽合成方法相对困难,这是因为长肽链因由于分子间和分子内氢键而经常出现树脂上聚集现象,从而产生几个作为杂质出现的截短序列,降低了最终化合物的产量和纯度。
[0009]
美国专利us3642763描述了通过在n-羟基-琥珀酰亚胺或n-羟基邻苯二甲酰亚胺
存在的情况下缩合[aa 1-6]和[aa 7-29]肽片段并且随后在三氟乙酸存在的情况下分离保护基团进行的胰高血糖素合成。所述专利没有公开在所述方法中获得的化合物的纯度。
[0010]
中国专利cn103333239描述了胰高血糖素固相肽合成方法,其中,氨基酸缩合是在较高温度下进行,并且其中,公开了使用伪脯氨酸二肽作为4/5位和7/8位处的保护基团。然而,通过所述方法获得的胰高血糖素的纯度始终较低。
[0011]
因此,需要用于合成胰高血糖素的改进方法,所述方法以高产量和纯度提供产物,并且还具有成本效益和工业可行性。
[0012]
发明目的
[0013]
本发明的一个目的在于克服现有技术的上述缺点。
[0014]
本发明的另一个目的在于提供用于制备胰高血糖素的改进方法,所述方法以高产量以及高纯度提供产物。
[0015]
本发明的另一个目的在于提供用于合成胰高血糖素的有用中间物。
技术实现要素:
[0016]
本发明提供了用于制备胰高血糖素的改进方法。
[0017]
在一个实施例中,本发明涉及用于制备胰高血糖素的方法,所述方法包含使n端四肽(1-4)(seq id no:2)与c端肽(5-29)(seq id no:3)偶合,其中,c端肽包含至少一种伪脯氨酸二肽。
[0018]
n端四肽(1-4)的序列为his(p)-ser(p)-gln(p)-gly-oh,其中,p为侧链保护基团或不存在。
[0019]
c端肽(5-29)具有以下氨基酸序列thr(p)-phe-thr(p)-ser(p)-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-asp(p)-ser(p)-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),所述序列通过至少一个丝氨酸或苏氨酸残基的存在来进一步指定,所述残基已经被可逆地保护为类脯氨酸的酸不稳定恶唑烷(也称为伪脯氨酸);并且其中,p为侧链保护基团或不存在。
[0020]
本发明的方法可以被描述为用于制备胰高血糖素的方法,所述方法包含使胰高血糖素的n端四肽(1-4)与上述胰高血糖素的c端肽(5-29)偶合,其中c端肽中的至少一个丝氨酸或苏氨酸通过使用伪脯氨酸二肽而受到保护。在一个优选实施例中,用于制备胰高血糖素的方法包含制备c端肽(5-29),所述制备包含以下步骤:
[0021]
a)使α-氨基保护的苏氨酸与树脂偶合;
[0022]
b)选择性裂解末端保护基团;
[0023]
c)在偶合剂存在的情况下使后来的α-氨基保护的氨基酸或肽与步骤b)中获得的脱保护的氨基偶合;
[0024]
d)重复步骤b)和c)以延长肽序列,从而最终获得c端肽(5-29);
[0025]
其中,至少一个步骤c)包含与伪脯氨酸二肽偶合。
[0026]
在一个步骤中,通过与伪脯氨酸二肽偶合,肽链延伸两个残基。
[0027]
本发明的另一个实施例为不同的伪脯氨酸二肽和其用于合成胰高血糖素的用途。伪脯氨酸二肽优选地选自由以下组成的组:
[0028]
fmoc-asp(otbu)-ser[psi(me,me)pro]-oh
[0029]
fmoc-asn(trt)-thr[psi(me,me)pro]-oh
[0030]
fmoc-tyr(tbu)-ser[psi(me,me)pro]-oh
[0031]
fmoc-phe-thr[psi(me,me)pro]-oh和
[0032]
fmoc-thr(tbu)-ser[psi(me,me)pro]-oh。
[0033]
更优选地,本发明的方法提供了胰高血糖素的制备,所述制备包含使n端四肽boc-his(trt)-ser(tbu)-gln(trt)-gly-oh(2)与c端肽(5-29)偶合的步骤,其中,c端肽包含伪脯氨酸二肽asp(otbu)-ser[psi(me,me)pro]。
[0034]
本发明的另一个实施例涉及c端肽(5-29)和受保护的胰高血糖素序列,其为胰高血糖素制备中的中间物。
具体实施方式
[0035]
本发明涉及用于制备式i所示胰高血糖素的方法:
[0036][0037]
胰高血糖素也由以下氨基酸单字母代码序列指示:
[0038]
hsqgtftsdyskyldsrraqdfvqwlmnt。
[0039]
在大肽分子例如胰高血糖素的合成中,不断生长的肽链的构象和其物理化学性质非常重要。二级结构的形成经常会导致聚合问题,从而使偶合反应不完全,导致最终化合物的合成产量和纯度下降。
[0040]
举例来说,发现在胰高血糖素的逐步spps制备中,在插入g1y4残基(即,4位处的甘氨酸)之后,偶合效率显著降低并且胰高血糖素序列的有效完成受到阻碍。这种情况通过在粗胰高血糖素中的残基gly4、gln3和ser2处存在截短序列(在从树脂中裂解之后)并且通过其非常低的hplc纯度来证明(参见实验部分的实例2,批次1a)。
[0041]
类似地,分子内和分子间聚集现象可能为导致胰高血糖素合成中的偶合反应效率甚至在逐步延长的较早阶段,例如在插入leu14之后降低的原因。为了解决这个问题,发现伪脯氨酸二肽的使用使得在胰高血糖素的c端肽(5-29)合成期间维持偶合效率。
[0042]
但是,伪脯氨酸二肽的使用不足以以合适的产量获得粗胰高血糖素(参见实验部分的实例2,批次1b)。
[0043]
发现在一个步骤中,通过基于片段的合成方法,包括使四肽his-ser-gln-gly偶合而非使fmoc-gly-oh偶合进行的胰高血糖素序列的最后四个氨基酸(1-4)插入得到了具有出乎意料地高的纯度的受保护的胰高血糖素序列。
[0044]
一方面,使用至少一种伪脯氨酸二肽允许有效制备胰高血糖素的c端肽(5-29)。另一方面,胰高血糖素n端四肽(1-4)与c端肽(5-29)的偶合非常高效,并且最终产生具有良好产量和高纯度的粗产物。
[0045]
因此,本发明提供用于制备胰高血糖素的方法,所述方法包含使胰高血糖素的任选地受保护的四肽(1-4)与胰高血糖素的c端肽(5-29)偶合,其中,c端肽包含至少一种伪脯氨酸二肽。
[0046]
本发明的方法可以通过spps或通过lpps(液相肽合成)或通过混合spps/lpps技
术,通过根据所属领域的技术人员熟知的规范调整本文所述的条件和方法来执行。
[0047]
本发明的方法中采用的氨基酸具有天然l-构型;一般来说,本发明的方法中采用的所述氨基酸和伪脯氨酸二肽(优选地携带末端保护基团)为可商购的。
[0048]
如本文所用的术语“末端保护基团”是指用于制备胰高血糖素的氨基酸或肽或完整胰高血糖素序列的α-氨基的保护基团,其在偶合以延长肽序列之前或在肽延长结束时被裂解。优选地,末端保护基团为9-芴基甲氧羰基(fmoc)或叔丁氧羰基(boc)。
[0049]
术语“树脂”用于描述适合执行肽合成的官能化聚合固体载体。优选地,本文中的树脂可以选自包含以下的组:2-氯三苯甲氯(ctc)、三苯甲氯、王氏树脂(wang)、rink酰胺树脂、rink酰胺am树脂和rink酰胺mbha树脂。
[0050]“树脂上聚集”是指由于分子内和分子间氢键结相互作用而导致肽链的二级结构形成或凝集,这会降低肽对偶合反应的可用性并阻碍肽链的进一步生长。
[0051]
术语“伪脯氨酸”是指以下恶唑烷:当通过用醛或酮进行环化来同时保护丝氨酸或苏氨酸的α-氨基和侧链羟基时,产生展现出类似于脯氨酸的结构特点的恶唑烷(还参见t.haack,m.mutter,tetrahedron lett.1992,33,1589-1592)。伪脯氨酸二肽结构如下所绘示,其中,还指示了fmoc末端保护基团的位置:
[0052][0053]
其中r1为氢或甲基;r2为用于ser的氢和用于thr的甲基;并且r3为伪脯氨酸保护的氨基酸旁边的氨基酸的侧链(立体中心处的构型未指示)。
[0054]
上述伪脯氨酸二肽也指示为fmoc-a
1-a2[psi(r1,r1)pro]-oh或更简单地指示为pa1a2,其中,a1和a2为所涉及的氨基酸的三字母或单字母代码,并且其中,在本发明的上下文中,a1是指天冬氨酸、天门冬酰胺、酪氨酸、苯丙氨酸或苏氨酸,并且a2是指丝氨酸或苏氨酸。特别地,当将伪脯氨酸二肽掺入肽序列时,即,当其不具有末端基团并且在c端处不具有游离羧酸时,缩写pa1a2在整个本公开中使用。
[0055]
将伪脯氨酸二肽(例如fmoc保护的伪脯氨酸二肽)引入肽序列中可以在标准偶合条件下在固相中执行。一旦通过酸解从树脂裂解完整肽,则也会在同一步骤中水解伪脯氨酸,从而在序列中提供两个相应的天然氨基酸。肽延长完成后进行的伪脯氨酸保护的裂解是通过例如用包含tfa的混合物进行酸处理发生的。
[0056]
如本文所用的“侧链保护基团”为用于氨基酸侧链化学官能团的保护基团,其在去除末端保护基团时不会被去除并且在偶合反应期间是稳定的。优选地,包括侧链保护基团以保护特别具有反应性或不稳定的氨基酸的侧链,以避免副反应和/或生长分子的分支化。说明性实例包括酸不稳定的保护基团,例如叔丁氧羰基(boc)、烷基例如叔丁基(tbu)、三苯甲基(trt)、2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基(pbf)等。其他保护基团可以有效使用,这是因为其对所属领域的技术人员来说是显而易知的。
[0057]
侧链保护基团的选择标准在于:一般来说,保护基团必须对在合成的每个步骤中
arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),(seq id no:5)
[0081]
thr(p)-phe-thr(p)-ser(p)-asp(p)-pys-lys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gin(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),(seq id no:6)
[0082]
thr(p)-phe-pts-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-asp(p)-ser(p)-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),(seq id no:7)
[0083]
thr(p)-phe-pts-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),(seq id no:8)
[0084]
thr(p)-pft-ser(p)-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-asp(p)-ser(p)-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),(seq id no:9)
[0085]
和
[0086]
thr(p)-pft-ser(p)-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),(seq id no:10)
[0087]
其中,p为侧链保护基团或不存在,并且pa1a2为如以上定义的伪脯氨酸二肽。
[0088]
c端肽(5-29)在不携带伪脯氨酸二肽作为保护单元时一般指示为seq d no:3,而seq id no:4到seq id no:10为在上文规定位置处包含特定伪脯氨酸的具体实例。
[0089]
在一个实施例中,上述胰高血糖素的任选地受保护的c端肽(5-29)在其c端处连接到固体载体,优选地连接到王氏树脂。
[0090]
在另一个实施例中,上述胰高血糖素的任选地受保护的c端肽(5-29)也受末端保护基团保护,优选地受fmoc保护。
[0091]
优选地,用于制备本发明的胰高血糖素的c端肽(5-29)为:
[0092]
thr(p)-phe-thr(p)-ser(p)-asp(p)-tyr(p)-ser(p)-iys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),(seq id no:4)
[0093]
其中,p和pds如以上所定义。
[0094]
最优选地,用于制备胰高血糖素的c端肽为
[0095]
thr(tbu)-phe-thr(tbu)-ser(tbu)-asp(tbu)-tyr(tbu)-ser(tbu)-lys(boc)-tyr(tbu)-leu-pds-arg(pbf)-arg(pbf)-ala-gln(trt)-asp(tbu)-phe-val-gln(trt)-trp(boc)-leu-met-asn(trt)-thr(tbu),(4a)
[0096]
其中,pds为asp(otbu)-ser[psi(me,me)pro]。
[0097]
本发明的另一个方面涉及与胰高血糖素的c端肽(5-29)偶合的用于合成本发明的胰高血糖素的n端四聚体肽(1-4)(或四肽),即:
[0098]
his(p)-ser(p)-gln(p)-gly-oh(seq id no:2)
[0099]
其中,p为侧链保护基团或不存在。
[0100]
上述四聚体肽优选地在(组氨酸的)α-氨基处受末端保护基团保护。优选地,末端保护基团为氨基甲酸酯类型,例如9-芴基甲氧羰基(fmoc)或叔丁氧羰基(boc)。更优选地,四聚体肽的末端保护基团为boc。在一个优选实施例中,本发明的方法中使用的四聚体肽为boc-his(trt)-ser(tbu)-gln(trt)-gly-oh(2a)。
[0101]
n端肽(1-4)一般指示为seq id no:2,而2a为包含规定保护基团的具体实例。
[0102]
优选地,c端肽和n端四聚体肽是使用spps通过使用至少一种偶合剂和添加剂使氨基酸或肽,根据所需序列与连接到树脂的c端氨基酸逐步偶合来制备。
[0103]
为了制备四聚体肽,优选地使用ctc树脂;为了制备c端肽,优选地使用王氏树脂。
[0104]
通过去除保护基团来活化树脂。活化树脂与第一氨基酸,即与thr29或gly4偶合,其中,氨基酸受末端保护基团和任选的侧链保护基团保护。
[0105]
末端保护基团取决于其类型而在合适的条件下裂解。
[0106]
当使用fmoc基团时,可以通过在碱性条件下进行处理来将其去除。所用碱可以为无机或有机碱。优选地,碱为选自包含以下的组的有机碱:哌啶、吡咯烷、哌嗪、叔丁胺、dbu和二乙胺,优选地哌啶。
[0107]
当使用boc基团时,可以通过在酸性条件下进行处理来将其去除。酸可以为所属领域的任何技术人员熟知的无机或有机酸。优选地,酸为合适浓度的tfa。
[0108]
氨基酸的偶合发生在偶合剂存在的情况下。偶合剂可以尤其选自包含以下的组:n,n
′‑
二异丙基碳二亚胺(dic)、n,n
′‑
二环己基碳二亚胺(dcc)、(苯并三唑-1-基氧基)三吡咯烷基鏻六氟磷酸盐(pybop)、n,n,n
′
,n
′‑
四甲基-o-(苯并三唑-1-基)脲四氟硼酸盐(tbtu)、2-(7-氮杂-1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(hatu)、2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(hbtu)和乙基-二甲氨基丙基碳二亚胺(edc)等。优选地,反应是在n,n
′‑
二异丙基碳二亚胺存在的情况下进行。
[0109]
在本发明的一个优选方面中,偶合步骤也在添加剂存在的情况下执行。当用于偶合反应中时,添加剂的存在减少了羧酸残基处的构型的损失,提高了偶合速率并降低了外消旋化风险。添加剂可以选自包含以下的组:1-羟基苯并三唑(hobt)、2-羟基吡啶n-氧化物、n-羟基琥珀酰亚胺、1-羟基-7-氮杂苯并三唑(hoat)、内-n-羟基-5-降冰片烯-2,3-二甲酰胺和2-氰基-2-羟基亚氨基-乙酸乙酯(oxymapure)、5-(羟基亚氨基)1,3-二甲基嘧啶-2,4,6-(1h,3h,5h)-三酮(oxyma b)。优选地,偶合反应是在2-氰基-2-羟基亚氨基-乙酸乙酯或5-(羟基亚氨基)1,3-二甲基嘧啶-2,4,6-(1h,3h,5h)-三酮存在的情况下进行。
[0110]
偶合反应可以在选自包含二异丙基乙胺(diea)、三乙胺、n-甲基吗啉、n-甲基哌啶等的叔胺的组的碱存在的情况下进行;优选地,反应是在diea存在的情况下进行。
[0111]
涉及肽或氨基酸的偶合反应发生在选自包含二甲基甲酰胺、二甲基乙酰胺、二甲亚砜、二氯甲烷、氯仿、四氢呋喃、2-甲基四氢呋喃和n-甲基吡咯烷的组的溶剂存在的情况下。
[0112]
另外,树脂上的未反应位点通过用大量过量的高反应性无阻碍试剂进行的短暂处理并且根据熟知的肽合成技术而任选地被封端,以避免截短序列并防止任何副反应,所述试剂是根据待封端的未反应位点来加以选择。
[0113]
一旦已经获得了期望肽序列,就需要从固体载体中裂解n端四聚体,以释放gly4的羧酸并提供任选地受末端保护基团保护的his(p)-ser(p)-gln(p)-gly-oh。所述裂解是在
适合所采用的固体载体并适合于保持对肽序列的任何保护例如末端保护基团和任何侧链保护基团p的条件下进行。举例来说,当使用ctc树脂时,裂解是在酸溶液例如1%tfa dcm溶液中进行。
[0114]
一旦已经获得期望肽序列,就裂解c端肽上的末端保护基团以释放α-氨基,从而使c端肽准备好与n端四聚体进行最终偶合。
[0115]
本发明提供了用于制备胰高血糖素的方法,所述方法包含使n端四肽(1-4)与c端肽(5-29)偶合以获得胰高血糖素肽序列的步骤。关于本发明的方法的所述偶合,上述所有特点经适当修改后适用。特别地,提及包含偶合剂、添加剂、溶剂、保护基团、末端保护基团裂解条件的偶合反应条件,以上所有都可以为所属领域的技术人员容易地以明确方式进行调整。
[0116]
在又另一个方面中,本发明因此涉及各种任选地受保护的胰高血糖素序列或片段,其为胰高血糖素合成中的中间物。肽序列可以选自包含以下的组:
[0117]
his(p)-ser(p)-gln(p)-gly-thr(p)-phe-thr(p)-ser(p)-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),
[0118]
(seq id no:11)
[0119]
his(p)-ser(p)-gln(p)-gly-thr(p)-phe-thr(p)-ser(p)-asp(p)-pys-lys(p)-tyr(p)-leu-asp(p)-ser(p)-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),(seq id no:12)
[0120]
his(p)-ser(p)-gln(p)-gly-thr(p)-phe-thr(p)-ser(p)-asp(p)-pys-lys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),
[0121]
(seq id no:13)
[0122]
his(p)-ser(p)-gln(p)-gly-thr(p)-phe-pts-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-asp(p)-ser(p)-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),
[0123]
(seq id no:14)
[0124]
his(p)-ser(p)-gln(p)-gly-thr(p)-phe-pts-asp(p)-tyr(p)-ser(p)-iys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),
[0125]
(seq id no:15)
[0126]
his(p)-ser(p)-gln(p)-gly-thr(p)-pft-ser(p)-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-asp(p)-ser(p)-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),
[0127]
(seq id no:16)
[0128]
和
[0129]
his(p)-ser(p)-gln(p)-gly-thr(p)-pft-ser(p)-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p),
[0130]
(seq id no:17),
[0131]
其中,p为侧链保护基团或不存在,并且并且pa1a2为如以上定义的伪脯氨酸二肽。
[0132]
胰高血糖素肽序列(1-29)指示为seq id no:1,而以seq id no 11-17表示的上述序列为在规定位置处包含一种或多种伪脯氨酸二肽作为受保护部分的胰高血糖素序列的具体实例。
[0133]
在一个实施例中,上述任选地受保护的中间物胰高血糖素序列在其c端处连接到固体载体,优选地连接到王氏树脂。
[0134]
在另一个实施例中,上述任选地受保护的中间物胰高血糖素序列也受末端保护基团保护,优选地受boc保护。
[0135]
在一个优选实施例中,作为胰高血糖素合成中的中间物的受保护的胰高血糖素序列为
[0136]
his(p)-ser(p)-gln(p)-gly-thr(p)-phe-thr(p)-ser(p)-asp(p)-tyr(p)-ser(p)-lys(p)-tyr(p)-leu-pds-arg(p)-arg(p)-ala-gln(p)-asp(p)-phe-val-gln(p)-trp(p)-leu-met-asn(p)-thr(p)
[0137]
(seq id no:11)。
[0138]
在甚至更优选的实施例中,本发明的用于制备胰高血糖素的方法的中间物受保护序列为
[0139]
boc-his(trt)-ser(tbu)-gln(trt)-gly-thr(tbu)-phe-thr(tbu)-ser(tbu)-asp(tbu)-tyr(tbu)-ser(tbu)-lys(boc)-tyr(tbu)-leu-pds-arg(pbf)-arg(pbf)-ala-gln(trt)-asp(tbu)-phe-val-gln(trt)-trp(boc)-leu-met-asn(trt)-thr(tbu)-王氏树脂(11a)。
[0140]
受保护的胰高血糖素序列的进一步脱保护提供了粗胰高血糖素,所述粗胰高血糖素可以任选地被纯化。
[0141]
在一个优选实施例中,当使用spps时,受保护的胰高血糖素序列最终被脱保护并从树脂中裂解,脱保护和裂解是同时或分两步进行的,从而提供粗胰高血糖素,所述粗胰高血糖素可以任选地被纯化。
[0142]
脱保护和裂解条件一般取决于保护基团和所用树脂的性质:在一个优选实施例中,脱保护和裂解是通过酸处理执行的;优选地,通过包含酸的混合物例如三氟乙酸(tfa)等处理执行的。任选地,裂解混合物可以包含一种或多种清除剂。清除剂为能够在裂解环境中最小化敏感性脱保护侧链例如精氨酸残基的敏感性脱保护侧链的修饰或破坏的物质例如苯甲醚、茴香硫醚、三异丙基硅烷(tis)、1,2-乙二硫醇(edt)和苯酚。
[0143]
举例来说,当使用王氏树脂时,所述裂解/脱保护步骤优选地通过使用包含tfa、tis和edt的混合物例如tfa/tis/h2o/edt/l-甲硫氨酸/nh4i(92.5∶2∶2∶2∶1∶0.5v/v/v/v/w/w)混合物来执行。所获得的粗胰高血糖素可以任选地通过所属领域中熟知的结晶或色谱技术进行纯化。
[0144]
本发明的方法的发明人已经发现,如以上定义并根据上述方法,使用上述n端四肽(1-4)与c端肽(5-29)之间的偶合提供了高产量和高纯度的胰高血糖素,这使其适合大规模工业生产。
[0145]
缩写
[0146]
spps
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
固相肽合成
[0147]
lpps
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相肽合成
[0148]
mbha树脂
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基二苯甲基酰胺树脂
[0149]
fmoc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9-芴基甲氧羰基
[0150]
boc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁氧羰基
[0151]
trt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三苯甲基
[0152]
tbu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁基
[0153]
pbf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基
[0154]
hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高效液相色谱
[0155]
h/min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时/分钟
[0156]
diea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二异丙基乙胺
[0157]
dbu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,8-二氮杂双环[5.4.0]十一-7-烯
[0158]
dmap
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-二甲氨基吡啶tfa三氟乙酸
[0159]
ac2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸酐
[0160]
dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基甲酰胺
[0161]
dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷
[0162]
acn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙腈
[0163]
meoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲醇
[0164]
dipe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二异丙醚
[0165]
tis
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三异丙基硅烷
[0166]
edt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,2-乙二硫醇
[0167]
dic
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二异丙基碳二亚胺
[0168]
dcc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二环己基碳二亚胺
[0169]
edc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙基-二甲氨基丙基碳二亚胺
[0170]
hobt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-羟基苯并三唑
[0171]
hoat
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-羟基-7-氮杂苯并三唑
[0172]
tbtu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n,n
′
,n
′‑
四甲基-o-(苯并三唑-1-基)脲四氟硼酸盐
[0173]
hbtu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3-[双(二甲氨基)甲基鎓基]-3h-苯并三唑-1-氧化物六氟磷酸盐
[0174]
hatu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-(7-氮杂-1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐
[0175]
pybop
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(苯并三唑-1-基氧基)-三吡咯烷基鏻六氟磷酸盐
[0176]
oxyma/oxymapure
ꢀꢀꢀ
2-氰基-2-羟基亚氨基-乙酸乙酯
[0177]
oxyma b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5-(羟基亚氨基)1,3-二甲基嘧啶-2,4,6-(1h,3h,5h)-三酮
[0178]
实验部分
[0179]
适合于制备本发明的胰高血糖素的详细实验条件由以下实例提供,所述实例旨在说明而非限制本发明的所有可能实施例。
[0180]
除非另外指出,否则所有材料、溶剂和试剂都是从商业供应商处获得,级别最高,并且无需进一步纯化即使用。
[0181]
分析(%)是通过hplc,将样品的峰面积与标准品的峰面积进行比较来计算。考虑到所获得的最终摩尔数(基于分析)除以初始摩尔数来计算摩尔产率(%)。
oh、fmoc-arg(pbf)-oh、fmoc-arg(pbf)-oh、fmoc-ser(tbu)-oh、fmoc-asp(tbu)-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-lys(boc)-oh、fmoc-ser(tbu)-oh、fmoc-tyr(tbu)-oh、fmoc-asp(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-phe-oh、fmoc-thr(tbu)-oh、fmoc-gly-oh、fmoc-gln(trt)-oh、fmoc-ser(tbu)-oh、boc-his(trt)-oh。
[0194]
在每个步骤中,在dmf(6ml)中用dic(4eq)和oxymapure(4eq)预活化fmoc保护的氨基酸(就树脂负载量来说,4eq,即2.8mmol)3分钟,然后将其添加到树脂中并使其偶合60分钟。在每次偶合之后,使用含0.5mac2o的dmf封端未反应的氨基。通过用含20%哌啶的dmf(2
×
6ml,每个循环10分钟)进行处理来去除fmoc基团,随后用dmf(4
×
6ml,2
×
5分钟和2
×
10分钟)洗涤树脂,以允许插入下一个氨基酸残基。在肽序列完整之后,用dmf(3
×
6ml)、dcm(3
×
6ml)洗涤肽基树脂并使其干燥到恒重。将干燥的肽基树脂悬浮于20ml tfa/tis/h2o/edt/甲硫氨酸/nh4i(92.5∶2∶2∶2∶1∶0.5v/v/v/v/w/w)混合物中,使其预冷却到0-5℃并将其在室温下搅拌4小时。滤出树脂,并向溶液中添加冷二异丙醚(80ml)。在0-5℃下搅拌所获得的浅黄色悬浮液。过滤固体,用20ml二异丙醚再洗涤3次并进行真空干燥,得到2.4g粗胰高血糖素(0.10mmol,分析15%),其中hplc纯度为37%。摩尔产率:15%。
[0195]
批次1b(参考)
[0196]
制备是通过采用以下氨基酸和肽进行,所述氨基酸和肽是从第一个到最后一个排序,连接到如上所述获得的h-thr-王氏树脂:
[0197]
fmoc-asn(trt)-oh、fmoc-met-oh、fmoc-leu-oh、fmoc-trp(boc)-oh、fmoc-gln(trt)-oh、fmoc-val-oh、fmoc-phe-oh、fmoc-asp(tbu)-oh、fmoc-gln(trt)-oh、fmoc-ala-oh、fmoc-arg(pbf)-oh、fmoc-arg(pbf)-oh、fmoc-asp(otbu)-ser[psi(me,me)pro]-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-lys(boc)-oh、fmoc-ser(tbu)-oh、fmoc-tyr(tbu)-oh、fmoc-asp(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-phe-oh、fmoc-thr(tbu)-oh、fmoc-gly-oh、fmoc-gln(trt)-oh、fmoc-ser(tbu)-oh、boc-his(trt)-oh。
[0198]
在每个步骤中,在dmf(6ml)中用dic(4eq)和oxymapure(4eq)预活化fmoc保护的氨基酸(就树脂负载量来说,4eq,即2.8mmol)3分钟,然后将其添加到树脂中并使其偶合60分钟。在dmf(6ml)中用dic和oxymapure(3eq)预活化3分钟之后,使伪脯氨酸残基fmoc-asp(otbu)-ser[psi(me,me)pro]-oh(3eq)偶合,然后将其添加到树脂中并使其偶合90分钟。在每次偶合之后,使用含0.5mac2o的dmf封端未反应的氨基。通过用含20%哌啶的dmf(2
×
6ml,每个循环10分钟)进行处理来去除fmoc基团,随后用dmf(4
×
6ml,2
×
5分钟和2
×
10分钟)洗涤树脂,以允许插入下一个残基。在肽序列完整之后,用dmf(3
×
6ml)、dcm(3
×
6ml)洗涤肽基树脂并使其干燥到恒重。将干燥的肽基树脂悬浮于20ml tfa/tis/h2o/edt/l-甲硫氨酸/nh4i(92.5∶2∶2∶2∶1∶0.5v/v/v/v/w/w)混合物中,使其预冷却到0-5℃并将其在室温下搅拌4小时。滤出树脂,并向溶液中添加冷二异丙醚(80m1)。在0-5℃下搅拌所获得的浅黄色悬浮液。过滤固体,用20ml二异丙醚再洗涤3次并进行真空干燥,得到1.7g粗胰高血糖素(0.02mmol,分析4%),其中hplc纯度为8%。摩尔产率:3%。
[0199]
批次1c
[0200]
制备是通过采用以下氨基酸和肽进行,所述氨基酸和肽是从第一个到最后一个排序,连接到如上所述获得的h-thr-王氏树脂:
[0201]
fmoc-asn(trt)-oh、fmoc-met-oh、fmoc-leu-oh、fmoc-trp(boc)-oh、fmoc-gln
(trt)-oh、fmoc-val-oh、fmoc-phe-oh、fmoc-asp(tbu)-oh、fmoc-gln(trt)-oh、fmoc-ala-oh、fmoc-arg(pbf)-oh、fmoc-arg(pbf)-oh、fmoc-asp(otbu)-ser[psi(me,me)pro]-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-lys(boc)-oh、fmoc-ser(tbu)-oh、fmoc-tyr(tbu)-oh、fmoc-asp(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-phe-oh、fmoc-thr(tbu)-oh、boc-his(trt)-ser(tbu)-gln(trt)-gly-oh。
[0202]
在每个步骤中,在dmf(6ml)中用dic(4eq)和oxymapure(4eq)预活化fmoc保护的氨基酸(就树脂负载量来说,4eq,即2.8mmol)3分钟,然后将其添加到树脂中并使其偶合60分钟。在40℃下在dmf(16ml)中用dic和oxymapure(2eq)预活化15分钟之后,使伪脯氨酸残基fmoc-asp(otbu)-ser[psi(me,me)pro]-oh(3eq,即2.1mmol)与四肽boc-his(trt)-ser(tbu)-gln(trt)-gly-oh(2eq)偶合,然后将其添加到树脂中并使其偶合180分钟。在每次偶合之后,使用含0.5m ac2o的dmf封端未反应的氨基。通过用含20%哌啶的dmf(2
×
6ml,每个循环10分钟)进行处理来去除fmoc基团,并且用dmf(4
×
6ml,2
×
5分钟和2
×
10分钟)对其进行洗涤,以允许插入下一个残基。在肽序列完整之后,用dmf(3
×
6ml)、dcm(3
×
6ml)洗涤肽基树脂并使其干燥到恒重。将干燥的肽基树脂悬浮于20ml tfa/tis/h2o/edt/l-甲硫氨酸/nh4i(92.5∶2∶2∶2∶1∶0.5v/v/v/v/w/w)混合物中,使其预冷却到0-5℃并将其在室温下搅拌4小时。滤出树脂,并向溶液中添加冷二异丙醚(80m1)。在0-5℃下搅拌所获得的浅黄色悬浮液。过滤固体,用20ml二异丙醚再洗涤3次并进行真空干燥,得到2.75g粗胰高血糖素(0.40mmol,分析5α%),其中hplc纯度为80%。摩尔产率:58%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1