显现耐高温性、高产量性以及单性结实性的果实类植物
1.本发明涉及一种显现耐高温性、高产量性以及单性结实性的果实类植物。
2.本发明还涉及一种上述单性结实性果实类植物的产生方法。
3.本发明还涉及一种从果实类植物中选拔出单性结实性植物的方法。
背景技术:
4.番茄是自花授粉植物,但在设施栽培中,已知因排除掉辅助授粉的风、虫而导致授粉率降低、坐果率下降。因此,广泛使用通过花簇的植物激素处理来促进单性结实和果实肥大的方法。此外,也经常使用利用了丸花蜂、振动器的授粉促进法。但是,基于植物激素处理、振动器的授粉促进处理需要大量的劳动力,作业性显著下降。关于使用丸花蜂的方法,虽然作业性好,但丸花蜂的活动温度范围是有限的,因此存在如下问题:夏季和冬季的设施内的温度管理的成本、劳动力增加。此外,基于授粉/授精的坐果也存在如下问题:由于夏季、冬季的花粉育性的降低而难以确保贯穿整年的稳定的生产量。由此,为了使季节等环境因素的影响减少且能以更少的劳动力和成本进行稳定的栽培,对于番茄植物要求开发以更高的作业效率诱导单性结实的技术。
5.作为诱导番茄的单性结实性的变异,已知pat(例如pat2等)变异、sldel1a变异等(专利文献1~3)。在这些技术中,其是使用与单性结实基因连锁而成的dna标记(marker)并向其他番茄品系导入单性结实变异而得到生产无籽果实的番茄的技术。
6.此外,已知还涉及诱导番茄的单性结实性的其他变异、基于细胞周期蛋白(cyclin)f-box基因的变异的单性结实性番茄等植物(专利文献4)。
7.而且,专利文献5和专利文献6记载了通过抑制茄科植物的单性结实控制基因的功能来产生单性结实性植物。
8.而且,专利文献7和专利文献8记载了关于在番茄等果实类植物中赋予耐暑性的基因变异。
9.而且,关于单性结实性和变异,记载了在乙烯受体蛋白质etr1的跨膜区带有变异的sletr1-1、sletr1-2对赋予保存性、单性结实性有效(非专利文献1~3)。
10.现有技术文献
11.专利文献
12.专利文献1:wo1999/021411a1
13.专利文献2:wo2017/022859a1
14.专利文献3:日本特表2010-532164号公报
15.专利文献4:日本再表2017/022859号公报
16.专利文献5:日本再表2014/021398号公报
17.专利文献6:日本再表2015/108185号公报
18.专利文献7:日本特开2015-089368号公报
19.专利文献8:日本再表2016/047778号公报
20.非专利文献
21.非专利文献1:okabe y等人,plant&cell physiology,2011;52(11):1994-2005
22.非专利文献2:okabe y等人,breeding science,2012;62(2):202-208非专利文献3:shinozaki y等人,the plant journal,2015;83(2);237-251
技术实现要素:
23.发明要解决的技术问题
24.已知专利文献1~3所记载的变异能使单性结实的效率上升,但也对生殖器官、营养器官等带来不良影响、使果实的品质降低等。
25.本发明的目的在于提供在包括果树、果蔬类的果实类的植物中以至少不给营养器官带来不良影响的方式能高效率地诱导单性结实性的基因变异。
26.技术方案
27.本发明人等进行了深入研究,结果发现了能在番茄等果实性植物中赋予高效率的单性结实性和高温下的高产量性的特定基因的变异,从而完成了本发明。
28.因此,本发明包含以下的特征。
29.[1]一种具有单性结实性的果实类植物或所述果实类植物的一部分,其特征在于,具有solyc10g038170基因或其直系同源物(ortholog)的变异,所述变异使由所述基因或其直系同源物编码的蛋白质的表达减少或缺损。
[0030]
[2]根据所述[1]所述的果实类植物或所述果实类植物的一部分,其中,所述基因或其直系同源物是编码包含序列号2的氨基酸序列或与所述氨基酸序列具有50%以上的序列同一性(sequence identity)的氨基酸序列的蛋白质的多核苷酸。
[0031]
[3]根据所述[1]或[2]所述的果实类植物或所述果实类植物的一部分,其中,所述基因或其直系同源物的变异包括:编码所述蛋白质的氨基酸序列中包含至少一个氨基酸的缺失、取代、添加或插入的氨基酸序列的核苷酸序列。
[0032]
[4]根据所述[3]所述的果实类植物或所述果实类植物的植物部分,其中,所述至少一个氨基酸的取代包括:序列号2的氨基酸序列中第37位的精氨酸取代为其他氨基酸的取代。
[0033]
[5]所述[4]所述的果实类植物或所述果实类植物的一部分,其中,还包括:所述序列号2的氨基酸序列中第49位的丙氨酸取代为其他氨基酸的取代。
[0034]
[6]根据所述[1]~[5]中任一项所述的果实类植物或所述果实类植物的一部分,其中,所述果实类植物选自由茄科植物、葫芦科植物、蔷薇科植物、以及葡萄科植物构成的组。
[0035]
[7]根据所述[1]~[6]中任一项所述的果实类植物或所述果实类植物的一部分,其中,具有95%以上、96%以上、97%以上、98%以上或99%以上的单性结实率。
[0036]
[8]根据所述[1]~[7]中任一项所述的果实类植物或所述果实类植物的一部分,其中,对30℃以上的环境温度具有耐性。
[0037]
[9]根据所述[1]~[8]中任一项所述的果实类植物或所述果实类植物的一部分,其中,所述变异是纯合型。
[0038]
[10]一种根据所述[1]~[9]中任一项所述的果实类植物的产生方法,所述方法特
征在于,包括:第一工序,在所述植物的野生型的细胞、愈伤组织或组织中导入solyc10g038170基因或其直系同源物的变异,所述变异使所述基因或其直系同源物的表达减少或缺损;第二工序,培养所述第一工序的植物的细胞、愈伤组织或组织而制作植物体群体;以及第三工序,从所述第二工序的植物体群体中选拔出具有单性结实性的植物。
[0039]
[11]根据所述[10]所述的方法,其中,所述变异是所述基因或其直系同源物的破坏或缺损。
[0040]
[12]根据所述[10]所述的方法,其中,通过在所述solyc10g038170基因的序列号1的核苷酸序列或所述基因的直系同源物的核苷酸序列中导入多核苷酸来进行所述变异,所述多核苷酸包含基于所述序列号1的核苷酸序列的第109位、第146位或其两者的位置、或相当于所述位置的所述直系同源物的核苷酸序列内的位置的单碱基取代的变异。
[0041]
[13]根据[12]所述的方法,其中,所述多核苷酸包含序列号3的核苷酸序列。
[0042]
[14]根据所述[10]~[13]中任一项所述的方法,其中,所述第三工序中选拔出的植物的所述变异是纯合型。
[0043]
[15]一种多核苷酸,其包含序列号3的核苷酸序列。
[0044]
[16]一种从果实类植物中选拔出单性结实性植物的方法,其特征在于,包括:检测果实类植物的细胞或组织中solyc10g038170基因或其直系同源物的表达的减少或缺损;或者,检测所述基因或其直系同源物的破坏或缺损。
[0045]
[17]根据所述[16]所述的方法,其中,通过聚合酶链式反应(polymerase chain reaction,以下称pcr)或杂交来进行所述检测。
[0046]
本说明书包含作为本技术的优先权的基础的日本专利申请号2019-158950号(2019年8月30日申请)的公开内容。
[0047]
通过使用本发明的solyc10g038170基因或其直系同源物的变异,能在作为果实类植物的番茄中赋予99%以上的高单性结实率,此外,即使在因高温而发生坐果不良的地域,也能通过单性结实诱导来维持高产量性。进而,通过将例如基因组编辑、同源重组等基因修饰技术用于上述基因或其直系同源物而诱导同样的变异,能在所有的果实类植物中高效率地诱导单性结实性和耐高温性的增强。
附图说明
[0048]
图1表示番茄micro-tom回交品系的单性结实率。上图是在高温胁迫条件下(夏季)栽培出的品系的单性结实率。“p”表示单性结实性(parthenocarpy)品系。野生株(wt,wild type)供试4个个体,单性结实性品系供试5个个体,对每一个个体将11~20花去雄。下图是在生育适宜温度条件下(24℃)栽培出的品系的单性结实率。“np”表示非单性结实性(non-parthenocarpy)品系,“p”表示单性结实性(parthenocarpy)品系。野生株供试3个个体,bc3s2品系供试4个个体,对每一个个体将10~15花去雄。基因型(genotype)表示后述的鉴定出的基因变异的基因型。“no.emasc.”表示去雄的花的合计数量。
[0049]
图2表示番茄w2939bc2s2单性结实性品系中的果实产量。在5月进行bc2s2品系和micro-tom野生株的播种。上图表示在8月下旬到9月上旬之间红熟的果实的产量(左:micro-tom野生株(wt)4个个体,右:w2939bc2s2单性结实性品系6个个体)。横条表示5cm。下图的柱状图表示从8月中旬到10月上旬为止收获的每一个个体的红色成熟果实合计产量(n
=6)。误差条表示标准误差,**表示与野生株的显著性差异(学生t检验:student’s t-test;1%标准)。
[0050]
图3表示番茄有籽果实的比例和种子数量。a和b表示从micro-tom野生株(a)和w2939bc2s2单性结实性品系(b)得到的红色成熟果实所包含的种子数量(各n=6)。栽培在温室中、在高温胁迫条件下(观测到的日平均气温约为25℃~33℃)进行。c、d以及e表示从micro-tom野生株(c)、bc3s2非单性结实性品系(d)、以及w2939bc3s2单性结实性品系(e)得到的红色成熟果实所包含的种子数量(c、e:n=8;d:n=5)。栽培在封闭体系栽培室中恒定24℃下进行。饼状图内的数字表示果实数。
[0051]
图4表示果实重(重量)和糖度(brix值)。a和b表示micro-tom野生株(wt)、w2939bc2s2单性结实性品系中的果实重和糖度的测定结果(果实重:wt,n=48;单性结实性品系,n=218,brix:wt,n=37;单性结实性品系,n=98)。**表示存在与野生株的显著性差异(welch t检验:welch’s t-test,1%标准)。误差条表示标准误差。c和d表示micro-tom野生株(wt)、w2939bc3s2非单性结实性品系(np)、以及单性结实性品系(sp)中的果实重和糖度的测定结果(果实重:wt,n=49;np,n=38;sp,n=44,brix:wt,n=48;np,n=39;sp,n=37)。果实重显示品系间无显著性差异(tukey-kramer,5%水准)。不同的英文字母显示在品系间存在显著性差异(tukey-kramer,1%标准)。
[0052]
图5表示粗略映射图(rough mapping)中使用的snp标记的一览和引物序列。标记名遵照番茄标记数据库(tomato marker database)(http://marker.kazusa.or.jp/tomato/)内的表述。s表示染色体短臂,l表示染色体长臂。染色体表示番茄染色体序号。
[0053]
图6表示使用了snp标记的w2939品系的图位克隆。分别表示:mt:micro-tom野生株,re:regina野生株,m:micro-tom型纯合株,h:杂合株,r:regina型纯合株,s:染色体短臂,l:染色体长臂。使用了将w2939品系与regina交配而产生的f2杂种品系中的显现单性结实性的12个个体。
[0054]
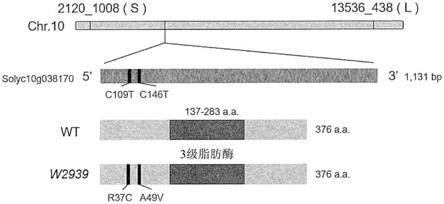
图7表示w2939单性结实性品系的候选原因基因(causative gene)solyc10g038170的基因结构。2120_1008(s)和13536_438(l)分别表示图位克隆所使用的短臂的标记和长臂的标记。solyc10g038170是仅由一个外显子构成的总长1131bp的基因,具有由3级脂肪酶(甘油三酯脂肪酶)保存的结构域。w2939单性结实性品系中,对自5’末端起第109位和第146位的碱基加入单碱基取代(均为c
→
t),其结果是引起了2处氨基酸错义变异(missense mutation)(r37c和a49v)。
[0055]
图8表示w2939品系的solyc10g038170基因内变异。a表示序列号1(野生型(wt))和序列号3(w2939(变异体))的第1~150位的核苷酸序列(分别为序列号5、6)中的、w2939与wt对比的变异位置,b表示序列号2(野生型(wt))和序列号4(w2939(变异体))的各自第1~100位的氨基酸序列(序列号7、8)中的变异位置,由黑框包围的序列表示变异所产生的位置。其是如下错义变异:第37位的精氨酸(r)变化为半胱氨酸(c),第49位的丙氨酸(a)变化为缬氨酸(v)。
[0056]
图9表示solyc10g038170(野生型)的氨基酸序列(序列号1的第1~80位;序列号9)与作为与其同源性最高的拟南芥直系同源物的at2g44810所对应的氨基酸序列(序列号10)的比较。由黑框包围的序列表示w2939品系(变异型)中错义变异所产生的位置。
[0057]
图10表示用于基因组编辑的载体的构建体和cas9载体的产生模型。图中,cas9表
示编码源自酿脓性链球菌(streptococcus pyogenes)的cas9蛋白质的序列,pubi表示欧芹(petroselinum crispum)泛素启动子,tpea3a表示大豆3a终止子,pu6表示拟南芥(arabidopsis thaliana)u6启动子,sgrna表示单链向导rna,pnos表示源自胭脂碱合酶(nopaline synthase)基因的启动子,nptii表示卡那霉素抗性基因,tnos表示源自胭脂碱合酶基因的终止子,rb表示源自土壤杆菌的t-dna边界序列(右边框:right-border),lb表示源自土壤杆菌的t-dna边界序列(左边框:left-border)。
[0058]
图11表示基于crispr/cas9系统的变异导入模型。在靶序列为1处的情况下,产生基于非同源末端连接(nhej:non-homologous end joining)修复的插入(insertion)/取代(substitution)/缺失(deletion)变异。此外,在靶序列为2处的情况下,可产生更大规模的缺失、逆位(inversion)、重复(duplication)变异。
[0059]
图12表示靶序列和原因变异周边的碱基序列(即,solyc10g038170的序列号1的翻译起始点起到300碱基对为止的碱基序列;序列号11(正链)、序列号12(互补链))以及氨基酸序列(序列号13)。后述的实施例中选择的两个靶序列由单线表示,将各个pam序列由双线表示,进而,w2939品系中发生了一个碱基取代的序列由黑框表示。
[0060]
图13表示野生株(wt)和t0变异导入品系(#3-1、#9-1、#10-1、#25-1、#37-1、#42-1)的靶1周边序列中的编辑模式、以及各品系的碱基序列。粗体字的序列指设计于5’侧的靶序列(靶1),“tgg”序列指pam序列,第23位的“t”序列指基于crispr/cas9系统的变异位置。嵌合体(#9-3、#9-4)表示根据桑格测序的波形认为混合有不同的变异模式的转化细胞。
[0061]
图14表示t0变异导入品系的氨基酸序列变化。表示野生株(wt)、w2939品系、以及导入变异成为纯合株的品系中的、靶序列(靶1)周边的氨基酸序列。变异表示变异的种类,多肽长度(polypeptide length)表示通过翻译产生的多肽链的总长(在此,a.a.:表示氨基酸)。由黑框包围的氨基酸残基表示产生变异的位置。此外,*表示终止密码子。
具体实施方式
[0062]
以下,进一步对本发明进行详细说明。
[0063]
1.单性结实性的原因基因及其变异
[0064]
在本发明中,表现作为果实类植物的特性的单性结实性的性状的原因基因是solyc10g038170基因或其直系同源物。
[0065]
上述基因存在于番茄植物(也可以称作“作物”)的10号染色体上,推测为dad1基因家族的一种。dad1蛋白质是催化茉莉酸生物合成的初始步骤的叶绿体磷脂酶(chloroplast phospholipase)a1。solyc10g038170基因也可以称作sldad1基因,包含编码3级脂肪酶(甘油三酯脂肪酶)活性的结构域(图7)。
[0066]
solyc10g038170基因或其直系同源物是如下多核苷酸,所述多核苷酸例如可以包含序列号1的核苷酸序列,或者可以包含与该核苷酸序列具有例如约50%以上、约60%以上、约70%以上、约80%以上、约85%以上、约90%以上、约95%以上、约96%以上、约97%以上、约98%以上、或约99%以上的序列同一性的核苷酸序列。或者,上述直系同源物也可以与序列号1的核苷酸序列具有小于50%的序列同一性。
[0067]
进而,由solyc10g038170基因或其直系同源物编码的蛋白质的氨基酸序列例如可以包含序列号2的氨基酸序列,或者可以包含与所述氨基酸序列具有例如约50%以上、约
60%以上、约70%以上、约80%以上、约85%以上、约90%以上、约95%以上、约96%以上、约97%以上、约98%以上、或约99%以上的序列同一性的核苷酸序列。或者,上述直系同源物也可以与序列号2的氨基酸序列具有小于50%的序列同一性。
[0068]
或者,在对solyc10g038170基因和其直系同源物的核苷酸序列或由其编码的氨基酸序列进行对齐比较(alignment)时,关于同源性最高的区域(或范围),可以具有例如约50%以上、约60%以上、或约70%以上的序列同一性。这样的区域例如是序列号1的核苷酸序列的第52位~第240位为止的区域、以及序列号2的氨基酸序列的第18位~第80位的区域(图9)。
[0069]
本说明书中使用的“直系同源物”是果实类植物中的通过物种分歧由共同的祖先基因产生的相同的基因组,是指在与番茄植物不同的生物物种中彼此具有相同的功能的基因组。
[0070]
此外,本说明书中使用的“序列同一性(%)”可以使用基于公知的算法blast、fasta的蛋白质或基因的检索系统,在两个序列间导入缺口或不导入缺口、优选导入缺口而决定(zheng zhang等人,j.comput.biol.,2000;7:203-214;altschul,s.f.等人,journal of molecular biology,1990;215:403-410;pearson,w.r.等人,proc.natl.acad.sci.u.s.a.,1988;85:2444-2448)。
[0071]
本说明书中使用的“单性结实”(parthenocarpy)是指,在植物中,在不发生授粉和授精的情况下,不伴随种子形成而子房、花托等肥大,产生无种子的果实。本发明中的“单性结实性”是指,不需要进行植物激素处理、特定的物理刺激等人为的单性结实诱导处理的前提下,植物产生单性结实的性质。
[0072]
如后述的实施例中验证的那样,本发明相关的单性结实性通过下述方式发生:solyc10g038170基因或其直系同源物的变异包括:编码由所述基因或其直系同源物编码的蛋白质的氨基酸序列中包括至少一个氨基酸的缺失、取代、添加或插入的氨基酸序列的核苷酸序列,通过这样的变异,该蛋白质的表达(或功能)会减少(或抑制)或缺损。换言之,上述变异包括上述基因或其直系同源物的核苷酸序列的部分或整体的核苷酸缺失、取代、添加或插入,由该变异引起单性结实性会产生的程度的、上述蛋白质的表达(或功能)的减少或缺损,优选为基因功能的破坏。
[0073]
与此相关,由solyc10g038170基因或其直系同源物编码的蛋白质的表达(或功能)的减少或缺损可以通过所述蛋白质的氨基酸序列中至少一个氨基酸的缺失、取代、添加或插入来引起。如后述的实施例中记载的那样,通过单碱基多态性(snp)中观察到的基于至少一个单碱基取代的上述蛋白质的氨基酸序列中的至少一个氨基酸的取代,能表达单性结实性。这样的单碱基取代的例子可以包括:在序列号2的氨基酸序列中第37位的精氨酸取代为其他氨基酸的取代、第49位的丙氨酸取代为其他氨基酸的取代、以及这两者的取代,但不限于此。
[0074]
在第37位的精氨酸的情况下,上述的其他氨基酸为精氨酸以外的氨基酸,例如亲水性氨基酸(除了精氨酸)或疏水性氨基酸,例如为半胱氨酸,在第49位的丙氨酸的情况下,上述的其他氨基酸为除了丙氨酸以外的氨基酸,例如亲水性氨基酸或疏水性氨基酸(除了丙氨酸),例如为缬氨酸。
[0075]
此外,作为核酸变异体的例子,solyc10g038170基因或其直系同源物中包含单性
pepo)、真桑瓜(cucumis melo var.makuwa)等]、蔷薇科[草莓(fragaria ananassa)、苹果(malus pumila)等]、葡萄科[葡萄(vitis spp.)等]、黄色辣椒(黄色唐辛子;capsicum baccatum)、蓖麻(ricinus communis)、中果咖啡(coffea canephora)等的植物,但不限定于此。
[0087]
上述植物是在自然环境下无单性结实性或单性结实性非常低的植物,优选的植物是番茄(番茄植物)。
[0088]
作为番茄的例子,可列举出属于solanum lycopersicum(日文:
ソラナム
·
リコペルシカム
)、solanum cerasiforme(也称作lycopersicon cerasiforme,日文
ソラナム
·
セラシフォルメ
)、solanum pimpinellifolium(也称作lycopersicon pimpinellifolium,日文
ソラナム
·
ピムピネリフォリウム
)、solanum cheesmanii(也称作lycopersicon cheesmanii,日文
ソラナム
·
チーズマニイ
)、solanum parviflorum(也称作lycopersicon parviflorum,日文
ソラナム
·
パルビフロルム
)、solanum chmielewskii(也称作lycopersicon chmielewskii,日文
ソラナム
·
クミエレウスキィ
)、solanum hirsutum(也称作lycopersicon hirsutum,日文
ソラナム
·
ヒルストゥム
)、solanum lycopersicon pennellii(日文
ソラナム
·
ペンネリィ
)、solanum pennellii(也称作lycopersicon peruvianum,日文
ソラナム
·
ペルビアヌム
)、solanum chilense(也称作lycopersicon chilense,日文
ソラナム
·
チレンセ
)、solanum lycopersicoides(日文
ソラナム
·
リコペルシコイデス
)以及solanum habrochaites(日文
ソラナム
·
ハブロカイネス
)等的番茄品系/品种或它们的衍生株(derivative),但不限定于此。
[0089]
作为番茄的一个例子的野生型番茄品种micro-tom番茄(solanum lycopersicum cv.micro-tom)(scott jw,harbaugh bk(1989)micro-tom a miniature dwarf tomato.florida agr.expt.sta.circ.370,p.1-6)已有市售,此处也可以通过根据番茄遗传资源中心(tomato genetics resource center,tgrc)(美国)保藏号la3911来获得。野生型番茄品种micro-tom番茄为矮性(约10~20cm),叶、果实小,能与现有番茄品种杂交。就野生型番茄品种micro-tom番茄而言,由全基因组序列确定(kobayashi m,等人,plant cell physiol.2014;55(2):445-454)。
[0090]
需要说明的是,本说明书中使用的“衍生株”是指,经过原植物与其他植物品系/品种的一次以上交配、或经过诱变或变异导入而得到的子代植物。
[0091]
本发明的果实类植物是通过下述方式得到的植物:通过对如上述例示的野生型植物进行目标基因修饰操作,导致由solyc10g038170基因或其直系同源物编码的蛋白质的表达(或功能)的减少或缺损,优选导致基因功能的破坏。
[0092]
基因变异包括solyc10g038170基因或其直系同源物的核苷酸序列的部分或整体的核苷酸的缺失、取代、添加或插入,由该变异引起单性结实性会产生的程度的、上述蛋白质的表达(或功能)的减少或缺损,优选为基因功能的破坏。作为改变例,可列举出:部分或整体地敲除并破坏上述基因或其直系同源物;或者,导入下述变异:编码上述基因的蛋白质的例如序列号2的氨基酸序列中第37位的精氨酸取代为半胱氨酸(r37c),以及根据情况第49位的丙氨酸取代为缬氨酸(a49v)。这些变异诱导单性结实。但是,未必限于上述的特定的变异,只要是减少或破坏基因功能的变异就可以实现单性结实。
[0093]
本发明的果实类植物具有如下特性:与野生型(不含上述基因变异)相比,即使在
高温(例如30℃以上的环境温度)下也能赋予高单性结实率、高坐果率以及高产量性。
[0094]
相关地,本发明的植物中的单性结实率例如为70%以上、75%以上、80%以上、85%以上、90%以上、95%以上、96%以上、97%以上、98%以上或99%以上,不限于此。在后述的实施例中,野生株中为57.1%的单性结实率,与此相对,本发明的植物、例如番茄植物中显现99.4%这一高单性结实率。而且,关于产量,以合计比较两者的成熟的红色成熟果实的重量,结果是,野生株中为26.3
±
2.7g,与此相对,本发明的植物、例如番茄植物中为63.1
±
2.5g,约为2.4倍这一高产量。
[0095]
关于solyc10g038170基因或其直系同源物的上述变异,本发明的果实类植物优选为纯合型(也简称作“纯合株”)。由于是纯合株,两个等位基因具有相同的上述变异。与此相对,在杂合型(也简称作“杂合株”)中,两个等位基因的一方是正常的,另一方具有变异。
[0096]
本发明的植物因solyc10g038170基因或其直系同源物的上述变异而有时具有子房的早期肥大、花柱的突出、花药筒顶端的变色、子房肥大后的花瓣、花柱的残留等表现型(参照后述的实施例)。
[0097]
除了上述果实类植物的植物体以外,本发明还提供植物的一部分。
[0098]
上述植物部分包括例如茎、叶、根、花、花蕾、果实、种子、组织、细胞、以及愈伤组织等,不限于此。在此,愈伤组织是在含有植物激素(例如生长素、细胞分裂素等)的培养基上培养植物体的一部分时产生的人工的细胞团。如上述那样的植物部分具有solyc10g038170基因或其直系同源物的变异,所述变异使由所述基因或其直系同源物编码的蛋白质的表达减少或缺损。
[0099]
3.单性结实性果实类植物的产生方法
[0100]
本发明还提供上述2.所述的果实类植物的产生方法,其特征在于,包括:
[0101]
第一工序,在该植物的野生型的细胞、愈伤组织或组织(包括植物部分)中导入solyc10g038170基因或其直系同源物的变异,所述变异使上述基因或其直系同源物的表达减少或缺损;
[0102]
第二工序,培养上述第一工序的植物(转化体)的细胞、愈伤组织或组织而制作植物体群体;以及
[0103]
第三工序,从上述第二工序的植物体群体中选拔出具有单性结实性的植物。
[0104]
以下,对上述第一工序至第三工序进行说明。
[0105]
《3.1》第一工序
[0106]
在该工序中,在野生型植物的细胞、愈伤组织或组织(包括植物部分)中导入上述solyc10g038170基因或其直系同源物的变异。
[0107]
该基因变异是上述基因或其直系同源物的表达的减少或缺损,因此,例如通过使用基因组编辑技术、同源重组技术等基因修饰技术来敲除上述基因,能进行上述基因的破坏或缺损。
[0108]
上述变异的例子是上述solyc10g038170基因或其直系同源物的破坏或缺损。
[0109]
上述变异的另一例子是在上述solyc10g038170基因的序列号1的核苷酸序列或其直系同源物的核苷酸序列中导入多核苷酸,所述多核苷酸包含基于所述序列号1的核苷酸序列的至少一个核苷酸、例如第109位、第146位或其两者的位置、或相当于该位置的所述直系同源物的核苷酸序列内的位置的单碱基取代的变异。所述多核苷酸的例子是包括序列号
3的核苷酸序列的多核苷酸。
[0110]
基因组编辑例如是使用talen(tale核酸酶)等人工切割酶、crispr-cas系统等来进行基因组dna的编辑、基因修饰的技术。在本发明的方法中,可以使用基因组编辑的任意技术,但优选使用crispr-cas系统。
[0111]
特别是,crispr/cas9系统被发现自针对细菌和古细菌的病毒、质粒的适应免疫机构,载体的构建比较简单,能同时改变多个基因(jinek等人,science,17,337(6096):816-821,2012;sander等人,nature biotechnology,32(4):347-355,2014)。该系统包含cas9蛋白质和具有约20个碱基对靶序列的单链向导rna(single guide rna;sgrna)。通过在植物体内使它们共表达,sgrna识别靶序列附近的pam序列并与靶基因组dna特异性地结合,cas9蛋白质在pam序列的5’侧上游诱导dsb(双链断裂)。现在最常使用的cas9蛋白质为spcas9型,pam序列为ngg,因此变异导入位置的限制少。crispr/cas9系统已经作为植物的诱变技术而被利用,在2014年首次确认了能够应用在番茄中(brooks等人,plant physiology,166(3):1292-1297,2014)。
[0112]
本发明中的靶基因是solyc10g038170基因或其直系同源物。solyc10g038170基因或其直系同源物的序列例如是序列号1的多核苷酸序列,或者是与该多核苷酸序列具有例如约50%以上、约60%以上、约70%以上、约80%以上、约85%以上、约90%以上、约95%以上、约96%以上、约97%以上、约98%以上、或约99%以上的序列同一性的核苷酸序列。
[0113]
上述基因或其直系同源物的核苷酸序列中,例如为了能由cas9识别,可以选择具有pam序列的区域作为靶序列。该情况下,pam序列例如是ngg(n为任意碱基)等。例如序列号1的核苷酸序列中的靶序列的例子是以下的序列。这些序列的3’末端的3个碱基(下划线)是ngg。
[0114][0115]
作为cas9的例子,例如可列举出:源自酿脓链球菌(s.pyogenes)的spcas9、源自金黄色葡萄球菌(s.aureus)的sacas9、源自嗜热链球菌(s.thermophilus)的stcas9等。pam序列也根据cas9的来源而不同。例如spcas9识别ngg(n为任意碱基)。
[0116]
sgrna是由与从靶基因内的pam序列的1碱基上游起优选18~26碱基、例如20~24碱基的核苷酸序列互补的核苷酸序列构成的多核苷酸。
[0117]
作为启动子的例子,可列举出泛素启动子、u6启动子、camv35s启动子、其他植物组织特异性启动子等。
[0118]
作为表达载体的例子,可列举出:包含编码上述的cas9的核苷酸序列、sgrna序列、启动子序列、耐药性基因或报告基因、终止子等的载体;除了上述元件以外,还包含源自土壤杆菌的t-dna边界序列(right-border)、源自土壤杆菌的t-dna边界序列(left-border)
等的二元载体。作为载体的例子,例如可列举出puc系、pbluescript系、pbi系、ppzp系载体等。将二元载体的一个例子示于图10(以具有两个靶的情况为例)。
[0119]
可以将上述载体例如通过土壤杆菌法、电穿孔法、原生质体法等导入到植物体、细胞、愈伤组织、组织(包括叶、根、茎等植物部分)等中。
[0120]
通过利用基因组编辑能导入如下变异:对于本发明的靶基因例如进行切割、缺失或(部分或完全)破坏(敲除)、插入(敲入)外来基因、或者取代、重复或逆位等(图11)的变异。在外来基因的插入、特定碱基的取代等情况下,通过事先将外来基因序列、包含应取代的特定碱基的序列以能够表达的方式插入到上述载体中而能进行。外来基因序列的例子为序列号3的核苷酸序列。通过上述变异,对植物至少赋予单性结实性的表现型,进而赋予高坐果率、耐高温性、高产量性等。
[0121]
《3.2》第二工序
[0122]
在该工序中,培养上述第一工序的植物(转化体)的细胞(包括培养细胞(细胞团))、愈伤组织或组织(包括植物部分)而制作植物体群体。
[0123]
培养可以通过使用固体培养基或液体培养基的组织培养(通常20℃~30℃)来进行。培养基是植物组织培养所要使用的培养基,例如可举例示出包含酵母提取物、椰奶、氨基酸类、糖类(例如蔗糖)、生长调节物质(例如2,4-二氯苯氧乙酸(2,4-d即2,4-dichlorophenoxy acetic acid)、1-萘乙酸(naa即α-naphtalenacetic acid)、吲哚-3-乙酸(iaa即indole-3-acetic acid))、维生素类(例如硫胺素、泛酸钙、生物素、叶酸、烟酸)、无机盐类等的培养基(通常,ph5.5~6)。
[0124]
《3.3》第三工序
[0125]
该工序中,从上述第二工序的植物体群体中选拔出具有单性结实性的植物。
[0126]
上述选拔包括:检测从制作出的植物体群体分离的细胞或组织中solyc10g038170基因或其直系同源物的表达的减少或缺损、或者该基因或其直系同源物的破坏或缺损。如后述的3.4中记载的那样,检测法可以包括pcr法、杂交法等。
[0127]
进而,例如可以通过使用荧光原位杂交技术(fish,fluorescence in situ hybridization)法,确认在两个等位基因这两者上存在solyc10g038170基因或其直系同源物的上述变异,确认选拔出的植物的上述变异是纯合型。
[0128]
可以使用适于植物的栽培法来栽培选拔出的单性结实性植物。栽培可以通过水耕栽培、设施栽培(例如温室栽培、植物工场栽培等)、露天栽培、花箱(planter)栽培等任意栽培法来进行。
[0129]
4.单性结实性植物的选拔方法
[0130]
本发明还提供从果实类植物中选拔出单性结实性植物的方法,其特征在于,包括:检测果实类植物的细胞或组织中solyc10g038170基因或其直系同源物的表达的抑制、或者该基因或其直系同源物的破坏或缺损。
[0131]
上述方法包括:从植物的细胞或组织中分离基因组dna(染色体)或总rna,根据需要由rna合成cdna,然后使预先制作的对solyc10g038170基因或其直系同源物有特异性的引物或探针(其中,可根据需要包含荧光色素等标记)与上述dna或rna或cdna接触,进行杂交(包括fish法、snp解析法)或聚合酶连锁反应(pcr;包括定量rt-pcr)。
[0132]
进而,根据需要,也可以通过使用针对由solyc10g038170基因或其同源编码的蛋
白质的特异抗体的例如免疫测定来调查上述细胞内有无该蛋白质,或者也可以通过测序来调查该蛋白质内有无变异。
[0133]
实施例
[0134]
一边参照以下的实施例,一边对本发明进一步具体说明,但本发明的范围不由这些实施例限制。
[0135]
[实施例1]
[0136]
《单性结实性番茄w2939品系的获得及特性》
[0137]
1.供试植物及栽培
[0138]
从对作为番茄(solanum lycopersicum l.)的矮性模型品种的micro-tom番茄“micro-tom进行了甲磺酸乙酯(ems)处理的番茄大规模变异体群体中,选拔出显现单性结实性的w2939(tomjpw2939)品系。将该品系与“micro-tom”野生株回交而成的bc2s2、bc3s2品系、以及与作为小番茄品种的“ueleie106wp”交配而成的f3杂种品系用于以下的实验。
[0139]
在筑波功能植物创新研究中心(筑波市,茨城,日本)内的g4温室、以及在筑波大学2d栋内封闭体系栽培室中进行栽培。在g4温室中在夏季(5~10月)进行bc2s2品系和f3杂种品系的栽培。将在培养皿内发芽的种子移植到填满了jiffy mix(sakata seed公司)的jiffy pots(sakata seed公司)。在温室中的供水使用了薄膜水耕(nutrient film technique:nft)系统。使通过oat house a配方(oat house 1号1.5g/l,oat house 2号1g/l,oat agrio)将电导率(electric conductivity:ec)调整为1.2ds/m~1.3ds/m的营养液(nutrient solution)在6点~18点之间每隔3小时循环15分钟。此外,在高温期即7月以后,为了防止养分不足,将ec提高至1.8左右。栽培期间,在温室内使风扇运转,此外,开放天窗和侧窗,通过遮光窗帘遮挡直射阳光,由此维持了植物体能生育的温度。栽培期间的光照期为12小时~13.5小时。
[0140]
此外,在封闭体系栽培室中在夏季(5~9月)进行bc3s2品系的栽培。将在培养皿内发芽的种子移植到石棉立方体(rock wool cube,grodan),与温室同样地使用nft系统而进行栽培。营养液使用oat house a配方(oat agrio),将ec调整为1.5。灌溉设定为在每早8点进行15分钟。室温保持在24℃恒定,光照期设定为16小时。任一品系都在移植后2天期间用保鲜膜覆盖植物体,渐渐空出间隙进行驯化。
[0141]
2.单性结实率调查
[0142]
通过去雄法评价了w2939品系与“micro-tom”野生株回交而成的bc2s2品系在高温条件下的单性结实性。bc2s2单性结实性品系供试5个个体,野生株供试4个个体,每一个个体在开花两天前对10~20花去雄。作为改变了环境条件的情况的比较,也一并评价了在封闭体系栽培室中栽培的w2939品系与“micro-tom”野生株回交的bc3s2品系。将bc3s2单性结实性品系、bc3s2非单性结实性品系各供试4个个体,将野生株供试3个个体,每一个个体在开花两天前对10~15花去雄。需要说明的是,对第一花簇进行振动授粉,以消除由第一花簇授精未完成导致的对坐果率的不良影响。从开花起约10天后进行判定,将直径成为5mm以上的果实判断为单性结实果实。
[0143]
使用将w2939品系与“ueleie106wp”野生株交配而成的f3杂种品系,进行基于去雄法的单性结实性判定。对开花两天前的第三花簇以下的花蕾进行去雄,以使由授精引起的坐果不会发生。此外,对第一花簇进行振动授粉,以消除由第一花簇授精未完成导致的对坐
果率的不良影响。从开花起约10天后进行判定,将直径成为1cm以上的果实判断为单性结实果实。
[0144]
3.产量调查
[0145]
使用bc2s2品系,验证了与高温胁迫条件下的野生株的果实产量的差异。播种在5月进行,发芽后移至温室,比较品系间在8月至10月上旬之间收获的红色成熟果实的合计重量。产量调查中,供试了在单性结实性调查中未使用的个体。
[0146]
此外,使用f3杂种品系,进行了产量调查。对于在5月播种的f3杂种单性结实性品系、f3杂种非单性结实性品系以及“ueleie106wp”野生株的代表性的1个个体,在9月初采摘红色成熟果实和绿色成熟果实。对于绿色成熟果实只采摘直径为1cm以上的果实。产量调查中,由于供试了与单性结实率调查重复的个体,因此未进行定量的调查。
[0147]
4.结果
[0148]
4.1 w2939品系的单性结实性
[0149]
为了调查由w2939品系所产生的基因变异带来的单性结实性的强度,使用将w2939品系与“micro-tom”野生株交配而成的bc2s2和bc3s2品系,进行了基于去雄法的单性结实性的评价试验。首先在夏季(8~10月)实施了高温条件下的评价。关于植物体,bc2s2单性结实性品系供试5个个体,“micro-tom”野生株供试4个个体,在单性结实性品系中,每一个个体对11~14花去雄,在野生株中,每一个个体对18~20花去雄。从第一花簇的开花开始的6月下旬到开始去雄的8月上旬期间多为平均气温30℃以上的天气,也有最高气温超过40℃的天气。在这样的基于授精的坐果严酷的环境条件下,判定有无去雄后的子房肥大,结果是,单性结实性品系中座果19%(63花中的12花),野生株中座果4%(77花中的3花)(图1)。此外,作为追加实验,调查了在生育适宜的温度24℃下栽培w2939品系(变异体)的情况下的单性结实率。关于植物体,将bc3s2单性结实性品系、非单性结实性品系各供试4个个体,将“micro-tom”野生株供试3个个体,每一个个体对3~15花去雄。其结果是,野生株全都没座果,bc3s2非单性结实性品系中座果9.8%(41花中的4花),bc3s2单性结实性品系中座果8.5%(59花中的5花)。
[0150]
此外,为了评价与其他品种交配的情况下的单性结实性,使用将w2939品系与“ueleie106wp”野生株交配而成的f3品系,进行了同样的评价试验。为了评价高温胁迫下的单性结实性的强度,栽培在夏季(5~9月)进行。该期间内的平均气温总体为25℃以上,生育期间后半几乎为30℃以上的天气。此外,最高气温从生育期间前半起经常达到35℃,6月下旬以后达到40℃以上等,成为与去年同样的对坐果严酷的高温条件。使“ueleie106wp”野生株和f3品系在该栽培环境下进行生育,在6~7月,在开花两天前进行去雄,调查了单性结实性。在f2杂种群体中,将坐果率高的品系判定为有耐暑性,将坐果率低且不显现耐暑性的品系判定为无耐暑性,将各自的下一代用于调查。将这些f3杂种品系和“ueleie106wp”野生株各供试4个个体,每一个个体对20花去雄。判定有无去雄后的子房肥大,结果是,“ueleie106wp”野生株中单性结实率为0%,f3杂种品系的不显现耐暑性的品系中为13.8%。然而,显现耐暑性的品系中显现57.5%的单性结实率。该结果暗示了下述可能性:在与作为无限生长型(非芯止
まり
)品种的“ueleie106wp”交配的情况下,与遗传背景为“micro-tom”的情况相比,单性结实率提高。
[0151]
4.2 w2939品系的耐高温性
[0152]
与“micro-tom”野生株回交的显现单性结实性的bc2s2品系各使用6个个体,进行了红色成熟果实的产量调查。8~9月内的“micro-tom”野生株的产量(平均)为26.3
±
2.7g。另一方面,单性结实性bc2s2品系的产量(平均)为63.1
±
2.5g,约增加为2.4倍(图2)。该结果示出:单性结实性与耐高温性(高温胁迫下的产量维持)连锁的可能性高。在本次去雄中,使花瓣残留而进行实施,因此这些植物激素由花瓣产生并作用于子房的可能性很大。除了“micro-tom”背景的品系以外,对于将“ueleie106wp”野生株与w2939品系(变异体)交配而得到的f3杂种品系,也在从播种起123天后对各品系采摘1个个体的红色成熟果实和绿色成熟果实,进行了产量比较。根据该结果确认到:在野生株和f2中未显现耐暑性的后代中,坐果率低,但在显现耐高温性的后代中,因坐果率的提高而维持产量性。由此,暗示了可通过单性结实性的赋予来维持高温胁迫下的产量性。
[0153]
4.3果实性状的特性
[0154]
果实重、有种率、糖度(brix值)这样的果实性状是左右番茄的食品味道的重要的性状。关于这些性状,使用在室外温室中栽培的“micro-tom”野生株和bc2s2单性结实性品系、在封闭体系栽培室中栽培的“micro-tom”野生株和bc3s2品系,进行了品系间的比较。
[0155]
在温室中栽培的“micro-tom”野生株中的平均果实重为3.28
±
0.23g,bc2s2品系中为1.74
±
0.06g(p《0.01)。就有种率而言,野生株中为42.9%(49个中的21个),bc2s2品系中为0.6%(363个中的2个)。此外,封闭体系栽培室中栽培的“micro-tom”野生株中的平均果实重为3.33
±
0.26g,bc3s2非单性结实性品系中为2.83
±
0.23g,bc3s2单性结实性品系中为2.73
±
0.19g。实施了tukey-kramer检测,结果未确认到品系间有显著性差异。此外,就有种率而言,野生株中为87.5%(48个中的42个),bc3s2非单性结实性品系中为92%(39个中的36个),bc3s2单性结实性品系中为75%(44个中的33个)(图3)。根据这些结果明确了:若在不发生花粉不育的环境条件下,w2939变异体单性结实性品系表现出能通过自花授精产生种子的兼性单性结实性。此外,在bc3s2变异体中发现了种子数量的减少倾向。关于果实重,在单性结实性品系的无籽果实的果实重变小,但在有种子的情况下,抑制了果实重的减少(图3)。也在procera变异体中确认到无籽果实中的果实重的减少,作者们指出了如下可能性:由于种子未形成,因此原本应该供给的生长素缺损,特别是抑制果肉部位的细胞分裂(carrera等人,plant physiology,2012;160(3):1581-96)。此外,作为另一原因,认为伴随单性结实的坐果数增加。上述的产量调查中计测出的一定期间内的平均红色成熟果实数在“micro-tom”野生株中为8.0
±
0.9个,但在由w2939品系制作出的bc2s2单性结实性品系中为36.3
±
3.1个,增加到4倍以上。
[0156]
在该实施例中,将brix值用作表示糖度的指标。测定的结果是,在温室中栽培的“micro-tom”野生株中的平均brix值为8.59
±
0.12%,bc2s2品系中为7.70
±
0.06%,学生t检验中未发现显著性差异。另一方面,在封闭体系栽培室中栽培的“micro-tom”野生株中的平均brix值为5.57
±
0.15%,但bc2s2非单性结实性品系中为5.02
±
0.15%,bc2s2单性结实性品系中为7.90
±
0.37%。实施了tukey-kramer检测,结果在单性结实性品系与非单性结实性品系之间、以及在单性结实性品系与野生株之间发现了按1%标准的显著性差异(图4)。根据以上的结果明确了:w2939品系的单性结实性品系中果实的brix值增加。
[0157]
[实施例2]
[0158]
《单性结实性原因基因及变异的鉴定》
[0159]
1.基于图位克隆法(map-based cloning)的基因区域的缩小
[0160]
1.1供试植物及栽培条件
[0161]
得到了将w2939(tomjpw2939)品系与小番茄品种“regina”(sakata seed公司)野生株交配而成的f2种子。在4月播种该f2杂种群体,在g4玻璃温室内的培育箱保温5天。之后,移植到温室内的薄膜水耕装置进行栽培,从总共314个个体中,仅供试明显显现单性结实性的个体。栽培期间的气温条件为白天25℃~40℃、夜间15℃~25℃,光照期为13小时~14.5小时。使通过oat house a配方(大塚1号1.5g/l;大塚2号1g/l,oat agrio)调整为1.2ds/m~1.3ds/m的营养液在9点到16点之间每隔1小时循环5分钟而进行供水。
[0162]
1.2基于花的表现型判定单性结实性
[0163]
基于开花期的花的表现型来进行单性结实性的判定。将发现了花器官中由子房的早期肥大引起的花柱的突出、花药筒的裂开、花瓣以及花柱的脱离不全的个体判定为单性结实性个体。
[0164]
1.3基因组dna提取
[0165]
将嫩叶采样到1.5ml管中,加入dna提取缓冲液400μl。向4ml的200mm三(羟甲基)氨基甲烷(tris)、10ml的250mm氯化钠(nacl)、1ml的25mm乙二胺四乙酸(edta)以及1ml的0.5%十二烷基硫酸钠(sds)中加入蒸馏水并制成20ml,由此制作出dna提取缓冲液。
[0166]
将用研杵捣碎了叶的溶液以13200rpm离心2分钟,将上清液300μl加入新的1.5ml管中。再加入等量的异丙醇300μl,使dna析出。进行2分钟的振荡后,以13200rpm离心5分钟。离心后,小心地使管倾斜来舍弃溶液,加入70%乙醇1ml后,再次以13200rpm离心5分钟。舍弃溶液,风干约30分钟而充分干燥后,加入100μl的1
×
te溶液,进行5分钟的振荡,在4℃下保存。对完成了提取的各样品,使用nanodrop2000(thermo fisher scientific)进行浓度测定。
[0167]
1.4粗略映射图用snp标记的选拔
[0168]
kazusa dna研究所(木更津,千叶,日本)开发了559处在“micro-tom”与“regina”之间显现多态性的snp标记,公开在kazusa番茄基因组数据库(kazusa tomato genomics database)上(http://marker.kazusa.or.jp/tomato/)。从其中选拔出位于1至12号染色体的短臂、长臂的标记,获得snp标记信息和snp的前后50个碱基对的序列。
[0169]
1.5引物的设计
[0170]
将上述1.4中获得的序列信息输入到sol基因组数据库(sol genomics database)的blast检索(https://solgenomics.net/tools/blast/)中,获得了snp的前后约300个碱基对的周边序列。引物的设计工具使用primer3(https://primer3plus.com/),设计为能扩增snp的前后约150个碱基对。
[0171]
1.6 pcr反应
[0172]
使用上述的dna粗提取液和引物进行了pcr反应。使用kod fx neo(东洋纺,大阪,日本)作为pcr用酶。这些反应液组成由0.3μl的kod fx neoo(1.0u/μl)、7.5μl的2
×
buffer、3.0μl的2mm dntps、0.3μl的fw primer(10μl)、0.3μl的rv primer(10μl)、3.3μl的蒸馏水、0.3μl的模板dna构成,合计15μl。
[0173]
pcr条件为:在94℃下处理2分钟,然后将在98℃下处理10秒、59℃下处理30秒、以及68℃下处理30秒设为1个循环而重复35个循环,然后在68℃下处理7分钟。
[0174]
1.7电泳
[0175]
pcr产物的电泳中使用了1%star琼脂糖凝胶(理科研)。使pcr反应溶液5μl与0.6μl的10
×
加载染料(loading dye,takara-bio,京都,日本)混和,将琼脂糖凝胶设置于由1
×
tae缓冲液充满的泳动槽,投入混合液。在100v下进行15分钟电泳,确认snp部位周边有无特异性扩增。dna标记使用gene ladder wide1(wako)。泳动后,利用紫外照射凝胶摄影装置e-box-vx2/20m(vilber lourmat)确认有无带。
[0176]
1.8 exostar处理
[0177]
为了去除未反应的引物、dntps,使用核酸外切酶i(exonuclease i,new england biolabs)和虾碱性磷酸酶(shrimp alkaline phosphatase,rsap,new england biolabs),对pcr产物进行了exo star处理。溶液组成由1μl的核酸外切酶i、1μl的rsap、1μl的蒸馏水(dw)、5μl的pcr产物构成,合计8μl。此外,反应在37℃下进行60分钟,在80℃下进行15分钟。
[0178]
1.9直接测序(direct sequencing)
[0179]
将进行过exo star处理的反应液用dw稀释到30倍。使用稀释液,制作出直接测序用的预混溶液。预混溶液的组成由1μl的稀释液(
×
30)、3μl的fw primer(3.2pmol/μl)、17μl的dw构成,合计21μl。直接测序中利用了value read序列表服务(eurofinsgenomics)。根据解析结果判定出:是各单性结实性个体为“micro-tom”纯合株、杂合株、“regina”纯合株中的哪一种基因型。
[0180]
2.基于下一代测序技术图谱(ngs mapping)的基因变异的检测
[0181]
2.1供试植物及栽培条件
[0182]
将w2939(tomjpw2939)品系与“micro-tom”野生株交配而得到的bc1s1、bc2s1、bc3s1分离群体供试。供试个体数设为:bc1s1单性结实性品系为2个个体,bc2s1单性结实性品系为13个个体,bc3s1单性结实性品系为4个个体,bc3s1非单性结实性品系为23个个体。为了准确地进行表现型判定,在筑波大学2d栋内的封闭体系栽培室中通过使用了石棉立方体(grodan)的薄膜水耕而进行栽培。灌溉在每天上午8点进行约10分钟。气温24℃恒定,湿度维持在60~70%左右。作为水耕栽培溶液,使用oat house a配方(oat house 1号1.5g/l;oat house 2号1g/l,oat agrio),使用将电导率(ec)设定为1.5ds/m的培养液。
[0183]
2.2基于花的表现型判定单性结实性
[0184]
基于开花期的花的表现型来进行单性结实性的判定。将发现了花器官中由子房的早期肥大引起的花柱的突出、花药筒的裂开、花瓣以及花柱的脱离不全的个体判定为单性结实性个体。
[0185]
2.3基因组dna的提取
[0186]
在ngs mapping用的基因组dna提取中,为了提高纯度而使用maxwell16dna purification kits(promega)。将约200mg的新鲜的叶样品采集到1.5ml微量离心管中,用液氮冻结后,使用均质器用研杵捣碎叶样品。在试剂盒的分析盒中加入有裂解缓冲液(lysis buffer)的单元中,以冻结状态加入捣碎的叶样品。将试剂盒附属的柱塞装接后,设置于maxwell16(promega),投入洗脱缓冲液(elution buffer)400μl。提取完成后,以6000rpm离心3分钟,将去除掉沉淀物的溶液移至另一1.5ml管,由此进行了提纯。使用nanodrop(thermofisher scientific)对提取出的基因组dna进行浓度测定。
[0187]
2.4基因组dna的提纯
[0188]
在bc3s1单性结实性品系中能供试的个体数仅为4个个体。因此,为了使基因组dna的品质进一步提高,提高全基因组测序的精度,对这些个体在maxwell提纯后进行使用genome-tip柱(qiagen)的基因组dna提纯。以总dna量为30μg以内的方式,将各个体的dna溶液250μl分注到1.5ml管中。向该dna溶液中加入1ml的qbt缓冲液(qiagen)并混合。将genome-tip柱置于15ml锥形管(falcon),加入qbt缓冲液3ml进行平衡化。将柱的通过级分舍弃。接着,将dna与qbt的混合液投入genome-tip柱,之后,投入qc缓冲液(qiagen)3ml。不舍弃这些步骤的通过级分并保管,以备未充分得到提纯dna的情况。接着,将接受genome-tip柱的管更换为新的15ml锥形管(falcon)。将预先在培育箱加温到50℃的qf缓冲液(qiagen)2ml分3次投入genome-tip柱。向通过柱的溶液加入2ml的2-异丙醇并混合,在室温下静置5分钟。之后,将加入到锥形管的溶液分注到3根2ml管,以13200rpm、4℃、15分钟设定进行离心。离心后,小心地使管倾斜来舍弃上清液,之后,加入70%乙醇约1ml,以13200rpm、4℃、15分钟设定进行离心。离心后,将管倒置风干15分钟,管充分干燥后,投入30μl的te缓冲液,将该溶液用于全基因组测序。
[0189]
2.5基于ngs的全基因组序列的确定
[0190]
为了在w2939品系中提取特异性的snp,实施了使用ngs的全基因组测序。使显现单性结实性的bc1s1品系2个个体、bc2s1品系13个个体、bc3s1品系4个个体、不显现单性结实性的bc3s1品系23个个体的基因组dna以总量为5μg的方式分别批量化,对各样品进行基于短读汇编(short read assembly)的基因组再测序。ngs平台使用hi seq x ten(illumina)。其中,对bc1s1品系使用hi seq2000(illumina)。如pulungun(plant cell physiology,2018;59(6):1170-1186)所述,存在于w2939品系的变异按照bowtie2-samtools-gatk的流水线来进行鉴定。再测序的参考序列中,使用了“heinz 1706”的番茄基因组sl3.0。对于bc1s1品系,使用了番茄基因组sl2.50。将通过对单性结实性bc2s1、bc3s1品系进行再测序而解析出的序列与非单性结实性bc3s1品系的序列以及由该研究室解析出的“micro-tom”野生型的全基因组信息进行比较,在变异体的单性结实性品系中检测出特异性的snp。此外,对于“micro-tom”野生型品系内的基因多态性,通过野生型10品系的序列比较而排除。对于单性结实性bc1s1品系,将“micro-tom”野生株3品系与另一“micro-tom”变异体6品系进行序列比较,检测出仅在该单性结实性品系中确认到的变异。
[0191]
2.6基于全基因组测序结果的候选基因变异的选拔
[0192]
进一步设定条件,从上述2.5中检测出的对单性结实性品系有特异性的snp中选拔出原因基因变异。限定于下述snp来进行选拔:引起氨基酸的非等价取代,snp-index为1(等位频率100%)、读取深度(读取数)为5以上、表示基因型分型的确定性的gq值20以上。此外,根据上述图位克隆的结果,候选基因变异仅从第10号染色体探索。分别对单性结实性bc1s1、bc2s1、bc3s1品系的特异性变异,应用同样的条件来进行选拔。此外,对于选拔出的候选基因,比较各品系的结果,调查共同表现的基因变异。
[0193]
3.基于连锁解析来鉴定原因基因变异
[0194]
3.1供试植物及对象基因
[0195]
将w2939(tomjpw2939)品系与“micro-tom”野生株交配而得到的bc3s1分离群体供试于连锁解析。供试个体数在单性结实性品系中为21个个体,在非单性结实性品系中为32个个体。进行连锁解析的对象的基因变异设为上述2.4的bc3s1单性结实性品系中选拔出的
候选基因变异。
[0196]
3.2基因组dna的提取
[0197]
bc3s1群体的基因组提取中,使用了maxwell16dna purification kits(promega)。提取方法与上述2.3相同。
[0198]
3.3引物的设计
[0199]
根据再测序的结果已明确的候选基因变异的物理位置,获得snp周边的碱基序列信息,输入到sol基因组数据库(sol genomics database)的blast检索(https://solgenomics.net/tools/blast/)中,获得了snp的前后约300个碱基对的周边序列。引物的设计工具使用primer3(https://primer3plus.com/),设计为能扩增snp的前后约150个碱基对。设计出的引物如表2所示。
[0200]
[表2]
[0201]
连锁解析中使用的引物
[0202]
引物名序列(5
’→3’
)序列号solyc10g009590_f247cgaagcacaagacgtttactttct21solyc10g009590_r248ccgaagcaacgaaagaaaactagt22solyc10g009640_ftgaagttcaagttgtttcgtctacg23solyc10g009640_rtagaggtaattctcctgcatagtgc24solyc10g019033_f264ttctgaaggatccagccatgac25solyc10g019033_r265aacagcctttaacgtcccaatg26solyc10g038170_f246agcccagagaaaataggcaagaat27solyc10g038170_r78ggaaatacgataaccagtacccga28
[0203]
3.4 pcr反应
[0204]
使用上述的dna提取液和引物进行pcr反应。使用kod fx neo(东洋纺)作为pcr酶。这些反应液组成由0.24μl的kod fx neoo(1.0u/μl)、6μl的2
×
缓冲液、2.4μl的2mm dntps、0.24μl的fw primer(10μl)、0.24μl的rv primer(10μl)、2.58μl的蒸馏水、0.3μl的模板dna构成,合计12μl。此外,pcr条件为:在94℃下处理2分钟,然后将在98℃下处理10秒、59℃下处理30秒、以及68℃下处理30秒设为1个循环而重复35个循环,然后在68℃下处理7分钟。
[0205]
4.结果
[0206]
4.1基于粗略映射图来缩小原因基因区域
[0207]
为了缩小w2939品系的原因基因区域,作为图位克隆的一个方法,进行每1个染色体配置2个品种间多态性标记的粗略映射。此时,进行基于使用图5所示的正向引物和反向引物的pcr的扩增。将在“micro-tom”与“regina”之间显现多态性的snp标记配置于各染色体的短臂和长臂,将w2939品系与“regina”野生株交配而成的f2单性结实性群体供试12个个体(图5)。其结果是,位于10号染色体的短臂的标记(21201008)中,12个个体中的10个个体显示“micro-tom”型纯合的基因型。其他23个标记中,显示“micro-tom”型的基因型的为8个个体以下(图6)。认为这些f2个体所具有的单性结实性源自向“micro-tom”导入变异的w2939品系,因此认为原因基因变异位于10号染色体短臂的标记附近。虽然认为通过进行对该区域进一步配置多态性标记的精细映射,能缩小原因基因区域,但是由于在缩小该区域的位置不存在多态性标记,因此无法进行更进一步的缩小。此外,作为在2120_1008标记中
12个个体中的2个个体成为杂合株的基因型的理由,认为遗传距离远离了原因基因。
[0208]
4.2基于全基因组测序结果的候选基因变异的选拔
[0209]
使用ngs实施w2939单性结实性bc1s1、bc2s1、bc3s1群体的全基因组测序,对参考序列sl2.50以及sl3.0进行再测序。针对所确定的碱基序列,比较“micro-tom”野生株、其他变异体、以及bc3s1非单性结实性品系的全基因组解析结果,检测出引起氨基酸的非等价取代、snp-index为1、gq值可靠的基因变异。将bc1s1群体与“micro-tom”野生株和变异体计9个个体进行比较,结果在10号染色体上发现3处特异性的变异。此外,将bc2s1、bc3s1单性结实性品系与“micro-tom”野生株、变异体以及bc3s1非单性结实性品系计32个个体比较,结果分别在10号染色体上发现3处、5处特异性的变异。对这些变异体特异性的基因变异中的、在bc1s1、bc2s1、bc3s1单性结实性品系中共同的部分进行调查,结果是,位于solyc10g038170的2处snp被提取。sl2.50与sl3.0中,对应于solyc10g038170的物理位置不同,但导入有变异的位置在各品系比较间是共同的。此外,为了确认除了10号染色体上的solyc10g038170以外,有无在全部品系中共同检测出的基因变异,也以其他染色体为对象进行探索。然而,共同检测出的其他变异并不存在。为了确认根据全基因组测序的结果明确的2处变异与单性结实性实际连锁,使用与“micro-tom”野生株的回交bc3s1品系,实施了基于桑格测序的连锁解析。其结果是,bc3s1单性结实性品系中,全部21个个体的变异位置的基因型为变异体型,另一方面,bc3s1非单性结实性品系中,全部32个个体为杂合株或野生株的基因型。在与单性结实性无关的变异最应该被排除的bc3s1品系中,除了solyc10g038170以外,solyc10g009590、solyc10g009640、solyc10g019033上的变异作为候选被检测出。solyc10g009590被推定为与拟南芥中次生细胞壁中的纤维素合成、沉积有关的trichome birefringence-like家族基因的番茄直系同源物。此外,solyc10g009640被推定为拟南芥中催化茉莉酸-异亮氨酸(jasmonoyl-isoleucine,ja-ile)的合成、诱导茉莉酸(jasmonic acid:ja)响应的jasmonate resistant 1(jar1)基因的番茄直系同源物(westfall等人,science,2012;336:1708-1711)。solyc10g019033是过去没有关于表明其功能的报告的未知基因。也对于这3个基因变异使用同样的个体进行基于桑格测序的连锁解析。bc3s1单性结实性品系中,solyc10g009590中21个个体中的6个个体为野生株型纯合株的基因型。此外,bc3s1非单性结实性品系中,solyc10g009590和solyc10g009640中32个个体中的2个个体为变异体型纯合株的基因型。solyc10g019033与solyc10g038170同样地,全部个体中,表现型与基因型是连锁的。根据该结果无法排除solyc10g019033与单性结实有关的可能性,因此如下一项所示,根据基于rna-seq的包罗性转录组解析数据,调查了各组织中的表达量。
[0210]
4.3基于转录组解析结果的候选基因变异的选拔
[0211]
根据上述3.1中描述的连锁解析结果,无法判断solyc10g019033和solyc10g038170中的哪个基因与单性结实有关或两个基因都有关。认为如果是与单性结实性有关的基因则会在子房组织中表达,使用通过“micro-tom”回交而得到的bc3s1单性结实性品系、bc3s1非单性结实性品系的开花两天后的子房,实施rna-seq,将两个品系的基因表达量用于判断材料。其结果是,在子房中,solyc10g019033完全未表达,而solyc10g038170有少量表达。此外,根据该结果,无法确认在单性结实性品系、非单性结实性品系之间,solyc10g038170的表达量(各为0.03、0.02)是否存在差距。由于两个基因的表达水平稍有差异,因此决定并用公共数据来进行判断。solyc10g019033是在作为番茄基因组的注释信
息的itag3.0中初次发现的基因。因此,参照了解析有该基因的番茄功能基因组学数据库(tomato functional genomics database)内的较新的解析数据(http://ted.bti.cornell.edu/cgi-bin/tfgd/digital/experiment.cgi?id=d019,2019年1月12日阅览)。其结果是,在作为解析对象的solanum lycopersicum“vf36”和solanum lycopersicoides同质基因品系的红色成熟果实中几乎未发现,即使在表达最多的品系(la4250a)中,提示表达量的rpkm(reads per kilobase of exon per million mapped reads)也为0.09。根据该结果认为:solyc10g019033上的变异与单性结实有关的可能性非常低。solyc10g019033的基因功能是未知的,根据注释信息,预测solyc10g038170编码ja生物合成的初始阶段。因此,根据单性结实性品系中发现特异性表达模式的degs列表,探索rna-seq所解析的基因中与ja功能关联的基因。单性结实性品系中表达增加的基因组中的第2位上q-value低的基因编码茉莉酸2(ja2)蛋白质,第238位的基因编码nac结构域蛋白质ipr003441(ja2-like;ja2l)。这些基因在单性结实性品系中分别增加到非单性结实性品系的4.5倍、3.8倍。报告了:ja2通过脱落酸(abscisic acid:aba)处理而表达上升,因此具有调节aba生物合成的作用。还报告了:ja2l是通过ja促进表达的基因,ja2l的反义个体与ja传递中具有缺损的jai1变异体共同地发生由持续气孔封闭带来的病害抗性的增强。认为solyc10g038170的功能缺损引起ja生物合成,与报告所认为的结果不同,但是rna-seq的结果中这些基因的表达模式变化,暗示了变异体中ja生物合成、传递路径上发生了变化。此外,对单性结实性品系中的表达量减少到非单性结实性品系的0.5倍以下的基因组也进行了调查。其结果是,无法发现与ja直接关连的基因,但作为应该特别指出的基因,可列举出第87位上q-value小的gibberellin 2-oxidase 2(ga2ox2)。该基因与ga生物合成路径中活性型ga的失活有关(xiao等人,dna sequence,2007;18(6):474-479)。单性结实性品系中的ga2ox2的表达量降低到非单性结实性品系的约16%。该结果暗示了下述可能性:在单性结实性品系中,活性型ga增加,促进了ga响应和坐果。以上的结果示出了因单性结实性原因基因的变异而在ja、ga的表达模式上发生变化的可能性,并且认为与ja生物合成有关的solyc10g038170是最有力的候选原因基因。
[0212]
4.4最有力的候选基因的序列解析
[0213]
通过sol genomics network(https://solgenomics.net/,2018年11月21日阅览)检索solyc10g038170的详细信息,结果推定该基因仅由1131个碱基对的外显子构成(图7)。solyc10g038170是仅由一个外显子构成的总长1.131kbp的基因,具有由3级脂肪酶(甘油三酯脂肪酶)保存的结构域。对w2939单性结实性品系中从5’末端起第109位和第146位的碱基加入单碱基取代,其结果是,引起了2处氨基酸错义变异。即,w2939单性结实性品系中,在2处确认到“c
→
t”的单碱基取代变异,确认到第37位的“精氨酸”(r)变换为“半胱氨酸”(c)、第49位的“丙氨酸”(a)变换为“缬氨酸”(v)的氨基酸的错义变异(图8)。确认这2处snp附近有无其他变异,结果是,solyc10g38170上不存在其他变异,最近的存在变异的位置是外显子起始序列的上游约13300碱基对的基因间区域。此外,使用作为检索工具的pfam(https://pfam.xfam.org/,2018年11月21日阅览)进行蛋白质的结构域检索。其结果是,确认了从第137位到第283位的蛋白质,由3级脂肪酶(甘油三酯脂肪酶)保存的结构域(图7)。然而,变异所产生的位置并不存在于结构域内。此外,通过ncbi的蛋白质blast(https://blast.ncbi.nlm.nih.gov/blast.cgi?program=blastp&page_type=blastsearch&link_
loc=blasthome,2018年12月1日阅览)探索该基因的直系同源物,结果是,发现了8个总分(total score)为200以上、同源性较高的直系同源物的基因。其中,2号染色体的at2g44810具有约63%的氨基酸序列同源性,与第2位上同源性高的at4g16820(约45%)相比,则突出地相似。对该直系同源物与solyc10g038170的氨基酸序列进行比较。其结果是,2处错义变异位置中的第37位的精氨酸在两者的序列中是共同的(图9)。由此认为:如果将该基因假定为solyc10g038170的直系同源物,则对于基因功能的维持而言,第37位的精氨酸比第49位的氨基酸更重要,第37位的氨基酸残基的变异给基因表达、翻译后的蛋白质的功能带来影响。
[0214]
[实施例3]
[0215]
《solyc10g038170基因变异导入品系的产生及特性》
[0216]
1.靶序列的确定
[0217]
对solyc10g038170基因诱导突变的sgrna使用作为crispr/cas9系统用靶序列检索网站的crispr-p2.0(http://cbi.hzau.edu.cn/crispr2/,2019年1月10日阅览,lei等人,molecular plant,2014;7(9):1494-1496)、以及crisprdirect(https://crispr.dbcls.jp/,2019年1月10日阅览,naito等人,bioinformatics,2015:31(7):1120-1123)而设计。将cas9载体的例子示于图10。此外,为了在solyc10g038170中发生大规模的变异,靶序列设定2个。进而,为了显示w2939品系中产生的变异与单性结实性有关联,选择存在于变异位置的附近的靶序列,期待得到在变异位置附近具有各种变异模式的个体。作为5’侧的靶序列(靶1)而选择的ccactagatgataatttacg(序列号77)中,在crispr-p中显示脱靶效果低的on-score为0.5071这一较高值,序列中包含变异体中发生单碱基取代的部位。此外,作为3’侧的靶序列(靶2)而选择的tatttgcacattgcgtatga(序列号78)中,on-score为0.0405这一较低值。然而,该序列与发生单碱基取代的部位接近,根据crisprdirect的结果,pam序列上游20碱基对中不存在同源序列,即使限定于pam序列上游12碱基对,特异性也较高,因此将ccactagatgataatttacg(序列号77)确定为靶序列。
[0218]
2.solyc10g038170基因变异导入品系的产生
[0219]
构建在表达盒中包含上述1.中选择的两个靶序列(序列号77和78)的载体,尝试产生敲除solyc10g038170基因的功能的品系(图11、图12)。对于番茄的转化,利用最适于“micro-tom”的土壤杆菌法,供试“micro-tom”野生株的种子约200粒(sun等人,plant cell physiology,2006;47(3):426-431)。由包含卡那霉素的一系列选拔培养基再分化出的植物体作为转化体的候选,使用流式细胞仪选拔出二倍体的个体。对这些个体调查是否包含通过cas9载体插入的nptii区域。其结果是,确认了11个品系14个个体中插入nptii区域。而且,为了确认是否发生由cas9蛋白质引起的dna的双链断裂和修复错误,使用使靶序列周边扩增的引物来调查有无变异导入。其结果是,确认了6个品系8个个体中,在solyc10g038170基因的pam序列附近导入有变异。所得到的共8个个体中,发现3个被认为通过靶1序列变异成为纯合株的个体。其中,在#3-1个个体中,在w2939品系中发生单碱基取代的部位向上游2个碱基处,观察到1个碱基的插入变异。此外,在#25-1、#42-1个体中,发生了基于前述的1个碱基插入和其附近的2个碱基缺失的双等位基因(biallelic)变异(图13)。
[0220]
其结果是,以后的氨基酸序列中发生移码,终止密码子出现在原来的位置之前。推定野生株和w2939品系中包含376个氨基酸残基的多肽在#3-1个体中变为47个氨基酸,在#
25-1、#42-1中变为47个氨基酸或42个氨基酸(图14)。剩余的个体中的#9-1、#10-1、#37-1个体中,与#3-1相同的位置的单碱基插入成为了杂合,另一侧单链为野生株型(图13)。此外,在#9-3和#9-4中,根据桑格测序的结果确认到三重的波形,由此暗示了:转化细胞和非转化细胞的混合存在或发生了不同的变异的转化细胞的混合存在。
[0221]
此外,调查基于靶2靶序列的变异导入,结果是,对于8个个体中的7个个体未确认到变异导入,而在#42-1中双链中的一链发生了7个碱基缺失变异。然而,未确认到由在2处同时导入变异引起的大规模的缺失等变异。作为靶2的变异导入效率比靶1低的理由,认为编入靶2序列的sgrna的序列有效性低。
[0222]
3.solyc10g038170基因变异导入品系的表现型
[0223]
认为变异导入品系中因氨基酸序列的变化而发生蛋白质的功能缺损。认为w2939品系中因solyc10g038170上的单碱基取代而失去蛋白质的功能、诱导单性结实,因此调查在变异导入品系中是否也产生单性结实。调查开花期的表现型,结果在导入变异成为纯合株的全部变异导入个体中,确认到子房的早期肥大、花柱的突出、花药筒顶端的变色、子房肥大后的花瓣、花柱的残留这样的表现型。这些表现型与w2939单性结实性品系是共同的。此外,变异导入个体中,多次确认到无种子的红色成熟果实。为了进行比较,也调查了加入有导入基因但未发生变异的转化体的表现型。其结果是,与变异导入个体对照地,花的表现型与野生株相同,全部红色成熟果实中有11个以上的种子。这些结果暗示了:通过变异导入品系中确认到的solyc10g038170基因的变异,诱导单性结实。由此推测:该基因是新型单性结实性关连基因。
[0224]
4.sldad1基因的表达量解析
[0225]
过去所实施的转录组解析的结果暗示了:sldad1(别称,solyc10g038170)基因在开花前的花蕾中特异性地表达。因此,为了确认w2939单性结实性品系的花蕾中sldad1基因的表达量被抑制,暗示给ja生物合成带来影响的可能性,分别对使用了“micro-tom”野生株、w2939非单性结实性品系、单性结实性品系的组织进行表达量解析。通过qrt-pcr法测定出表达量,结果是,野生株中的各组织的表达量在4mm花蕾的时期和开花当日都非常低,而在开花两天前的花瓣样品中表达量大幅增加。此外,本实施例的采样方法中,番茄的花丝(filaments)因花瓣与组织局部地结合而包含在花瓣样品中。根据该事实,如拟南芥的直系同源物at2g44810所示(图9),考虑到sldad1基因暂时在该发达阶段的花丝中表达的可能性(ishiguro等人,the plant cell,2001;13(10):2191-2209;klepikova等人,the plant journal,2016;88(6):1058-1070)。另一方面,w2939单性结实性品系中开花两天前的花瓣样品的表达量与野生株相比约为1%,明显地减少了。此外,在w2939非单性结实性品系中,表达量也减少到约38%,但未发现显著性差异。如果认为除了上述的2处以外并不存在由ems导入到sldad1基因的单碱基取代变异,则认为sldad1基因的表达被这2处的snp抑制。
[0226]
上述实验的结果归纳如下。
[0227]
番茄w2939品系的单性结实性的原因基因是10号染色体上的solyc10g038170(别称,sldad1)基因,这是仅由一个外显子构成的总长1131bp的基因,具有由3级脂肪酶(甘油三酯脂肪酶)保存的结构域。本发明明确了:w2939单性结实性品系的原因基因变异是从5’末端起第109位和第146位这2处的碱基的“c
→
t”,即第37位的“精氨酸”(r)变化为“半胱氨酸”(c)、第49位的“丙氨酸”(a)变化为“缬氨酸”(v)的氨基酸的错义变异。
[0228]
对于夏季(高温胁迫条件下)的单性结实率和产量性,将番茄的野生株与利用crispr/cas9系统导入有sldad1变异的植物体的表现型进行比较,此外,对于单性结实率,在开花前对花进行去雄,然后调查种内果实发达的雄蕊的比例,结果是,野生株中为57.1%的单性结实率,与此相对,具有sldad1变异的植物中显现99.4%这一高单性结实率。而且,关于产量,以合计比较两者的成熟的红色成熟果实的重量,结果是,野生株中为26.3
±
2.7g,与此相对,具有sldad1变异的植物中为63.1
±
2.5g,并且显现出高坐果率和耐高温性。
[0229]
产业上的可利用性
[0230]
在现有的番茄栽培中,为了使坐果稳定。需要对开花后的花进行振动刺激、植物激素剂的处理或利用媒介昆虫,但通过利用诱导单性结实的本发明的变异,能减轻劳动力,此外,在高温下也能栽培,因此能有助于扩展栽培时间、栽培区域。其结果是,能开发将根据本发明的植物变异体作为育种素材而能进行节省劳动力的栽培的品种,能全年稳定地生产以生食和加工用为目的的番茄。进而,通过利用该基因变异信息,不仅在以后,在其他果蔬类等中也能开发赋予了单性结实性、耐高温性的品种。
[0231]
序列表文本
[0232]
序列号3:solyc10g038170基因变异体的核苷酸序列
[0233]
序列号4:solyc10g038170蛋白质变异体的氨基酸序列
[0234]
序列号6:solyc10g038170基因变异体的部分核苷酸序列(核苷酸编号1~150)
[0235]
序列号8:solyc10g038170蛋白质变异体的部分氨基酸序列(氨基酸编号1~80)
[0236]
序列号15~16:t0变异导入品系的靶1区域的核苷酸序列(图13)
[0237]
序列号18~20:t0变异导入品系的靶1区域的氨基酸序列(图14)
[0238]
序列号21~76:引物。
[0239]
本说明书中引用的全部出版物、专利以及专利申请通过直接引用结合到本说明书中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1