多核苷酸的高效无模板酶促合成的制作方法
多核苷酸的高效无模板酶促合成
发明背景
1.使用多种长度的预定序列的高度纯化的廉价多核苷酸已经成为包括基因组和诊断测序多重核酸扩增/治疗性抗体开发、合成生物学、基于核酸的治疗剂、dna起源、基于dna的数据存储等在内的多种技术的核心。最近,在通过使用无模板聚合酶的基于酶的方法,例如末端脱氧核苷酸转移酶(tdt),补充或替代基于化学的合成方法方面产生了兴趣,因为这类酶的经证实的效率和温和的无毒反应条件的益处,例如ybert等人的国际专利公开wo2015/159023;hiatt等人的美国专利5763594;jensen等人,biochemistry,57:1821-1832(2018)等。大多数基于酶的合成方法需要使用可逆封闭的核苷三磷酸,以便在多核苷酸产物中获得所需的序列。不幸的是,与未修饰的核苷三磷酸相比,天然tdts以降低的效率掺入这种修饰的核苷三磷酸。因此,大量的工作已经致力于开发对于修饰的核苷三磷酸具有更好掺入效率的新的tdt变体,例如champion等,美国专利公开us2019/0211315;ybert等,国际专利公开wo2017/216472等。
2.鉴于上述情况,如果新的无模板聚合酶,如新的tdt变体,以及使用方法可用于可逆性封闭的核苷三磷酸的改进掺入,则将促进无模板酶促多核苷酸合成领域的发展。发明概述
3.本发明涉及用于多核苷酸的无模板酶促合成的方法、组合物和试剂盒,所述多核苷酸包括末端脱氧核苷酸转移酶(tdt)变体,所述变体在不同的反应环境下,包括(i)当掺入不同种类的可逆封闭的核苷三磷酸时,和(ii)在所需产物的多核苷酸中间体中不同的二级结构(例如发夹,交叉链杂交体,链内杂交体,g-四联体等)的存在下,在掺入核苷三磷酸中显示增强的效率。更具体地,本发明部分地认识和理解到,可以工程化不同的tdt变体以引入具有不同效率的不同种类的3'-o-封闭的核苷三磷酸,并且通过在相同的方法中使用具有不同种类的3'-o-封闭的核苷三磷酸或3'-o-封闭的核苷三磷酸的子集的不同的tdt变体,可以使用这种效率上的差异来改善总体合成效率。同样,本发明部分地认识和理解到,不同的tdt变体可以被工程化以在可以在多核苷酸中间体中形成的不同二级结构的存在下掺入3'-o-封闭的核苷三磷酸。
4.在一些实施方案中,本发明涉及包含末端脱氧核苷酸转移酶(tdt)变体(“act-tdt变体”)的组合物,所述末端脱氧核苷酸转移酶变体包含与seq id no:1的氨基酸至少百分之九十相同的氨基酸序列,并且相对于seq id no:1具有以下取代:a17v+l52f+g57e+m63r+a108v+k147r+c173g+r207l+m210q+r325v+e328k+n345e+r351k,其中tdt变体(i)能够合成没有模板的核酸片段,并且(ii)能够以比参比的tdt高的速率将3'-o-修饰的datp、dctp或dttp中的每一个掺入到核酸片段的游离3'-羟基上,所述参比的tdt对于所有dntp显示出基本上相等的掺入速率。
5.在一些实施方案中,本发明涉及包含末端脱氧核苷酸转移酶(tdt)变体(“g-tdt变体”)的组合物,所述变体包含与seq id no:1的氨基酸至少百分之九十相同的氨基酸序列,并且相对于seq id no:1具有以下取代:a17v+l52f+g57e+m63r+176v+a108v+c173g+r207l+f259e+q261r+k265g+r325v+e328n+r351k,其中tdt变体(i)能够合成没有模板的核酸片段,
并且(ii)能够以比参比的tdt高的速率将3'-o-修饰的dgtp掺入到核酸片段的游离3'-羟基上,所述参比的tdt对于所有dntp显示出基本上相等的掺入速率。
6.在一些实施方案中,seq id no:2的tdt变体(m27)用作参考的tdt,以评估和比较其它tdt变体,例如act-tdt或g-tdt变体的掺入速率。
7.本发明的另一个目的是提供末端脱氧核苷酸转移酶(tdt)变体,其包含与seq id no:1中所示的全长氨基酸序列具有至少80%、85%、90%、95%、99%或100%同一性的氨基酸序列,除了(ii)与seq id no:1相比取代的组合a17v+l52f+g57e+m63r+a108v+k147r+c173g+r207l+m210q+r325v+e328k+n345e+r351k,(iii)能够在没有模板下合成核酸片段,和(iv)能够将修饰的核苷酸掺入核酸片段。在一个具体实施方案中,tdt包含取代的组合a17v+q37e+d41r+l52f+g57e+m63r+s94r+g98e+a108v+s146e+k147r+q149r+c173g+m184t+r207l+k209h+m210q+g284l+e289a+r325v+e328k+n345e+r351k。
8.本发明的另一个目的是提供一种末端脱氧核苷酸转移酶(tdt)变体,其包含与seq id no:1中所示的全长氨基酸序列具有至少80%、85%、90%、95%、99%或100%同一性的氨基酸序列,(ii)除了与seq id no:1相比取代的组合a17v+l52f+g57e+m63r+176v+a108v+c173g+r207l+f259e+q261r+k265g+r325v+e328n+r351k,其中tdt变体,(iii)能够在没有模板下合成核酸片段,和(iv)能够将修饰的核苷酸掺入核酸片段。在一个具体实施方案中,tdt与seq id no:1相比包含以下取代的组合:a17v+q37e+d41r+l52f+g57e+m63r+i76v+s94r+g98e+a108v+s146e+q149r+c173g+m184t+r207l+k209h+f259e+q261r+k265g+g284l+e289a+r325v+e328n+r351k。
9.一方面,本发明涉及使用上述tdt变体或类似tdt变体的组合物合成多核苷酸的方法,所述方法包括以下步骤:(a)提供具有游离3'-羟基的起始子;和(b)重复以下循环:(i)在延伸条件下使具有游离3'-o-羟基的起始子或延伸的片段与3'-o-封闭的核苷三磷酸和末端脱氧核苷酸转移酶(tdt)变体接触,使得所述起始子或延伸的片段通过掺入3'-o-封闭的碱保护的核苷三磷酸而延伸以形成3'-o-封闭的延伸的片段,以及(ii)解封闭所述延伸的片段以形成具有游离3'-羟基的延伸的片段,直到合成所述多核苷酸,其中第一tdt变体用第一组3'-o-封闭的核苷三磷酸的3'-o-封闭的核苷三磷酸延长所述起始子或延伸的片段,并且第二tdt变体用第二组3'-o-封闭的核苷三磷酸的3'-o-封闭的核苷三磷酸延长所述起始子或延伸的片段,并且其中所述第一tdt变体以比所述第二tdt变体更高的效率用来自所述第一组的3'-o-封闭的核苷三磷酸延长所述起始子或延长的片段,并且所述第二tdt变体以比所述第一tdt变体更高的效率用来自所述第二组的3'-o-封闭的核苷三磷酸延长所述起始子或延长的片段。在一些实施方案中,act-tdt变体是第一tdt变体,g-tdt变体是第二tdt变体。
10.在一些实施方案中,可以使用第一,第二和第三tdt变体,它们各自分别具有来自其第一,第二和第三组的3'-o-封闭的核苷三磷酸的最高掺入速率。在其它实施方案中,可以使用第一,第二,第三和第四tdt变体,它们各自具有分别相对于第一,第二,第三和第四3'-o-封闭的核苷三磷酸的最高掺入速率。
11.在一些实施方案中,第一和第二;第一、第二和第三;或者第一、第二、第三和第四tdt变体可以与它们各自组的3'o-封闭的dntp分开使用;在其它实施方案中,这种tdt变体可以在掺入和去保护的每个循环中作为混合物使用。
12.在一些实施方案中,本发明涉及用于实施上述方法的试剂盒,其中所述试剂盒包含第一tdt变体和第二tdt变体,并且其中(i)所述第一tdt变体以比第二tdt变体更高的速率将第一组的3'-o-修饰的dntp掺入起始子或延长片段上,(ii)所述第二tdt变体以比第一tdt变体更高的速率将第二组的3'-o-修饰的dntp掺入起始子或延长片段上tdt变体,和(iii)第一组和第二组dntp是不重叠的。
13.在一些实施方案中,act-tdt变体包含与seq id no:1的氨基酸序列至少90%相同并且具有以下取代的tdt:a17v+q37e+d41r+l52f+g57e+m63r+s94r+g98e+a108v+s146e+k147r+q149r+c173g+m184t+r207l+k209h+m210q+g284l+e289a+r325v+e328k+n345e+r351k。这种tdt变体包括tdt变体m55,其与seq id no:1的氨基酸序列具有100%的同一性,按照前述句子的取代。在进一步的实施方案中,act-tdt变体包括seq id no:15(m55-1),具有突变q4e的seq id no:16(m55-2)。
14.在一些实施方案中,g-tdt变体包含与seq id no:1的氨基酸序列至少90%相同并且具有以下取代的tdt:a17v+q37e+d41r+l52f+g57e+m63r+i76v+s94r+g98e+a108v+s146e+q149r+c173g+m184t+r207l+k209h+f259e+q261r+k265g+g284l+e289a+r325v+e328n+r351k。这种tdt变体包括tdt变体m56,其与seq id no:1的氨基酸序列具有100%的同一性,按照前述句子的取代。在进一步的实施方案中,g-tdt变体包括seq id no:9(m33),seq id no:10(m33-1),具有突变q4e的seq id no:11(m33-2),seq id no:13(m56-1)和具有突变q4e的seq id no:14(m56-2)。
15.在一些实施方案中,上述同一性百分比值与所指示的seq id nos具有至少80%的同一性;在一些实施方案中,上述百分比同一性值与所指示的seq id nos具有至少90%的同一性;在一些实施方案中,上述百分比同一性值与所指示的seq id nos具有至少95%的同一性;在一些实施方案中,上述同一性百分比值为至少97%同一性;在一些实施方案中,上述同一性百分比值是至少98%的同一性;在一些实施方案中,上述同一性百分比值是至少99%的同一性。
16.关于(ii),这样的3'-o-修饰的核苷酸可以包含3'-o-nh2-核苷三磷酸,3'-o-叠氮基甲基-核苷三磷酸,3'-o-烯丙基-核苷三磷酸,3'o-(2-硝基苄基)-核苷三磷酸,或3'-o-炔丙基-核苷三磷酸。附图简要说明
17.图1图解说明了使用本发明的tdt变体的无模板的酶促核酸合成方法的步骤。发明详述
18.尽管本发明可以进行各种修改和替换形式,但是其细节已经通过附图中的示例示出并将被详细描述。应当理解,本发明不限于所描述的特定实施例。其意图是覆盖落入本发明的精神和范围内的所有修改、等同物和替代物。本发明的方面的指导可在本领域普通技术人员熟知的许多可用参考文献和论文中找到,包括例如sambrook等人(1989),molecular cloning:a laboratory manual,cold spring harborlaboratory等。
19.本发明涉及使用在不同反应条件下具有增强的dntp掺入效率的不同tdt变体酶促合成具有预定序列的多核苷酸的方法和试剂盒,以便增强总体合成效率。在一些实施方案中,不同的tdt变体在不同的合成循环步骤中分别使用,所述不同的合成循环步骤提供了这样的tdt变体提供最大掺入效率的反应环境(例如掺入的3'-o-封闭的dntp的类型)。在其它
实施方案中,使用不同的tdt变体作为混合物,使得tdt变体总是存在于反应混合物中,该反应混合物提供最大的掺入效率,但也必须与其它用于进行偶联反应的tdt变体竞争。在后一种类型的一些实施方案中,选择混合物中tdt变体的比例,以使待合成的靶多核苷酸的给定或预期核苷酸组合物的多核苷酸合成时间最小化。在一些实施方案中,这种给定的核苷酸组成是a:c:g:t=1:1:1:1。
20.在一些实施方案中,本发明的方法用以下步骤进行:a)提供具有游离3'-羟基的起始子;和b)重复以下循环:(i)在延长条件下使具有游离3'-o-羟基的起始子或延长的片段与3'-o-封闭的核苷三磷酸和末端脱氧核苷酸转移酶(tdt)变体接触,使得通过掺入3'-o-封闭的核苷三磷酸来延长所述起始子或延长的片段以形成3'-o-封闭的延长的片段,和(ii)解封闭所述延长的片段以形成具有游离3'-羟基的延长的片段,直到合成所述多核苷酸,其中第一tdt变体用选自第一组3'-o-封闭的核苷三磷酸的3'-o-封闭的核苷三磷酸延长所述起始子或延长的片段,以及不同于所述第一tdt变体的第二tdt变体用选自第二组3'-o-封闭的核苷三磷酸的3'-o-封闭的核苷三磷酸延长起始子或延长的片段,并且其中第一tdt变体以比第二tdt变体更高的效率用来自第一组的3'-o-封闭的核苷三磷酸延长起始子或延长的片段,并且第二tdt变体以比第一tdt变体更高的效率用第二组的3'-o-封闭的核苷三磷酸延长起始子或延长的片段。
21.在其它实施方案中,本发明的方法用以下步骤进行:a)提供具有游离3'-羟基的起始子;和b)重复以下循环:(i)在延长条件下使具有游离3'-o-羟基的起始子或延长的片段与3'-o-封闭的核苷三磷酸和tdt混合物接触,使得起始子或延长的片段通过掺入3'-o-封闭的核苷三磷酸而延长以形成3'-o-封闭的延长的片段,和(ii)解封闭延长的片段以形成具有游离3'-羟基的延长的片段,直到合成多核苷酸,其中tdt混合物包含用选自第一组3'-o-封闭的核苷三磷酸的3'-o-封闭的核苷三磷酸延长起始子或延长的片段的第一tdt变体和用选自第二组3'-o-封闭的核苷三磷酸的3'-o-封闭的核苷三磷酸延长起始子或延长的片段的不同于第一tdt变体的第二tdt变体,并且其中所述第一tdt变体以比所述第二tdt变体更高的效率用来自所述第一组的3'-o-封闭的核苷三磷酸延长所述起始子或延长的片段,并且所述第二tdt变体以比所述第一tdt变体更高的效率用来自所述第二组的3'-o-封闭的核苷三磷酸延长所述起始子或延长的片段。在一些实施方案中,tdt混合物包含第一tdt变体和第二tdt变体,其比率在给定产物产率下使合成所需多核苷酸的时间最小化。tdt变体
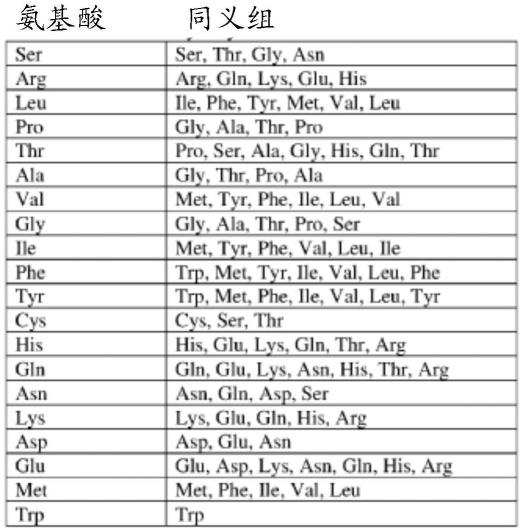
22.如上所述的本发明的tdt变体各自包含与指定的seq id no具有百分比序列同一性的氨基酸序列,其条件是存在指定的取代。在一些实施方案中,以这种方式描述的本发明的tdt变体与指定的seq id no之间的序列差异的数目和类型可能是由于取代,缺失和/或插入,并且被取代,缺失和/或插入的氨基酸可能包含任何氨基酸。在一些实施方案中,这种缺失,取代和/或插入仅包括天然存在的氨基酸。在一些实施方案中,取代仅包括保守的或同义的氨基酸改变,如grantham,science,185:862-864(1974)中所述。也就是说,氨基酸的取代只能在其同义氨基酸组的成员中发生。在一些实施方案中,可以使用的同义氨基酸组列于表1a中。表1a:同义氨基酸组i
在一些实施方案中,可以使用的同义氨基酸组列于表1b中。表1b:同义氨基酸组ii核苷酸掺入活性的测量
23.本发明变体的核苷酸掺入效率可通过延伸或延长测定来测量,例如如boule等(下文引用);bentolila等(下文引用);和hiatt等人的美国专利5808045中所述,后者通过引用并入到本文中。简言之,在这种测定的一种形式中,具有游离3'-羟基的荧光标记的寡核苷酸在tdt延伸条件下与待测试的变体tdt在可逆封闭的核苷三磷酸存在下反应预定的持续时间,之后终止延伸反应,通过凝胶电泳分离后定量延伸产物和未延伸的起始寡核苷酸的量。通过这种测定,变体tdt的掺入效率可以容易地与其它变体或野生型或参比tdt或其它
聚合酶的效率比较。在一些实施方案中,变体tdt效率的量度可以是在等同测定中使用变体tdt的延长产物的量与使用野生型tdt的延长产物的量的比率(以百分比给出)。
24.在一些实施方案中,以下特定延伸测定可用于测量tdt的掺入效率:所用引物如下:5'-aaaaaaaaaaaaaaaagggg-3'(seq id no:3)所述引物在5'末端还具有atto荧光染料。使用的代表性修饰核苷酸(在表2中记为dntp)包括3'-o-氨基-2',3'-双脱氧核苷酸-5'-三磷酸(onh2,firebird biosciences),例如3'-o-氨基-2',3'-双脱氧腺苷-5'-三磷酸。对于每个测试的不同变体,使用一个管进行反应。将试剂加入管中,从水开始,然后按表2的顺序加入。在37℃下30分钟后,通过添加甲酰胺(sigma)终止反应。表2:延伸活性测定试剂活性缓冲液包含例如补充有cocl2的tdt反应缓冲液(可得自new england biolabs)。
25.通过常规聚丙烯酰胺凝胶电泳分析测定的产物。例如,上述测定的产物可以在16%聚丙烯酰胺变性凝胶(bio-rad)中分析。刚好在分析之前通过将聚丙烯酰胺倾倒在玻璃板内并使其聚合来制备凝胶。将玻璃板内的凝胶加载在装有用于电泳步骤的tbe缓冲液(sigma)的适合的槽中。将待分析的样品装载在凝胶的顶部。在室温下在凝胶的顶部和底部之间施加500至2,000v的电压持续3至6h。分离后,使用例如台风扫描仪(ge life sciences)扫描凝胶荧光。使用imagej软件(imagej.nih.gov/ij/)或其等同物分析凝胶图像,以计算修饰的核苷酸的掺入百分比。
26.发夹完成测定。在一个方面,本发明包括测量聚合酶(例如tdt变体)将dntp掺入多核苷酸(即“测试多核苷酸”)的3'末端的能力的方法。一种这样的方法包括在反应条件下提供具有游离3'羟基的测试多核苷酸,其中所述测试多核苷酸基本上仅是单链的,但在用聚合酶如tdt变体延伸时形成包含单链环和双链环的稳定发夹结构。因此,可以通过双链多核苷酸的存在来检测3'端的延伸。双链结构可以以多种方式检测,包括但不限于,插入双链结构时优先发荧光的荧光染料,延伸多核苷酸上的受体(或供体)和寡核苷酸上的供体(或受体)之间的荧光共振能量转移(fret)等,所述寡核苷酸与新形成的发夹茎形成三链体,在形成发夹时所述fret受体和供体都连接到测试多核苷酸并且被带入fret附近。在一些实施方案中,测试多核苷酸在由单个核苷酸延伸后的茎部分的长度在4至6个碱基对的范围内;在其它实施方案中,这样的茎部分的长度为4至5个碱基对;在其它实施例中,这种茎部的长度为4个碱基对。在一些实施方案中,测试多核苷酸的长度在10至20个核苷酸的范围内;在其
它实施方案中,测试多核苷酸具有12-15个核苷酸的长度。在一些实施方案中,有利的是或方便的是用核苷酸延伸测试多核苷酸,所述核苷酸使不具有延伸的茎和具有延伸的茎的熔融温度之间的差异最大化;因此,在一些实施方案中,用dc或dg延伸测试多核苷酸(因此选择具有用于茎形成的适当互补核苷酸的测试多核苷酸)。
27.用于发夹完成测定的示例性测试多核苷酸包括p875(5'-cagttaaaaact)(seq id no:4),其通过用dgtp延伸而完成;通过用dctp延伸而完成的p876(5'-gagttaaaact)(seq id no:5);和通过用dgtp延伸而完成的p877(5'-cagcaaggct)(seq id no:6)。这种测试多核苷酸的示例性反应条件可以包括:2.5-5μm的测试多核苷酸,1:4000稀释的(来自biotium,inc的嵌入染料,fremont,ca),200mm cacodylate koh ph6.8,1mm cocl2,0-20%dmso以及期望浓度的3'-onh
2 dgtp和tdt。发夹的完成可以通过使用常规荧光计(例如tecan读数器)在28-38℃的反应温度下使用设置为360nm的激发过滤器和设置为635nm的发射过滤器的染料荧光的增加来监测。
28.在本发明该方面的一些实施方案中,可以通过以下步骤测试tdt变体对无模板掺入核苷三磷酸的能力:(a)在其中测试多核苷酸是单链的但掺入核苷三磷酸后形成具有双链茎区的发夹的条件下,合并具有游离3'-羟基的测试多核苷酸、tdt变体和核苷三磷酸,和(b)检测形成的双链茎区的量,作为tdt变体掺入核苷三磷酸的能力的量度。在一些实施方案中,核苷三磷酸是3'-o-封闭的核苷三磷酸。无模板酶促合成
29.多核苷酸的无模板酶促合成可以通过多种已知方案使用无模板聚合酶进行,例如末端脱氧核苷酸转移酶(tdt),包括其经改造以具有改善的特性的变体,例如在掺入3'-o-封闭的脱氧核苷三磷酸(3'-o-封闭的dntp)中更高的温度稳定性或更高的效率。例如ybert等人的国际专利公开wo/2015/159023;ybert等人的国际专利公开wo/2017/216472;hyman,美国专利5436143;hiatt等人的美国专利5763594;jensen等人,biochemistry,57:1821-1832(2018);mathews等人,organic&biomolecularchemistry,doi:0.1039/c60ob01371f(2016);schmitz等人,organic lett.,1(11):1729-1731(1999)。
30.在一些实施方案中,酶促dna合成方法包括重复的步骤循环,如图1所示,其中在每个循环中加入预定的核苷酸。提供了起始子多核苷酸(100),例如附着于固体支持物(102),具有游离3'-羟基(103)。在有效地将3'-o-保护的dntp酶促掺入到起始子多核苷酸(100)(或延长的起始子多核苷酸)的3'末端的条件(104)下,向起始子多核苷酸(100)(或后续循环中延长的起始子多核苷酸)中加入3'-o-保护的dntp和tdt变体。该反应产生其3'-羟基被保护的延长的起始子多核苷酸(106)。如果延长的起始子多核苷酸含有完整的序列,则3'-o-保护基团被去除或去保护,并且期望的序列被从原始起始子多核苷酸切割。这种切割可以使用多种单链切割技术中的任一种进行,例如,通过在原始起始子多核苷酸内的预定位置插入可切割的核苷酸。示例性的可切割核苷酸可以是被尿嘧啶dna糖基化酶切割的尿嘧啶核苷酸。如果延长的起始子多核苷酸不包含完整的序列,则除去3'-o-保护基团以暴露游离的3'-羟基(103),并且延长的起始子多核苷酸经历核苷酸添加和去保护的另一个循环。
31.如本文所用,关于特定基团,例如核苷酸或核苷的3'-羟基的术语“受保护的”和“封闭的”可互换使用,并且旨在表示部分共价连接至特定基团,其防止在化学或酶促过程期间基团的化学变化。每当指定基团是核苷三磷酸的3'-羟基,或其中已掺入3'-保护的(或
封闭的)-核苷三磷酸的延伸片段(或“延伸中间体”)时,阻止的化学变化是延伸片段(或“延伸中间体”)通过酶偶联反应的进一步或随后的延伸。
32.在一些实施方案中,核苷酸的有序序列在每个合成步骤中在3'-o-可逆封闭的dntp的存在下使用tdt与起始核酸偶联。在一些实施方案中,合成寡核苷酸的方法包括以下步骤:(a)提供具有游离3'-羟基的起始子;(b)在延伸条件下,使所述起始子或具有游离3'-羟基的延伸中间体与tdt在3'-o-封闭的核苷三磷酸存在下反应,以产生3'-o-封闭的延伸中间体;(c)解封闭所述延伸中间体以产生具有游离3'-羟基的延伸中间体;以及(d)重复步骤(b)和(c),直至合成多核苷酸。(有时“延伸中间体”也称为“延长片段”。)在一些实施方案中,起始子作为连接到固体支持物上的寡核苷酸提供,例如通过其5'末端。上述方法还可以包括在反应或延伸步骤之后以及在解封闭步骤之后的洗涤步骤。例如,反应步骤可以包括例如通过洗涤,在预定的温育期或反应时间之后除去未掺入的核苷三磷酸的子步骤。这种预定的温育时间或反应时间可以是几秒,例如30秒至若干分钟,例如30分钟。
33.上述方法还可以包括封端步骤以及在反应或延伸步骤之后以及在解封闭步骤之后的洗涤步骤。如上所述,在一些实施方案中,封端步骤可以包括在其中非延伸的游离3'-羟基与防止封端链的任何进一步延伸的化合物反应中。在一些实施方案中,这样的化合物可以是二脱氧核苷三磷酸。在其它实施方案中,具有游离3'-羟基的非延伸链可通过用3'-外切核酸酶活性(例如exo i)处理而降解。例如,参见hyman,美国专利5436143。同样,在一些实施方案中,未被解封闭的链可以被处理以除去链或使其对进一步的延伸是惰性的。
34.在包括寡核苷酸的连续合成的一些实施方案中,加帽步骤可能是不希望的,因为加帽可能阻止产生等摩尔量的多个寡核苷酸。在没有加帽的情况下,序列将具有均匀分布的缺失错误,但是多个寡核苷酸中的每一个将以相等的摩尔量存在。这不是非延伸的片段被加帽的情况。
35.在一些实施方案中,用于延伸或延长步骤的反应条件可以包括以下:2.0μm纯化的tdt;125-600μm 3'-o-封闭的dntp(例如3'-o-nh
2-封闭的dntp);约10至约500mm的二甲胂酸钾缓冲液(ph在6.5和7.5之间)和约0.01至约10mm的二价阳离子(例如cocl2或mncl2),其中延长反应可以在50μl反应体积中,在rt至45℃范围内的温度下进行3分钟。在其中3'-o-封闭的dntp是3'-o-nh
2-封闭的dntp的实施方案中,用于解封闭步骤的反应条件可以包括以下:700mm nano2;1m乙酸钠(用乙酸调节至4.8-6.5范围内的ph),其中解封闭反应可以在50μl体积中在rt至45℃范围内的温度下进行30秒至若干分钟。
36.根据具体应用,解封闭和/或切割的步骤可以包括多种化学或物理条件,例如光,热,ph,能够切割特定化学键的特定试剂如酶的存在。在选择3'-o-封闭基团和相应的解封闭条件方面的指导可以在以下参考文献中找到,这些文献通过引用并入本文:美国专利5808045;美国专利8808988;国际专利公开wo91/06678;以及以下引用的参考文献。在一些实施方案中,切割剂(有时也称为解封闭剂或试剂)是化学切割剂,例如二硫苏糖醇(dtt)。在替代实施方案中,切割剂可以是酶切割剂,例如磷酸酶,其可以切割3'-磷酸封闭基团。本领域技术人员将理解,解封闭剂的选择取决于所用的3'-核苷酸封闭基团的类型,是否使用一个或多个封闭基团,起始子是否连接到活细胞或生物体或固体支持物等,这需要温和的处理。例如,膦,如三(2-羧乙基)膦(tcep)可用于切割3'o-叠氮基甲基,钯络合物可用于切割3'o-烯丙基,或亚硝酸钠可用于切割3'o-氨基。在具体的实施方案中,切割反应涉及
technologies brochure,“strategies for attaching oligonucleotides to solid supports,”v.6(2014);hermanson,bioconjugate techniques,第二版(academic press,2008);和类似的参考文献。
42.在本发明中使用的许多3'-o-封闭的dntp可以从商业销售商购买或使用公开的技术合成,例如美国专利7057026;国际专利公布wo2004/005667,wo91/06678;canard等,gene(上文引用);metzker等人,nucleic acids research,22:4259-4267(1994);meng et al,j.org.chem.,14:3248-3252(3006);美国专利公开2005/037991。在一些实施方案中,经修饰的核苷酸包含经修饰的核苷酸或核苷分子,所述经修饰的核苷酸或核苷分子包含嘌呤或嘧啶碱基和核糖或脱氧核糖糖部分,所述核糖或脱氧核糖糖部分具有与其共价连接的可移除的3'-oh封闭基团,使得所述3'碳原子连接有以下结构的基团:-o-z其中-z是-c(r’)
2-o-r”,-c(r’)
2-n(r”)2,-c(r’)
2-n(h)r”,-c(r’)
2-s-r”和-c(r’)
2-f中的任一个,其中每个r”是或是可移除保护基的一部分;每个r’独立地是氢原子,烷基,取代的烷基,芳基烷基,烯基,炔基,芳基,杂芳基,杂环基,酰基,氰基,烷氧基,芳氧基,杂芳氧基或酰胺基,或通过连接基团连接的可检测标记;条件是在一些实施方案中,这样的取代基具有至多10个碳原子和/或至多5个氧或氮杂原子;或(r’)2表示式=c(r
”’
)2的基团,其中每个r
”’
可以相同或不同并且选自包含氢原子、卤素原子和烷基的基团,条件是在一些实施方案中,每个r
”’
的烷基具有1至3个碳原子;并且其中所述分子可以反应以产生中间体,其中每个r”交换为h,或者其中z是-(r’)
2-f,f交换为oh,sh或nh2,优选oh,其中间体在水性条件下离解以提供具有游离3'-oh的分子;条件是当z是-c(r’)
2-s-r”时,两个r’基团不是h。在某些实施方案中,修饰的核苷酸或核苷的r’是烷基或取代的烷基,条件是这样的烷基或取代的烷基具有1-10个碳原子和0-4个氧或氮杂原子。在某些实施方案中,修饰的核苷酸或核苷的-z具有式-c(r’)
2-n3。在某些实施例中,z是叠氮基甲基。
43.在一些实施方案中,z是具有或不具有200或更低的分子量的杂原子的可切割的有机部分。在其它实施方案中,z是具有或不具有100或更低的分子量的杂原子的可切割的有机部分。在其它实施方案中,z是具有或不具有50或更低的分子量的杂原子的可切割的有机部分。在一些实施方案中,z是具有或不具有200或更低的分子量的杂原子的可酶促切割的有机部分。在其它实施方案中,z是具有或不具有分子量为100或更低的杂原子的可酶促切割的有机部分。在其它实施方案中,z是具有或不具有50或更低的分子量的杂原子的可酶促切割的有机部分。在其它实施方案中,z是分子量为200或更低的可酶促切割的酯基。在其它实施方案中,z是可被3'-磷酸酶除去的磷酸基团。在一些实施方案中,以下3'-磷酸酶中的一种或多种可与制造商推荐的方案一起使用:t4多核苷酸激酶,小牛肠碱性磷酸酶,重组虾碱性磷酸酶(例如可得自new england biolabs,beverly,ma)。
44.在进一步的具体实施方案中,3'-封闭的核苷三磷酸被3'-o-叠氮基甲基,3'-o-nh2或3'-o-烯丙基封闭。
45.在其它实施方案中,本发明的3'-o-封闭基团包括3'-o-甲基,3'-o-(2-硝基苄基),3'-o-烯丙基,3'-o-胺,3'-o-叠氮基甲基,3'-o-叔丁氧基乙氧基,3'-o-(2-氰基乙基)和3'-o-炔丙基。变体tdt的生产
46.本发明的变体可以通过突变已知的参考或野生型tdt编码多核苷酸,然后使用常规分子生物学技术表达而产生。例如,小鼠tdt基因(seq id no:1)可以使用常规分子生物学技术从合成片段组装(例如使用stemmer et al,gene,164:49-53(1995);kodumal et al,proc.natl.acad.sci.,101:15573-15578(2004)等记载的方案),或者它可以直接从小鼠细胞中克隆,使用boule et al,mol.biotechnology,10:199-208(1998),or bentolila et al,embo j.,14:4221-4229(1995)等记载的方案。
47.例如,可以将分离的tdt基因插入表达载体,如pet32(novagen),得到载体pctdt,然后可以使用常规方法制备和表达变体tdt蛋白。具有正确序列的载体可以在大肠杆菌生产菌株中转化。
48.使用常规技术培养转化的菌株以沉淀从中提取tdt蛋白。例如,将预先制备的沉淀球在30至37℃水浴中解冻。一旦完全解冻,将沉淀球重悬于由50mm tris-hcl(sigma)ph7.5,150m nacl(sigma),0.5mm巯基乙醇(sigma),5%甘油(sigma),20mm咪唑(sigma)和1tab的100ml蛋白酶混合物抑制剂(thermofisher)组成的裂解缓冲液中。小心地进行再悬浮以避免过早裂解和剩余聚集体。重悬的细胞通过几个french press循环裂解,直到获得完全的颜色均匀性。所用的通常压力为14,000psi。然后将裂解物以10,000rpm离心1小时至1小时30分钟。在柱纯化之前,使离心物通过0.2μm过滤器以除去任何碎片。
49.tdt蛋白可以在一步亲和程序中从离心物中纯化。例如,ni-nta亲和柱(ge healthcare)用于结合聚合酶。最初用15柱体积的50mm tris-hcl(sigma)ph7.5,150mm nacl(sigma)和20mm咪唑(sigma)洗涤和平衡柱。平衡后将聚合酶结合到柱上。然后将由50mm tris-hcl(sigma)ph7.5,500mm nacl(sigma)和20mm咪唑(sigma)组成的洗涤缓冲液加到柱上15倍柱体积。洗涤后,用50mm tris-hcl(sigma)ph7.5,500mm nacl(sigma)和0.5m咪唑(sigma)洗脱聚合酶。收集对应于感兴趣的聚合酶的最高浓度的级分,并将其汇集在单个样品中。将合并的级分对透析缓冲液(20mm tris-hcl,ph6.8,200mnacl,50mmmgoac,100mm[nh4]2so4)透析。随后在浓缩过滤器(amicon ultra-30,merk millipore)的帮助下浓缩透析液。将浓缩的酶分小份分配,最后加入50%甘油,然后将这些等分试样在-20℃冷冻并长期储存。在sds page凝胶中分析5μl的纯化酶的不同级分。
[0050]
在一些实施方案中,tdt变体可以可操作地连接到包含共价键或非共价键的接头部分;氨基酸标签(例如,聚氨基酸标签、聚his标签、6his-标签等);化合物(例如,聚乙二醇);蛋白-蛋白结合对(例如,生物素-抗生物素蛋白);亲和偶联;捕获探针;或这些的任意组合。接头部分可以与tdt变体分开或作为tdt变体的一部分。用于本发明的tdt变体的示例性his标签是masshhhhhssgsenlyfqtgssg-(seq id no:12))。标签-接头部分不干扰核苷酸结合活性或tdt变体的催化活性。
[0051]
上述方法或等同方法导致分离的tdt变体,其可以与各种试剂混合,例如盐,ph缓冲液等,它们对于活性和/或保存是必需的或有用的,从而提供可以用于本发明方法的制剂。用于实施本发明方法的试剂盒
[0052]
本发明包括用于实施本发明方法的多种试剂盒。在一个方面,本发明的试剂盒包含在一个制剂或多个制剂中的多种本发明的tdt变体,其适于进行如本文所述的无模板的酶促多核苷酸合成。在一些实施方案中,多种tdt变体在2和4之间。在其它实施例中,多种是
2。这样的试剂盒还可以包括用于每个tdt变体的合成缓冲液,其提供用于优化3'-o-保护的dntp向生长链的无模板添加或掺入的反应条件。在一些实施方案中,所述多种tdt变体中的每一种可以在相同或不同的制剂中,在单独的容器中单独提供,并且在其它实施方案中,一些或所有的tdt变体可以在其混合物中以共同的制剂提供。在一些实施方案中,本发明的试剂盒还包括3'-o-可逆保护的dntp。在这样的实施方案中,3'-o-可逆保护的dntp可以包含3'-o-氨基-dntp或3'-o-叠氮基甲基-dntp。在进一步的实施方案中,试剂盒可以包括一个或多个以下项目,单独或与上述项目一起:(i)用于进行如本文所述的去保护步骤的去保护试剂,(ii)其上连接有起始子的固体载体,(iii)用于从固体载体释放完成的多核苷酸的切割试剂,(iv)用于在酶促添加或偶联步骤结束时除去未反应的3'-o-保护的dntp的洗涤试剂或缓冲液,以及(v)合成后的处理试剂,如净化柱,脱盐试剂,洗脱试剂等。
[0053]
关于以上项目(ii)和(iii),某些起始子和切割试剂结合在一起。例如,包含肌苷可切割核苷酸的起始子可以与内切核酸酶v切割试剂一起存在;包含硝基苄基可光切割接头的起始子可以与合适的光源一起用于切割可光切割接头;包含尿嘧啶的起始子可以与尿嘧啶dna糖基化酶切割试剂一起存在等等。
实施例1
tdt变体m55和m56的掺入效率
[0054]
测试tdt变体m55和m56(如上定义)在以下反应条件下将3'-o-叠氮基甲基核苷三磷酸(am-dntp)掺入溶液中的两种不同引物(syngg:5'-tgtgagagagtgaaatgagg(seq id no:7)和polyt:5'-tttttttttttttttttttttt(20t)(seq id no:8)的能力:1μm引物,2μm纯化的tdt变体,80μm am-dntp,10%dmso,缓冲液(100mm二甲胂酸钾,1mm cocl2,ph:6.8);在37℃下进行反应5分钟;通过在95℃加热5分钟终止反应。表3显示了不同的引物、dntp和tdt变体的延伸引物的百分比。表3am-dntp掺入百分比定义
[0055]
氨基酸由根据以下命名法的它们的单字母或三字母代码表示:a:丙氨酸(ala);c:半胱氨酸(cys);d:天冬氨酸(asp);e:谷氨酸(glu);f:苯丙氨酸(phe);g:甘氨酸(gly);h:组氨酸(his);i:异亮氨酸(iic);k:赖氨酸(lys);l:亮氨酸(leu);m:甲硫氨酸(met);n:天冬酰胺(asn);p:脯氨酸(pro);q:谷氨酰胺(gln);r:精氨酸(arg);s:丝氨酸(ser);t:苏氨酸(thr);v:缬氨酸(val);w:色氨酸(trp)和y:酪氨酸(tyr)。
[0056]
关于两个或多个不同tdts中的氨基酸位置的“功能上等同的”是指(i)在相应位置的氨基酸在tdts的活性中起相同的功能作用,和(ii)氨基酸出现在相应tdts的氨基酸序列中的同源氨基酸位置。可以基于序列比对和/或分子建模来鉴定两个或多个不同tdt的氨基酸序列中的位置上等同的或同源的氨基酸残基。在一些实施方案中,功能上等同的氨基酸
位置属于在进化相关物种的tdts的氨基酸序列中保守的序列基序,例如与属、家族等相关的序列基序。这种保守序列基序的实例描述于motea et al,biochim.biophys.acta.1804(5):1151-1166(2010);delarue et al,embo j.,21:427-439(2002);和类似的参考文献中。
[0057]
关于蛋白质的“分离的”是指这样的化合物,其已经从其天然环境的组分或从非均相反应混合物中鉴定和分离和/或回收。天然环境或反应混合物的污染物组分是会干扰蛋白质功能的物质,并且可以包括酶,激素和其它蛋白质或非蛋白质溶质。在一些实施方案中,将本发明的蛋白质(1)纯化至大于95重量%的蛋白质,最优选大于99重量%,所述蛋白质通过lowry方法测定;(2)纯化至足以通过使用旋转杯定序器获得n-末端或内部氨基酸序列的至少15个残基的程度,或(3)纯化至在还原或非还原条件下通过sds-page使用考马斯蓝或优选银染的均匀度。当通过重组方法制备时,本发明的分离的蛋白质可以在重组细胞内原位包括本发明的蛋白质,因为蛋白质的天然环境的至少一个组分会不存在。通常,通过至少一个纯化步骤制备本发明的分离的蛋白质。
[0058]“试剂盒”是指用于递送用于实施本发明方法的材料或试剂的任何递送系统。在反应测定的上下文中,这样的递送系统包括允许储存、运输或递送反应试剂(例如,在适当容器中的一种或多种tdt变体,反应缓冲液,3'-o-保护的-dntp,去保护试剂,附有起始子的固体支持物等)和/或支持材料(例如,缓冲液,用于进行测定的书面说明等)从一个位置到另一个位置的系统和/或化合物(诸如稀释剂、表面活性剂、载体等)。例如,试剂盒包括含有相关反应试剂和/或支持材料的一个或多个外壳(例如盒子)。这种内容物可以一起或分开递送到预期的接受者。例如,第一容器可含有一种或多种用于合成方法的tdt变体,而第二或另外的容器可含有去保护剂、具有起始子的固体载体、3'-o-保护的dntp等。
[0059]
可互换使用的“突变体”或“变体”是指衍生自seq id no:1或其它特定氨基酸序列的多肽,其在一个或多个位置包含修饰或改变,即取代,插入和/或缺失。这种突变体或变体通常同时具有无模板聚合酶活性和掺入一种或多种可逆封闭的核苷三磷酸前体的能力。这些变体可以通过本领域熟知的各种技术获得。特别地,用于改变编码野生型蛋白的dna序列的技术的实例包括但不限于定点诱变,随机诱变和合成寡核苷酸构建等。诱变活性在于在蛋白质序列中或在本发明的聚合酶的情况下缺失,插入或取代一个或多个氨基酸。
[0060]
以下术语用于指定取代:l238a表示参考序列或野生型序列的238位氨基酸残基(亮氨酸,l)被改变为丙氨酸(a)。a132v/i/m表示母体序列的位置132处的氨基酸残基(丙氨酸,a)被下列氨基酸之一取代:缬氨酸(v),异亮氨酸(i)或甲硫氨酸(m)。取代可以是保守的或非保守的取代。保守取代的实例在以下组内:碱性氨基酸(精氨酸,赖氨酸和组氨酸),酸性氨基酸(谷氨酸和天冬氨酸),极性氨基酸(谷氨酰胺,天冬酰胺和苏氨酸),疏水性氨基酸(甲硫氨酸,亮氨酸,异亮氨酸,半胱氨酸和缬氨酸),芳族氨基酸(苯丙氨酸,色氨酸和酪氨酸)和小氨基酸(甘氨酸,丙氨酸和丝氨酸)。
[0061]“序列同一性”是指两个序列(例如两个多肽序列或两个多核苷酸序列)之间的匹配(例如相同的氨基酸残基)的数目(或分数,通常表示为百分比)。通过比较对齐时的序列来确定序列同一性,以便在最小化序列间隙的同时最大化重叠和同一性。特别地,序列同一性可以使用许多数学全局或局部比对算法中的任何一种来确定,这取决于两个序列的长度。相似长度的序列优选使用全局比对算法(例如needleman和wunsch算法;needleman和
wunsch,1970)来比对,其在整个长度上最优地比对序列,而基本上不同长度的序列优选地使用局部比对算法(例如smith和waterman算法(smith和waterman,1981)或altschul算法(altschul等人,1997;altschul等人,2005))进行比对。用于确定氨基酸序列同一性百分比的比对可以以本领域技术人员所熟知的各种方式实现,例如,使用可在互联网网站上获得的公开可获得的计算机软件,如http://blast.ncbi.nlm.nih.gov/或ttp://www.ebi.ac.uk/tools/emboss/。本领域技术人员可以确定用于测量比对的适当参数,包括在所比较的序列的整个长度上实现最大比对所需的任何算法。出于本文的目的,氨基酸序列同一性%值是指使用成对序列比对程序emboss needle产生的值,其使用needleman-wunsch算法创建两个序列的最佳全局比对,其中所有搜索参数被设置为默认值,即,评分矩阵=blosum62,空位开头=10,间隙延长=0.5。末端空位罚分=假,末端空位开头=10和末端空位延长=0.5。
[0062]“多核苷酸”或“寡核苷酸”可互换使用,并且各自意指核苷酸单体或其类似物的线性聚合物。构成多核苷酸和寡核苷酸的单体能够通过单体-单体相互作用的规则模式与天然多核苷酸特异性结合,例如watson-crick类型的碱基配对、碱基堆叠、hoogsteen或反向hoogsteen类型的基对等。这样的单体和它们的核苷间键可以是天然存在的或可以是其类似物,例如天然存在的或非天然存在的类似物。非天然存在的类似物可包括pna,硫代磷酸核苷间键,含有允许连接标记(例如荧光团或半抗原)的连接基团的碱基等。每当使用寡核苷酸或多核苷酸需要酶促加工,例如通过聚合酶延伸,通过连接酶连接等时,本领域普通技术人员将理解,在那些情况下,寡核苷酸或多核苷酸不会在任何或一些位置含有核苷间键,糖部分或碱基的某些类似物。当多核苷酸通常被称为“寡核苷酸”时,多核苷酸的大小通常在几个单体单位,例如5-40个,到几千个单体单位的范围内。每当多核苷酸或寡核苷酸由字母序列(大写或小写)表示时,例如“atgcctg”,应当理解的是,核苷酸从左至右为5'-》3'顺序,并且“a”表示脱氧腺苷,“c”表示脱氧胞苷,“g”表示脱氧鸟苷,并且“t”表示胸苷。“i”表示脱氧肌苷,“u”表示尿苷,除非另有说明或从上下文显而易见。除非另有说明,术语和原子编号惯例将遵循strachan和read,human molecular genetics 2(wiley-liss,new york,1999)中公开的那些。通常,多核苷酸包含通过磷酸二酯键连接的四个天然核苷(例如脱氧腺苷、脱氧胞苷、脱氧鸟苷、脱氧胸苷用于dna或其核糖对应物用于rna);然而,它们也可以包含非天然核苷酸类似物,例如包括修饰的碱基,糖或核苷间键。本领域技术人员清楚的是,当酶具有对活性的特异性寡核苷酸或多核苷酸底物要求时,例如单链dna,rna/dna双链体等,那么选择用于寡核苷酸或多核苷酸底物的合适的组成完全在普通技术人员的知识范围内,特别是在来自论文的指导下,例如sambrook等,molecular cloning,第二版(cold spring harborlaboratory,,new york,1989)等参考文献。同样,寡核苷酸和多核苷酸可以指单链形式或双链形式(即寡核苷酸或多核苷酸的双链体及其相应的互补物)。本领域的普通技术人员从术语使用的上下文中可以清楚哪种形式或者这两种形式都是有意的。
[0063]“引物”是指天然的或合成的寡核苷酸,其能够在与多核苷酸模板形成双链体时充当核酸合成的起始点,并从其3'末端沿着模板延伸,从而形成延伸的双链体。引物的延伸通常用核酸聚合酶进行,例如dna或rna聚合酶。在延伸过程中加入的核苷酸序列由模板多核苷酸的序列决定。通常引物由dna聚合酶延伸。引物通常具有14-40个核苷酸的长度,或18-36个核苷酸的长度。引物用于多种核酸扩增反应,例如使用单一引物的线性扩增反应,或使
用两种或多种引物的聚合酶链反应。选择用于特定应用的引物的长度和序列的指导是本领域普通技术人员熟知的,如以下参考文献所证明的:dieffenbach,editor,pcr primer:alaboratory manual,2nd edition(cold spring harbor press,new york,2003)。
[0064]“取代”是指氨基酸残基被另一个氨基酸残基替代。优选地,术语“取代”是指氨基酸残基被选自天然存在的标准20个氨基酸残基、稀有天然存在的氨基酸残基(例如羟脯氨酸,羟赖氨酸,别羟赖氨酸,6-n-甲基赖氨酸,n-乙基甘氨酸,n-甲基甘氨酸,n-乙基天冬酰胺,别异亮氨酸,n-甲基异亮氨酸,n-甲基缬氨酸,焦谷氨酰胺,氨基丁酸,鸟氨酸,正亮氨酸,正缬氨酸)和经常合成制备的非天然存在的氨基酸残基(例如,环己基-丙氨酸)的另一个替代。优选地,术语“取代”是指氨基酸残基被选自天然存在的标准20个氨基酸残基中的另一个替代。符号“+”表示取代的组合。
[0065]
在本文件中,使用以下术语表示取代:l238a表示母体序列的238位的氨基酸残基(亮氨酸,l)被更换为丙氨酸(a)。a132v/i/m表示母体序列的位置132处的氨基酸残基(丙氨酸,a)被下列氨基酸之一取代:缬氨酸(v)、异亮氨酸(i)或甲硫氨酸(m)。取代可以是保守的或非保守的取代。保守取代的实例在以下组内:碱性氨基酸(精氨酸,赖氨酸和组氨酸),酸性氨基酸(谷氨酸和天冬氨酸),极性氨基酸(谷氨酰胺,天冬酰胺和苏氨酸),疏水性氨基酸(甲硫氨酸,亮氨酸,异亮氨酸,半胱氨酸和缬氨酸),芳族氨基酸(苯丙氨酸,色氨酸和酪氨酸)和小氨基酸(甘氨酸,丙氨酸和丝氨酸)。
[0066]
本公开内容不旨在限于所阐述的特定形式的范围,而是旨在覆盖本文中描述的变型的替代、修改和等同物。此外,本公开内容的范围完全涵盖了鉴于本公开内容对于本领域技术人员而言可以变得显而易见的其它变型。本发明的范围仅受限于所附权利要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1