脊髓OLIG2+神经祖细胞诱导及自我更新培养体系、诱导方法及应用
本发明涉及生物医药工程技术领域,涉及一种能够在体外获得人多能干细胞来源的脊髓olig2+神经祖细胞并维持其稳定自我更新的培养体系、诱导方法及应用。
背景技术:
人胚胎干细胞(humanembryonicstemcells,hescs)是源自胚胎内细胞团的一种可以维持在体外稳定自我更新并保留多向分化潜能的人多能干细胞(humanpluripotentstemcells,hpscs)。理论上,通过在体外模拟细胞的发育历程,hescs可以被定向诱导分化为人体三个胚层中的任意一种类型的细胞。正因为如此,定向诱导hescs获得特定目的细胞在疾病细胞治疗、药物筛选以及发育生物学研究上都有着非常广泛的应用前景。
在胚胎的发育过程中,pmn区(motoneuronprogenitordomain)是脊髓腹侧的一个特定区域,该区域内的细胞特异性表达转录因子olig2(oligodendrocytetranscriptionfactor2)。在人体的发育的过程中,该区域的olig2+神经祖细胞首先分化产生负责控制机体骨骼肌运动的脊髓运动神经元;之后,olig2+神经祖细胞又会分化为脊髓大部分的少突胶质细胞前体细胞(oligodendrocyteprecursorcells,opcs),而这些opcs会在随后的发育过程中分化成熟为负责脊髓中髓鞘形成的少突胶质细胞。
不论是脊髓运动神经元还是少突胶质细胞出现异常,都会导致复杂疾病的发生,严重降低患者生活质量甚至导致患者死亡。而目前针对以上复杂的疾病临床上尚无特效的治疗办法。随着对多能干细胞研究的开展,在脊髓损伤动物模型中移植hpscs来源的脊髓神经干细胞和在脱髓鞘疾病动物模型中移植hpscs来源的opcs均能够有效缓解实验动物的临床症状,改善其多项生理功能,显示了hpscs巨大的临床转化潜力。
在基础研究中,人们对于调控olig2+神经祖细胞在后续发育过程中命运决定的具体调控机制尚不十分清楚,仍需要可稳定自我更新的olig2+神经祖细胞作为模型以解决这一基础的生物学问题。而通过hescs获得可在体外稳定自我更新的脊髓olig2+神经祖细胞,一方面可以在短时间内分化为可供细胞治疗使用的目的细胞以推动临床转化应用,另一方面由于该细胞兼备神经元及少突胶质细胞的分化潜能,也可以作为研究细胞命运决定调控机制的细胞模型以解决尚不明确的生物学问题。因此,获得hpscs来源的可于体外稳定自我更新的脊髓olig2+神经祖细胞不论是对于临床转化应用还是基础研究都有重要的意义。
而目前,本领域尚无法于体外得到可以稳定自我更新的脊髓olig2+神经祖细胞,而这无疑给细胞治疗等临床转化应用以及相应的基础研究带来了一定的阻碍和困扰。
技术实现要素:
本发明是为解决上述问题而进行的,针对目前尚无法于体外得到可以稳定自我更新的脊髓olig2+神经祖细胞提供了一种初步的解决办法,从而获得人多能干细胞来源的脊髓olig2+神经祖细胞,并维持其稳定自我更新。
本发明的第一方面,提供了一种于体外获得人多能干细胞来源的脊髓olig2+神经祖细胞诱导及自我更新培养体系,包含基础培养基以及与该基础培养基分别组合使用的诱导分化因子和体外维持因子。
其中,所述诱导分化因子至少包括0.01-50μm糖原合成酶3(gsk3)抑制剂、0.01-500μm转化生长因子β(tgfβ)抑制剂以及0.01-500μm骨形态发生蛋白(bmp)抑制剂;
所述体外维持因子包括0.01-50μmgsk3抑制剂、0.01-500μmtgfβ抑制剂、0.01-5000ng/mlsonichedgehog(shh)、0.01-20μmsmoothened激动剂、0.01-500ng/ml上皮生长因子(egf)家族生长因子、0.01-500ng/ml成纤维生长因子(fgf)家族生长因子、0.01-500μmbmp抑制剂、0.01-50μmjak1/2抑制剂、0.01-10000nmsrc激酶抑制剂和0.01-50μmretinoicacid(ra)。
使用该培养体系,人多能干细胞可以于体外在大约1周的时间里被包含基础培养基和诱导分化因子的培养体系诱导分化为脊髓神经祖细胞;之后在2周的时间内被包含基础培养基和体外维持因子的培养体系进一步腹侧化为脊髓olig2+神经祖细胞,且该脊髓olig2+神经祖细胞具有继续分化为成熟脊髓运动神经元和少突胶质细胞的能力。
在该培养体系中,基础培养基(bm)包括dmem/f12液体基础培养基、0-5×b27添加剂、0-5×n2添加剂、1%青霉素/链霉素、0.01-500μg/ml2-磷酸-维生素c。
gsk3抑制剂、tgfβ抑制剂以及bmp抑制剂是诱导人多能干细胞定向分化为脊髓神经祖细胞的必需因子;gsk3抑制剂、tgfβ抑制剂、shh、smoothened激动剂、egf家族生长因子、fgf家族生长因子、bmp抑制剂、jak1/2抑制剂、src激酶抑制剂和retinoicacid作为脊髓olig2+神经祖细胞维持因子加入bm培养基中,用于诱导脊髓神经祖细胞腹侧化为脊髓olig2+神经祖细胞并维持该细胞在体外的稳定自我更新。
优选的,基础培养基中,b27添加剂的量为0.5×b27添加剂,n2添加剂的量为0.5×n2添加剂,2-磷酸-维生素c的浓度为60μg/ml。
所述gsk3抑制剂包括但不限于chir99021、bio及ly2090314等小分子gsk3抑制剂中的一种或多种;
tgfβ抑制剂包括但不限于sb431542、ly2109761及a-83-01等小分子tgfβ受体抑制剂中的一种或多种;
bmp抑制剂包括但不限于dmh1、k02288、ldn-193189等小分子bmp受体抑制剂中的一种或多种,以及noggin等bmp抑制蛋白;
smoothened激动剂包括但不限于purmorphamine、sag及gsa10等小分子smoothened受体激动剂中的一种或多种;
egf家族生长因子包括但不限于egf、tgfα及hb-egf中的一种或多种;
fgf家族生长因子包含但不限于fgf1~fgf23中的任意一种或多种;
jak1/2抑制剂包括但不限于ruxolitinib、azd1480、pacritinib及filgotinib中的一种或多种;
src激酶抑制剂包括但不限于dasatinib、saracatinib及kx2-391等小分子src激酶抑制剂中的一种或多种。
进一步,诱导分化因子中,各组分和最优浓度如下:gsk3抑制剂为3μm的chir99021,tgfβ抑制剂为2μm的sb431542,bmp抑制剂为2μm的k02288;
体外维持因子中,各组分和最优浓度如下:gsk3抑制剂为1μm的chir99021,tgfβ抑制剂为2μm的sb431542,sonichedgehog的浓度为100ng/ml,smoothened激动剂为0.2μm的sag的浓度,egf家族生长因子为10ng/ml的egf,fgf家族生长因子为20ng/ml的fgf2,bmp抑制剂为1μm的k02288,jak1/2抑制剂为1μm的ruxolitinib,src激酶抑制剂为10nm的dasatinib的浓度,retinoicacid浓度为0.5μm。
本发明的具体实施方式中,采用上述组分进行实验,但每种组分中不限于上述具体成分。如,gsk3抑制剂中,选择3μm的chir99021bio进行实验,但bio及ly2090314也能实现相应功能。其他组分的成分选择亦然。
本发明的第二方面,提供了一种采用上述培养体系维持脊髓olig2+神经祖细胞在体外稳定自我更新的培养方法,流程如下:
a、采用含有1%基质胶的dmem/f12培养基预先包被培养支持物(如细胞培养板),并于4℃保存过夜;
b、将人多能干细胞(hues9细胞系)种植于预先包被基质胶的培养板上;
c、以本发明所述的包含基础培养基和诱导分化因子的培养体系诱导人多能干细胞定向分化为脊髓神经祖细胞;之后在获得的神经祖细胞基础上进一步用包含基础培养基和体外维持因子的培养体系诱导其腹侧化为脊髓olig2+神经祖细胞,并在得到脊髓olig2+神经祖细胞后继续以该培养体系维持该神经祖细胞在体外的稳定自我更新。
具体步骤如下:
a、诱导人多能干细胞分化获得脊髓神经祖细胞
将人多能干细胞接种至基质胶包被的培养板上,当人多能干细胞的融合度达到30%左右时,弃去人多能干细胞扩增培养基,更换包含基础培养基和诱导分化因子的培养体系,当细胞融合度达到70%-80%时进行传代并隔天换液,诱导分化一周后,稳定获得后端化的具有脊髓特征的神经祖细胞,
b、诱导脊髓神经祖细胞腹侧化获得脊髓olig2+神经祖细胞
将脊髓神经祖细胞接种至含有1%基质胶的培养体系包被的培养板上,用包含基础培养基和体外维持因子的培养体系诱导腹侧化,经过12~16天的腹侧化诱导,可获得较高比例的脊髓olig2+神经祖细胞;该培养体系也可使细胞长期稳定扩增并维持其神经祖细胞的状态。
本发明中,人多能干细胞为人胚胎内细胞团来源的胚胎干细胞细胞系或经体细胞重编程获得的诱导多能干细胞。
据此,本发明的第三方面提供了根据本发明的培养方法获得的脊髓olig2+神经祖细胞的应用,如进一步分化为成熟的脊髓运动神经元和少突胶质细胞,及其在中枢神经类疾病的治疗细胞以及在神经组织再生或神经性疾病体外药物筛选中的应用。
本发明的有益保障及效果如下:
通过实验,使用本发明的化学成份明确的诱导分化培养基可以在体外快速诱导人多能干细胞定向分化为脊髓olig2+神经祖细胞,并且维持该神经祖细胞在体外稳定自我更新10余代,该神经祖细胞具备进一步向脊髓运动神经元和脊髓少突胶质细胞分化的功能。
附图说明
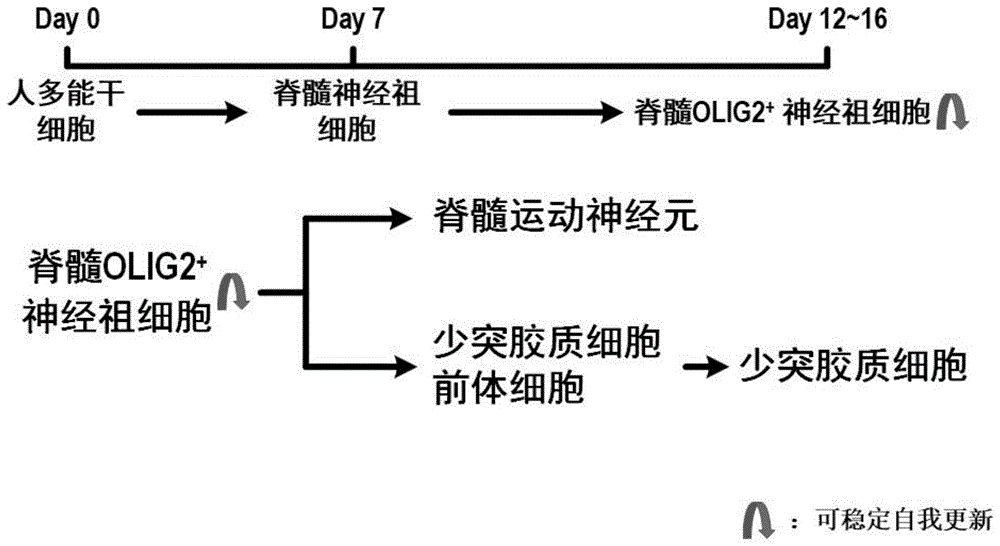
图1为体外快速诱导人多能干细胞定向分化为脊髓olig2+神经祖细胞的流程图。
图2为对利用本发明培养体系定向诱导人多能干细胞(hues9细胞系)分化获得的脊髓神经祖细胞的免疫荧光检测。其中,(a)诱导得到的脊髓神经祖细胞表达神经祖细胞和脊髓相应节段的分子标志物;(b、c)诱导得到的脊髓神经祖细胞表达神经祖细胞分子标志物,但尚不表达脊髓腹侧及少突胶质细胞谱系分子标志物;(d)诱导得到的脊髓神经祖细胞表达脊髓相应节段的分子标志物,同时表达细胞增殖的分子标志物。
图3为对利用本发明培养体系定向诱导人多能干细胞(hues9细胞系)分化获得的脊髓神经祖细胞的rna-seq检测。其中,(a、b)诱导分化得到的脊髓神经祖细胞在基因表达上已经与人多能干细胞产生了巨大的差异;(c)与人多能干细胞相比,脊髓神经祖细胞与细胞多能性相关的标志基因的表达水平出现了下调;(d)与人多能干细胞相比,脊髓神经祖细胞与神经祖细胞相关的标志基因的表达水平出现了上调;(e)与人多能干细胞相比,脊髓神经祖细胞与脊髓节段定位相关的基因的表达水平出现了上调。
图4为对利用本发明培养体系获得的脊髓olig2+神经祖细胞的免疫荧光检测。其中,(a)为获得的脊髓olig2+神经祖细胞表达特定分子标志olig2以及脊髓定位分子标志hoxb9;(b)为获得的脊髓olig2+神经祖细胞表达特定分子标志olig2以及细胞增殖标志物;(c、d)获得的脊髓olig2+神经祖细胞已有少部分细胞自发进入到神经元分化进程中。
图5为对利用本发明培养体系获得的脊髓olig2+神经祖细胞的rna-seq检测。(a)与人多能干细胞相比,脊髓olig2+神经祖细胞与细胞多能性相关的基因的表达水平出现了下调;(b)与人多能干细胞相比,脊髓olig2+神经祖细胞与神经祖细胞相关的基因的表达水平出现了上调;(c)与人多能干细胞相比,脊髓olig2+神经祖细胞与脊髓节段定位相关的基因的表达水平出现了上调。
图6为对利用本发明培养体系获得的脊髓olig2+神经祖细胞的rna-seq检测。(a、b)诱导分化得到的脊髓olig2+神经祖细胞与前期得到的脊髓神经祖细胞相比在基因表达上亦出现了显著差异;(c)脊髓自背侧向腹侧,由于基因表达差异分成不同区域的示意图;(d)与脊髓神经祖细胞相比,脊髓olig2+神经祖细胞的脊髓腹侧pmn区域标志基因的表达出现上调;(e)go分析显示,与脊髓腹侧pmn区神经祖细胞功能相关的基因在得到的脊髓olig2+神经祖细胞中的表达出现了上调。
图7为对利用本发明培养体系获得的在体外长期传代培养的脊髓olig2+神经祖细胞的rna-seq检测。(a-f)长期传代培养的脊髓olig2+神经祖细胞第2代、9代和15代细胞之间基因表达存在一定差异;(g、h)但与其他类型细胞相比较,此3代细胞之间差异表达基因数目明显较少,主成分分析显示此3代细胞的基因表达模式和水平基本一致。
图8为对利用本发明培养体系获得的脊髓olig2+神经祖细胞进一步分化得到的脊髓运动神经元的光景下视野及免疫荧光检测。(a)脊髓olig2+神经祖细胞可以快速分化为脊髓运动神经元;(b)分化所得到的细胞表达神经元相关分子标志;(c)分化得到的神经元表达成熟神经元分子标志以及脊髓节段定位分子标志;(d、e)分化得到的神经元表达胆碱能神经元分子标志和运动神经元分子标志。
图9为对利用本发明培养体系获得的脊髓olig2+神经祖细胞进一步分化得到的脊髓少突胶质细胞的光景下视野及免疫荧光检测。(a-d)脊髓olig2+神经祖细胞可以快速分化为双极样的少突胶质细胞前体细胞(opcs),并且表达相关分子标志;(e、f)得到的opcs可以进一步分化为成熟的蛛网样的少突胶质细胞;(g、h)得到的成熟少突胶质细胞可以包裹纳米纤维和神经元形成髓鞘。
具体实施方式
现结合实施例对本发明作详细描述,但本发明的实施不仅限于此。
本发明所用试剂和原料均市售可得或可按文献方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1:定向诱导人多能干细胞分化为脊髓olig2+神经祖细胞并维持其稳定自我更新
根据图1,人多能干细胞定向诱导分化为脊髓olig2+神经祖细胞主要分为两个步骤:第一步为诱导人多能干细胞分化以获得脊髓神经祖细胞;第二步为在获得的脊髓神经祖细胞的基础之上诱导其腹侧化以获得脊髓olig2+神经祖细胞。
1、定向诱导人多能干细胞分化为脊髓神经祖细胞
脊髓神经祖细胞的诱导分化方法如下:将人多能干细胞接种至基质胶包被的培养板上,当人多能干细胞的融合度达到30%左右时,弃去人多能干细胞扩增培养基,更换为脊髓神经祖细胞诱导分化培养基,当细胞融合度达到70%-80%时进行传代。以此培养基诱导人多能干细胞分化1周后,可以稳定获得后端化的具有脊髓特征的神经祖细胞。此诱导分化阶段隔天换液。
脊髓神经祖细胞诱导分化培养基的最优成分如下:基础培养基dmem/f12,0.5×n2(thermofisherscientific,cat#17502048),0.5×b27(thermofisherscientific,cat#17504044),60μg/ml2-磷酸-维生素c(sigma,cat#a8960),1%青霉素/链霉素,3μmgsk3抑制剂chir99021,2μmtgfβ抑制剂sb431542(selleck,s7099),2μmbmp抑制剂k02288。
对获得的脊髓神经祖细胞进行免疫荧光染色鉴定和rna-seq测序分析以确定细胞的性质。免疫荧光染色结果显示,经过1周的诱导分化后,细胞表达神经祖细胞以及脊髓节段定位的分子标志,同时该细胞具有增殖能力,但此阶段的细胞不表达脊髓腹侧的分子标志以及少突胶质细胞谱系的分子标志(图2)。测序分析结果显示,经过1周的诱导分化后,所获得的细胞在基因表达上与人多能干细胞产生了极大的差异,其与细胞多能性相关的基因的表达出现了下调,而与神经祖细胞和脊髓节段定位相关的基因的表达出现了明显的上调(图3)。
2、腹侧化脊髓神经祖细胞获得脊髓olig2+神经祖细胞并维持其稳定自我更新
将脊髓神经祖细胞接种至基质胶包被的培养板上,当细胞的融合度达50%左右时弃旧培养基,更换脊髓olig2+神经祖细胞诱导分化培养基开始腹侧化诱导,当细胞融合度达到90%左右时传代至新的以基质胶包被的培养板中。传代方法同上述。经过2周左右的腹侧化诱导,即可获得较高比例的脊髓olig2+神经祖细胞。继续利用该培养基进行培养,该细胞在此培养条件下可以长期稳定扩增,维持其神经祖细胞的状态。该细胞在体外长期培养时需每天进行半量换液。
脊髓olig2+神经祖细胞诱导分化培养基的最优成分如下:基础培养基dmem/f12,0.5×n2(thermofisherscientific,cat#17502048),0.5×b27(thermofisherscientific,cat#17504044),60μg/ml2-磷酸-维生素c(sigma,cat#a8960),1%青霉素/链霉素,1μmgsk3抑制剂chir99021、2μmtgfβ抑制剂sb431542、100ng/mlsonichedgehog(shh)、0.2μmsmoothened激动剂sag、10ng/mlegf家族生长因子egf、20ng/mlfgf家族生长因子fgf2、1μmbmp抑制剂k02288、1μmjak1/2抑制剂ruxolitinib、10nmsrc激酶抑制剂dasatinib和0.5μmretinoicacid。
对获得的脊髓olig2+神经祖细胞进行免疫荧光染色鉴定及rna-seq测序分析以明确细胞性质。免疫荧光染色结果显示,经过近2周的腹侧化诱导分化,获得的细胞表达olig2这一特定分子标志,同时具有脊髓节段定位特征以及增殖能力,另外部分细胞已经自发的进入到了神经元的分化进程中(图4)。测序分析结果显示,该阶段所获得的细胞与人多能干细胞以及前一阶段的脊髓神经祖细胞相比,其基因表达已出现显著差异。其中与细胞多能性相关的基因表达出现下调,与神经祖细胞、脊髓节段定位表达的基因出现了上调(图5)。而与脊髓神经祖细胞相比,该阶段细胞脊髓腹侧定位相关的基因表达出现了上调,同时对高表达的基因功能进行go分析,结果显示与脊髓腹侧神经元发育、少突胶质细胞发育等功能相关的基因的表达出现了明显的上调(图6)。
继续利用该培养条件在体外长期传代培养脊髓olig2+神经祖细胞,并对各代次细胞进行rna-seq测序分析以明确其细胞自我更新的稳定性。测序结果显示,各代次脊髓olig2+神经祖细胞基因表达虽略有差异,但是其基因表达的模式和水平基本一致(图7)。
以上结果显示,利用本发明的培养体系可以在较短的时间里定向诱导人多能干细胞分化为脊髓olig2+神经祖细胞,并维持其在体外稳定自我更新。
实施例2:脊髓olig2+神经祖细胞分化为脊髓运动神经元
得到实施例1所得的脊髓olig2+神经祖细胞后,定向诱导该细胞分化为成熟的脊髓运动神经元。经过诱导分化后,大部分细胞已具备神经元的形态(图8a)。对获得的细胞进行免疫荧光染色鉴定,染色结果显示,该细胞确为神经元,并且已经分化成熟(图8b、c),同时具有脊髓的节段定位特征(图8c)。另外,该神经元表达运动神经元和胆碱能神经元的分子标志(图8d、e)。
以上结果说明脊髓olig2+神经祖细胞在体外可以在相对较短的时间内分化为成熟的脊髓运动神经元。
实施例3:脊髓olig2+神经祖细胞分化为少突胶质细胞
得到实施例1所得的脊髓olig2+神经祖细胞后,定向诱导该细胞分化为成熟的少突胶质细胞。经过诱导分化后,上皮样的脊髓olig2+神经祖细胞逐渐分化为双极或多极样细胞,对该阶段细胞进行免疫荧光染色鉴定,发现该细胞表达少突胶质细胞谱系的分子标志(图9a-c),同时该细胞还具有增殖能力(图9d),证明脊髓olig2+神经祖细胞以及分化为少突胶质细胞前体细胞(opcs)。将该前体细胞种植于层粘连蛋白(laminin)包被的培养板上继续诱导其分化成熟,经过近2个月的诱导分化后,对其进行免疫荧光染色鉴定,发现该细胞突起呈蛛网样,并且表达成熟少突胶质细胞的分子标志(图9e、f),证明该细胞已经分化成熟为少突胶质细胞。为了进一步证明得到的少突胶质细胞具有功能,将该细胞种植于聚乳酸-羟基乙酸共聚物(pgla)纳米纤维包被的培养板上,发现该少突胶质细胞可以包绕纳米纤维形成髓鞘(图9g)。将该细胞与神经元进行共培养,发现该细胞也可以包绕神经元突起形成髓鞘(图9h)。
以上结果说明,脊髓olig2+神经祖细胞在体外可以在相对较短的时间内分化为成熟的少突胶质细胞,并且该细胞具有可以包绕相应纤维形成髓鞘的功能。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!