催化长侧链芳香族胺与2-酮丁酸合成L-2-氨基丁酸的方法
催化长侧链芳香族胺与2
‑
酮丁酸合成l
‑2‑
氨基丁酸的方法
技术领域
1.本发明属于酶工程技术领域,尤其涉及一种催化长侧链芳香族胺与2
‑
酮丁酸合成l
‑2‑
氨基丁酸的方法。
背景技术:
2.手性胺化合物是一类重要的医药中间体,具有较高的科研和开发价值。手性胺l
‑2‑
氨基丁酸作为非天然氨基酸,是医药领域多种具有价值的化合物的手性前体,包括抗惊厥药物布瓦西坦和左乙拉西坦,以及用于结核病治疗的乙胺丁醇等。合成l
‑2‑
氨基丁酸的方法有很多,化学法反应条件苛刻、成本高昂、路线复杂。生物法进行催化合成或拆分相对于上述化学法具有明显优势,绿色环保,底物廉价,反应温和,选择性高。
3.ω
‑
转氨酶(ω
‑
transaminase,ec 2.6.1.x)是一类5
’‑
磷酸吡哆醛依赖性酶,能介导酮的不对称还原胺化或手性胺动力学拆分。该酶相对于胺氧化还原酶,具有选择性高,无需辅因子,高芳香族胺活性的优点。最早的转氨酶于上个世纪中旬被发现,直至上世纪末在手性体研究方面出现了重大的进展,如今ω
‑
转氨酶在不对称合成手性胺方面研究发挥了重要作用。该酶最早在河流弧菌中发现并筛选而来,后逐渐被发现存在人苍白杆菌、节杆菌、紫色杆菌中等,并且研究充分且具有代表性。
4.非杆菌来源的ω
‑
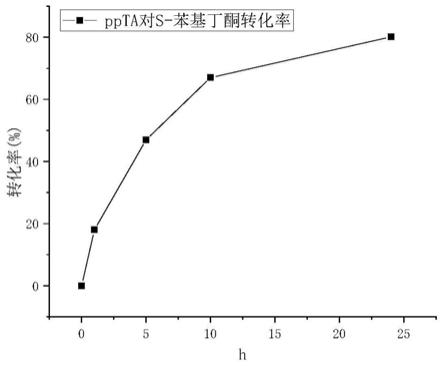
转氨酶报道较少,并且活性与应用远不如杆菌来源的酶。但是杆菌来源ω
‑
转氨酶具有强烈底物抑制,以及底物适用性低,尤其涉及大于两个c的长侧链底物时毫无活性。
技术实现要素:
5.为解决上述问题,本发明利用基因挖掘的便利性,找到非杆菌来源的酶活高,稳定性强,底物耐受性好的ω
‑
转氨酶,并用于制备l
‑2‑
氨基丁酸,在利用无论是芳香族胺—苄胺,还是长侧链芳香族胺
‑‑
s
‑
苯基丁胺,在合成l
‑2‑
氨基丁酸方面有巨大潜力,在生物医药领域有较大的应用前景。
6.本发明的第一个目的是提供一种催化芳香族长链胺与2
‑
酮丁酸合成l
‑2‑
氨基丁酸的方法,包括采用氨基酸序列如seq id no.1所示的ω
‑
转氨酶作为催化剂催化芳香族长链胺与2
‑
酮丁酸合成l
‑2‑
氨基丁酸。
7.进一步地,编码所述的ω
‑
转氨酶的基因的核苷酸序列如seq id no.2所示。
8.进一步地,催化反应的体系包括:1~5u/ml的ω
‑
转氨酶、5~15mm芳香族长链胺与5~15mm 2
‑
酮丁酸。
9.进一步地,催化反应的条件是在25~40℃、ph 7~8条件下搅拌反应。
10.进一步地,催化反应通过加酸进行终止反应。
11.进一步地,所述的ω
‑
转氨酶通过如下方法进行制备:
12.(1)将核苷酸序列如seq id no.2所示的ω
‑
转氨酶编码基因与质粒连接后转入宿主菌中,得到表达ω
‑
转氨酶的重组菌;
13.(2)采用步骤(1)构建的重组菌诱导发酵生产得到含有ω
‑
转氨酶的发酵粗酶液;
14.(3)将步骤(2)的发酵粗酶液进行纯化得到ω
‑
转氨酶。
15.进一步地,所述的宿主菌为大肠杆菌。
16.进一步地,所述的质粒为pet28a(+)。
17.进一步地,所述的诱导发酵是在发酵至od为0.5~0.7时,加入iptg在15~18℃进行低温诱导产酶。
18.进一步地,所述的纯化包括采用镍离子亲和层析柱上样,咪唑作为流动相进行梯度洗脱;洗脱液经g25脱盐柱脱盐后超滤浓缩。
19.借由上述方案,本发明至少具有以下优点:
20.本发明筛选得到的ω
‑
转氨酶,用于制备l
‑2‑
氨基丁酸,该ω
‑
转氨酶ppta在利用无论是芳香族胺—苄胺,还是长侧链芳香族胺
‑‑
s
‑
苯基丁胺,在合成l
‑2‑
氨基丁酸方面有巨大潜力,在生物医药领域有较大的应用前景。
21.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细说明如后。
附图说明
22.图1为7种理论表达ω
‑
转氨酶蛋白的基因工程菌粗酶液sds
‑
page电泳图。
23.图2为ω
‑
转氨酶纯化sds
‑
page电泳图。
24.图3为ω
‑
转氨酶的最适温度以及在相应条件下的稳定性。
25.图4为ω
‑
转氨酶的最适ph以及在相应条件下的稳定性。
26.图5为ω
‑
转氨酶在4℃下的一阶指数衰减函数图。
27.图6为ω
‑
转氨酶在金属离子影响下的活性。
28.图7为ω
‑
转氨酶利用苄胺参与合成l
‑2‑
氨基丁酸的hplc检测结果。
29.图8为ω
‑
转氨酶利用长侧链胺合成l
‑2‑
氨基丁酸的结果。
具体实施方式
30.实施例1:
31.根据已报道的高活性来源ω
‑
转氨酶氨基酸序列为探针,在ncbi蛋白数据库中进行同源比对,经过blast选择氨基端序列一致性范围在20%
‑
100%之间的19个理论氨基酸序列。经氨基酸关键序列分析,复筛7个候选的理论ω
‑
转氨酶序列。见下表1。
32.表1
[0033][0034]
实施例2:
[0035]
本实施例说明ω
‑
转氨酶编码基因的克隆方法。引入见表2。设计50μl的pcr反应体系,反应体系中加入25μl 2 x es taq mastermix、2μl的上下游引物、1μl全基因组模板以及20μl无菌水。pcr反应条件为95℃预变性5min后开始30轮循环:95℃变性15秒,55℃退火15秒,72℃延申25秒。最后终延伸5min。pcr产物进行电泳鉴定以决定采取胶回收片段或产物纯化片段。纯化后进行ta克隆至pmd18
‑
t载体。利用cacl2法热激转化至大肠杆菌e.coli jm109。经过菌p验证转化子与提取质粒双酶切验证,测序验证。
[0036]
表2
[0037][0038]
实施例3:
[0039]
本实施例说明产ω
‑
转氨酶基因工程菌的构建与产酶分析。将验证正确的目的基因片段与质粒pet28a(+)都进行双酶切,片段回收纯化后用t4连接酶16℃过夜连接,利用cacl2法热激转化至大肠杆菌e.coli bl21(de3)。经过菌p验证转化子与提取质粒双酶切验证。选择正确的产ω
‑
转氨酶的菌株bl21(de3)(pet28a
‑
ta)于37℃lb抗性培养基中培养至od=0.6时,加入0.1mm终浓度iptg并于16℃低温诱导12h。低温高速离心收集菌体细胞并用pbs缓冲液清洗三次,至于高压匀浆机破壁,收集破碎液低温高速离心,上清过0.22μm水膜得粗酶样品。粗酶上样sds
‑
page进行蛋白分析,取5μl酶液于15μl蛋白上样缓冲液,沸水浴10min离心。根据蛋白胶制作说明书浓度配制分离胶与浓缩胶。待凝固后上样电泳即可。电泳完毕加入考马斯亮蓝r250染色30min,用水过夜脱色即可。观察表达情况,见图1。结合酶活检测筛选最适合的ω
‑
转氨酶。酶活定义为1min催化10mm底物(苄胺+2
‑
酮丁酸)形成1μmol产物所需的酶量。
[0040]
实施例4:
[0041]
本实施例说明产ω
‑
转氨酶基因工程菌的表征。取发酵破碎液,经膜过滤后上样至ni
‑
nta亲和层析柱,用低浓度咪唑(20mm)冲洗杂蛋白,再利用咪唑溶液以3.0ml
·
min
‑1的浓度从20mm至500mm进行梯度洗脱,出峰收集洗脱液。在洗脱液中加入足量plp上样至g
‑
25脱盐柱中,pbs缓冲液洗脱至出峰收集,超滤浓缩即得纯酶液,见图2。收集的纯ω
‑
转氨酶的表征步骤见发明内容对应部分,见图3与图4,低温时酶活性随着温度上升变化不大,在37℃左右酶活达到最大,之后随着温度继续上升,酶活迅速下降。同样ppta的温度稳定性随着温度的上升持续下降,在小于35℃培养2h依旧可以保持80%活性;ppta的最适ph是9,与其他大部分ω
‑
转氨酶一样喜碱厌酸,但是考察其ph稳定性发现,在ph=7左右酶可以保持很强的稳定性,而不是其最适ph处,因此进行长时间催化时选择的ph应当选择ph=8左右。测量该酶的稳定性时,将加入plp与未加入两组样品一起置于4℃贮存,每隔一段时间取出置于30℃复苏30min进行检测,根据一阶指数衰减函数(公式1)和失活半衰期公式(公式2)计算出
ppta在不同条件下的失活速率常数(k
d
)和半衰期(t
1/2
)。见图5,可知ppta有plp存在下半衰期高达1650h。
[0042][0043][0044]
测量金属离子的影响时,先配制200mm fe
2+
、fe
3+
、k
+
、cu
2+
、mg
2+
、ca
2+
、na
+
、zn
2+
的母液,在反应体系中加入适量的母液配置成终浓度1mm或10mm。按照酶活测量方法检测酶活即可。结果见图6,高浓度的na
+
与fe
2+
对酶活有积极的正向作用,而金属离子螯合剂,高浓度cu
2+
和低浓度fe离子有抑制效果,因此在进行催化时加入适量的na
+
是必需的。
[0045]
实施例5:
[0046]
表3 ppta的氨基供体
[0047][0048]
注:[a]以2
‑
酮丁酸为氨基受体,底物浓度20mm;[b]初始反应速率为43μm
·
min
‑1;[c]n.r.:not reactive(或者反应活性<1%).
[0049]
本实施例说明该新型ω
‑
转氨酶进行l
‑2‑
氨基丁酸合成试验。当采用苄胺作为氨基供体,反应体系10ml,由0.01m ph7.5的pbs缓冲液配制而成的10mm苄胺与2
‑
酮丁酸组成底物,加入终浓度2u/ml的ω
‑
转氨酶作为催化剂。在180rpm、30℃条件下反应,间或取样加入10%体积的1m hcl终止反应,通过hplc检测产物产量。如图7所示,在0.5h后反应放缓,4h最终完成87%的产率,ee值大于99%。当采用大于乙烷的侧链氨基供体进行反应时,以s
‑
苯基丁胺为例,反应体系10ml,由0.01m ph7.5的pbs缓冲液配制而成的10mm s
‑
苯基丁胺与2
‑
酮丁酸为底物,加入终浓度10u/ml的ppta作为催化剂,如图8所示,反应24h后,产率大于80%,ee值大于99%。而文献研究中杆火热的人苍白杆菌来源ω
‑
转氨酶几乎无反应,产率小于1%。说明该ω
‑
转氨酶ppta在利用无论是研究火热的芳香族胺—苄胺,还是长侧链芳香族胺
‑‑
s
‑
苯基丁胺,在合成l
‑2‑
氨基丁酸方面有巨大潜力,在生物医药领域有较大的应用前景。
[0050]
以上仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1