用于可逆加成-断裂链转移RAFT聚合的α,ω-型链转移剂及其制备方法和应用与流程
本发明涉及高分子合成技术领域,尤其是涉及一种用于可逆加成-断裂链转移raft聚合的α,ω-型链转移剂及其制备方法和应用。
背景技术:
上世纪九十年代以来,基于对自由基聚合的深入理解,多种类型的“活性”/可控自由基聚合体系被相继发明出来。其中应用最为广泛的有三种:a)稳定自由基聚合(sfrp);b)原子转移自由基聚合(atrp);c)可逆加成-断裂链转移(raft)自由基聚合。这三种可控自由基聚合都是通过在聚合物链端的活性种和休眠种之间建立可逆的动态平衡,使聚合体系中的自由基稳定维持在一个较低的浓度,从而实现对聚合反应的有效控制。由于raft聚合在各种条件下的普适性以及对于各种单体都具有很好的控制性,它已成为多功能、复杂结构聚合物材料的主要制备方法之一。此外,通过raft聚合获得的聚合物仍具有链转移剂(chaintransferagent,cta)的部分功能基团,可方便地进行后修饰反应。这也使得raft在表面修饰、大分子药物、以及无机纳米粒子复合材料制备等领域越来越受到关注,有望在未来应用于有机光电材料、智能材料、生物制药等新兴产业。
raft试剂对于反应速率和生成物分子量的控制有着至关重要的影响。因此,设计合理的cta结构便成为raft聚合成功的关键。一般来说,一个有效的raft试剂应具有以下特点:(1)有一个能够有效地与自由基发生加成反应的碳硫双键;(2)中间体能发生快速裂解生成带有自由基的增长链,并且这个过程中没有副反应;(3)离去基团r可以有效活化,引发链增长。但是,只满足这三个特点并不能保证cta能够适合所有的单体进行raft聚合,实际上不同的单体对于同一种cta加成速率相差很大。另外,使用α,ω-型链转移剂可以高效制备遥爪功能聚合物,在学术和应用中极富价值。然而,合成α,ω-型链转移剂所需步骤多、三硫代酯本身稳定性不好,这些均造成α,ω-型链转移剂在制备上极富挑战性。这就需要我们合理设计反应,才能将不同官能团引入cta,得到新型α,ω-型链转移剂,为后继探究α,ω-型链转移剂是否与能够与单体匹配并开发新型遥爪功能高分子奠定基础。
技术实现要素:
本发明的目的是提供一种用于可逆加成-断裂链转移聚合的α,ω-型链转移剂及其制备方法和应用,解决目前难以制备具有规整结构且链两端带有不同官能团的高分子链转移剂的技术问题。
为了达到上述目的,本发明提供如下技术方案:
一种用于可逆加成-断裂链转移raft聚合的α,ω-型链转移剂,该链转移剂的结构如式(i)所示:
式(i),
其中,r1、r2分别为c1-c18的烷基、聚乙二醇结构和芳基中的至少一种;r3为含羟基、1,3-酮酸酯、羧基、氨基、苯甲酸衍生物中的任意一种。
进一步地,所述链转移剂的结构式为以下式(ii)-式(viii)中的任意一个:
式(ii);
式(iii);
式(iv);
式(v);
式(vi);
式(vii);
式(viii)。
本发明还提供一种用于可逆加成-断裂链转移raft聚合的α,ω-型链转移剂的制备方法,包括如下步骤:
(1)以2-(2-(2-氯乙氧基)乙氧基)乙醇,对羟基苯甲醛为原料,在碳酸钾和碘化钠的作用下得到2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙醇;
(2)2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙醇在三乙胺的作用下与2-溴丙酰溴反应得到2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙基2-溴丙烷;
(3)2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙基2-溴丙烷与巯基己醇、巯基乙酸、巯基丙酸中的任意一个,以及二硫化碳反应的产物在氢氧化钠溶液中反应,最终得到含有醛基和末端含有羟基或羧基的链转移剂。
进一步地,所述含有醛基和末端含有羟基或羧基的链转移剂中的所述醛基包括芳香醛基或脂肪醛基。
进一步地,含有醛基和末端含有羟基的链转移剂分别与双乙烯酮、或对苯二甲酸、或邻苯二甲酸酐、或氨基乙酸、或氨基苯乙酸反应,得到含有醛基和末端含有羟基、或双酮、或羧基、或氨基的链转移剂。
进一步地,所述氨基乙酸和氨基苯乙酸分别为带boc保护基团的boc-氨基乙酸和boc-氨基苯乙酸。
进一步地,步骤(1)中,将2-(2-(2-氯乙氧基)乙氧基)乙醇、对羟基苯甲醛、碳酸钾和碘化钠溶解在dmf溶液中,100℃充分反应后冷却萃取,再经过干燥后去除萃取液,分离得到2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙醇。
进一步地,步骤(2)中,将2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙醇和三乙胺溶于四氢呋喃中,冰浴下,将2-溴丙酰溴滴加至反应液中,反应完成后除去四氢呋喃,分离得到2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙基2-溴丙烷。
进一步地,步骤(3)中,先将巯基己醇、巯基乙酸、巯基丙酸中的任意一个与氢氧化钠溶液混合反应,再加入二硫化碳后继续反应,最后缓慢滴加2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙基2-溴丙烷,反应后得到含有醛基和末端含有羟基或羧基的链转移剂。
本发明还提供一种如上述的用于可逆加成-断裂链转移raft聚合的α,ω-型链转移剂在功能性高分子合成中的应用。
本发明的一种用于可逆加成-断裂链转移raft聚合的α,ω-型链转移剂及其制备方法和应用,其有益效果在于:
(1)本发明提供了合成不同用于可逆加成-断裂链转移聚合的α,ω-型链转移剂的制备方法,这些链转移剂均具有商业应用价值;
(2)这一系列链转移剂可用于高效制备结构规整、两端带有不同官能团的聚合物,具有学术和应用前景;
(3)这类聚合物在研究高分子聚集状态、组装结构、生物应用领域具有较高价值。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
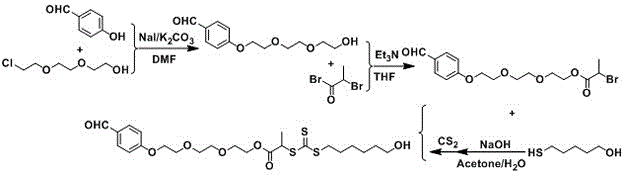
图1为本发明实施例1中一端为醛基一端为羟基结构的链转移剂的合成路线图;
图2为本发明实施例2中一端为醛基一端为羧基结构的链转移剂的合成路线图;
图3为本发明实施例3中一端为醛基一端为苯甲酸基结构的链转移剂的合成路线图;
图4为本发明实施例4中一端为醛基一端为β-二酮结构结构的链转移剂的合成路线图;
图5为本发明实施例5中一端为醛基一端为氨基结构的链转移剂的合成路线图。
具体实施方式
下面将结合本发明的附图,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明的一种用于可逆加成-断裂链转移raft聚合的α,ω-型链转移剂,该链转移剂的结构如式(i)所示:
其中,r1、r2分别为c1-c18的烷基、聚乙二醇结构和芳基中的至少一种;r3为含羟基、1,3-酮酸酯、羧基、氨基、苯甲酸衍生物中的任意一种。
本发明中的用于可逆加成-断裂链转移raft聚合的α,ω-型链转移剂的制备方法,包括如下步骤:
(1)以2-(2-(2-氯乙氧基)乙氧基)乙醇,对羟基苯甲醛为使用原料,在碳酸钾和碘化钠的作用下得到2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙醇;
(2)2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙醇在三乙胺的作用下与2-溴丙酰溴反应得到2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙基2-溴丙烷;
(3)2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙基2-溴丙烷与巯基己醇、巯基乙酸、巯基丙酸中的任意一个,以及二硫化碳反应的产物在氢氧化钠溶液中反应,最终得到含有醛基和末端含有羟基或羧基的链转移剂。
接下来,以具体实施例对本发明做进一步说明。
实施例1、制备一端为醛基一端为羟基结构的raft试剂:
按照图1中的合成路线图制备含有醛基和末端是羟基的raft试剂具体步骤如下:
1)2-(2-(2-氯乙氧基)乙氧基)乙醇(0.2mol),对羟基苯甲醛(0.2mol),碳酸钾(0.4mol)和碘化钠(0.2mol)溶解在200mldmf(二甲基甲酰胺)中,于100℃反应24小时。冷却至室温后,加入去离子水,以乙酸乙酯进行萃取。收集有机相,经硫酸镁干燥后旋转蒸发除去乙酸乙酯,随后通过硅胶柱色谱进行分离(乙酸乙酯/石油醚,体积比:1/4),得淡黄色液体30.6g,产率60%。
2)2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙醇(0.12mol)和三乙胺(0.12mol)溶于100ml四氢呋喃中,冰浴下,将2-溴丙酰溴(0.12mol)滴加至反应瓶中。滴加完成后继续反应12h。反应完成后,旋转蒸发除去thf(四氢呋喃),随后通过硅胶柱色谱进行分离(乙酸乙酯/石油醚,1:4),得到无色有液体42.1g,产率90%。
3)巯基己醇(0.1mol)和氢氧化钠(0.1mol)溶解在100ml丙酮/水的混合液中(体积比:1/1),室温下(25℃)反应10分钟。然后,加入二硫化碳(0.15mol)。二硫化碳加入时,溶液颜色快速由无色变为黄色。反应进行2h后缓滴加2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙基2-溴丙烷(0.1mol)。然后再进行6小时的反应,然后用旋转蒸发除去反应中的丙酮,再用乙酸乙酯萃取产物。用硫酸镁对有机相进行干燥。经柱色谱法(石油醚乙酸乙酯1:1)纯化后,得到粘稠黄色液体46g,产率90%。
1hnmr(400mhz,dmso-d6)δ9.87(s,1h),7.86(d,j=8.7hz,2h),7.13(d,j=8.7hz,2h),4.74(q,j=7.3hz,1h),4.31(t,j=5.1hz,1h),4.21(dd,j=9.3,4.9hz,4h),3.82–3.75(m,2h),3.59(m,6h),3.40–3.33(m,4h),1.62(m,2h),1.51(d,j=7.3hz,3h),1.43–1.21(m,7h).
实施例2、制备一端为醛基一端为脂肪酸结构的raft试剂:
按照图2中的合成路线图制备含有醛基末端为羧基结构的raft试剂,具体步骤如下:步骤(1)和(2)同实施例1,步骤(3)中,巯基丙酸(10mmol)和氢氧化钠(10mmol)溶解在10ml丙酮/水的混合液中(v/v,1/1),室温下(25℃)反应10分钟。然后,加入二硫化碳(15mmol)。二硫化碳加入时,溶液颜色快速由无色变为黄色。反应进行2h后缓滴加2-(2-(2-(4-甲酰基苯氧基)乙氧基)乙氧基)乙基2-溴丙烷(10mmol)。然后再进行6小时的反应,然后用旋转蒸发除去反应中的丙酮,再用乙酸乙酯萃取产物。用硫酸镁对有机相进行干燥。经柱色谱法(石油醚乙酸乙酯1:1)纯化后,得到粘稠黄色液体3.9g,产率80%。
1hnmr(400mhz,dmso-d6)δ9.82(s,1h),7.82(d,j=8.6hz,2h),7.09(d,j=8.6hz,2h),4.68(q,j=7.3hz,1h),4.21(d,j=4.6hz,2h),4.16(m,4h),3.98(q,j=7.1hz,1h),3.76–3.70(m,2h),3.59–3.50(m,7h),1.48(d,j=7.3hz,3h).
实施例3、制备一端为醛基一端为苯甲酸基团的raft试剂:
按照图3中的合成路线图制备苯甲酸基团的raft试剂,具体步骤如下:将实施例1中得到的一端为醛基一端为羟基结构的raft试剂(10mmol)与三乙胺(15mmol)溶于20ml甲苯中,然后,加入邻苯二甲酸酐(11mmol)于80℃下加热回流8h,经柱色谱法(石油醚乙酸乙酯1:1)纯化后,得到粘稠黄色液体4.2g,产率63%。
1hnmr(300mhz,dmso-d6)δ12.76(s,1h),9.85(s,1h),7.84(d,j=8.7hz,2h),7.76–7.59(m,4h),7.11(d,j=8.7hz,2h),4.72(q,j=7.2hz,1h),4.17(t,j=6.1hz,6h),3.80–3.72(m,2h),3.65–3.51(m,6h),1.70–1.56(m,4h),1.49(d,j=7.2hz,3h),1.35(m,4h),1.22(m,2h).
实施例4、制备一端为醛基一端为双酮结构的raft试剂:
按照图4中的合成路线图制备含有醛基和β-二酮结构的raft试剂,具体步骤如下:将实施例1中得到的含有醛基和羟基结构的raft试剂(10mmol)与三乙胺(15mmol)溶于20ml二氯甲烷中,然后,冰浴下,滴加双乙烯酮(11mmol)于40℃下加热回流8h。经柱色谱法(石油醚乙酸乙酯1:1)纯化后,得到粘稠黄色液体4.8g,产率80%。
1hnmr(400mhz,dmso-d6)δ9.82(s,1h),7.80(d,2h,j=8.0hz),7.08(d,2h,j=8.0hz),4.69(q,1h,j=8.0hz),4.17(m,4h),4.07(t,2h),3.73(t,2h),3.64-3.45(m,6h),3.38(t,2h,),3.32(s,2h),2.14(s,3h),1.90(m,2h),1.47(d,3h,j=8.0hz).
实施例5、制备一端为醛基一端为氨基结构的raft试剂:
按照图5中的合成路线图制备一端为醛基一端为氨基结构的raft试剂,具体步骤如下:1)将实施例1中得到的含有醛基和羟基结构的raft试剂(10mmol)与boc保护的对氨基苯乙酸(10mmol)溶于20ml二氯甲烷中;然后,在冰浴下,加入edc盐酸盐(11mmol);加完后室温反应2h。反应完毕后加入去离子水20ml,二氯甲烷萃取,食盐水洗涤。旋蒸得到黄色液体。
1hnmr(400mhz,dmso-d6)δ9.82(s,1h),9.25(s,1h),7.81(d,j=8.7hz,2h),7.34(d,j=8.3hz,2h),7.08(dd,j=8.6,3.3hz,4h),4.70(q,j=7.3hz,1h),4.21–4.13(m,4h),3.94(t,j=6.5hz,2h),3.76–3.70(m,2h),3.54(ddd,j=14.3,7.7,4.3hz,8h),3.34(dd,j=14.1,7.1hz,5h),3.13(d,j=5.3hz,1h),1.59–1.52(m,2h),1.52–1.44(m,2h),1.47(d,j=7.3hz,3h),1.42(s,9h),1.05(t,j=7.0hz,3h).
2)将1)得到的黄色液体加入20ml三氟乙酸/二氯甲烷的混合液(v/v,1/1),加热回流2h。反应完成后旋蒸出去溶剂,经柱色谱法(石油醚乙酸乙酯1:1)纯化后,得到粘稠黄色液体4.6g,产率68%。
1hnmr(400mhz,dmso-d6)δ9.83(s,1h),8.20(s,2h),7.82(d,j=8.7hz,2h),7.21(d,j=7.4hz,2h),7.13(d,j=7.3hz,2h),7.09(d,j=8.7hz,2h),4.70(q,j=7.3hz,1h),4.17(m,j=,4h),4.10(t,j=6.5hz,2h),3.84–3.70(m,4h),3.55(m,6h),3.32(t,j=7.3hz,1h),2.26(s,2h),1.68–1.51(m,4h),1.49(t,j=13.3hz,3h).
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应所述以权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!