doc2α和doc2β基因缺失斑马鱼突变体的制备及斑马鱼自闭症模型的构建方法
本发明涉及基因工程技术领域,尤其是涉及一种doc2α和doc2β基因缺失斑马鱼突变体的制备及斑马鱼自闭症模型的构建方法。
背景技术:
自闭症谱系障碍(autismspectrumdisorder,asd)是一种中枢神经系统发育障碍性疾病,是儿童神经发育障碍中最为严重的疾病之一。根据世界卫生组织icd-10自闭症的诊断标准,自闭症病人的临床表现主要为语言障碍,社交活动障碍,以及伴有局限的、重复性的刻板行为,感觉系统异常,部分患者存在明显的特定兴趣,智力超常或低下,约3/4的病例有显著的精神发育迟滞等。患者一般在3岁时出现疾病症状,7岁前为最佳的训练康复时期,目前尚有许多家庭缺乏对自闭症的疾病认识,导致自闭症患者未得到足够的重视,错过了最佳的康复治疗期,疾病将很大可能伴随终生。在全球,自闭症患病率约为0.6%-3.7%,患者终生需要干预治疗,给自闭症患者和家庭带来巨大的精神压力和经济负担,该疾病已成为一个严重的公共卫生问题,建立一个自闭症动物模型,明确更多自闭症的发病机制和获得药物进行靶向治疗是医学研究中亟待解决的问题。
目前已有多项临床和基础研究用于研究自闭症的发病机理,如在小鼠和斑马鱼中敲除自闭症相关基因,利用重金属处理动物或注射一些可能的发病药物进而使其产生人类自闭症样疾病表型。例如近期一项研究显示研究人员使实验鼠的chd8基因出现和人类自闭症患者一样的变异,该小鼠则出现类似自闭症病症;在斑马鱼中,xu等敲除shank3b基因进而产生类似自闭症表型。
斑马鱼(zebrafish,daniorerio)作为一种新兴模式生物,已被广泛应用在医学科学研究中。斑马鱼可应用于建立多种疾病模型,包括神经系统疾病模型,心血管系统疾病模型,免疫疾病和感染模型,肿瘤疾病模型,血液系统疾病模型等多个疾病研究领域。斑马鱼具有独特的生物学特征,使其成为一种非常重要的发育生物学模式动物:(1)斑马鱼成鱼体积小,性成熟的周期短,相比小鼠可大大缩短实验周期;(2)斑马鱼胚胎在早期发育时期透明,可通过组织特异性表达基因荧光追踪其各个器官发育过程;(3)繁殖能力很强,可获得大量胚胎,胚胎在体外发育迅速,小分子化合物渗透性强,可用于大规模疾病表型和药物筛选使用;(4)目前已完成斑马鱼的全基因组的测序,基因组与人类基因组高度保守,与人类参考基因组的比较表明,大约70%的人类基因在斑马鱼中都具有直系同源基因;(5)与其他实验生物小鼠和细胞进行药物筛选而耗时长、成本高缺点相比,利用斑马鱼进行药物筛选的给药方法更方便,具有耗时短、高通量、低成本的优点,可进行大规模疾病模型的建立和药物实验,更能比较准确的评估药物效果以及药物毒性。1-2周龄的斑马鱼脑含有数万个神经元,已具有成年动物的多种复杂行为模式和脑功能。斑马鱼生物习性好动,可接收多种外界感觉信息,具有捕食猎物、逃避天敌以及群聚生活等丰富的行为,可进行群聚和社交行为研究;同时,斑马鱼可产生自闭症的大部分临床指症,除了不能进行语言沟通外,斑马鱼具有类似人类的行为学特征,患有自闭症样疾病的斑马鱼可能出现社会交流行为削弱、存在防御行为、感知行为缺陷、焦虑、兴奋异常等异常表征。因此,斑马鱼已广泛应用于自闭症、精神分裂症、帕金森病、舞蹈病等神经精神系统疾病的机制研究中。斑马鱼成为研究自闭症疾病和进行活体高通量药物筛选理想的模式动物。
然而现有技术一般是通过在小鼠中单一敲除某一自闭症相关的发病基因,来建立自闭症模型;(1)仅仅敲除某一单一基因来进行自闭症发病机制研究并不全面,同时利用小鼠建立自闭症模型资金消耗多,实验周期长,繁殖过程繁琐,不能进行高通量的药物筛选。(2)利用重金属处理或注射药物不能从遗传学上建立稳定遗传品系,有很多未知不确定因素影响模型的建立,发病机制研究不系统,每次进行研究都要重新建模,实验过程复杂并伴有不稳定因素,造成建模不稳定,更不适用于高通量药物筛选。(3)目前在斑马鱼中建立自闭症模型的研究还相对较少,已有研究只是单独敲除某一个基因,并不是将基因家族都敲除,进而研究某个基因在自闭症中的发病机制不系统。
技术实现要素:
本发明的目的在于克服上述现有技术的不足之处而提供一种doc2α和doc2β基因缺失斑马鱼突变体的制备及斑马鱼自闭症模型的构建方法,本发明利用crispr/cas9技术,在斑马鱼中敲除doc2α和doc2β两个基因,建立doc2α和doc2β基因缺失斑马鱼(命名为双基因突变体doc2αm/mdoc2βm/m)。
本发明的第一方面,提供了一种靶向斑马鱼doc2α基因和doc2β基因的sgrna,所述靶向斑马鱼doc2α基因sgrna的序列包括seqidno:1所示的核苷酸序列,所述靶向斑马鱼doc2β基因sgrna的序列包括seqidno:2所示的核苷酸序列。
本发明的第二方面,提供了一种doc2α和doc2β基因缺失斑马鱼突变体的制备方法,包括以下步骤:
1)设计并合成doc2α基因和doc2β基因靶位点的sgrna序列,所述doc2α基因靶位点的sgrna序列包括seqidno:1所示的核苷酸序列,所述doc2β基因靶位点的sgrna序列包括seqidno:2所示的核苷酸序列;
2)分别将doc2α基因和doc2β基因靶位点的sgrna序列和cas9蛋白共同注射到野生型斑马鱼胚胎单细胞中,通过鉴定、筛选和培养获得稳定遗传的doc2α和doc2β双基因缺失斑马鱼突变体。
本发明利用crispr/cas9技术敲除doc2α基因和doc2β基因靶位点的sgrna序列,设计并合成doc2α基因和doc2β基因靶位点的sgrna序列,设计原则如下:①靶点设计区域尽量选择在外显子区域或者是内含子和外显子的交界处,以破坏基因的剪接,最好破坏保守功能区;②靶点长度最适为20个碱基,长度最好不要超过23bp。紧邻靶点3’端的3个碱基构成pam区,要求序列为ngg(n为任意碱基),可在正义链或反义链上选择靶位点;③靶点需进行特异性检测,需确认此序列为斑马鱼基因组中单一位点;④设计检测靶点效率用引物,每个基因可选6-8条待做显微注射实验的野生型斑马鱼进行剪尾测序,检测靶向序列部位的单核苷酸多态性(single-nucleotidepolymorphism,snp)情况。
作为本发明所述制备方法的优选实施方式,所述doc2α基因靶位点的位置为第一外显子区,所述doc2β基因靶位点的位置为第3外显子区。
本发明的第三方面,提供了一种斑马鱼自闭症模型的构建方法,包括以下步骤:
s1.分别将doc2α基因和doc2β基因靶位点的sgrna序列和cas9蛋白共同注射到野生型斑马鱼胚胎单细胞中,得到嵌合体f0代doc2α基因缺失的斑马鱼和doc2β基因缺失的斑马鱼;
s2.将嵌合体f0代doc2α基因缺失的斑马鱼和doc2β基因缺失的斑马鱼分别与野生型斑马鱼杂交,得到f1代doc2α基因缺失的杂合型斑马鱼doc2α+/m和doc2β基因缺失的杂合型斑马鱼doc2β+/m;
s3.将得到的f1代doc2α基因缺失的杂合型斑马鱼doc2α+/m和得到的f1代doc2β基因缺失的杂合型斑马鱼doc2β+/m进行杂交得到双基因杂合品系doc2α+/mdoc2β+/m斑马鱼;
s4.将得到的双基因杂合品系doc2α+/mdoc2β+/m斑马鱼进行自交,得doc2α和doc2β基因缺失斑马鱼。
在本发明的技术方案中,分别筛选具有突变的嵌合体f0代doc2α基因缺失的斑马鱼和doc2β基因缺失的斑马鱼养大至成年,后与野生型斑马鱼杂交,通过dna测序筛选获得f1代doc2α基因缺失的杂合型斑马鱼doc2α+/m(命名为doc2α(-7+0)突变体)和doc2β基因缺失的杂合型斑马鱼doc2β+/m(命名为doc2β(-8+0)突变体),然后两者杂交产生双基因杂合品系doc2α和doc2β斑马鱼,进而自交筛选产生doc2α和doc2β基因缺失斑马鱼(命名为双基因突变体doc2αm/mdoc2βm/m)。
本发明利用新型模式生物斑马鱼建立人类自闭症模型,具有突出的技术优势:a.斑马鱼成鱼体积小,性成熟的周期短,相比小鼠可大大缩短实验周期;b.斑马鱼胚胎在早期发育时期透明,可通过组织特异性表达基因荧光追踪其各个器官发育过程;c.繁殖能力很强,可获得大量胚胎,胚胎在体外发育迅速,小分子化合物渗透性强,可用于大规模疾病表型和药物筛选使用;d.与其他实验生物小鼠和细胞进行药物筛选而耗时长、成本高缺点相比,利用斑马鱼进行药物筛选的给药方法更方便,具有耗时短、高通量、低成本的优点,可进行大规模疾病模型的建立和药物实验,更能比较准确的评估药物效果以及药物毒性。
利用crispr/cas9技术进行靶向基因敲除,形成可以稳定遗传的突变体品系,与利用重金属或药物建立模型相比时间周期更快更准确。
相比于其他研究只敲除一个基因相比,在斑马鱼中同时敲除doc2家族两个基因,模型建立更稳定,机制研究正准确。
本发明的第四方面,提供了一种筛选doc2α和doc2β基因缺失斑马鱼的引物序列,所述引物序列包括正向引物序列和反向引物序列,所述正向引物序列包括seqidno:3和seqidno:5所示的核苷酸序列,所述反向引物序列包括seqidno:4和seqidno:6所示的核苷酸序列。
本发明的第五方面,提供了一种doc2α和doc2β基因缺失斑马鱼的检测方法,采用上述引物序列筛选得到doc2α和doc2β基因缺失斑马鱼。
本发明的第六方面,提供了doc2α和doc2β基因在制备斑马鱼自闭症模型中的应用。
本发明的第六方面,提供了上述sgrna在构建doc2α基因缺失和doc2β基因缺失的斑马鱼中的应用。
本发明的第七方面,提供了上述doc2α和doc2β基因缺失斑马鱼突变体在高通量药物筛选中的应用。
与现有技术相比,本发明具有以下有益效果:
1)本发明利用crispr/cas9技术首次实现斑马鱼doc2α基因和doc2β基因的双基因特异敲除,形成可以稳定遗传的突变体品系,与利用重金属或药物建立模型相比时间周期更快更准确;
2)本发明提供了一种斑马鱼自闭症模型的构建方法,构建方法简单,构建得到的斑马鱼自闭症模型可以更高效准确的用于高通量药物筛选,更能比较准确的评估药物效果以及药物毒性。
附图说明
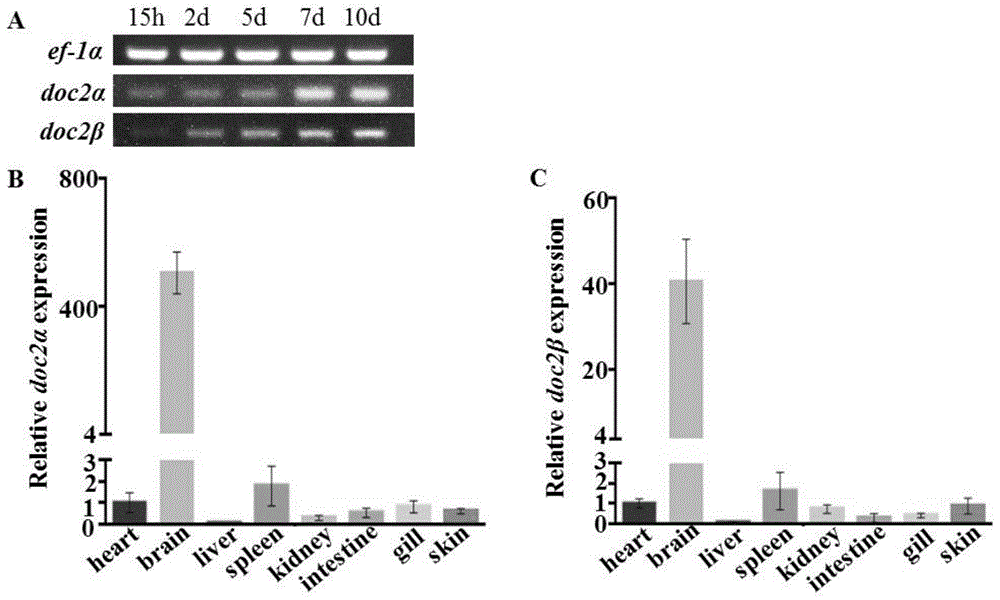
图1a为semi-q-pcr检测doc2α基因和doc2β基因在野生型斑马鱼中不同时间的表达情况图;
图1b为q-pcr检测doc2α基因在野生型斑马鱼各个器官组织中的表达情况图;
图1c为q-pcr检测doc2β基因在野生型斑马鱼各个器官组织中的表达情况图;
图2为合成的doc2α基因和doc2β基因的sgrna跑胶结果图;
图3为doc2α基因的sgrna效率检测跑胶图,白色虚线框内为未被消化片段,显示有效率;
图4为doc2β基因的sgrna效率检测跑胶图,白色虚线框内为未被消化片段,显示有效率;
图5a为斑马鱼中doc2α基因和crispr/cas9靶向作用序列图;
图5b为doc2α(-7+0)纯合突变体基因型sanger测序鉴定图谱;
图5c为斑马鱼中doc2β基因和crispr/cas9靶向作用序列图;
图5d为doc2β(-8+0)纯合突变体基因型sanger测序鉴定图谱;
图5e为doc2α(-7+0)纯合突变体和doc2β(-8+0)纯合突变体蛋白结构预测示意图;
图6a为doc2α基因和doc2β基因分别在野生型doc2α+/+doc2β+/+斑马鱼、双基因突变体doc2αm/mdoc2βm/m斑马鱼表达情况图;
图6b为doc2α+/+doc2β+/+斑马鱼、双基因突变体doc2αm/mdoc2βm/m斑马鱼的wish(whole-mountin-situhybridization,整体原位杂交)结果示意图(箭头分别指示m:midbrain中脑,mhb:midbrain-hindbrainboundary中脑和后脑连接区,h:hindbrain后脑,***p<0.001,****p<0.0001);
图6c为doc2α+/+doc2β+/+斑马鱼和双基因突变体doc2αm/mdoc2βm/m斑马鱼的形态发育示意图;
图6d为doc2α+/+doc2β+/+斑马鱼和双基因突变体doc2αm/mdoc2βm/m斑马鱼的尾巴弯曲率、畸形率和死亡率比较图(*p<0.05,**p<0.01);
图7a为doc2α+/+doc2β+/+斑马幼鱼(n=22)和双基因突变体doc2αm/mdoc2βm/m斑马幼鱼(n=20)在1h内运动距离测试结果图(**p<0.01);
图7b为doc2α+/+doc2β+/+斑马幼鱼(n=22)和双基因突变体doc2αm/mdoc2βm/m斑马幼鱼(n=20)在1h内运动速率测试结果图(**p<0.01);
图7c为doc2α+/+doc2β+/+斑马幼鱼(n=22)和双基因突变体doc2αm/mdoc2βm/m斑马幼鱼(n=20)运动示踪图;
图7d为doc2α+/+doc2β+/+斑马幼鱼(n=22)和双基因突变体doc2αm/mdoc2βm/m斑马幼鱼(n=20)在5h内运动距离测试结果图(**p<0.01);
图7e为doc2α+/+doc2β+/+斑马幼鱼(n=22)和双基因突变体doc2αm/mdoc2βm/m斑马幼鱼(n=20)在5h内运动速率测试结果图(**p<0.01);
图7f为doc2α+/+doc2β+/+斑马幼鱼(n=42)和双基因突变体doc2αm/mdoc2βm/m斑马幼鱼(n=45)灯光/黑暗敏感性唤醒刺激实验检测示意图;
图7g为doc2α+/+doc2β+/+斑马幼鱼(n=42)和双基因突变体doc2αm/mdoc2βm/m斑马幼鱼(n=45)光/黑暗敏感性唤醒刺激实验检测结果图;
图8a为双基因突变体doc2αm/mdoc2βm/m斑马鱼旷场实验示意图;
图8b为doc2α+/+doc2β+/+斑马鱼(n=16)和双基因突变体doc2αm/mdoc2βm/m斑马鱼(n=15)在10min内运动距离测试结果图(**p<0.01);
图8c为doc2α+/+doc2β+/+斑马鱼(n=16)和双基因突变体doc2αm/mdoc2βm/m斑马鱼(n=15)在10min内运动速率测试结果图(**p<0.01);
图8d为doc2α+/+doc2β+/+斑马鱼(n=16)和双基因突变体doc2αm/mdoc2βm/m斑马鱼(n=15)在10min内中心区域停留时间比较图(*p<0.05);
图8e为doc2α+/+doc2β+/+斑马鱼(n=16)和双基因突变体doc2αm/mdoc2βm/m斑马鱼(n=15)在10min内运动能力轨迹图和热图;
图9a为双基因突变体doc2αm/mdoc2βm/m斑马鱼社交趋避实验示意图;
图9b为doc2α+/+doc2β+/+斑马鱼和双基因突变体doc2αm/mdoc2βm/m斑马鱼运动轨迹热图;
图9c为doc2α+/+doc2β+/+斑马鱼(n=12)和双基因突变体doc2αm/mdoc2βm/m斑马鱼(n=10)社交趋避实验结果图(*p<0.05);
图10为doc2α+/+doc2β+/+斑马鱼(n=12)和双基因突变体doc2αm/mdoc2βm/m斑马鱼(n=10)记忆实验结果图(****p<0.0001)。
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
以下实施例中所使用的实验方法如无特殊说明,均为常规方法。
以下实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、斑马鱼doc2α基因和doc2β基因表达情况检测(1)利用半定量pcr(semi-q-pcr)检测doc2α基因和doc2β基因在野生型斑马鱼发育过程中表达情况,收集15h,2d,5d,7d,10d斑马鱼小鱼,进行mrna表达检测;结果显示,随着时间推移,基因的表达量逐渐增加(参考图1a)。(2)利用q-pcr检测doc2α基因和doc2β基因在野生型斑马鱼各组织中的表达情况,解剖并收集野生型成年斑马鱼的心脏,脑,肝脏,脾脏,肾脏,肠,鳃,皮肤,放入trizol中并提取rna,进行反转录后续进行q-pcr,以了解doc2α基因和doc2β基因在斑马鱼中的表达情况以及是否在神经组织中特异性高表达;通过q-pcr检测发现,斑马鱼doc2α和doc2β基因在脑组织中高表达(参考图1b和图1c),这与在小鼠中情况并不一致,在小鼠中,doc2a特异性在脑中表达,而doc2b是广泛性的表达在各个组织中,这说明在斑马鱼中,doc2α基因和doc2β基因的表达具有脑表达特异性。
实施例2、crispr/cas9基因敲除靶位点设计
doc2α基因和doc2β基因sgrna的靶位点(target)设计原则和合成方法如下:
一、target设计:
a.到数据库找到敲除基因的基因组dna以及cds,应在最后一个isoform的atg之后设计target,target设计在外显子区域;
b.target包含19-23bp个碱基,如果用t7启动子合成则5’端应为gga,或ggg,紧邻靶点3’端的3个碱基构成pam区,要求序列为ngg(n为任意碱基),可在正义链或反义链上选择靶位点。target应在数据库上进行blast,确保单一位点。注意:ngg不是靶位点,合成时不要加。如果不用t7引物合成,用sp6合成则第一个碱基为g,第二、三个为嘌呤碱基;
c.确定靶位点3’端有合适的酶切识别位点,应在3’端数起6bp内,可跨ngg,且保证此酶切位点在未来检测的pcr序列中酶切位点只有一个;
d.一般用t7引物合成,sp6引物效率较低;最终合成doc2α基因引物序列fp(oligo)为:t7(17bp)+doc2α靶向target+grna(guiderna),即为taatacgactcactata+cggacagacgtcta+gttttagagctagaaatagc;
合成doc2β基因引物序列fp(oligo)为:t7(17bp)+doc2β靶向target+grna(guiderna),即taatacgactcactata+ggagaagtattcggtctgct+gttttagagctagaaatagc。
e.设计检测靶点效率用引物,每个基因可选6-8条待做显微注射实验的野生型斑马鱼进行剪尾测序,检测靶向序列部位的单核苷酸多态性(single-nucleotidepolymorphism,snp)情况。若靶向序列不存在snp,则在单细胞时期,分别将两个基因的sgrna和cas9蛋白共同显微注射进入野生型斑马鱼胚胎单细胞中,1dpi(dayafterinjection,注射后天数)进行crispr/cas9效率检测。
二、pcr,切胶回收纯化
1、fpoligo
rpgrnarp序列为:5’-agcaccgactcggtgccact-3’。
pcr体系:50ul/管,体系如下:
2、pcr之后进行切胶回收纯化,20ulelute,各1ul用仪器检测浓度及跑胶测浓度。
三、转录:
1、50ul体系如下:
2、37度,反应3h,然后加2uldnase1,37度反应15-30分钟。转录之后各取0.5ul用仪器检测浓度及跑胶查看浓度。
四、sgrna纯化
1、转录体系50ul,每管加500ultrireagent;
2、vortex混匀;
3、加100ul三氯甲烷,手晃摇动,15s;
4、常温静止15分钟;
5、12000g,4度,离心15分钟;
6、小心吸取上清于另外ep管中;
7、加入250ul异丙醇(forrna),混匀,常温静止15分钟;
8、12000g,4度,离心15分钟;
9、小心去上清,加入1ml75%乙醇(indepc),震荡混匀;
10、12000g,4度,离心10分钟;
11、小心吸取上清,室温开盖子晾10min;
12、加5uldepc水;
13、各取0.5ul用仪器检测浓度及跑胶查看浓度,合成的doc2α和doc2β的sgrna跑胶结果图如图2所示。
五、显微注射
1、分别将doc2α基因sgrna(终浓度200ng/ul)、doc2β基因sgrna(终浓度200ng/ul)与cas9蛋白(neb,m0646t)共同注入斑马鱼单细胞中。
六、检测sgrna效率:
取24hpf胚胎3-20个,取基因组dna之后进行pcr,酶切,观察酶切情况,是否存在未切开条带,如存在并且未切开条带dna量多,则sgrna具有效率并且效率高,如不存在,则无效率。doc2α基因的sgrna效率检测跑胶如图3所示,f0代显示有未切开条带,具有效率:
doc2β基因的grna效率检测跑胶如图4所示,f0代显示有未切开条带,具有效率:
靶向斑马鱼doc2α基因sgrna的序列为cggacagacgtctatgg(seqidno:1),下划线处为pam区;doc2α基因靶位点的位置为第一外显子区。
靶向斑马鱼doc2β基因sgrna的序列为ggagaagtattcggtctgctggg(seqidno:2),下划线处为pam区;doc2β基因靶位点的位置为第3外显子区。
实施例3、一种斑马鱼自闭症模型的构建方法
一种斑马鱼自闭症模型的构建方法,包括以下步骤:
s1.分别将doc2α基因和doc2β基因靶位点的sgrna序列和cas9蛋白共同注射到野生型斑马鱼胚胎单细胞中,得到嵌合体f0代doc2α基因缺失的斑马鱼和doc2β基因缺失的斑马鱼;
s2.将嵌合体f0代doc2α基因缺失的斑马鱼和doc2β基因缺失的斑马鱼分别与野生型斑马鱼杂交,得到f1代doc2α基因缺失的杂合型斑马鱼doc2α+/m和doc2β基因缺失的杂合型斑马鱼doc2β+/m;
s3.将得到的f1代doc2α基因缺失的杂合型斑马鱼doc2α+/m和得到的f1代doc2β基因缺失的杂合型斑马鱼doc2β+/m进行杂交得到双基因杂合品系doc2α+/mdoc2β+/m斑马鱼;
s4.将得到的双基因杂合品系doc2α+/mdoc2β+/m斑马鱼进行自交,得doc2α和doc2β基因缺失斑马鱼。
其中筛选doc2α(-7+0)突变体、doc2β(-8+0)突变体及双基因突变体doc2αm/mdoc2βm/m所使用的引物序列和限制性内切酶如表1所示,参考图5a和图5c。
表1
检测:通过sanger测序检测到在斑马鱼中成功已敲除doc2α和doc2β基因,参考图5b和图5d,获得纯合的f2代doc2α基因缺失的斑马鱼(doc2α(-7+0)纯合突变体)和纯合的f2代doc2β基因缺失的斑马鱼(doc2β(-8+0)纯合突变体),突变后的两个基因的编码序列编码表达形成截短的蛋白质(参考图5e),这表示在双基因突变体doc2αm/mdoc2βm/m中,doc2α和doc2β基因功能可能减少或缺失。
实施例4、doc2α基因和doc2β基因在双基因突变体doc2αm/mdoc2βm/m的表达情况
通过q-pcr检测与野生型斑马鱼(称为doc2α+/+doc2β+/+)相比,在双基因突变体doc2αm/mdoc2βm/m中,doc2α和doc2β表达均明显降低(参考图6a)。
5dpf整体原位杂交显示,doc2α和doc2β基因主要原位表达在脑中,在纯合突变体中doc2α和doc2β基因表达较野生型均明显降低(参考图6b)。
通过2周内对野生型和双基因突变体doc2αm/mdoc2βm/m示踪观察发现,双基因突变体doc2αm/mdoc2βm/m发育迟缓、尾巴弯曲率、畸形率和死亡率较野生型明显增高,这表明,斑马鱼缺失doc2α和doc2β基因表达后,影响斑马鱼神经系统发育,造成形态发育异常,生存能力下降(参考图6c和图6d)。
实施例5、doc2αm/mdoc2βm/m幼鱼和成年鱼的行为学检测
1)doc2αm/mdoc2βm/m5dpf幼鱼显示类似人类自闭症疾病行为
a.自发活动能力检测:利用斑马鱼幼鱼行为分析系统(viewpointlifesciences),在96孔板中,加入200μl鱼培养液体(eggwater),将5dpf野生型斑马幼鱼doc2α+/+doc2β+/+和doc2αm/mdoc2βm/m幼鱼放入板液体中,置于培养箱内静置1h,放入分析系统机器中,记录1h内运动轨迹、运动距离和运动速度,观察doc2αm/mdoc2βm/m幼鱼期活动能力是否升高或下降,是否出现刻板行为。
结果显示,通过对双基因纯合突变体doc2αm/mdoc2βm/m幼鱼和5dpf野生型斑马幼鱼自发活动行为检测发现,doc2αm/mdoc2βm/m幼鱼在1h内(参考图7a,图7b)和5h内(图7d,图7e)运动距离和运动速率与野生型比较均下降,这表明,doc2αm/mdoc2βm/m幼鱼自发活动能力下降,有类似人类自闭症疾病的呆滞表现行为,同时其运动示踪图显示,20条doc2αm/mdoc2βm/m幼鱼中有14条(14/20)斑马鱼只在实验板孔内做绕圈运动,有类似人类自闭症疾病的重复刻板行为(参考图7c)。
b.灯光/黑暗敏感性唤醒刺激实验检测:利用斑马鱼幼鱼行为分析系统(viewpointlifesciences),在96孔板中,加入200μl鱼培养液体(eggwater),将5dpf野生型斑马幼鱼和doc2αm/mdoc2βm/m幼鱼放入板液体中,置于培养箱内静置1h,放入分析系统机器中,给予3个循环的5min黑暗刺激和5min灯光刺激,各阶段称为dark1(d1),bright1(b1),dark2(d2),bright2(b2),dark3(d3),bright3(b3),记录该刺激阶段内运动距离和运动速度,观察双基因突变体幼鱼期对灯光/黑暗交替刺激的应激活动能力是否升高或下降。结果发现,doc2αm/mdoc2βm/m幼鱼给予灯光刺激时,其敏感性比正常鱼减弱,运动能力比正常鱼相比依然减弱(参考图4f、4g(第一条线代表doc2α+/+doc2β+/+幼鱼速度改变率,第二条线代表doc2αm/mdoc2βm/m幼鱼速度改变率)),结果显示,doc2αm/mdoc2βm/m幼鱼具有类似人类自闭症疾病表型。
2.doc2αm/mdoc2βm/m5dpf成年鱼存在社交障碍,显示类似人类自闭症疾病行为
斑马鱼成鱼期:对3m(month,月)-6m的野生型斑马鱼和doc2αm/mdoc2βm/m斑马鱼进行行为学实验,所有行为学检测都在光照5-9小时内进行,所有实验开始前,先将受试鱼转移至行为学检测所用场地,并给予受试鱼30分钟时间来适应周围环境;当受试鱼适应环境后,将受试鱼轻柔且迅速地放入鱼缸内并开启摄像头,记录12分钟视频,在后来的结果分析时,前2分钟为缸内适应时间,选取第3至第12分钟共10分钟的数据进行分析。
行为学检测包括:a.旷场实验(openfield):鱼类对外界固体刺激而产生的定位反应,又称趋触性(thigmotaxis)。鱼类的趋触性是依靠鱼类的触觉来实现的。在触觉中除神经末梢外,遍布于鱼体皮肤及触须上的味蕾起着十分重要的作用。斑马鱼进入鱼缸后,由于警惕会在贴近缸四周游动。将doc2αm/mdoc2βm/m斑马鱼的运动距离、运动速度,以及在水缸边缘区域和中心区域所持续的时间与野生型斑马鱼进行对比,测试doc2αm/mdoc2βm/m斑马鱼是否出现压力和焦虑。结果显示:doc2αm/mdoc2βm/m斑马鱼运动距离和速度与野生型相比都减少,同时,在中心区域停留时间却增多,这表示,较野生型相比doc2αm/mdoc2βm/m斑马鱼趋触性降低(参考图8)。
b.社交趋避实验:(socialinteractiontest):在doc2αm/mdoc2βm/m斑马鱼的鱼缸两端各放置一个刺激缸,其中一个装有15条野生型成鱼,另一个是空的,将测试缸划分为4个相同大小的区域,最接近有鱼缸的定义为1区,依次编号,最接近空缸的定义为4区,将野生型斑马鱼和doc2αm/mdoc2βm/m斑马鱼在各区停留的时间进行数据对比,测试doc2αm/mdoc2βm/m斑马鱼是否存在社交障碍。通过对3-6个月龄成年doc2αm/mdoc2βm/m斑马鱼社交行为检测发现,与野生型相比,doc2αm/mdoc2βm/m斑马鱼停留在1区时间明显减少,这说明doc2αm/mdoc2βm/m斑马鱼不愿意停留在与靠近其他鱼群的区域,同时,停留在2区和4区时间明显增多,停留在3区时间也增加但不明显(参考图9),这说明doc2αm/mdoc2βm/m斑马鱼更愿意停留在距离其他鱼群更远的区域,这表明,doc2αm/mdoc2βm/m斑马鱼具有社交障碍,显示类似人类自闭症疾病表型。
c.t迷宫实验(t-mazetanktest):该测试选取3组进行实验,第1和2组实验中间间隔3小时,第3组实验在24小时后完成,其中,第1组为学习训练组,与第3组即记忆检测组进行比较,而第2组为加强学习强化组,不纳入分析。将受试鱼轻柔且迅速地放入自制的t迷宫长臂起始处,t迷宫有两个短臂与长臂垂直,其中一个连接有更深底部的蓄水池,池底布置有人工水草和鹅卵石,以此作为斑马鱼环境偏爱区,记录野生型斑马鱼和doc2αm/mdoc2βm/m斑马鱼受训后到达偏爱区的时间,测试doc2αm/mdoc2βm/m斑马鱼记忆是否出现障碍。结果显示,doc2αm/mdoc2βm/m斑马鱼记忆力并未受损(参考图10)。
综上所述,与野生型斑马鱼(doc2α+/+doc2β+/+)相比较,doc2αm/mdoc2βm/m成鱼记忆力并未受损,但幼鱼和成鱼的运动能力均大大降低,趋触性和社交能力也降低,根本世界卫生组织icd-10自闭症的诊断标准判断,doc2αm/mdoc2βm/m成鱼具有人类自闭症疾病表型,doc2αm/mdoc2βm/m斑马鱼自闭症疾病模型建立成功,该斑马鱼自闭症模型可用于高通量药物筛选。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>南方医科大学南方医院
<120>doc2α和doc2β基因缺失斑马鱼突变体的制备及斑马鱼自闭症模型的构建方法
<130>2021.01.18
<160>6
<170>patentinversion3.5
<210>1
<211>19
<212>dna
<213>靶向斑马鱼doc2α基因sgrna的序列
<400>1
gggcccggacagacgtcta19
<210>2
<211>20
<212>dna
<213>靶向斑马鱼doc2β基因sgrna的序列
<400>2
ggagaagtattcggtctgct20
<210>3
<211>25
<212>dna
<213>doc2α正向引物
<400>3
tctctgctttagctctatgacggtg25
<210>4
<211>25
<212>dna
<213>doc2α反向引物
<400>4
tgctgtcatcactgtctgaactgca25
<210>5
<211>25
<212>dna
<213>doc2β正向引物
<400>5
acgtctagtggagcgtctggacaac25
<210>6
<211>25
<212>dna
<213>doc2β反向引物
<400>6
tctctgctgctccaatgtggcgtct25
- 还没有人留言评论。精彩留言会获得点赞!