一种白及多糖及其制备方法和应用、包含所述白及多糖的免疫佐剂和纳米疫苗
1.本发明涉及免疫调节技术领域,尤其涉及一种白及多糖及其制备方法和应用、包含所述白及多糖的免疫佐剂和纳米疫苗。
背景技术:
2.中药白及为兰科(orhidaceae)植物白及属(bletilla)白及bletilla striata (thunb.)reichb.f.的干燥块茎,具有收敛止血,消肿生肌,补肺止咳的功效。目前文献报道的白及属的主要化学成分为联苄(bibenzyls)、菲类(phenanthrenes)及其衍生物、甾体皂苷、三萜、黄酮、花青素等,共150余种。这些成分在后续的研究中表现出多样的生物活性,如抗炎、抗氧化,抗菌、止血、抗肿瘤和抑制络氨酸酶等。
3.白及富含多糖,目前报道的白及多糖骨架类型主要为1,2-或1,4-链接甘露糖残基与葡萄糖残基1,4-链接方式,传统白及多糖的制备与应用多集中在伤口愈合方面,或者作为加工代血浆、血管栓塞剂用于肿瘤的介入治疗。
技术实现要素:
4.本发明的目的在于提供一种白及多糖及其制备方法和应用、包含所述白及多糖的免疫佐剂和纳米疫苗,本发明提供的白及多糖具有免疫调节作用。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种白及多糖,化学结构式如式i所示;所述白及多糖的相对分子量为42.0~42.5kda;
[0007][0008]
优选的,所述白及多糖的相对分子量为42.4kda。
[0009]
本发明还提供了上述方案所述白及多糖的制备方法,包括以下步骤:
[0010]
1)对白及块茎粉进行脱脂处理,得到脱脂原料;
[0011]
2)将所述脱脂原料和水混合进行水提,得到水提液;
[0012]
3)采用乙醇对所述水提液进行醇沉,固液分离,收集沉淀;
[0013]
4)对所述沉淀进行脱蛋白处理,得到白及粗多糖;
[0014]
5)依次采用水和浓度为0.05mol/l的nacl水溶液对所述白及粗多糖进行第一色谱柱层析,收集nacl水溶液的洗脱部分;采用水对nacl水溶液的洗脱部分进行第二色谱柱层析,收集洗脱液,对所述洗脱液进行hplc-elsd 检测,收集出峰时间为9.32min的组分,得到白及多糖。
[0015]
优选的,步骤3)中所述采用乙醇对所述水提液进行醇沉包括:对所述水提液依次进行过滤和浓缩,得到浓缩液;将所述浓缩液和乙醇混合,得到混合液,静置进行醇沉;所述混合液中乙醇的体积浓度>70%。
[0016]
优选的,步骤4)中所述脱蛋白处理包括:对所述沉淀复溶,得到复溶液;将所述复溶液与sevage试剂按照体积比为4:1的比例混合、振荡、离心,变性后的蛋白质介于复溶液与sevage试剂交界处;所述sevage试剂是将氯仿和正丁醇按照4:1的体积比混合得到。
[0017]
本发明还提供了上述方案所述白及多糖或者上述方案所述制备方法制备得到的白及多糖在制备免疫调节产品中的应用。
[0018]
优选的,所述免疫调节产品包括免疫调节药品、免疫调节化妆品或免疫调节功能食品。
[0019]
本发明还提供了上述方案所述白及多糖或者上述方案所述制备方法制备得到的白及多糖作为免疫佐剂在制备疫苗中的应用。
[0020]
本发明还提供了一种纳米疫苗,包括多糖和蛋白疫苗,所述多糖为上述方案所述白及多糖或者上述方案所述制备方法制备得到的白及多糖。
[0021]
优选的,所述蛋白疫苗包括sars-cov-2rbd蛋白。
[0022]
本发明提供了一种白及多糖。本发明的白及多糖具有免疫调节作用,本发明的白及多糖和蛋白疫苗混合后,会发生自组装现象生成纳米疫苗,自组装后的纳米疫苗为较为均一的圆形颗粒。利用纳米疫苗免疫小鼠时,其能够通过激活抗原呈递细胞(apcs)并提高其对抗原的摄取,该纳米疫苗产生了比传统疫苗强2~10倍的抗体和细胞应答。
附图说明
[0023]
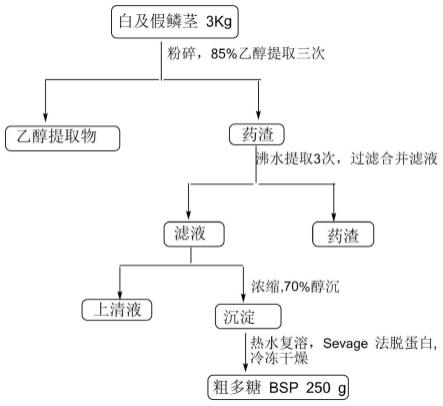
图1为实施例1中白及多糖提取的流程图;
[0024]
图2为实施例1中白及多糖分离纯化的流程图;
[0025]
图3为bps纯品hplc图谱;
[0026]
图4为bps纯品pmp-hplc图谱;
[0027]
图5为bps纯品ir图谱;
[0028]
图6为bps纯品uv图谱;
[0029]
图7表示bps纯品中所有的氢质子信号;
[0030]
图8表示bps纯品中所有的氢原子信号;
[0031]
图9表示bps纯品中碳与其附着氢质子之间的关联性;
[0032]
图10表示bps纯品中氢质子与碳(包括非质子碳、远离质子的两个或三个键)之间的关联;
[0033]
图11表示bps纯品中氢质子与氢质子之间的关联;
[0034]
图12表示bps纯品中从质子到直接连接到碳以及同一质子自旋系统中的质子碳的碳维度的关联;
[0035]
图13为bps纯品与sars-cov-2rbd蛋白自组装电镜图谱;标尺为 500nm;
[0036]
图14为bps与sars-cov-2rbd蛋白形成的纳米疫苗的免疫调节活性结果。
具体实施方式
[0037]
本发明提供了一种白及多糖,化学结构式如式i所示;所述白及多糖的相对分子量为42.0~42.5kda;
[0038][0039]
在本发明中,所述白及多糖的相对分子量优选为42.4kda。
[0040]
在本发明中,所述白及多糖的单糖构成为甘露糖:葡萄糖=3.08:1;所述白及多糖的重复序列为1,4-β-d-葡萄糖(a)、1,4,6-β-d-甘露糖(c)和1,4-β-d
‑ꢀ
甘露糖(b)按式i的重复单元为主链,单元(c)上乙酰基摩尔百分比含量为7.54%。
[0041]
本发明还提供了上述方案所述白及多糖的制备方法,包括以下步骤:
[0042]
1)对白及块茎粉进行脱脂处理,得到脱脂原料;
[0043]
2)将所述脱脂原料和水混合进行水提,得到水提液;
[0044]
3)采用乙醇对所述水提液进行醇沉,固液分离,收集沉淀;
[0045]
4)对所述沉淀进行脱蛋白处理,得到白及粗多糖;
[0046]
5)依次采用水和浓度为0.05mol/l的nacl水溶液对所述白及粗多糖进行第一色谱柱层析,收集nacl水溶液的洗脱部分;采用水对nacl水溶液的洗脱部分进行第二色谱柱层析,收集洗脱液,对所述洗脱液进行hplc-elsd 检测,收集出峰时间为9.32min的组分,得到白及多糖。
[0047]
本发明首先对白及块茎粉进行脱脂处理,得到脱脂原料。
[0048]
在本发明中,所述白及块茎粉优选的采用白及块茎粉碎得到;本发明对所述白及块茎的粒径没有特殊限制,本领域常规粒径即可。
[0049]
在本发明中,所述对白及块茎粉进行脱脂处理包括:将体积浓度为95%的乙醇水溶液和白及块茎粉混合后浸提,得到浸提液;对所述浸提液进行固液分离,收集沉淀,得到脱脂原料。
[0050]
在本发明中,所述浸提的次数优选为3次;本发明对每次浸提采用的乙醇水溶液的用量没有特殊限制,以本领域常规用量即可。
[0051]
在本发明中,对所述浸提液进行固液分离的方式优选为过滤;所述过滤采用的滤网的孔径优选为20~60目。
[0052]
得到脱脂原料后,本发明将所述脱脂原料和水混合进行水提,得到水提液。在本发明中,所述水优选的包括去离子水;所述水提的方式优选的包括回流提取;所述回流提取的温度优选为80~100℃;所述回流提取的次数优选为3次,每次回流提取的时间优选为1~3h。
[0053]
得到水提液后,本发明采用乙醇对所述水提液进行醇沉,固液分离,收集沉淀。在本发明中,采用乙醇对所述水提液进行醇沉的方法包括:对所述水提液进行过滤、浓缩,得到浓缩液;将所述浓缩液和乙醇混合,得到混合液,静置进行醇沉;所述混合液中乙醇的体
积浓度优选的>70%。在本发明中,所述过滤采用的滤网的孔径优选为0.25~0.45;本发明对所述浓缩的方式没有特殊限制,采用本领域常规浓缩方式即可。在本发明具体实施过程中,所述浓缩的方式为减压浓缩。在本发明中,所述固液分离的方式优选为离心;所述离心的转速优选为3000~5000rpm;所述离心的时间优选为20~25min。
[0054]
得到沉淀后,本发明对所述沉淀进行脱蛋白处理,得到白及粗多糖。在本发明的具体实施过程中,对所述沉淀进行脱蛋白处理的方法为:对所述沉淀复溶,得到复溶液;利用蛋白质在氯仿等有机溶剂中变性的特点,将复溶液与sevage试剂按照体积比为4:1的比例混合、振荡、离心,变性后的蛋白质介于提取液与sevage试剂交界处;所述sevage试剂是将氯仿和正丁醇按照4:1的体积比混合得到。利用sevage试剂去除所述上清液中的蛋白条件温和,不会引起多糖的变性。在本发明中,去除所述上清液中的蛋白的次数优选为3次。在本发明中,对所述沉淀复溶采用的试剂优选为水;所述水的温度优选为80~100℃。本发明对所述水的用量没有特殊限制,以使所述沉淀充分溶解即可。
[0055]
得到白及粗多糖后,本发明依次采用水和浓度为0.05mol/l的nacl水溶液对所述白及粗多糖进行第一色谱柱层析,收集nacl水溶液的洗脱部分;采用水对nacl水溶液的洗脱部分进行第二色谱柱层析,收集洗脱液,对所述洗脱液进行hplc-elsd检测,收集出峰时间为9.32min的组分,得到白及多糖。
[0056]
在本发明中,所述第一色谱柱层析采用的色谱柱优选为deae-52色谱柱(80
×
4cm)。
[0057]
在本发明中,所述第二色谱柱层析采用的色谱柱优选为浓度为 deae-sepharose fast flow、sephadex g-75和sephacryl s-200。在本发明具体实施过程中,0.05mol/l的nacl水溶液的洗脱部分过deae-sepharose fastflow、sephadex g-75和sephacryl s-200反复柱层析。
[0058]
在本发明中,hplc-elsd检测的条件包括:色谱柱:tskgel-g4000wxl7.8*30;流动相:水100%等度洗脱;时间:0~15min;进样量:10ml。
[0059]
本发明还提供了上述方案所述白及多糖或上述方案所述制备方法制备得到的白及多糖在制备免疫调节产品中的应用。在本发明中,所述免疫调节产品优选的包括免疫调节药品、免疫调节化妆品或免疫调节功能食品。
[0060]
本发明还提供了上述方案所述白及多糖或者上述方案所述制备方法制备得到的白及多糖作为免疫佐剂在制备疫苗中的应用。
[0061]
本发明还提供了一种纳米疫苗,包括多糖和蛋白疫苗,所述多糖为上述方案所述白及多糖或者上述方案所述制备方法制备得到的白及多糖。在本发明中,所述多糖和蛋白疫苗的质量比优选为(4~50):(1~5),进一步优选为(10~30):(2~3)。
[0062]
在本发明中,所述蛋白疫苗优选的包括sars-cov-2rbd蛋白。
[0063]
本发明还提供了上述方案所述纳米疫苗的制备方法,包括以下步骤:
[0064]
将所述白及多糖和蛋白疫苗混合,得到纳米疫苗。在本发明中,所述混合包括:将白及多糖和蛋白疫苗分别和水混合,分别得到白及多糖水溶液和蛋白疫苗水溶液;所述白及多糖水溶液中白及多糖的浓度优选为2~5mg/ml,更优选为3~4mg/ml;所述蛋白疫苗水溶液的浓度优选为1~5mg/ml,更优选为2~3mg/ml。在混合前,所述蛋白疫苗水溶液优选的经过0.25μm滤膜过滤处理;所述白及多糖水溶液和蛋白疫苗水溶液的体积比优选为(2~
10): 1,进一步优选为(5~8):1。
[0065]
在本发明中,所述混合的温度优选为20~30℃,更优选为25℃;本发明对所述混合的时间没有特殊限制,以混合均匀为准。
[0066]
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0067]
实施例1:白及多糖提取分离纯化及结构鉴定
[0068]
白及多糖提取的流程图参见图1。白及多糖分离纯化的流程参见图2。
[0069]
1、取白及干燥粉末3kg,加入85%乙醇浸提三次,采用目径为00.25~0.45 目的滤纸过滤,滤渣置于室温通风晾干,然后沸水提取,加入20l蒸馏水,沸水提取2h,提取2次。
[0070]
2、过滤,合并滤液,65℃减压浓缩至10l,向浓缩液中加入95%乙醇,慢加快搅,使醇终浓度达到70%,放置过夜,离心(5000rpm,20min),所得沉淀加10l的热水复溶,离心去除滤渣;
[0071]
3、离心得到的上清液与sevage试剂(氯仿和正丁醇按照4:1的体积比混合得到)按照体积比为4:1的比例混合、振荡、离心,变性后的蛋白质介于提取液与sevage试剂交界处,重复两次步骤3,得到的剩余液浓缩,冷冻干燥,即得白及粗多糖bps 250g。
[0072]
4、每次取bps 400mg,加3ml水,加热溶解,放至室温冷却,3000rpm 离心5min,得上清液,上清液用deae-52色谱柱(80
×
4cm),依次用蒸馏水、0.05、0.3和0.5mol/lnacl水溶液为洗脱,自动接样器收集每一组分,用hplc-elsd检测合并相同出峰时间的组分,透析,每一组分减压浓缩到,后真空冷冻很干燥,得到3个组分bps-0(水洗脱部分),bps-1(0.05mol/lnacl水溶液洗脱部分),bps-2(0.3和0.5mol/lnacl水溶液洗脱部分,含量少颜色深,因此没有继续纯化)。再进一步对bps-0部分过deae-sepharosefast flow再经和sephacryl s-200反复柱层析,用水洗脱,自动接样器,每隔一管hplc-elsd检测合并得到bps i。bps-1部分过deae-sepharose fastflow、sephadex g-75和sephacryl s-200反复柱层析,用水洗脱,自动接样器,每隔两管取样hplc-elsd检测(hplc-elsd检测的条件包括:色谱柱:tskgel-g4000wxl 7.8*30;流动相:水100%等度洗脱;时间:0~15min;进样量:10ml)合并分离纯化得到bps ii、bps iii和bps iv。其中bps ii 为目标产物-具有免疫调节作用的白及多糖。
[0073]
bps纯品(bps ii)的hplc图谱参见图3。采用多糖链接组成甲基化分析(pmp-hplc);红外光谱分析;紫外和旋光分析及nmr光谱测定,最终确定均一多糖的结构为分子量≈42.4kda,单糖构成为甘露糖:葡萄糖=3.08:1,多糖重复序列为1,4-β-d-葡萄糖(a)、1,4,6-β-d-甘露糖(c)和1,4-β-d
‑ꢀ
甘露糖(b)按如下图的重复单元为主链,单元c上乙酰基含量为7.54%,结构如下:
[0074]
[0075]
多糖链接组成甲基化分析结果参见图4。
[0076]
红外光谱分析(ir)结果参见图5。
[0077]
紫外和旋光分析结果参见图6。
[0078]
nmr光谱测定是确定bps纯品的结构构成及单糖连接方式的重要手段,nmr光谱测定结果参见图7~图12,其中图7表示bps纯品中所有的氢质子信号,图8表示bps纯品中所有的氢原子信号,图9表示bps纯品中碳与其附着氢质子之间的关联性,图10表示bps纯品中氢质子与碳(包括非质子碳、远离质子的两个或三个键)之间的关联,该结构具有杂核多键相关性,图11表示bps纯品中氢质子与氢质子之间的关联,图12表示bps 纯品中从质子到直接连接到碳以及同一质子自旋系统中的质子碳的碳维度的关联。
[0079]
实施例2:纳米疫苗的制备
[0080]
取白及均一多糖10mg溶于2ml纯水配置成浓度为5mg/ml的多糖水溶液,过0.25μm滤膜过滤备用。取sars-cov-2rbd蛋白适量加纯水配制成浓度为3mg/ml蛋白疫苗水溶液,过0.25μm滤膜过滤备用。在纯水缓冲液中(ph 7.0),利用上述制备好的多糖水溶液与sars-cov-2rbd蛋白疫苗水溶液以5:1比例混匀,形成纳米疫苗,现配现用。
[0081]
实施例3:纳米疫苗透射电镜
[0082]
将上述实施例2中所制备的纳米疫苗,取10μl,利用透射电子显微镜 (tem)观察纳米疫苗的形态。结果参见图13,由图13可以看出该均一多糖与疫苗自组装成均一圆形颗粒即纳米疫苗。
[0083]
实施例4多糖bps与sars-cov-2rbd蛋白形成的纳米疫苗的免疫调节活性
[0084]
动物免疫的具体方法:将上述实施例2中所制备的纳米疫苗免疫动物,动物选用spf级的balb/c小鼠,6~8周龄,在无菌环境下饲养,分为3组,每组5只。具体的动物实验分组:
[0085]
阴性对照组:肌肉注射生理盐水100μl/只鼠;
[0086]
普通疫苗组:肌肉注射sars-cov-2rbd蛋白疫苗溶液10μg/只鼠;
[0087]
纳米疫苗组:肌肉注射bps-rbd纳米疫苗10μg/只鼠;
[0088]
上述三组动物免疫时间间隔为0、2、4周,最后一次免疫后10天采血做假病毒中和实验与ifn-γelispot检测。检测结果参见表1、表2和图14,由表1、表2和图14可以看出组装后的纳米疫苗活性较普通疫苗有显著差异。
[0089]
表1中和抗体检测结果
[0090]
组别中和抗体检测阴性对照组3.5普通疫苗组45.2纳米疫苗组279
[0091]
表2ifn-γelispot实验结果
[0092]
组别ifn-γelispot实验阴性对照组11普通疫苗组28纳米疫苗组86
[0093]
所有动物实验经中国医学科学院医学生物学研究所动物实验伦理委员会批准,严
格按照云南省实验室动物福利与伦理委员会规定操作。
[0094]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1