重组人组织型激肽释放酶及其制备方法与流程
本发明属于生物工程基因领域,具体涉及重组人组织型激肽释放酶及其制备方法。
背景技术:
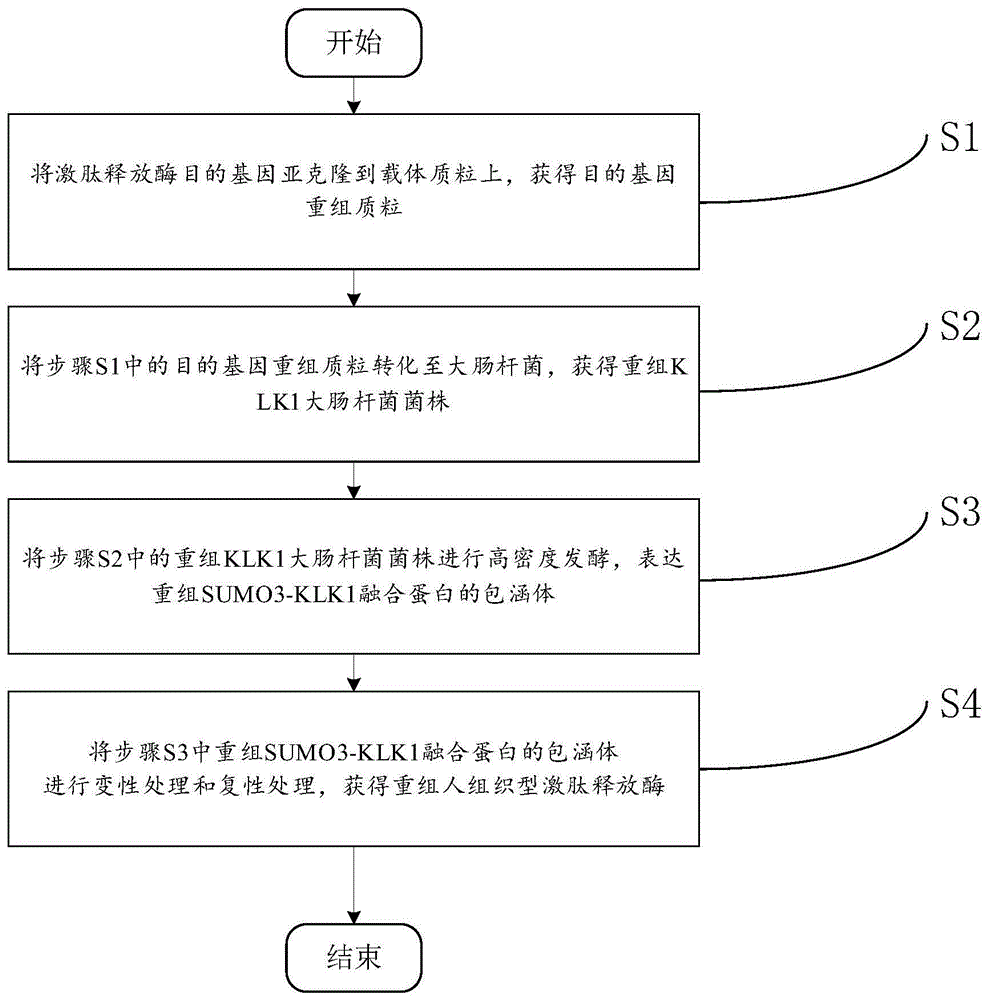
:蛋白酶在生物理化过程中起着极其重要的作用,自然界中的蛋白酶因氨基酸功能残基的不同被划分为四类:丝氨酸、半胱氨酸、天冬氨酸和金属蛋白酶。丝氨酸蛋白酶(serineproteases,又称sps)因其在活性位点上的催化丝氨酸残基而得名。目前人体中已发现175种丝氨酸蛋白酶,其中绝大多数为分泌蛋白。经典的丝氨酸蛋白酶在c端具有特异性保守催化三联体(his、asp、ser)结构域,同时具有包括ser-his-glu、ser-lys/his、his-ser-his和n端ser等在内的多个活性位点。这类蛋白酶广泛存在于生物体中,参与细胞凋亡与分化、胚胎发育、免疫防御等多种重要的生物代谢与化学过程,发挥重要的生物学作用。目前研究较多的是消化过程必不可少的胰蛋白酶和胰凝乳蛋白酶;此外,在消化、凝血、补体等多个系统中不可或缺的调节因子、作为外源性和内源性凝血途径重要组成部分的凝血因子x和凝血因子xi、补体系统经典途径中的c1r和c1s、凝集素途径中的masp都是丝氨酸蛋白酶超家族的重要成员;甚至中性粒细胞(nsps)中都存在着丝氨酸蛋白酶,主要发挥组织降解和微生物杀灭作用;近年来,丝氨酸蛋白酶在癌症进展和转移中的作用也受到广泛关注。激肽释放酶(klks)是一类具有多种生理功能的丝氨酸蛋白酶。“激肽释放酶”一词最早是在20世纪30年代由werle等人提出,用来描述人类胰腺中能够产生释放激肽的物质。目前研究表明,klks是一个有15种分泌型的丝氨酸蛋白酶的家族,可以根据在体内分布的差异区分为两个主要的群体:一是血浆激肽释放酶(也称为klk1b),参与血浆激肽形成;另一个是组织激肽释放酶(包括klk1),参与组织细胞分裂素的形成。两组klks在基质、理化性质和功能特性等方面都有所差异。现有研究结果表明klk1对健康的心血管系统很重要,并且klk1缺乏与心血管疾病和终末器官病理有关。重要的是,klk1补给疗法在亚洲得到了广泛的应用,在亚洲,klk1被用于治疗从急性缺血性中风(ais)到糖尿病并发症(视网膜病变和肾脏疾病)的疾病,这些疾病均涉及微循环不良或组织缺血。此外,ais的发病机制包括适应不良的免疫系统反应和复杂的炎症途径均可通过klk1治疗来解决。急性缺血性中风(ais)是全世界死亡和致残的主要原因,其最严重的形式是由脑部威利斯环岛主要分支的大血管闭塞引起的。西方国家目前可用于大血管闭塞的治疗策略涉及通过使用机械或药理学手段(例如组织血浆激活剂tpa)去除有害血块来快速恢复血流。klk1负责激肽(缓激肽和激肽)的产生,激肽促进局部血管舒张和长期血管形成。此外,klk1在临床上已被直接用于治疗与局部血流受损有关的多种疾病,包括ais。中华人民共和国已批准从人尿液中分离出一种人klk1,用于亚急性ais治疗。现有技术中,利用酵母表达系统生产重组klk1,由于酵母为真核细胞,重组表达操作复杂,并且由于种属差异,klk1很难直接在酵母中表达,无法实现产业量化,使klk1的应用受到限制。技术实现要素:针对上述现有技术的不足,本发明提供了重组人组织型激肽释放酶的制备方法,目的是为了解决现有技术中,利用酵母表达系统生产重组klk1,由于酵母为真核细胞,重组表达操作复杂,并且由于种属差异,klk1很难直接在酵母中表达,无法实现产业量化,使klk1的应用受到限制的技术问题。本发明提供的重组人组织型激肽释放酶的制备方法,具体技术方案如下:重组人组织型激肽释放酶的制备方法,其特征在于,包括如下步骤:s1,将激肽释放酶目的基因亚克隆到载体质粒上,获得目的基因重组质粒;s2,将步骤s1中的目的基因重组质粒转化至大肠杆菌,获得重组klk1大肠杆菌菌株;s3,将步骤s2中的重组klk1大肠杆菌菌株进行高密度发酵,表达重组sumo3-klk1融合蛋白的包涵体;s4,将步骤s3中重组sumo3-klk1融合蛋白的包涵体进行变性处理和复性处理,获得重组人组织型激肽释放酶。在某些实施方式中,在步骤s1中,所述激肽释放酶目的基因的碱基序列如seqidno.1所示,所述激肽释放酶目的基因通过同源重组处理方法亚克隆到载体质粒上;所述载体质粒为psumo3质粒。在某些实施方式中,在步骤s1中,所述同源重组处理方法包括如下步骤:(1)利用引物1和引物2获得线性化激肽释放酶目的基因,所述引物1的碱基序列如seqidno.2所示,所述引物2的碱基序列如seqidno.3所示;(2)利用引物3和引物4获得线性化psumo3质粒,所述引物3的碱基序列如seqidno.4所示,所述引物4的碱基序列如seqidno.5所示;(3)将步骤(1)中的线性化激肽释放酶目的基因与步骤(2)中的线性化psumo3质粒进行同源重组反应。在某些实施方式中,在步骤s3中,所述高密度发酵的具体步骤如下:将重组klk1大肠杆菌菌株接种至摇瓶进行扩大培养后,再转入发酵罐进行高密度发酵培养。在某些实施方式中,所述扩大培养的培养基为氨苄抗性的2×yt培养基,培养温度为37℃,培养基摇床的转速为220rpm;所述高密度发酵培养包括下列步骤:将扩大培养后的菌液按1:(50-100)比例接种于经过高温灭菌过的发酵基础培养基中进行通气,搅拌培养,初始培养条件包括:转速100-120rpm,通气量20-40l/min,罐压0.03-0.07mpa,ph6.8-7.2,温度35-39℃;当细菌密度增加,溶氧低于20%时,提高转速至200-400rpm,提高通气量至50-80l/min;当发酵od600至30以上时,加入诱导剂,同时,将发酵罐温度由35℃-39℃降为25℃-27℃,继续培养至发酵结束;所述诱导剂为0.5mm异丙基硫代半乳糖苷。在某些实施方式中,在步骤s3中,所述重组sumo3-klk1融合蛋白的氨基酸序列如seqidno.6所示。在某些实施方式中,在步骤s4中,重组sumo3-klk1融合蛋白的包涵体经过变性处理获得蛋白变性液,所述蛋白变性液逐滴滴加到剧烈搅拌的复性液中,静止复性,所述复性液的成分为50mm的ph7.5-8.5tris-hcl、0-700mm的l-arg、0-700mm的guhcl、0-20%的glycerol、0-250mm的nacl、3.8mmgsh/1.2mmgssg和0-1800mm的sorbitol。在某些实施方式中,所述复性液的成分为50mm的ph8.0tris-hcl、50mm的nacl、500mm的guhcl、3.8mmgsh/1.2mmgssg和1800mm的sorbitol;所述复性温度为4℃,所述复性的时间为24-48h。在某些实施方式中,在步骤s4中,复性后的蛋白液进行透析、镍亲和层析和反向镍柱亲和层析,获得纯化后的重组人组织型激肽释放酶。本发明还提供了重组人组织型激肽释放酶,根据上述方法制备的重组人组织型激肽释放酶。本发明具有以下有益效果:本发明将人组织型激肽释放酶经过密码子优化构建重组质粒,并以大肠杆菌作为宿主进行高密度发酵,最终通过变复性处理获得产量较高的人组织型激肽释放酶,为人组织型激肽释放酶实现工业化生产提供研究基础,使人组织型激肽释放酶在疾病治疗中具有良好的前景。附图说明图1是本发明提供的重组人组织型激肽释放酶的制备方法的流程图;图2是本发明实施例1中psumo3质粒的结构示意图;图3是本发明实施例4中盐酸胍和l-arg对klk1复性活性的影响对比图;图4是本发明实施例4中添加剂甘油、山梨醇和edta对复性的影响的平行比较图;图5是本发明实施例4中山梨醇浓度对复性的影响示意图;图6是本发明实施例4中甘油浓度对复性的影响示意图;图7是本发明实施例4中nacl浓度对复性的影响示意图;图8是本发明实施例4中氧化和还原型谷胱甘肽浓度比例对复性的影响示意图;图9是本发明实施例4中镍亲和层析洗脱蛋白的sds聚丙烯酰胺电泳胶图;图10是本发明实施例4中反镍亲和层析洗脱蛋白的sds聚丙烯酰胺电泳胶图;图11是本发明实施例4重组klk的活性验证的sds聚丙烯酰胺电泳胶图图。具体实施方式为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图1-11,对本发明进一步详细说明。实施例1获得目的基因重组质粒一、目的基因密码子优化根据genbank已公开的人组织型激肽释放酶1的cdna序列(genbank登录号:bc005313)(未经密码子优化的基因,天然基因)进行密码子优化后得到本发明的目的基因,如seqidno1所示。本发明的目的基因是基于宿主细胞偏好的密码子使用方式对目的基因的稀有密码子进行同义替换得来的。密码子优化的原理是,一个氨基酸可以对应多个密码子,但在不同的宿主里这些密码子出现的频率和对应的trna含量不同。如果插入的外源基因上携带大量在宿主中频率很低的密码子,会影响该蛋白的合成。因此可以将异源蛋白的密码子进行优化,使用那些在宿主中使用频率较高的密码子,以期获得较高的重组蛋白的表达。二、同源重组技术利用引物1(seqidno.2)和引物2(seqidno.3)通过pcr获得线性化激肽释放酶目的基因,反应体系如表1所示,pcr反应过程如表2所示。表1激肽释放酶目的基因线性化反应体系2×nebq5reactionmixture25ulprimer1-forward2ulprimer1-reverse2ul优化后的目的基因(50ng/ul)1ulddh2o20ul表2激肽释放酶目的基因线性化pcr反应过程利用引物3(seqidno.4)和引物4(seqidno.5)获得线性化psumo3质粒(结构如图2所示),psumo3质粒线性化pcr反应体系和过程如表3、表4所示。表3psumo3质粒线性化pcr反应体系2×nebq5reactionmixture25ulprimer2-forward2ulprimer2-reverse2ulpsumo3vector(50ng/ul)1ulddh2o20ul表4psumo3质粒线性化pcr反应过程将线性化激肽释放酶目的基因与线性化psumo3质粒进行同源重组反应,反应体系如表5所示。表5同源重组反应体系线性化载体xul插入片段yul5×ceiibuffer4ulexnaseii2ulddh2oto20ulx与y按照摩尔比5:1加入特定体积的胶回收产物,37℃反应30min,获得目的基因重组质粒,即携带激肽释放酶基因序列的psumo3质粒。实施例2获得重组klk1大肠杆菌菌株将携带激肽释放酶基因序列的psumo3质粒转化至大肠杆菌,具体的步骤如下:a)在冰上解冻克隆感受态细胞(如:dh5α、bl21感受态细胞)。b)取10μl重组产物加入到100μl感受态细胞中,轻弹管壁混匀(请勿振荡混匀),冰上静置30min。c)42℃水浴热激45sec后,立即置于冰上冷却2-3min。d)加入900μlsoc或lb培养基(不添加抗生素),37℃摇菌1h(转速200-250rpm)。e)将相应抗性的lb固体培养基平板在37℃培养箱中预热。f)5000rpm离心5min,弃掉900μl上清。用剩余培养基将菌体重悬,用无菌涂布棒在含有正确抗性的平板上轻轻涂匀。g)37℃培养箱中倒置培养12-16h。挑取取若干个单菌落进行dna测测序比对,验证质粒构建成功。实施例3高密度发酵表达重组sumo3-klk1融合蛋白的包涵体挑取单克隆菌落接种至100ml含有氨苄抗性的2×yt培养基,37℃,220rpm培养过夜。将扩大培养后的菌液按1:(50-100)比例接种于经过高温灭菌过的发酵基础培养基中进行通气,搅拌培养,初始培养条件包括:转速100-120rpm,通气量20-40l/min,罐压0.03-0.07mpa,ph6.8-7.2,温度35-39℃;当细菌密度增加,溶氧低于20%时,提高转速至200-400rpm,提高通气量至50-80l/min;当发酵od600至30以上时,加入0.5mm异丙基硫代半乳糖苷,同时,将发酵罐温度由35℃-39℃降为25℃-27℃,继续培养至发酵结束。实施例4获得重组人组织型激肽释放酶一、变性处理收集重组sumo3-klk1融合蛋白的包涵体变性处理具体操作步骤如下:d)4500rpm,15min收集菌体。按照5g/ml的比例添加bufferp1(20mmtris-hcl-hclph7.4,1%tritonx-100,0.5mnacl和20mmedta)重悬菌体,然后利用低温高压破碎仪裂解细菌。破碎后样品12000g离心20min,弃上清并收集沉淀。e)用bufferp1重悬沉淀,混合均匀,12000g离心20min。弃上清并收集沉淀,重复2次。f)用bufferp2(20mmtris-hcl-hcl,ph7.4和10mmedta)重悬沉淀,混合均匀,12000g离心20min。弃上清并收集沉淀。g)用bufferp3(6m盐酸胍,20mmtris-hcl-hclph7.4和10mmdtt)溶解沉淀,20000g离心30min,收集上清。h)将蛋白变性液透析到10mm盐酸中,透析后的液体30000g离心30min。收集沉淀再次溶解于不含dtt的bufferp3。二、复性处理1、筛选合适的复性条件:设计了近200种不同的复性条件,并对其进行初筛,得到了适合klk1包涵体重折叠的12组最佳条件,如表6所示。表6有效的klk1复性条件1tris-hcl(ph8.5)50mm,l-arg500mm,edta1mm2tris-hcl(ph8.5)50mm,l-arg500mm,nacl250mm3tris-hcl(ph8.0)50mm,l-arg500mm4tris-hcl(ph8.0)50mm,l-arg500mm,nacl250mm5tris-hcl(ph7.5)50mm,l-arg500mm,cyclodextrin6mm6tris-hcl(ph7.5)50mm,l-arg500mm,edta1mm,cyclodextrin6mm,gsh3.8mm/gssg1.2mm7tris-hcl(ph8.0)50mm,glycerol20%,nacl100mm,cyclodextrin6mm,gsh3.8mm/gssg1.2mm8tris-hcl(ph8.0)50mm,glycerol20%,nacl250mm,cyclodextrin6mm9tris-hcl(ph8.0)50mm,edta1mm,nacl250mm,gsh3.8mm/gssg1.2mm10tris-hcl(ph8.0)50mm,edta1mm,nacl250mm,cyclodextrin6mm,gsh3.8mm/gssg1.2mm11tris-hcl(ph7.5)50mm,glycerol20%,nacl250mm12tris-hcl(ph8.0)50mm,peg60000.1%(w/v),edta1mm,nacl250mm,gsh3.8mm/gssg1.2mm2、复性条件系统筛选在复性条件初筛结果的基础上,设计了系统筛选方案,来找出最适合klk7包涵体复性的条件,包括试剂浓度、ph值和温度。将前述试剂组成不同的试剂组合,并不断改变试剂浓度及组合,尝试寻找最佳复性条件。作为稳定剂,l-arg更适合klk1复性(如图3所示),首先在一个较宽泛的l-arg浓度范围内进行筛选,l-arg浓度在500mm左右时,klk1复性效果更好(如图4所示);相较于甘油(glycerol),山梨糖醇(sorbitol)在klk1复性中展现了更好的效果(如图5、6所示),较适合klk1复性的山梨糖醇浓度为1800mm(如图5所示);较适合klk1复性的nacl浓度为50mm(如图7所示);谷胱甘肽还原型与氧化型的比例在3:1-9:1时,klk1复性效果较好(如图8所示),考虑到尽量降低成本,较适合大量复性klk1的谷胱甘肽还原型与氧化型的比例为3:1。l-arg浓度和guhcl浓度在klk1复性中的影响:在tris-hcl(ph8.0)50mm,gsh3.8mm/gssg1.2mm,山梨糖醇1500mm的条件下,l-arg比guhcl在klk1复性中的效果更好。l-arg浓度在klk1复性中的影响:在没有其他添加剂的情况下,l-arg500mm更有助于klk1复性;在添加了20%甘油的情况下,l-arg500mm更有助于klk1复性;在添加了1500mm山梨糖醇的情况下,l-arg500mm更有助于klk1复性;在添加了1mmedta的情况下,l-arg700mm更有助于klk1复性。山梨糖醇浓度在klk1复性中的影响:在添加了tris-hclph8.050mm,gsh3.8mm/gssg1.2mm,l-arg500mm的情况下,山梨糖醇1800mm更有助于klk1复性。甘油浓度在klk1复性中的影响:在添加了tris-hclph8.050mm,gsh3.8mm/gssg1.2mm,l-arg500mm的情况下,甘油5%-10%更有助于klk1复性;甘油在klk1复性中的效果不如山梨糖醇。nacl浓度在klk1复性中的影响:在添加了tris-hclph8.050mm,gsh3.8mm/gssg1.2mm,l-arg500mm的情况下,nacl50mm更有助于klk1复性。谷胱甘肽还原型与氧化型的比例在klk1复性中的影响:在添加了tris-hclph8.050mm,l-arg500mm,山梨糖醇1500mm的情况下,谷胱甘肽还原型与氧化型的比例在3:1-9:1时更有助于klk1复性。3、最佳复性条件进行复性处理选择最佳条复性条件(tris-hclph8.050mm,nacl50mm,guhcl500mm,gsh3.8mm/gssg1.2mm,1800mm山梨糖醇)进行蛋白复性。将变性蛋白液逐滴滴加到正在剧烈搅拌的复性液中。滴加完毕后于4℃静置复性1天。复性液10倍体积透析到20mmtris-hclph7.4,0.5mnacl中备用。三、目的蛋白纯化1、镍亲和层析:将透析液离心并用0.45um的滤膜过滤,以5ml/min的流速结合镍柱,buffera(20mmtris-hclph7.4,0.5mnacl,20mm咪唑)冲洗至uv280基线平稳,用0-100%bufferb(20mmtris-hclph7.4,0.5mnacl,200mm咪唑)梯度共洗脱20管,共100ml。sds-page检测蛋白纯度和均一性,收集目的蛋白按照质量比1:500加入senp2酶切透析过夜。对镍亲和层析洗脱的组分(7-18)进行sds聚丙烯酰胺电泳胶鉴定,图9中,s为复性液上清;ft为流穿液;mk为分子量标准品,图9结果表明sumo3-klk1融合蛋白表达正常。2、反向镍柱亲和层析将透析液离心并用0.45um的滤膜过滤,以5ml/min的流速结合镍柱,buffera(20mmtris-hclph7.4,0.5mnacl,20mm咪唑)冲洗至uv280基线平稳,用bufferb(20mmtris-hclph7.4,0.5mnacl,200mm咪唑)一步洗脱。sds-page检测蛋白纯度和均一性。对镍亲和层析洗脱的蛋白进行sds聚丙烯酰胺电泳胶鉴定。图10中,k为分子量标准品;前为重组融合蛋白sumo3-klk;后为senp2酶切后的融合蛋白样品;ft为ni柱流穿液;aw为20mm咪唑洗脱液;bw为200mm咪唑洗脱液。如图10所示,sumo3-klk1融合蛋白表达正常。3、活性验证取1ugklk1与3ugantitrypsin室温混合反应30min,若出现两者复合物的条带,则证明重组蛋白有生物学活性。图11中,mk为分子量标准品;k1为制备的重组klk1;+为1ugklk1和3ugantitrypsin混合物;antitrypsin为3ug抗胰蛋白酶。跑胶结果(如图11所示)显示有额外的复合物的条带出现,重组蛋白具有生物学活性。上述仅本发明较佳可行实施例,并非是对本发明的限制,本发明也并不限于上述举例,本
技术领域:
的技术人员,在本发明的实质范围内,所作出的变化、改型、添加或替换,也应属于本发明的保护范围。序列表<110>宁波瑞林生物科技有限公司<120>重组人组织型激肽释放酶及其制备方法<160>6<170>siposequencelisting1.0<210>1<211>717<212>dna<213>人工序列(artificialsequence)<400>1attgtgggcggctgggaatgcgaacagcatagtcagccgtggcaagcggcgctgtatcat60tttagcacctttcagtgcggcggcattctggtgcatcgtcagtgggtgctgaccgcggcg120cattgcattagcgataactatcagctgtggctgggccgccataacctgtttgatgatgaa180aacaccgcgcagtttgtgcatgtgagcgaaagctttccgcatccgggctttaacatgagc240ctgctggaaaaccatacccgccaagcggatgaagattatagccatgatctgatgctgctg300cgcctgaccgaaccggcggataccattaccgatgcggtgaaagtggtggaactgccgacc360gaagaaccggaagtgggcagcacctgcctggcgagcggctggggcagcattgaaccggaa420aactttagctttccggatgatctgcagtgcgtggatctgaaaattctgccgaacgatgaa480tgcaaaaaagcgcatgtgcagaaagtgaccgattttatgctgtgcgtgggccatctggaa540ggcggcaaagatacctgcgtgggcgatagcggcggcccgctgatgtgcgatggcgtgctg600caaggcgtgacgagctggggctatgtgccgtgcggcaccccgaacaaaccgagcgtggcg660gtgcgcgtgctgagctatgtgaaatggattgaagataccattgcggaaaacagctaa717<210>2<211>45<212>dna<213>人工序列(artificialsequence)<400>2tccagcagcagacgggaggaattgtgggcggctgggaatgcgaac45<210>3<211>45<212>dna<213>人工序列(artificialsequence)<400>3tggtggtggtggtgctcgagttagctgttttccgcaatggtatct45<210>4<211>45<212>dna<213>人工序列(artificialsequence)<400>4ctcgagcaccaccaccaccaccactgagatccggctgctaacaaa45<210>5<211>45<212>dna<213>人工序列(artificialsequence)<400>5tcctcccgtctgctgctggaacacgtcgatggtgtcctcgtcctc45<210>6<211>340<212>prt<213>人工序列(artificialsequence)<400>6metglyhishishishishishisglyglymetsergluglulyspro151015lysgluglyvallysthrgluasnasphisileasnleulysvalala202530glyglnaspglyservalvalglnphelysilelysarghisthrpro354045leuserlysleumetlysalatyrcysgluargglnglyleusermet505560argglnileargpheargpheaspglyglnproileasngluthrasp65707580thrproalaglnleuglumetgluaspgluaspthrileaspvalphe859095glnglnglnthrglyglyilevalglyglytrpglucysgluglnhis100105110serglnprotrpglnalaalaleutyrhispheserthrpheglncys115120125glyglyileleuvalhisargglntrpvalleuthralaalahiscys130135140ileseraspasntyrglnleutrpleuglyarghisasnleupheasp145150155160aspgluasnthralaglnphevalhisvalsergluserpheprohis165170175proglypheasnmetserleuleugluasnhisthrargglnalaasp180185190gluasptyrserhisaspleumetleuleuargleuthrgluproala195200205aspthrilethraspalavallysvalvalgluleuprothrgluglu210215220progluvalglyserthrcysleualaserglytrpglyserileglu225230235240progluasnpheserpheproaspaspleuglncysvalaspleulys245250255ileleuproasnaspglucyslyslysalahisvalglnlysvalthr260265270aspphemetleucysvalglyhisleugluglyglylysaspthrcys275280285valglyaspserglyglyproleumetcysaspglyvalleuglngly290295300valthrsertrpglytyrvalprocysglythrproasnlysproser305310315320valalavalargvalleusertyrvallystrpilegluaspthrile325330335alagluasnser340当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1