检测南方菜豆花叶病毒的交叉引物等温扩增引物组、试剂盒及应用
本发明属于生物技术领域,涉及一种大豆种传检疫性病毒南方菜豆花叶病毒的交叉引物等温扩增快速检测试剂盒及应用
技术背景
南方菜豆花叶病毒(southernbeanmosaicvirus,sbmv)是豇豆花叶病毒科(comoviridae)南方菜豆花叶病毒属(sobemovirus)的典型成员,其由单链rna组成,病毒粒体为等轴对称的二十面体。南方菜豆花叶病毒主要侵染菜豆、豇豆等豆科植物,其可通过机械传播、介体传播和种子传播等方式进行传播。sbmv传播介体主要为菜豆叶甲(ceratomatrifurcata)和墨西哥菜豆叶甲(epilachnavarivetis)。带毒种子可进行远距离传播,菜豆种传率为1%~30%,豇豆种传率为5%~40%。sbmv侵染会造成菜豆产生花叶和斑驳病状,引起菜豆果实坏死,导致菜豆产量及品质降低。sbmv主要分布于美洲和非洲的温热带地区,如美国、墨西哥、塞内加尔等地,此外,法国、印度等地也有该病毒发生的报道。鉴于南方菜豆花叶病毒巨大的传播性和破坏性,1992年我国已将其列入二类进境检疫名录,2017年我国将其列入中国进境植物检疫性有害生物名录。南方菜豆花叶病毒随菜豆和大豆种子传入我国的风险较高,重庆、宁波、青岛等海关多次从美国和巴西的进口大豆中截获sbmv,广州海关还首次从西班牙进境的菜豆种子中截获到sbmv。
目前,南方菜豆花叶病毒的检测方法主要包括elisa、rt-pcr和实时荧光taqman-mgb探针rt-pcr等检测方法。但这些方法都存在局限性,elisa方法检出限低,难以实现无症状植物中少量病毒的检测,且elisa方法常常无法鉴别病毒种类,特异性差,而基于pcr技术的检测方法存在反应时间长、需要昂贵的热循环仪器和专业的操作人员等缺陷,难以满足口岸检疫的快速检测的需求。
交叉引物等温恒温扩增(cross-primingisothermalamplification,cpa)是杭州优思达生物技术有限公司研发的恒温扩增技术,也是中国首个具有自主知识产权的核酸扩增技术。根据反应体系中交叉引物等温数量的不同,cpa可分为单交叉引物等温扩增(singlecrossingcpa)和双交叉引物等温扩增(doublecrossingcpa)两种类型。这两种类型反应都需要一条交叉引物等温(cpf)、两条扩增引物(dr、mbr)、两条解开链的外围引物(bf、br)以及具有链置换活性的dna聚合酶bst。其中,双交叉cpa具有两条交叉引物等温,比单交叉cpa多一条交叉引物等温。单交叉cpa是在对双交叉cpa机制优化后诞生的,其能够在不到一小时的时间内扩增出4个基因组dna拷贝,具有高度的特异性,也是目前被广泛引用的交叉引物等温扩增技术。cpa自诞生起,其主要应用于肺结核分枝杆菌的检测,进行肺结核病的诊断。目前优思达公司开发了结核分枝杆菌核酸检测试剂盒(tb-cpa),具有较高的灵敏度和特异度,可以在2h内完成检测并出具报告,适用于基层医院和卫生所。此外,cpa在食品安全领域也开展了研究如转基因作物检测、食源性致病菌李斯特菌的检测;在动物检疫领域建立了结合试纸条的非洲猪瘟检测方法,在植物检疫性领域建立了李属坏死环斑病毒(pnrsv)和黄瓜绿斑驳花叶病毒(ggmmv)的检测方法。
技术实现要素:
本发明针对检测南方菜豆花叶病毒存在的问题,提供了一种南方菜豆花叶病毒的交叉引物等温扩增快速检测试剂盒及引物,该试剂盒具有高特异性、高灵敏度、操作简单、检测快、检测结果直观的特点。
本发明首先公开了一种检测南方菜豆花叶病毒的交叉引物等温扩增引物组,所述交叉引物等温扩增引物组由外围置换引物sbbf3、外围置换引物sbbr3、扩增引物sbdr3、扩增引物sbmbr3、交叉引物等温sbcp3f组成;
所述外围置换引物sbbf3的核苷酸序列如seqidno.1所示;
所述外围置换引物sbbr3的核苷酸序列如seqidno.2所示;
所述扩增引物sbdr3的核苷酸序列如seqidno.3所示;
所述扩增引物sbmbr3的核苷酸序列如seqidno.4所示;
所述交叉引物等温sbcpf3的核苷酸序列如seqidno.5所示。
作为本发明的优选方案,所述扩增引物sbdr3的5’端有6-羧基荧光素(fam)标记,扩增引物sbmbr3的5’端有生物素荧光基团(biotin)标记。
更加优选的,所述外围置换引物sbbf3、外围置换引物sbbr3、扩增引物sbdr3、扩增引物sbmb3r和交叉引物等温sbcpf3的摩尔比为:1:1:3:3:5。
本发明还提供了一种检测南方菜豆花叶病毒的交叉引物等温恒温扩增试剂,其包括所述的交叉引物等温扩增引物组;
所述外围置换引物sbbf3和所述外围置换引物sbbr3在所述扩增试剂中的终浓度均为0.2μmol/l;
所述扩增引物sbdr3和扩增引物sbmbr3在所述扩增试剂中的终浓度均为0.6μmol/l;
所述交叉引物等温sbcpf3在所述扩增试剂中的终浓度均为1μmol/l。
本发明还提供了一种检测菜豆荚斑斑驳病毒的交叉引物等温扩增试剂盒,其包括所述的引物组或所述的扩增试剂。
本发明还提供了所述的引物组或所述的扩增试剂或所述的试剂盒在检测待检测样品是否感染南方菜豆花叶病毒中的应用。
本发明还进一步提供了一种检测待测样品是否感染南方菜豆花叶病毒的方法,其包括如下步骤:
采用所述的引物组或所述的扩增试剂或所述的试剂盒对待测样品进行交叉引物等温扩增,
利用荧光染料和实时荧光仪器进行实时监测,观察荧光曲线;
若未出现扩增曲线,则待测样品没有南方菜豆花叶病毒侵染;
若出现扩增曲线,则待测样品为南方菜豆花叶病毒感染。
本发明还进一步提供了一种检测待测样品是否感染南方菜豆花叶病毒的方法,其包括如下步骤:
采用所述的引物组或所述的扩增试剂或所述的试剂盒对待测样品进行交叉引物等温扩增,
利用核酸试纸条检测扩增产物,2-5min后观察试纸条;
若在质控线出现一条蓝色条带,在检测线无条带出现,则待测样品没有南方菜豆花叶病毒侵染;
若在质控线出现一条蓝色或红色条带,在检测线出现红色一条条带,则待测样品为南方菜豆花叶病毒感染。
优选的,所述交叉引物等温恒温扩增反应条件为60℃,反应时间为90min。
优选的,所述交叉引物等温恒温扩增的模板为rna。
与现有技术相比,本发明可以获得包括以下技术效果:
(1)由于交叉引物等温扩增检测方法成本低廉,利用amv逆转录酶和bstdna聚合酶在60℃实现等温扩增(无需单独反转录步骤,可直接实现rna模板的扩增),因此本发明提供的试剂盒使用方便且使用成本低。
(2)本发明提供的试剂盒得到的反应结果直观准确,无需进行复杂操作。实时荧光检测方法只需要在试剂盒反应体系中加入syto16核酸染料,利用实时荧光仪器实时监测扩增过程,结果可以利用扩增曲线进行判定;核酸试纸条检测方法只需要对扩增引物dr标记6-羧基荧光素基团,另一条扩增引物mbr标记生物素,然后再用一次性核酸试纸条对反应产物检测,可以准确直观、快速的判读。
(3)本发明提供的试剂盒特异性好,对番茄环斑病毒、南芥菜花叶病毒、烟草环斑病毒和菜豆荚斑驳病毒等都呈阴性反应;灵敏度高,实时荧光检测方法最低可以检测到浓度为5×10-4ng/μl南方菜豆花叶病毒总rna模板,核酸试纸条检测方法最低可以检测到浓度为5ng/μl南方菜豆花叶病毒总rna模板。
(4)本发明所述的南方菜豆花叶病毒交叉引物等温扩增试剂盒可快速、灵敏的检测南方菜豆花叶病毒。该试剂盒操作简单、成本低廉,反应结果易于观察,特异型好,非常适用于医疗卫生、食品安全以及进出口检疫的现场检测,易于大范围推广应用。
附图说明
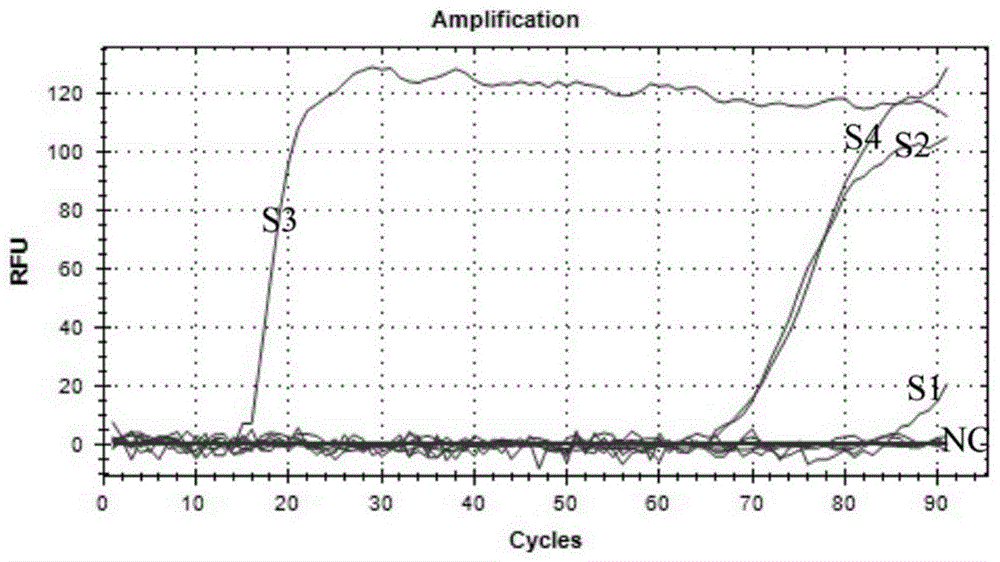
图1是本发明利用实时荧光交叉引物等温扩增筛选检测南方菜豆花叶病毒引物组结果图;实时荧光每60s监测一次,一个循环为1min。s1~s5依次对应sbmv引物组s1—引物组s5的实时荧光交叉引物等温扩增的扩增曲线,nc(negativecontrol,nc)为以水为模板的扩增曲线;
图2是本发明利用实时荧光交叉引物等温扩增方法评估s3引物组检测sbmv特异性结果图;以s3为实时荧光交叉引物等温扩增引物组检测sbmv、torsv、armv、trsv和sbmv的总rna模板和以水为模板(nc)的扩增曲线;
图3是本发明提供的交叉引物等温扩增试剂盒结合核酸试纸条方法检测sbmv特异性试验结果图;其中,编号1-5依次对应南方菜豆花叶病毒、番茄环斑病毒、南芥菜花叶病毒、烟草环斑病毒和菜豆荚斑驳病毒总rna模板的检测结果,nc为以水为模板的检测结果;
图4是本发明提供的实时荧光交叉引物等温扩增方法检测sbmv灵敏度试验结果图;以sbmv总rna模板浓度为50ng/μl连续10倍梯度稀释,设立7个浓度梯度,100-10-6依次对应连续10倍梯度稀释的南方菜豆花叶病毒rna模板,模板浓度分别为5ng/μl、0.5ng/μl、5×10-2ng/μl、5×10-3ng/μl、5×10-4ng/μl、5×10-5ng/μl,nc为以水为模板的阴性对照。
图5是本发明提供的交叉引物等温等温扩增试剂盒结合核酸试纸条方法检测sbmv灵敏度试验结果图;100-10-6依次对应连续10倍梯度稀释的南方菜豆花叶病毒rna模板,模板浓度分别为5ng/μl、0.5ng/μl、5×10-2ng/μl、5×10-3ng/μl、5×10-4ng/μl、5×10-5ng/μl;nc为以水为模板的阴性对照。
图6是实时荧光pcr检测sbmv灵敏度试验结果图;100-10-6依次对应连续10倍梯度稀释的南方菜豆花叶病毒rna模板,模板浓度分别为5ng/μl、0.5ng/μl、5×10-2ng/μl、5×10-3ng/μl、5×10-4ng/μl、5×10-5ng/μl;nc为以水为模板的阴性对照。
具体实施方式
以下将配合实施例再详细说明本发明的实施方式,藉此对本发明如何应用技术手段解决技术问题并达成技术功效的实验过程能充分理解并拘以实施。
实施案例中所涉及的材料:
a.引物由上海派森诺生物有限公司合成;bstdna聚合酶购自newengland公司;amv逆转录酶购自promega公司;pfudna聚合酶购自全式金公司;甜菜碱购自上海生工生物工程股份有限公司;sytotm16greenfluorescentnucleicacidstain购自thermofisher公司;
b.南方菜豆花叶病毒(southernbeanmosaicvirus,sbmv)实验样本为带毒的白肋烟叶片,在特异性评估中用于对照的样本番茄环斑病毒(tomatoringspotvirus,torsv)、烟草环斑病毒(tobaccoringspotvirus,trsv)、南芥菜花叶病毒(arabismosaicvirus,armv)和菜豆荚斑驳病毒(beanpodmottlevirus,bpmv)同样为带毒的白肋烟叶片,这些实验样本均由中国检验检疫科学研究院提供。实施例1:交叉引物等温恒温扩增引物的设计与合成
一:序列获得
1.rna的提取
取患有sbmv、bpmv、torsv、armv和trsv病毒的烟草叶片各50mg,参照植物总rna提取试剂盒操作说明,提取sbmv病毒样品及阴性对照的总rna。
2.cdna合成
取上述提取的5种病毒总rna各3μl,按两步法试剂盒(primescripttmii1ststrandcdnasynthesiskit,6210a)反转录5种病毒的cdna。
3.cp基因引物设计合成
从genbank中下载南方菜豆花叶病毒基因组序列(genbank登录号为:afo55887、af055888、dq875594),利用软件geneious11.1.5,基于gc含量40%~50%,tm值50%~60%,避免重复序列的引物设计原则设计南方菜豆花叶病毒cp基因引物,上游扩增引物sbf的核苷酸序列如seqidno.21所示,下游扩增引物sbr的核苷酸序列如seqidno.22所示(sbf-tacaaaatcaaagtccgcgct、sbr-ggtgcaggtattattatacaactcc),引物由上海桑尼生物科技有限公司合成。
4.cp扩增
利用筛选的引物和高保真酶pfudna聚合酶(pfudnapolymerase,2xtransstartfastpfupcrsupermix,全式金)进行pcr扩增sbmv-cp基因,50μl反应体系如下:2×supermix25μl,模板cdna1μl,sbf和sbr各1μl,引物终浓度为0.5μmol/l,补ddh2o至50μl。pcr扩增条件为:94℃预变形3min;98℃变性10s,53℃退火30s,72℃延伸120s,34个循环;72℃延伸8min。
5.序列获得(连接转化克隆)
将pcr产物琼脂糖凝胶电泳验证后,利用sanprep柱式dna胶回收试剂盒(sanprepcolumndnagelextractionkit,生工)割胶回收,将纯化后的dna连a尾,配置10μl反应体系,包括extaq酶0.1μl,10×pcr缓冲液1μl,dntp0.8μl,纯化的dna8.1μl,再连接到pmd19t载体(takara),配置10μl反应体系,包括5μlsolutioni,0.5μlpmd19t载体,4.5μlcdna,在冰上配置,置于16℃下连接12h,再将连接产物转化到感受态细胞(t-fastcompetente.coli,天根),取转化好的菌液200μl,并加入40μlx-gal(20mg/ml)和16μliptg(50mg/ml)混匀后涂布于氨苄抗性(ampicillin,amp)的固体培养基,置于37℃培养箱中培养10-12h,挑白色单菌落扩摇。
扩摇后的菌液送测序,测序由上海生工生物工程股份有限公司完成,得到sbmv-cp基因序列,经过ncbi序列比对后确定为sbmv-cp基因序列。
二:引物的设计与合成
1.特异引物设计
利用软件geneiousprimers11.1.5,基于cpa引物设计原则(交叉引物等温由5’端的扩增引物mbr和与3’端的与靶基因互补的20-22bp左右的序列组成),交叉引物等温全长在40bp左右,其余4条引物(外围置换引物bf/br和扩增引物dr/mbr)都在18-20bp左右,各引物的cg含量需控制在40%~60%之间,以保证引物间的tm值不会差距太大,且在引物设计时要尽量避免引物之间的二聚体对扩增结果的影响,同时尽量避免大量重复序列和突变位点),设计了5组sbmv-cp基因序列的cpa引物(表1),每组引物包含5条引物,包括交叉引物等温cpf(40bp)、外围剥离单链的引物bf/br(19bp)以及扩增引物dr/mbr(19bp)。s3组外围置换引物sbbf1的核苷酸序列如seqidno.1所示,外围置换引物sbbf1的核苷酸序列如seqidno.2所示,扩增引物sbdr1的核苷酸序列如seqidno.3所示,扩增引物sbmbr1的核苷酸序列如seqidno.4所示,交叉引物等温sbcpf1的核苷酸序列如seqidno.5所示,s1组对应的核苷酸序列如seqidno.6~seqidno.10所示;s2组对应的核苷酸序列如seqidno.11~seqidno.15所示;s4组对应的核苷酸序列如seqidno.16~seqidno.20所示。
引物合成由上海桑尼生物科技有限公司完成。
实施例2:交叉引物等温恒温扩增引物在检测南方菜豆花叶病毒中的应用
一、引物筛选
以南方菜豆花叶病毒总rna为模板,利用实时荧光交叉引物等温扩增筛选检测南方菜豆花叶病毒5组引物组。结果如图(1)所示:经过实时荧光交叉引物等温扩增检测,确定用于检测南方菜豆花叶病毒的交叉引物等温扩增的引物组s3(表1),引物组s3包括外围置换引物(sbbf3和sbbr3)、两条扩增引物(sbdr3和sbmbr3)和1条交叉引物等温(sbcpf3)。
表1南方菜豆花叶病毒交叉引物等温扩增反应引物信息表
二、实时荧光交叉引物等温检测方法的建立
(1)实时荧光rt-cpa使用实时荧光仪器:cfxconnectreal-timesystem(bio-rad,america)。
(2)表2南方菜豆花叶病毒交叉引物等温扩增反应体系
实时荧光反应体系需要在表2中的反应体系中加入0.5μl的sytotm16greenfluorescentnucleicacidstain(100μmol/l,thermofisher),其余与表2种的反应体系一致。
(3)结果判定:
是否出现扩增曲线,
阴性—未出现扩增曲线,未收集到荧光信号;
阳性—出现扩增曲线,收集到荧光信号;
无效—扩增曲线杂乱,且断裂的情况。
(4)实时荧光方法反应程序:
实时荧光交叉引物等温扩增在60℃恒温下反应90min,荧光每60s监测一次,1min为一个周期,并选择第一通道中的fam通道(激发波长和发射波长在450-490nm)作为荧光的吸收通道。
三、试纸条检测方法的建立
交叉引物等温等温扩增结合核酸试纸条的检测方法反应需要使用pcr仪器(bio-radt100tmthermalcycler,america)。交叉引物等温等温扩增结合核酸试纸条的检测方法反应体系与表2所示反应体系相同,交叉引物等温等温扩增结合核酸试纸条的检测方法体系中需要对扩增引物sbdr和sbmbr进行标记,在扩增引物dr的5’端标记6-羧基荧光素(fam),在另一条扩增引物mbr的5’端标记生物素(biotin)。
交叉引物等温等温扩增结合核酸试纸条的检测方法在60℃恒温下反应90min,反应结束后将核酸试纸条插入到pcr管中,2-5min后即可观察结果。
核酸试纸条的结果鉴定方法如下:
阴性(-):仅在质控线(controlband)出现一条蓝色条带,在检测线(testband)无条带出现。证明所检测的样本没有南方菜豆花叶病毒侵染。
阳性(+):出现两条条带,质控线出现一条红色或蓝色条带,检测线出现一条红色条带。证明所检测的样本为南方菜豆花叶病毒侵染。
四:交叉引物等温扩增检测体系特异性、灵敏度分析
1.实时荧光检测方法
(1)特异性分析
利用5种大豆种传检疫性病毒(南方菜豆花叶病毒、番茄环斑病毒、南芥菜花叶病毒、烟草环斑病毒和菜豆荚斑驳病毒)的总rna为模板检测体系的特异性,同时以水为模板设置阴性对照。利用交叉引物等温实时荧光检测体系,进行引物组s3检测南方菜豆花叶病毒的特异性评估,利用实时荧光pcr仪对扩增反应过程进行实时监测。引物组s3的特异性评估结果如图(2)所示:以南方菜豆花叶病毒总rna为模板的交叉引物等温扩增反应产物出现扩增曲线;以南方菜豆花叶病毒、番茄环斑病毒、南芥菜花叶病毒和烟草环斑病毒总rna为模板的交叉引物等温扩增反应没有出现荧光扩增曲线,且以水为模板的阴性对照也没有出现扩增曲线。结果显示引物组s3检测体系特异性良好,可特异的检测到南方菜豆花叶病毒,最终确定引物组s3为交叉引物等温扩增检测南方菜豆花叶病毒试剂盒中引物组。
(2)灵敏度分析
用rnase-freeddh2o将sbmv样品总rna(50ng/μl)连续10倍梯度稀释,设立7个梯度,以按梯度稀释的sbmv总rna为模板,同时设置水为模板作阴性对照,得到的结果如图(3)所示:100-10-5稀释梯度的sbmv总rna模板都出现了扩增曲线,即模板浓度为5ng/μl、0.5ng/μl、5×10-2ng/μl、5×10ng/μl和5×10-4ng/μl的sbmv总rna模板能实现扩增,实时荧光cpa检测sbmv的检测限为5×10-4ng/μl。
2.核酸试纸条检测方法
(1)特异性分析
同样利用五种大豆种传检疫性病毒(南方菜豆花叶病毒、番茄环斑病毒、南芥菜花叶病毒、烟草环斑病毒和菜豆荚斑驳病毒)的总rna为模板检测体系的特异性,同时以水为模板设置阴性对照。反应体系如表2所示,使用一次性核酸试纸条对产物进行检测。结果如图(4)所示:以南方菜豆花叶病毒总rna为模板的交叉引物等温扩增反应产物出现两条条带,质控线和检测线都出现红色条带;以菜豆荚斑驳病毒、番茄环斑病毒、南芥菜花叶病毒和烟草环斑病毒总rna为模板的交叉引物等温扩增反应产物,仅在质控线出现一条蓝色条带,检测线无条带出现。结果显示核酸试纸条交叉引物等温扩增检测体系特异性良好,可特异的检测到南方菜豆花叶病毒。
(2)灵敏度分析
用rnase-freeddh2o将sbmv样品总rna(50ng/μl)连续10倍梯度稀释,设立7个梯度,以按梯度稀释的sbmv总rna为模板,同时设置水为模板作阴性对照,使用一次性核酸试纸条对产物进行检测,得到的结果如图(5)所示:100和10-1稀释梯度,即浓度为5ng/μl和0.5ng/μl的sbmv总rna模板的交叉引物等温扩增产物出现两条条带,cpa结合核酸试纸条检测sbmv灵敏度可达5ng/μl。
3.taq-man实时荧光rt-pcr
为了比较本研究建立的交叉引物等温扩增检测方法与taqman-mgb实时荧光rt-pcr检测灵敏度,参考白静等设计的sbmv引物和探针(表3,seqidno.23~seqidno.25),将连续10倍梯度稀释的sbmv总rna进行rt-qpcr反应,分析比较交叉引物等温扩增技术和rt-qpcr检测sbmv的灵敏度差异。rt-qpcr50μl反应体系如(表4)所示。rt-qpcr反应程序为:50℃反转录30min;95℃预变性3min;95℃预变形15s,60℃延伸30s,40个循环(在循环步骤收集荧光)。taq-man实时荧光rt-pcr的检测结果如图(6)所示,100~10-6共7个稀释梯度都出现扩增曲线,taq-man实时荧光rt-pcr检测sbmv灵敏度可达5×10-5ng/μl。
表3用于rt-qpcr检测sbmv引物和探针
表4rt-qpcr反应体系
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
序列表
<110>中国计量大学
<120>检测南方菜豆花叶病毒的交叉引物等温扩增引物组、试剂盒及应用
<160>25
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>1
tccgttcatatgggtttcc19
<210>2
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>2
tgtccagatacatagcctctgtatgatatggctgacaccc40
<210>3
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttggacaactggttaacgg19
<210>4
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>4
tgtccagatacatagcctc19
<210>5
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>5
ggtcgtgatagcattggca19
<210>6
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>6
atggcgaagaggctgacaa19
<210>7
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggtagactgaggctgccttgtcagttagccaaggctatag40
<210>8
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>8
tgggcctcctcgattgagt19
<210>9
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>9
ggtagactgaggctgcctt19
<210>10
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>10
gcaataggggccatggata19
<210>11
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>11
agaacggctggaggagtaa19
<210>12
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>12
cataacaagctcggaagagatacgcactccgagctctcaa40
<210>13
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>13
ctatcgcattcgtcacagc19
<210>14
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>14
cataacaagctcggaagag19
<210>15
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>15
atacctcaccgacaccaga19
<210>16
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>16
gaagtggtatcctttcaag19
<210>17
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>17
catggctatcactagcctacttagtacggatttcactgcc40
<210>18
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>18
atgttgacgttaacgccaa19
<210>19
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>19
catggctatcactagccta19
<210>20
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>20
ctcaatcagctgtacagtg19
<210>21
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>21
tacaaaatcaaagtccgcgct21
<210>22
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>22
ggtgcaggtattattatacaactcc25
<210>23
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>23
ttcatatgggtttccaatatcatat25
<210>24
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>24
cctgtccagatacatagcctctaagg26
<210>25
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>25
ccgtatccgttaaccagtt19
- 还没有人留言评论。精彩留言会获得点赞!