仿生肾器官芯片结构和仿生肝肾芯片结构
本发明属于人类仿生器官芯片技术领域,具体涉及一种仿生肾器官芯片结构和仿生肝肾芯片结构。
背景技术:
肝脏和肾脏是人体内的主要解毒器官。为了研究肝脏和肾脏的解毒功能,常常使用仿生肝脏芯片和仿生肾脏芯片。然而,当前的肝脏芯片与人体肝脏组织的结构差异较大,难以较为真实和准确地模拟肝脏内的代谢情况,这会导致模拟结果与实际结果差异较大,不利于取得较为准确的药代动力学实验数据或毒性实验数据。当前的肾脏芯片也存在同样的问题。另外,研究者们常常单独研究肝脏芯片和肾脏芯片进行研究,而缺乏将两种仿生器官的代谢过程结合起来进行研究的操作,这会导致研究结果无法包含肝脏和肾脏之间的通讯,从而缺失器官之间的药代动力学作用和毒性作用。
技术实现要素:
本申请的一个目的在于提供一种仿生肾小球芯片结构。该结构能够较为真实和准确地模拟肾小球的过滤功能,从而为肾小球的药代动力学特性和解毒作用提供数据支撑,进而为药物安全性评估及新药研发提供依据。
本申请的另一个目的在于提供一种仿生肾小管芯片结构,该结构能够较为真实和准确地模拟肾小管的重吸收功能,从而为肾小管的药代动力学特性和解毒作用提供数据支撑,进而为药物安全性评估及新药研发提供依据。
本申请的再一个目的在于提供一种仿生肾器官芯片结构,其将仿生肾小球芯片结构和仿生肾小管芯片结构相结合,从而将肾小球对相关液体的过滤功能和肾小管对滤液的重吸收功能结合在一起进行研究,能够较为真实和准确地模拟肾器官整体上的药代动力学特性和解毒特性。
本申请的其它一个目的在于提供一种仿生肝肾芯片结构,其将仿生肝器官芯片结构、仿生肾器官芯片结构和用于支持两种芯片结构之间液体循环的循环微结构相结合,从而将仿生肝脏和仿生肾脏的功能结合在一起进行研究,既能模拟或检测单个仿生器官的作用,又能模拟或检测两个仿生器官之间的生理通讯以及对整个循环系统的响应,使所获得的药物安全性评价结果具有较高的准确性。
为了达到上述目的,本申请提供了一种仿生肾小球芯片结构,包括:顶层芯片、底层芯片以及设于顶层芯片和底层芯片之间的过滤膜层;
其中,顶层芯片包括:
进液流道,至少接收进液;
出液流道,至少排出进液中的未过滤液;以及
仿生流道,分别与进液流道和出液流道相连通,其横截面积从与进液流道相连通的第一端部至与出液流道相连通的第二端部的方向逐渐缩小;
过滤膜层对进液进行过滤并向底层芯片排出滤液,其覆盖面积大于或等于仿生流道的覆盖面积;
底层芯片包括:
滤液腔室,容纳滤液;以及
滤液流道,至少排出滤液。
在一些实施例中,仿生肾小球芯片结构还包括:设有中间流道的中间层芯片;
其中,过滤膜层还包括:
第一过滤膜,其设于仿生流道和中间流道之间并且其覆盖面积大于仿生流道,使进液经过滤后在中间流道中形成中间滤液;以及
第二过滤膜,其设于中间流道和滤液腔室之间,并且其覆盖面积大于中间流道,使中间滤液经过滤后在滤液腔室中形成滤液。
在一些实施例中,第一端部的横截面积可以等于第二端部的横截面积的1.5倍至3倍。
在一些实施例中,进液流道的横截面积可以大于出液流道的横截面积。
在一些实施例中,中间流道的横截面积的变化趋势与仿生流道的变化趋势一致。
在一些实施例中,中间流道的尺寸等于仿生流道的尺寸。
在一些实施例中,滤液腔室的横截面积的变化趋势与仿生流道的变化趋势一致。
在一些实施例中,滤液腔室的尺寸等于仿生流道的尺寸。
在一些实施例中,第一过滤膜的靠近仿生流道的表面上接种人类肾小球内皮细胞。
在一些实施例中,第一过滤膜的靠近中间流道的表面上不接种细胞。
在一些实施例中,第二过滤膜的靠近中间流道的表面上不接种细胞。
在一些实施例中,第二过滤膜的靠近滤液腔室的表面上接种人类足细胞。
在一些实施例中,第一过滤膜为多孔聚酯膜。
在一些实施例中,第二过滤膜为表面经过糖蛋白、带阴电荷的硫酸类肝素、胶原ⅳ、层粘连蛋白和纤粘连蛋白修饰的多孔聚酯膜。
在一些实施例中,进液流道接收人类肾小球内皮细胞的细胞悬液,并将其输送至仿生流道,以便第一过滤膜的靠近仿生流道的表面上接种人类肾小球内皮细胞。
在一些实施例中,顶层芯片包括:
入口流道,贯穿中间层芯片并深入底层芯片中,用于接收人类足细胞的细胞悬液,以便在第二过滤膜的靠近滤液腔室的表面上接种人类足细胞;以及
出口流道,贯穿中间层芯片并且与滤液流道相连通。
本申请还提供了一种仿生肾小管芯片结构,其包括:顶部芯片、底部芯片以及设于顶部芯片和底部芯片之间的多孔膜层;
其中,顶部芯片包括:
进液通道,至少接收滤液并将该滤液输送至底部芯片;
重吸收腔室,储存滤液中被重吸收的重吸收液体;以及
排液通道,与重吸收腔室流体相连,排放重吸收液体;
多孔膜层具有用于使重吸收液体沿着自底部芯片向顶部芯片的方向通过的孔道;
底部芯片包括:
储液腔室,储存滤液。
在一些实施例中,仿生肾小管芯片结构还包括:设有通孔的中间部芯片;
其中,多孔膜层包括:
第一多孔膜,设于重吸收腔室和通孔之间并且其覆盖面积大于通孔,;以及
第二多孔膜,设于孔道与储液腔室之间并且其覆盖面积大于储液腔室。
在一些实施例中,第一多孔膜的靠近重吸收腔室的表面上接种肾小管近端上皮细胞。
在一些实施例中,第一多孔膜和第二多孔膜为采用胶原基质修饰的多孔聚酯膜。
在一些实施例中,第二多孔膜的靠近储液腔室的表面上接种人脐静脉血管内皮细胞。
在一些实施例中,进液通道311接收人脐静脉血管内皮细胞的细胞悬液,以便在第二多孔膜的靠近重吸收腔室的表面上接种人脐静脉血管内皮细胞。
在一些实施例中,顶部芯片包括:接种通道312,接收肾小管近端上皮细胞的细胞悬液,并将其输送至重吸收腔室,以便第一多孔膜的靠近重吸收腔室的表面上接种肾小管近端上皮细胞。
本申请还提供了一种仿生肾器官芯片结构,其包括:
仿生肾小球芯片结构,对进液进行过滤以产生滤液;以及
仿生肾小管芯片结构;对滤液进行重吸收,产生重吸收液。
本申请还提供了一种仿生肝肾芯片结构,其包括:
循环微结构,包括第一出口、第二出口、第一进口、第二进口、第三进口;
仿生肾小球芯片结构,对来自于第一出口的第一进液进行过滤以产生滤液,并将第一进液中的未过滤液输送至第一进口;
仿生肾器官芯片结构;对滤液进行重吸收以产生重吸收液,并将该重吸收液输送至第三进口;以及
仿生肝器官芯片,其一端接收来自于第二出口的第二进液,并将第二进液经处理后的排出液输送至第二进口。
在一些实施例中,仿生肝器官芯片包括:
进液管道组,接收第二进液;
多个容置腔室,相邻两个容置腔室之间通过多条流体连接管道相连;
肝小叶模型,设于容置腔室内;以及
出液管道组,对排出液进行排放。
在一些实施例中,进液管道组包括位于侧边的侧进液管道和位于中间的中间进液管道,中间进液管道的形状为弯折型。
由于采用以上技术方案,本申请取得了以下技术效果:
本申请提供了一种仿生肾器官芯片结构和仿生肝肾芯片结构。本申请的仿生肾器官芯片结构将仿生肾小球芯片结构和仿生肾小管芯片结构相结合,从而将肾小球对相关液体的过滤功能和肾小管对滤液的重吸收功能相结合,能够较为真实和准确地模拟肾器官整体上的药代动力学特性和解毒特性。本申请的仿生肝肾芯片结构将仿生肝器官芯片结构、仿生肾器官芯片结构和循环微结构相结合,从而将仿生肝脏和仿生肾脏的功能相结合,既能模拟或检测单个仿生器官的作用,又能模拟或检测两个仿生器官之间的生理通讯以及对整个循环系统的响应,使所获得的药物安全性评价结果具有较高的准确性。
具体而言,本申请利用生物3d打印及微流控芯片构建了三维肝小叶模型器官芯片,利用多层流道结构和多孔膜模拟肾器官芯片,并且利用实现两者之间的血液循环以构建药物毒性评估平台。生物3d打印技术可以得到多细胞仿生有序排列的类肝小叶结构模型,微流控芯片内部微流道为细胞提供生长微环境,两者结合可获得功能完备的肝脏微结构。在微流控流道中利用高度差以及修饰的多孔膜模拟渗透压先实现肾小球生理过滤,再通过流道内培养的上皮细胞完成重吸收,实现肾脏的排泄功能。循环系统通过微泵和微流道实现,药物和营养液通过支路分别流经肝脏和肾脏模型,肝脏流出物和肾脏重吸收部分汇入循环腔室,利用微泵在系统内持续循环,以模拟人体肝肾药物代谢。对肝肾细胞形态和代谢物进行检测来评估药物毒性,为新药研发提供了快速有效的体外测试平台。
附图说明
图1为本发明实施例一的仿生肾小球芯片结构的示意图;
图2为本发明实施例一的顶层芯片的俯视图;
图3为本发明实施例一的顶层芯片的立体图;
图4为本发明实施例一的仿生流道的立体图;
图5为本发明实施例一的仿生流道的俯视图;
图6为本发明实施例一的中间层芯片的立体图;
图7为本发明实施例二的仿生肾小管芯片结构的立体图;
图8为本发明实施例二的顶部芯片的俯视图;
图9为本发明实施例二的顶部芯片的立体图;
图10为本发明实施例二的中间部芯片的立体图;
图11为本发明实施例三的仿生肝肾芯片结构的俯视图;
图12为本发明实施例四的循环微结构的立体图;
图13为本发明实施例五的肝器官芯片的立体图。
附图标记:
肝器官芯片1、仿生肾小球芯片结构2、仿生肾小管芯片结构3、循环微结构4。
主体11、盖板12、容置腔室111、入口管道112、出口管道113、流体连接管道114、分支管道115、分流管道116。
仿生肾小球芯片结构20、顶层芯片21、第一过滤膜210、入口流道211、进液流道212、仿生流道213、出液流道214、出口流道215、中间层芯片22、第二过滤膜220、第一贯通孔221、中间流道222、第二贯通孔223、底层芯片23、第二进液柱231、滤液腔室232、滤液流道233、第一进液柱241、第一总流道242、第一分支流道243、第一端部244、第二端部245、第二分支流道246、第二总流道247、第一出液柱248、第三总流道249、第三分支流道250、变化前的边缘线251、第四分支流道252、第四总流道253、第二出液柱254。
顶部芯片31、第一多孔膜310、进液通道311、接种通道312、重吸收腔室313、溶液缓冲室314、排液通道315、接种通道316、排液柱317、顶层采样柱318、中间部芯片32、第二多孔膜320、第三贯通孔321、第二贯通孔322、底部芯片33、底层进液柱331、底层采样柱332、储液腔室333、底层进液通道334、底层缓冲室335、底层采样通道336、通孔342。
样品进口411、第二出口412、第一出口413、第二进口414、第一进口415、第三进口416、取样管道417、第三出口418、侧边进液管道419、中间进液管道420、混合腔室421、循环腔室422、水凝胶支架423、第一分流管道424、第二分流管道425、第一容置腔室426、第二容置腔室427。
具体实施方式
以下结合具体实施方式对本申请的技术进行详细的描述。应当知道的是,以下具体实施方式仅用于帮助本领域技术人员理解本申请,而非对本申请的限制。本文中对于方向(如上、下、左、右、前、后等)的描述仅针对其在图中相应的方向而言,并不意味着该方向即为实际放置时所采用的方向。
本发明的技术方案中包括仿生肾小球芯片结构、仿生肾小管芯片结构、仿生肝器官芯片和仿生肝肾芯片结构,其是发明人基于以下考虑而研发所得的。
人体内的肝脏在维持正常生理活动中起着关键性作用(例如血糖和氨水平的控制、各种激素的合成、内源性和外源性物质的解毒等)。虽然其具有一定的再生能力以应对物理损伤和化学损伤,但是药物的不良反应(尤其是慢性毒副作用)会削弱其执行生理功能的能力。另外,除肝脏外,肾脏也是人体中药物清除和产生药物诱导毒性的主要部位。因此,有必要研究两种脏器的解毒功能。
目前,有的研究者采用在哺乳动物中建立体内模型来研究药物对肝和肾的效用,但是由于动物器官与人体存在差异,这种模型模拟人体的准确性较差。另一些研究者采用器官芯片(肝芯片和肾芯片)等来模拟人体器官,虽然其可以最大程度上模拟人体器官,但是往往单独研究单片肝或单片肾,这种方法未能考虑两种器官之间的通讯,从而在药物毒性测试期间缺乏多个器官之间的药代动力学特性和毒性作用。
由于在人体内,药物在肝脏和肾脏之间通过体内动静脉组成的循环系统进行生理循环代谢,因此,本发明人除了构建能够较为真实模拟肝脏的仿生肝器官芯片结构和能够较为真实模拟肾脏的仿生肾器官芯片结构之外,还构建了上述两种芯片结构有机结合的整体系统(即仿生肝肾芯片结构)。该仿生肝肾芯片结构基于微流控技术,在流体中添加生长因子或特定小分子物质,通过对流体的操控来模拟人体动态微环境以及模拟肝肾的供血系统;利用3d生物打印技术构造肝三维结构,其利用3d打印而成的水凝胶支架以及特定的细胞外基质诱导肝系细胞在立体空间上仿生排布,从而制成仿生肝器官芯片结构;利用多层芯片叠加结构和多层多孔聚酯膜来构建近端肾小管模型,从而制成仿生肾小管芯片结构;利用多层芯片结构、多层膜和渐扩通道建立肾小球模型,从而制成仿生肾小球芯片结构;利用交错的微通道组合构建连接仿生肝器官芯片结构(简称肝芯片)和仿生肾器官芯片结构(简称肾芯片)的仿生循环系统(又称循环微结构),从而实现对肝肾生物信息交流的循环系统的模拟。因此,本发明既能单独实现肝芯片的肝功能模拟和肾芯片的肾功能模拟,也能实现肝肾之间的生理通讯模拟。实验证明,本发明的模型能够用于肝脏和肾脏药物毒性测试和药物研发,其药物安全性评价结果具有较高的准确性,是药物临床前测试的有效方法。
以下结合实施例对本申请作进一步的说明。
实施例一
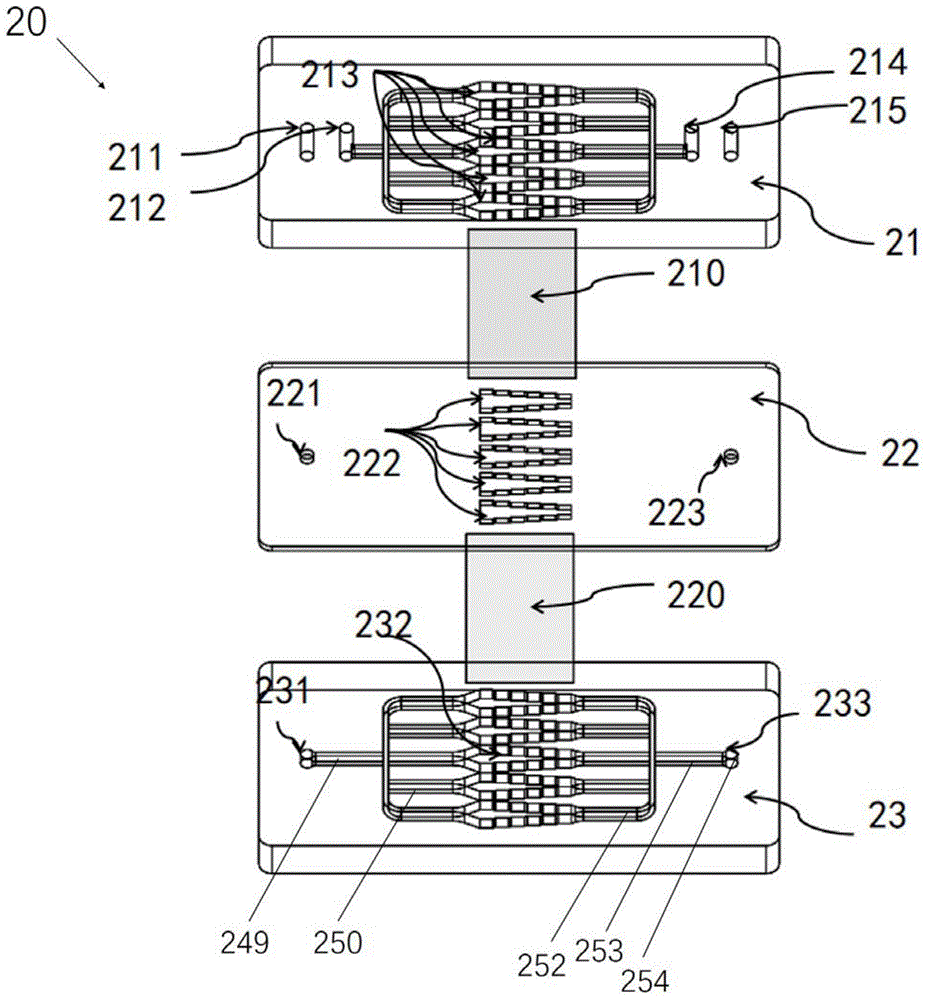
如图1所示,本实施例提供了一种仿生肾小球芯片结构20,其能够模拟人体肾脏器官中肾小球的过滤功能。该仿生肾小球芯片结构20包括:自上而下依次排列的顶层芯片21、第一过滤膜210、中间层芯片22、第二过滤膜220、底层芯片23等。
如图2和图3所示,顶层芯片21至少包括:进液流道212、仿生流道213和出液流道214。
其中,进液流道212用于接收和向下游输送功能液体(例如:进液、接种的细胞悬液、药液等)。进液流道212又包括依次连通的第一进液柱241、第一总流道242、第一分支流道243。第一进液柱241从顶层芯片21的上表面向其下表面凹陷,即凹陷入顶层芯片21内,用于接收功能液体。第一总流道242与第一进液柱241的连通处位于第一进液柱241的侧面高度的1/2以上,因此,当功能液体的液面上升至第一进液柱241的连通处后,再沿着第一总流道242向下游流动,这样能够避免气泡进入管道,从而避免气泡对整个循环过程或测试过程的影响。第一总流道242的下游分支成五条独立传输功能液体的第一分支流道243。在其它的实施例中,第一分支流道243的数目也可以不限于五条,少于五条(如三条或四条),多于五条(如六条或七条等)均可以。这五条第一分支流道243整体上呈平行排列,并且路径长度均相同,以避免流体路径长度的不同对检测结果带来影响。
仿生流道213位于进液流道212的下游。本实施例的仿生流道213一共有五条,每条仿生流道213的上游端与相应的第一分支流道243的下游端相连通。五条仿生流道213的中轴线相互平行,因此,功能液体在五条仿生流道213中的流经路径的长度和流体动力学特性等参数均相同,属于五次平行实验。在其它的实施例中,仿生流道213的数目也可以不限于五条,少于五条(如三条或四条),多于五条(如六条或七条等)均可以。仿生流道213的数目应当等于第一分支流道243的数目。仿生流道213整体上呈楔形结构,即其横截面积沿着与进液流道212的第一分支流道243相连通的第一端部244至与出液流道214相连通的第二端部245的方向具有逐渐缩小的趋势。在本实施例中,仿生流道213的第一端部244的横截面积为第二端部245的2倍。然而,在其它的一些实施例中,第一端部244的横截面积也可以不限于2倍,例如,第一端部244等于第二端部245的横截面积的1.5倍至3倍。在本实施例中,仿生流道213的横截面积的缩小趋势为折线形趋势,即每隔一段距离,横截面积会缩小一个数值。在每个横截面积的缩小处,仿生流道213的边缘线的斜率均会发生变化,即变化前的边缘线251的斜率小于变化后的边缘线252的斜率。如图4和图5所示,变化前的边缘线251与变化后的边缘线252所成的锐角为a。由于斜率的变化每隔一段距离(优选为每隔一段相同的距离)重复一次,因此,仿生流道213的边缘线呈现规律性渐缩结构。图3中的箭头表示水平面上液体的流向。液体在渗透时的渗透方向是自上而下。
出液流道214设于仿生流道213的下游,与仿生流道213相连通,用于排出未处理的功能液体,如进液中的未过滤液、已接种后的细胞悬液、废弃的药液等。出液流道214又包括依次连通的第二分支流道246、第二总流道247和第一出液柱248。第二分支流道246有五条,每条第二分支流道246的上游端均与对应的仿生流道213的下游端相连通。五条第二分支流道246相互平行排列。在其它的实施例中,第二分支流道246的数目也可以不限于五条,少于五条(如三条或四条),多于五条(如六条或七条等)均可以。五条独立传输功能液体的第二分支流道246的下游端结合成第二总流道247。第二总流道247与第一出液柱248的连通处位于第一出液柱248的侧面高度的1/2以上。
第一过滤膜210和第二过滤膜220设于顶层芯片21和底层芯片23之间,并且第一过滤膜210和第二过滤膜220的中间设有中间层芯片22。因为第一过滤膜210和第二过滤膜220起到过滤作用,故可以统称为过滤膜层。过滤膜层用于对进液进行过滤并向底层芯片23排出已过滤的滤液。过滤膜层的覆盖面积一般大于或等于仿生流道213的覆盖面积,以避免漏液。
第一过滤膜210设于仿生流道213和中间层芯片22的中间流道222之间。第一过滤膜210对仿生流道213中的进液进行过滤并向下层排出已过滤的滤液。为了顺利实现过滤功能,仿生流道213的下底面贯通顶层芯片21并且与第一过滤膜210的上表面相接触,也即,仿生流道213的下底面对第一过滤膜210开放,但是顶层芯片21的其它结构并不贯通整个顶层芯片21的厚度,例如,进液流道212和出液流道214均不贯通顶层芯片21的下底面,因此,功能液体只能通过仿生流道213下方区域的过滤膜向下渗透。另外,第一过滤膜210的覆盖面积大于或等于仿生流道213的覆盖面积。这样能够防止因为密封不严而导致的漏液现象,从而防止过滤失败的现象。第一过滤膜210可以为多孔聚酯膜,孔径范围为0.4微米。在本申请的其它实施例中,多孔聚酯膜的孔径范围在0.4微米至2微米范围内均可以,也可以在0.5微米至1.8微米范围内,还可以在0.8微米至1.5微米范围内,可以进一步在1.0微米至1.3微米范围内,还可以进一步在1.1微米至1.2微米范围内。
为了更好地模拟过滤作用,第一过滤膜210的靠近仿生流道213的表面上(图1中所示的第一过滤膜210的上表面)接种人类肾小球内皮细胞(hgecs)。在本实施例中,为了实现接种,需先制备人类肾小球内皮细胞的细胞悬液,并将该细胞悬液注入顶层芯片21的第一进液柱241中,使该细胞悬液经过进液流道212的第一总流道242和第一分支流道243而被输送至仿生流道213中。由于仿生流道213的下底面对第一过滤膜210开放,故第一过滤膜210的靠近仿生流道213的表面上(图1中所示的第一过滤膜210上表面)便会接种人类肾小球内皮细胞(hgecs)。待细胞接种完毕后,冲洗掉多余的细胞悬液即可。第一过滤膜210的靠近中间流道222的表面上(图1中所示的下表面)不接种细胞。
如图6所示,中间层芯片22设于第一过滤膜210和第二过滤膜220之间。中间层芯片22的中间区域设有中间流道222。中间流道222的位置正好位于仿生流道213的正下方,并且其排布方式与仿生流道213的排布方式一致。本实施例的中间流道222也设有5条,然而其数目可以不限于5条,只要与仿生流道213的设置数目相同即可。中间流道222的横截面积的变化趋势与仿生流道213的变化趋势一致。在一些实施例中,中间流道222的尺寸可以等于仿生流道213的尺寸。在另一些实施例中,中间流道222的尺寸可以大于仿生流道213的尺寸。但是仿生流道213和中间流道222的覆盖面积小于或等于第一过滤膜210的覆盖面积,从而使仿生流道213、第一过滤膜210和中间流道222之间形成半通透结构,以便仅允许滤液从上而下透过,而不允许未过滤液从第一过滤膜210的四周漏入中间流道222中。经过上述的过滤作用,从进液流道212输入的进液便经第一过滤膜210过滤后,渗透入中间流道222中,形成了中间滤液。在一些实施例中,中间流道222的两端可以设置为封闭结构,此时,仅中间流道222能够作为中间滤液的储存腔室。在另一些实施例中,中间流道222的两端也可以设置为敞口结构,此时,整个中间层芯片22的内腔均可以用来储存中间滤液。在一些实施例中,中间流道222的高度可以等于中间层芯片22的内腔的高度,此时,中间流道222的上表面与第一过滤膜210的下表面紧密接触,以便与仿生流道213一起挟持第一过滤膜210。在另一些实施例中,中间流道222的高度可以小于中间层芯片22的内腔的高度,此时,中间流道222的上表面并不与第一过滤膜210的下表面紧密接触,而由中间层芯片22的内腔的两条侧边与仿生流道213一起挟持第一过滤膜210。
第二过滤膜220设于中间流道222和底层芯片23的滤液腔室232之间,并且其覆盖面积大于中间流道222和滤液腔室232的覆盖面积,使中间滤液经第二过滤膜220过滤后在滤液腔室232中形成滤液。第二过滤膜220的靠近中间流道222的表面上(图1中所示的第二过滤膜220的上表面)不接种细胞,第二过滤膜220的靠近滤液腔室232的表面上接种人类足细胞(podocyte,又称肾小囊脏层上皮细胞)。第二过滤膜220为表面经过糖蛋白、带阴电荷的硫酸类肝素、胶原ⅳ、层粘连蛋白和纤粘连蛋白修饰的多孔聚酯膜,以有利于人类足细胞的粘附。第二过滤膜220的孔径范围为0.5微米。在本申请的其它实施例中,多孔聚酯膜的孔径范围在0.4微米至2微米范围内均可以,也可以在0.6微米至1.8微米范围内,还可以在0.8微米至1.5微米范围内,可以进一步在1.0微米至1.3微米范围内,还可以进一步在1.1微米至1.2微米范围内。
底层芯片23设于第二过滤膜220的下方,其包括:滤液腔室232和滤液流道233。滤液腔室232用于容纳经过第一过滤膜210和第二过滤膜220过滤后的滤液,因此,为了避免中间滤液从第二过滤膜220的边缘漏入滤液腔室232中,滤液腔室232的覆盖面积应当小于第二过滤膜220的覆盖面积。滤液流道233与滤液腔室232相连通,用于排出滤液。在本实施例中,底层芯片23的结构类似于顶层芯片21的结构,因此,滤液腔室232也有五个,每个滤液腔室232排布于对应的仿生流道213和中间流道222的正下方。因为上述三种流道自上而下排列具有一致性,所以能够很好地模拟进液从上而下的渗透过程。滤液腔室232的横截面积的变化趋势与仿生流道213的变化趋势一致。在一些实施例中,滤液腔室232尺寸等于仿生流道的尺寸。在另一些实施例中,滤液腔室232的数目也可以不限于5个。
在一些实施例中,可以对第二过滤膜220的下表面(即靠近滤液腔室232的表面)接种细胞,因此,可以在顶层芯片21上设置入口流道211和出口流道215,从而实现利用上述结构进行直接接种。第二过滤膜220的上表面(即靠近中间流道222的表面)并不接种细胞。
其中,顶层芯片21上的入口流道211贯穿顶层芯片21和中间层芯片22,并且深入底层芯片23中。入口流道211在中间层芯片22上形成第一贯通孔221,该第一贯通孔221对中间层芯片22的内腔封闭,以使接种液(如人类足细胞的细胞悬液等)不漏入中间层芯片22的内腔中。入口流道211嵌入底层芯片23的部分形成第二进液柱231。因此,入口流道211包括依次连通的第二进液柱231、第三总流道249、第三分支流道250。第二进液柱231从底层芯片23的上表面向其下表面凹陷,即凹陷入底层芯片23内,用于接收接种液体。第三总流道249与第二进液柱231的连通处位于第二进液柱231的侧面高度的1/2以上,因此,当接种液体的液面到达第二进液柱231的连通处后,再沿着第三总流道249向下游流动,这样能够避免气泡进入管道,从而避免气泡对整个循环过程或测试过程的影响。第三总流道249的下游分支成五条独立传输功能液体的第三分支流道250。在其它的实施例中,第三分支流道250的数目也可以不限于五条,少于五条(如三条或四条),多于五条(如六条或七条等)均可以。第三分支流道250的数目等于滤液腔室232的数目。这五条第三分支流道250整体上呈平行排列,以避免流体路径长度不同而对测试结果造成影响。底层芯片23的滤液腔室232的上游端与对应的入口流道211的第三分支流道250的下游端相连通,并且该滤液腔室232的下游端与滤液流道233相连通。滤液流道233的结构与出液流道214相同,也包括第四分支流道252、第四总流道253和第二出液柱254。
顶层芯片21上的出口流道215贯穿中间层芯片22和顶层芯片21,并且与底层芯片23的滤液流道233相连通,以便排出滤液或多余的接种液等液体。出口流道215在中间层芯片22上形成第二贯通孔223,该第二贯通孔223对中间层芯片22的内腔封闭,以使接种液(如人类足细胞的细胞悬液)不漏入中间层芯片22的内腔中。
具体的接种方法为:从顶层芯片21上的入口流道211中注入人类足细胞的细胞悬液,该细胞悬液经过第二进液柱231后进入滤液腔室232内。因为第二过滤膜220的下表面与滤液腔室232紧密接触,所以第二过滤膜220的靠近滤液腔室232的表面上(图1中所示的第二过滤膜220的下表面)会接种人类足细胞。待细胞接种完毕后,排出多余的细胞悬液即可。
在上述的结构中,顶层芯片21可以视为第一层pdms芯片21(polydimethylsiloxane,中文名称为聚二甲基硅氧烷,简称为pdms)。该顶层芯片21设有内皮细胞培养腔室(由仿生流道213和第一过滤膜210共同形成)。该内皮细胞培养腔室包括细胞接种入口(入口流道211、进液流道212)、培养基和药物入口(入口流道211)、5条仿肾小球毛细血管小叶的通道(仿生流道213),通道入口的横向长度与出口的横向长度的比例为2:1。
在上述的结构中,中间层芯片22可以视为第二层pdms芯片,其上放置第一过滤膜210。该第一过滤膜210为多孔聚酯膜,膜上培养人类肾小球内皮细胞,作为肾小球滤过膜的第一层,以充当静电屏障。中间流道222为空腔,用于滤液的暂存或流通。
在上述的结构中,底层芯片23可以视为第三层pdms芯片,其上放置由糖蛋白,带阴电荷的硫酸类肝素和胶原ⅳ、层粘连蛋白、纤粘连蛋白等修饰的第二过滤膜220。该第二过滤膜220为多孔聚酯膜,充当肾小球的基底膜。第二过滤膜220的靠近滤液腔室232的表面附着肾小囊脏层上皮细胞(又称人足细胞),起选择性过滤作用。第三层pdms芯片的滤液腔室232为肾小球滤过液收集腔室,在有效过滤压下过滤的液体从出口(滤液流道233、第二贯通孔223、出口流道215)流向肾小管芯片3,未过滤的液体则从出口(出液流道214)流向循环微结构4。
在上述的结构中,进液流道212的横截面积是出液流道214的横截面积的2倍,然而,也不限于2倍,可以为3倍、4倍等,只要保证进液流道212的横截面积大于出液流道214的横截面积即可。另外,内皮细胞腔室(由仿生流道213和第一过滤膜210共同形成)与进液流道212的第一分支流道243的连接处至与出液流道214的第二分支流道246的连接处的横截面积逐渐减小。上述结构能在过滤区域产生压强差,从而为肾小球过滤提供动力。由上述可知,本实施例的肾小球芯片结构设置为三层pdms芯片与两层多孔聚酯膜的堆叠结构。具体为:
第一层pdms芯片设置肾动脉入口(进液流道212)、两种细胞的接种入口(进液流道212、入口流道211)、5条渐缩的动脉毛细血管小叶(仿生流道213)、肾动脉出口(出液流道214)和超滤液出口(出口流道215)。通过模拟体内入球小动脉与出球小动脉直径比(2:1)来设置动脉毛细血管小叶的进出口宽度,设计宽度分别为20mm(仿生流道213的进口宽度)与10mm(仿生流道213的出口宽度)。如图11所示,肾动脉入口(进液流道212)连接循环微结构4的药物和营养物质的出口(第一出口413),毛细血管小叶通道为内皮细胞培养腔室(仿生流道213),肾动脉出口(出液流道214)连接循环微结构4的药物循环腔室入口(第一进口415)。
第二层pdms芯片上放置多孔聚酯膜(第一多孔膜310),该多孔聚酯膜上接种人类肾小球内皮细胞充当静电屏。
第三层pdms芯片上放置由糖蛋白、带阴电荷的硫酸类肝素和胶原ⅳ、层粘连蛋白、纤粘连蛋白等修饰的多孔聚酯膜(第二多孔膜320),充当肾小球的基底膜。并且第二多孔膜320的下表面附着肾小囊脏层上皮细胞,起选择性滤过作用。该第三层pdms芯片上设置肾小球滤过液收集腔室(滤液腔室232),储存过滤后的滤液。过滤后的液体从超滤液出口(出口流道215)排出去。
实施例二
如图7、图8和图9所示,本实施例提供了一种仿生肾小管芯片结构,其包括:从上至下依次排列的顶部芯片31、第一多孔膜310、中间部芯片32、第二多孔膜320和底部芯片33。
顶部芯片31包括:进液通道311、重吸收腔室313、排液通道315和排液柱317。进液通道311用于至少接收滤液并将该滤液输送至底部芯片33。该滤液可以为来自于实施例1的仿生肾小球芯片结构产生的滤液。重吸收腔室313用于储存被重新吸收后的液体(简称重吸收液体)。本实施例的重吸收腔室313有三个,作为三个平行对照实验。然而,重吸收腔室313的数目也可以不限于三个,例如2个、4个或5个均可以,只要保证每个重吸收腔室313的尺寸相同以保证平行实验的条件的一致性即可。在一些实施例中,如图8所示,如果有多个重吸收腔室313,则顶部芯片31的中央区域还可以设有溶液缓冲室314。溶液缓冲室314呈圆环结构,与多个重吸收腔室313溶液缓冲室314分别相连通。在一些实施例中,多个重吸收腔室313溶液缓冲室314平均分配于多个溶液缓冲室314的四周。溶液缓冲室314也能够使得多个溶液缓冲室314重吸收腔室313之间能够进行溶液交换,从而更真实地模拟肾小管之间的结构。在另一些实施例中,重吸收腔室313和溶液缓冲室314的形状均为圆形,但是重吸收腔室313的覆盖面积大于溶液缓冲室314的覆盖面积。排液通道315用于排放重吸收液体。排液通道315与重吸收腔室313的数目相同,与一一对应的重吸收腔室313相连通。排液柱317与排液通道315相连通,排液通道315与排液柱317的连通处位于排液柱317的侧面高度的1/2以下。
第一多孔膜310和第二多孔膜320统称为多孔膜层,其设于顶部芯片31和底部芯片33之间。本实施例中的多孔膜层与实施例的过滤膜层所起的作用不同,其主要起到重吸收的作用,而并非单纯起到过滤的作用。多孔膜层设有用于供重吸收液体通过的孔道,该孔道的孔径为0.6微米。然而,在其它的一些实施例中,孔道的孔径范围在0.4微米至2.0微米范围内均可以。第一多孔膜310和第二多孔膜320为采用胶原基质修饰的多孔聚酯膜。
第一多孔膜310设于顶部芯片31的重吸收腔室313和中间部芯片32的通孔342之间,其覆盖面积大于重吸收腔室313和通孔342的覆盖面积,从而实现液体从下至上的重吸收,以避免液体从第一多孔膜310的边缘漏入重吸收腔室313中,进而避免对重吸收液体的检测结果产生影响。
为了更好地模拟重吸收情况,需要对第一多孔膜310的靠近重吸收腔室313的表面上(图6中所示的上表面)接种肾小管近端上皮细胞(renalproximaltubularepithelialcells,简称rptecs),因此,重吸收腔室313也可以称为肾近端小管上皮细胞的培养腔室。在一些实施例中,为了实现采用本实施例的结构进行直接接种,需要在顶部芯片31设置接种柱316和接种通道312。接种柱316陷入顶部芯片31的内部。接种通道312的一端与接种柱316相连通,另一端与溶液缓冲室314相连通,溶液缓冲室314与重吸收腔室313相连通。接种通道312与接种柱316的连通处位于接种柱316的侧面高度的1/2以下。在一些实施例中,如果重吸收腔室313只有一个,那么接种通道312也可以直接与重吸收腔室313相连通。由于重吸收腔室313贯穿顶部芯片31,因此,重吸收腔室313的底面对第一多孔膜310开放并且与第一多孔膜310的上表面紧密接触。具体接种过程为:首先配制肾小管近端上皮细胞(rptecs)的细胞悬液,将该细胞悬液注入接种柱316中,细胞悬液经由接种通道312进入溶液缓冲室314,并且被溶液缓冲室314平均分配至三个重吸收腔室313中,作为三个平行样。由于重吸收腔室313对第一多孔膜310开放,因此,第一多孔膜310的靠近重吸收腔室313的表面上(图7中所示的第一多孔膜310的上表面)便接种了肾小管近端上皮细胞(rptecs)。待接种完毕后,移除多余的细胞悬液即可。第一多孔膜310的下表面(即接近中间部芯片32的通孔342的表面)并不接种细胞。
如图10所示,中间部芯片32设于第一多孔膜310和第二多孔膜320之间。其中间区域设有通孔342。该通孔342允许液体自下而上经过。通孔342的覆盖面积小于第一多孔膜310和第二多孔膜320的覆盖面积,以防止重吸收液体从第一多孔膜310和第二多孔膜320的边缘泄露,从而避免对重吸收结果的影响。在一些实施例中,通孔342的数目可以等于重吸收腔室313的数目。此时,通孔342的大小可以等于重吸收腔室313的大小。每一个通孔342对应设置于重吸收腔室313的正下方。各个通孔342之间间隔一定距离,所间隔的距离为实体结构,能够对其上表面的第一多孔膜310起到支撑作用,防止该第一多孔膜310在吸收腔室313的液体的重力作用下形变,进而避免液体从第一多孔膜310的边缘处泄露。
第二多孔膜320设于中间部芯片32的通孔342和底部芯片33的储液腔室333之间,并且其覆盖面积大于通孔342和底部芯片33的储液腔室333的覆盖面积,以防止漏液。第二多孔膜320的上表面(即靠近中间部芯片32的表面)不接种细胞,其下表面(即靠近底部芯片33的储液腔室333的表面)接种人脐静脉血管内皮细胞(huvecs)。
底部芯片33设于第二多孔膜320的下方,其包括底层进液柱331、底层进液通道334、储液腔室333、底层采样柱332、底层缓冲室335、底层采样通道336。底部芯片33的整体结构与顶层芯片31相类似。底部芯片33的底层进液柱331与顶层芯片31的进液通道311对应设置。底层进液柱331可以设于进液通道311的正下方。顶层芯片31的进液通道311贯穿中间部芯片32并深入底部芯片33中,其与中间部芯片32的贯穿处321对中间部芯片32封闭,因此,进液通道311内的液体不会渗入中间部芯片32内。进液通道311深入底部芯片33中的部分为底层进液柱331,该底层进液柱331与底层进液通道334相连通,将相关液体输送至底层缓冲室335。底层缓冲室335的周围平均分布着三个储液腔室333,因此,底层缓冲室335能够将液体平均分配至三个储液腔室333中,形成平行样。在其它的一些实施例中,储液腔室333的数目也可以不限于3个。在另一些实施例中,储液腔室333和底层缓冲室335的形状为圆形,并且储液腔室333的覆盖面积大于底层缓冲室335的覆盖面积。储液腔室333通过底层采样通道336与底层采样柱332相连通。3个底层采样柱332分别与对应的顶层采样柱318相连通,以便在顶部芯片31上就能实现对储液腔室333内的上清液采样。顶层采样柱318有3个,设于顶部芯片31上,然而,其数目也可以不限于3个。每个顶层采样柱318均贯穿中间部芯片32向下延伸,并且与底层采样柱332连通。顶层采样柱318贯穿中间部芯片32的位置形成第二贯通孔322,该第二贯通孔322对中间部芯片32的内腔封闭,以使液体不漏入中间部芯片32的内腔或芯片之间的间隙。底层采样柱332凹陷入底部芯片33内,因此,底层采样柱332一一对应设置于顶层采样柱318的正下方。顶部芯片31的进液通道311同样贯穿中间部芯片32并与底层进液柱331相连通,底层进液柱331向下凹陷入底部芯片33内,故底层进液柱331一一对应设置于进液通道311的正下方。进液通道311贯穿中间部芯片32的位置形成第三贯通孔321,该第三贯通孔321对中间部芯片32的内腔或芯片之间的间隙封闭,以使液体不漏入中间部芯片32的内腔或芯片之间的间隙中。从入口流道211进入的滤液中,未被重吸收的液体保留在储液腔室333中,已被重吸收的液体则在重吸收腔室313中储存。
为了更好地模拟重吸收情况,第二多孔膜320的靠近底部芯片33的储液腔室333的表面上需要接种人脐静脉血管内皮细胞(huvecs)。具体步骤如下:首先制备人脐静脉血管内皮细胞(huvecs)的细胞悬液,将其注入进液通道311中,细胞悬液自上而下流动,最终流入储液腔室333中。由于储液腔室333的上表面覆盖第二多孔膜320,而第二多孔膜320的表面经过修饰后容易使细胞发生附着,因此第二多孔膜320的靠近储液腔室333的表面上便接种人脐静脉血管内皮细胞(huvecs)。为了顺利实现接种,细胞悬液需要尽可能充满储液腔室333,故细胞悬液的上液面需要尽可能贴近第二多孔膜320的下表面。
由上述可知,本实施例的肾小管芯片结构设置为三层pdms芯片与两层多孔聚酯膜的堆叠结构。具体为:
第一层pdms芯片(顶部芯片31)具有三个环形的重吸收腔室313,以及环形的溶液缓冲室314。溶液缓冲室314能够将接种的细胞悬液平均分配至三个重吸收腔室313中,以便实现均匀接种。
第一层pdms芯片(顶部芯片31)与第二层pdms芯片(中间部芯片32)之间为由胶原基质修饰的多孔聚酯膜(第一多孔膜310),第一多孔膜310的上表面接种肾小管近端上皮细胞,该细胞从接种通道312或者溶液缓冲室314接种。如果通过接种通道312接种,由于接种通道312的距离较长,使得细胞悬液在该接种通道312中流动时能够进一步混匀,另外,接种通道312较长的距离也能够避免移液器在对溶液缓冲室314接种时对接种平面造成的冲击力,进而避免该冲击力造成的难以向三个重吸收腔室313平均分配接种液的现象,因此,通过接种通道312接种的细胞分布的均匀性要好于直接通过溶液缓冲室314接种。
第二层pdms芯片(中间部芯片32)与第三层pdms芯片(底部芯片33)之间为第二张由胶原基质修饰的多孔聚酯膜(第二多孔膜320),膜下层为人脐静脉血管内皮细胞,以实现肾小管重吸收功能。细胞经由进液通道311、第三贯通孔321和底层进液柱331接种。接种后,在后继检测时,使营养物质与待测药物从入口(进液通道311)进入,通过重吸收后经由底层采样柱332、第二贯通孔322、排液通道315流向循环微结构4。
由上述可知,本实施例的肾小管芯片部分设置三层pdms芯片与两层多孔聚酯膜。第一层pdms芯片设置超滤液入口(进液通道311)、人肾近端小管上皮细胞培养腔室(重吸收腔室313)、内皮细胞接种腔室(溶液缓冲室314或接种通道312)、重吸收液体出口(排液通道315)、废液出口(顶层采样柱318)。第二层pdms芯片为面积略小的空腔芯片(中间部芯片32),用于支撑第一多孔膜310。第三层pdms芯片具有液体通道(底层进液通道334),其超滤液入口(进液通道311)可以连接仿生肾小管芯片的超滤液出口(出口流道215),其重吸收液体出口(排液通道315)可以连接循环微结构4的药物循环腔室入口(第三进口416),废液出口(顶层采样柱318)可以连接循环微结构4的的废液入口(第一进口415),由此,便实现液体的循环功能,能够更好地模拟人体的循环系统。
实施例三
本实施例提供了一种仿生肾器官芯片结构,其包括:实施例一的仿生肾小球芯片结构,以及与该仿生肾小球芯片结构串联的仿生肾小管芯片结构。在该仿生肾器官芯片结构中,肾小球结构能够利用有效渗透压实现过滤功能,肾小管结构能够实现上皮细胞微绒毛重吸收功能。
其中,仿生肾小球芯片结构用于对进液进行过滤以产生滤液,仿生肾小管芯片结构用于对仿生肾小球芯片结构产生的滤液进行重吸收,产生重吸收液。
本实施例利用多层芯片中的流道结合多层多孔膜的形式搭建肾单元(包括肾小球和肾小管)。其中,利用流道横截面差异模拟人体肾小球渗透压来实现过滤功能,同时肾小球设有两条出口流道。第一条出口流道包括进液流道212、仿生流道213和出液流道214等。在仿生流道213和第一过滤膜210构成的腔室内培养肾近端小管上皮细胞。第二条出口流道包括入口流道211、第二进液柱231、滤液腔室232、滤液流道233和出口流道215等,与第一条出口流道间设置间隔屏障,使两条流道中流经的液体相互独立而不发生相互干渉,并在第二条出口流道的滤液腔室232和第二过滤膜220构成的腔室内培养内皮细胞,模拟肾小管重吸收功能。由此,实现对不同种类细胞的分层培养。同理,肾小管芯片也设有两个互不干涉的流道,并且也能实现对不同种类细胞的分层培养。
因此,本实施例的仿生肾器官芯片结构将肾器官的两项功能结合在一起进行模拟,能够较为真实和准确地模拟肾器官整体上的药代动力学特性和解毒特性等工作特性,为后继药物研发和机理研究提供基础。
实施例四
如图11和图12所示,本实施例提供了一种仿生肝肾芯片结构,其包括:实施例一的仿生肾小球芯片结构2、与该仿生肾小球芯片结构串联的仿生肾小管芯片结构3、肝器官芯片1以及与负责上述仿生器官之间液体循环的循环微结构4。
其中,循环微结构4包括第一出口413、第二出口412、混合腔室421、第一进口415、第二进口414、第三进口416、循环腔室422、取样管道417等。
其中,第一出口413与仿生肾小球芯片结构2的进液流道212通过流体相连通,例如,第一出口413将一部分进液(称为第一进液)提供给进液流道212,以便仿生肾小球芯片结构2对该部分进液进行处理。
第二出口412与肝器官芯片1的入口管道112通过流体相连通,例如,第二出口412将另一部分进液(称为第二进液)提供给入口管道112,以便肝器官芯片1对该部分进液进行处理。
混合腔室421位于第一出口413和第二出口412之间,并与第一出口413和第二出口412分别连通。混合腔室421还与样品进口411相连通。样品进口411用于通入新鲜的培养基和/或药物。新鲜的培养基和/或药物随后进入混合腔室421中混合,然后被平均分配至肝器官芯片1和仿生肾小球芯片结构2中。
第一进口415与仿生肾小球芯片结构2的出液流道214相连通,接收出液流道214排出的未过滤液。第一进口415还可以与仿生肾小管芯片结构3的顶层采样柱318相连通,接收顶层采样柱318排出的未被重吸收的液体(属于滤液中的一部分液体)。仿生肾小球芯片结构2经过出口流道215将过滤后的滤液排放至仿生肾小管芯片结构3的进液通道311,以便仿生肾小管芯片结构3对该滤液进行重吸收。
第二进口414与肝器官芯片1的出口管道113相连通,接收肝器官芯片1的出口管道113所排出的排出液。
第三进口416与仿生肾小管芯片结构3的三条排液通道315分别相连通,接收排液通道315排放的重吸收液。
循环腔室422的一端与混合腔室421相连通,另一端与第一进口415、第二进口414和第三进口416分别相连通,用于实现来自于第一进口415、第二进口414和第三进口416这三个进口的液体之间的混合。循环腔室422还与取样管道417相连通,以便操作人员通过该取样管道417对循环腔室422中的液体进行取样。
本实施例的循环微结构4的第一出口413与仿生肾小球芯片结构2相连通,第二出口412与肝器官芯片1相连通,从而将成分相同的进样分别输送至仿生肾小球芯片结构2和肝器官芯片1。通过对二者排出液的检验,能够获得二者的药代动力学数据、解毒数据等数据,以研究两种芯片的不同之处。
另外,本实施例的循环微结构4还收集仿生肾小球芯片结构2、仿生肾小管芯片结构3和肝器官芯片1的排出液,并通过循环腔室422的作用实现排出液在上述结构之间的循环,能够更准确地模拟肝器官芯片和肾器官芯片之间的相互作用或协同作用。
本实施例的循环微结构4能够在肝肾芯片间模拟人体内血液流通,
将肝芯片与肾芯片通过生理循环通路有机地联系在一起,又利用自动灌注装置从样品进口411自动灌注培养基和/或药物,以提供类人体动态微环境,从而构建肝肾药物代谢的体外仿生平台,能够用于全面且准确地评估药物对于肝肾的安全性,属于用于评价药物安全性的微流控芯片装置。
本实施例的技术方案基于以下内容:本实施例的循环微结构4实际上起到连接芯片的作用,其上设置药物和营养物质腔室(混合腔室421)、药物循环腔室(循环腔室422)、废液腔室(图中未显示)。药物和营养物质腔室(混合腔室421)设置1个入口通道(样品进口411)和2个出口通道(第一出口413和第二出口412)。样品进口411属于营养物质与药物的总入口。混合腔室421用于均匀混合营养物质(如培养基)和/或药物。一个出口通道(第二出口412)连接肝器官芯片1的入口管道112,另一个出口通道(第一出口413)连接肾芯片中的仿生肾小球芯片结构2的进液流道212。药物循环腔室(循环腔室422)用于模拟人体内药物代谢途径,3个入口(第一进口415、第二进口414和第三进口416)设置在该腔室的底部,1个出口(第三出口418)设置在该腔室的顶部,第三出口418连接药物和营养物质腔室(混合腔室421)。在循环腔室422中,从肝芯片1的出口管道113流回到循环腔室422的第二进口414,从肾小球芯片2的出液流道214流回到循环腔室422的第一进口415,从肾小管芯片3排液通道315流回到循环微结构4的第三进口416。该液体在循环微结构4的循环腔室422混合充分后再一次流向总腔室(混合腔室421),从而实现各器官芯片之间的循环。
废液腔室(图中未显示)设置一个入口和一个出口。
本实施例的连接芯片的循环腔室422在药物注射入样品进口411后开始使用,用于模拟药物在人体内代谢的半衰期,同时模拟人体血液循环连接药物在肝脏和肾脏间的通讯,检测药物毒性指标时从与循环腔室422连通的取样管道417中进行取样。
本实施例的循环微结构4能够模拟人体循环系统,与其连接的肝器官芯片含有生物3d打印肝小叶仿生模型,与其连接的肾脏芯片具有过滤和重吸收功能,因此,本实施例能够将肝芯片和肾芯片的体外生理功能有机结合,从而用于药物安全性评估及新药研发。
实施例五
如图13所示,本实施例提供了一种肝器官芯片1,其包括主体11和盖板12。盖板12用于对主体11起到保护作用。
主体11包括进液管道组、多个容置腔室111、肝小叶模型(图中未显示)、流体连接管道114、出液管道组。
其中,进液管道组包括入口管道112和分支管道115。肝器官芯片1的入口管道112与循环微结构4的第二出口412相连通,用于接收第二进液。入口管道112随后分支为3条分支管道115。入口管道112与这3条分支管道115分别相连通。3条分支管道115分为2条侧边进液管道419和1条中间进液管道420。2条侧边进液管道419为直线型管道,与第一容置腔室426的左端的两侧边相连通。1条中间进液管道420的形状为弯折型,而并非直线型。具体而言,中间进液管道420包括第一弯折部和第二弯折部。第一弯折部以入口管道112的轴向β为基准线向下方弯折,第二弯折部以入口管道112的轴向β为基准线向上方弯折。第一弯折部和第二弯折部的连通点标记为ε。在一些实施例中,第一弯折部和第二弯折部以连通点ε为对称中心呈中心对称。在其它的一些实施例中,容置腔室111的数目也可以不限于两个,容置腔室111的数目设置得越多,测试所得的结果就越准确。
两个容置腔室111(包括第一容置腔室426和第二容置腔室427)内均设有肝小叶模型(图中未显示),该肝小叶模型通过生物3d打印技术生成。用生物3d打印技术来构建多种肝系细胞有序排列的三维肝小叶结构,其在两个容置腔室111的肝小叶芯片中动态培养仿生肝的最小功能单元(肝腺泡)。具体的打印方法如下:分别将肝细胞和非实质肝细胞(包括肝血窦细胞、肝星状细胞、巨噬细胞)添加到改性明胶(gelma)中配制成含有肝相关细胞系的多种生物墨水。每种生物墨水含有一种或者一种以上的细胞。将多种生物墨水由微挤出式生物三维打印机的多喷头在被特定细胞外基质修饰的载玻片表面打印成成形,含细胞的打印物依次按照肝板、窦间隙、肝索排布,并辅助水凝胶支架排列,形成为细胞生长提供三维空间的可高度仿生人肝结构。另外,将特定的细胞外基质(可诱导不同种类的细胞)在打印组织中有序排布,从而构建出具有肝索和肝血窦等结构的完整的肝小叶模型,将该模型在肝芯片1的矩形的容置腔室111内进行培养。
相邻两个容置腔室11之间通过多条流体连接管道114相连。相邻两条流体连接管道114之间为水凝胶支架423,也即,相邻两个水凝胶支架423之间形成了一条流体连接管道114,两侧的水凝胶支架423与侧壁也分别形成了流体连接管道114。故本实施例中共形成了5条流体连接管道114。然而,在其它的一些实施例中,流体连接管道114的数目也不限于5条,如3条、6条等均可以。
出液管道组包括2条分流管道116和1条出口管道113。2条分流管道116与第二容置腔室427的右端的两侧边相连通。每条分流管道116整体上呈m型结构。具体而言,位于上方的第一分流管道424的弯折方向远离入口管道112的轴向β,位于下方的第二分流管道425的弯折方向也远离入口管道112的轴向β。然而,在其它的实施例中,第一分流管道和第二分流管道的弯折方向也可以朝向轴向β。第一分流管道和第二分流管道可以以轴向β为对称轴。2条分流管道116(包括第一分流管道424和第二分流管道425)汇合入1条出口管道113中。肝器官芯片1的出口管道113与循环微结构4的第二进口414相连通。
在其它的一些实施例中,上述各类管道的数目也可以不限于上述数目。
本实施例的肝器官芯片1属于pdms微流控芯片,其为利用数字光处理后,打印出的含有流道的光敏树脂模具,用pdms在模具上翻模,再将pdms基片上有微流道的一侧(主体11)与带肝小叶模型的玻璃底片(盖板12)封装为一体,即组装成为上述的肝器官芯片1。该肝器官芯片1中的流体可以提供三维肝小叶中肝系细胞生长的微环境。
具体而言,本实施例的肝器官芯片1主要由两个10mm×10mm×0.8mm的容置腔室111组成。经过组装后,将打印的肝小叶模型限制在容置腔室111内。培养液和药物从入口管道112进入,并从肝小叶模型的四周、顶部以及细胞排列支架(如水凝胶支架)的间隙向内部细胞渗透,则营养物质和药物浓度沿着肝小叶模型的边缘至中心逐渐降低,并设置5条300μm宽的流体连接管道114以连通两个容置腔室111,使两个1/6肝小叶结构可以进行物质交换,从而模拟肝最小功能单元(肝腺泡),进而保证肝损伤程度尽可能地模拟人体。
本实施例的的进口流道被设置为由1个进液通道(入口管道112)转变为3个培养区进液通道(分支管道115)。入口管道112作为主进液通道为培养液和药物通道,随后分为3条培养区进液通道(分支管道115)是为了使水凝胶支架423受液体侧压一端的细胞所受的剪切力减小并分布均匀。第2条培养区进液通道(中间进液管道420)为弯折型流道,是为了平衡3条培养区进液通道的流速。出口管道113设置了2个m型流道(分流管道116),是为了延长液体向水凝胶内部细胞渗透的时间,有利于细胞营养物质的吸收或药物的代谢。
由上述可知,本实施例的肝芯片包括3d生物打印的肝小叶结构和营造动态微环境的微流控通道。肝小叶结构为通过微挤出式生物三维打印法打印形成的三维条状结构,其采用生物墨水进行3d打印,该生物墨水中含有改性明胶、以及添加到改性明胶(gelma)中的肝细胞和非实质肝细胞(包括肝血窦细胞、肝星状细胞、巨噬细胞)的。。在3d打印时,在特定的细胞外基质的修饰下仿照肝板、窦间隙、肝索的顺序排列。在细胞条状间隙中用组织液凝胶填充,构建细胞外周环境。
为了更真实地模拟肝小叶结构,本实施例的肝脏微流控芯片(肝器官芯片1)设置静脉入口(入口管道112)、3条直径为200μm的宽入口通道(分支管道115)、2个10mm×10mm×0.8mm的肝小叶细胞培养腔室(容置腔室111)、5条300μm的宽肝小叶连接通道(流体连接管道114)、2条200μmm型出口通道(分流管道116)和仿中央静脉的出口(出口管道113)。静脉入口(入口管道112)连接循环微结构4的药物和营养物质腔室(混合腔室421)的出口(第二出口412),静脉出口(出口管道113)连接循环微结构4的药物循环腔室(循环腔室422)的入口(第二进口414)。
为了更真实地模拟肝小叶结构,本实施例的三维肝小叶模型的精准打印构建过程如下:
(1)、配制含有肝相关或肝相关细胞系的生物墨水;生物墨水成分包括gelma、胶原和明胶以及肝相关细胞生长特定的细胞外基质,生物墨水的溶剂为pbs溶液;gelma在生物墨水中的含量为7.5%至10.5%。采用多喷头微挤出式打印肝系细胞特定的排列结构。
(2)、通过注模法使用pdms材料来构建微流体芯片。利用dlp光固化打印含有流道的光敏树脂模具,将pdms的a胶与b胶按10:1比例混合并搅拌均匀,使用真空泵去除搅拌产生的气泡,然后将其倒入模具并再次抽真空除气泡,最后将模具放置在加热板上固化,温度为65℃,时间为3h使其充分固化。
(3)、将固化完全后的pdms缓慢从树脂模具上剥离,切除废料,在流道上预留的孔位使用0.5mm打孔器打孔,等离子清洗后贴合组装或者使用夹具固定,即制成三维肝小叶模型。
实施例六
本发明提供了一种将上述的仿生肝肾芯片结构作为体外药物毒性评价平台或药物安全性评价平台的应用。该仿生肝肾芯片结构将3d生物打印技术与微流控芯片技术相结合,所进行体外毒性评价的药物具体涉及对乙酰氨基酚(paracetamol)、他汀类、顺铂、庆大霉素等治疗药物。
以下以对乙酰氨基酚为例进行毒性评估实验。然而,其它的药物(如他汀类、顺铂、庆大霉素等)经过实验证明,均可以使用。
1、准备工作:
(1)、打印:
配制含有肝相关或肝相关细胞系的生物墨水;生物墨水成分包括gelma、胶原和明胶以及肝相关细胞生长特定的细胞外基质,生物墨水的溶剂为pbs溶液;gelma在生物墨水中的含量为7.5%。采用多喷头微挤出式打印肝系细胞特定的排列结构。
(2)、细胞接种:
用胰酶分别消化长势良好的rptecs和huvecs,以制备细胞悬液。rptecs的细胞悬液从肾小管芯片2的接种通道312通入该肾小管芯片2中,并接种在第一多孔膜310的上表面,huvecs的细胞悬液分别进液通道311、第三贯通孔321、底层进液柱331通入肾小管芯片2中,并接种第二多孔膜320的下表面。待细胞贴壁后,换新鲜的含10%胎牛血清、1%双抗的高糖dmem培养基培养。
用胰酶分别消化长势良好的hgecs和人足细胞,以制备细胞悬液。hgecs从进液流道212接种在5条仿生流道213内,贴附于在第一过滤膜210的上表面,人足细胞从入口流道211、第一贯通孔221、第二进液柱231进入,接种在第二过滤膜220的下表面。待细胞贴壁后,换新鲜的含10%胎牛血清、1%双抗的高糖dmem培养基培养。
待打印组织以及细胞接种后,整个系统开始通培养基。dmem培养基从图1的循环微结构4中的样品进口411注入至混合腔室421。此后培养基分两条支路。混合腔室421中的培养基一部分从第二出口412流入图1的肝芯片1的入口管道112,通过分支管道115进入打印肝小叶的容置腔室111,再通过分流管道116从出口管道113进入循环微结构4。肝芯片1的出口管道113与循环微结构4的第二进口414连接,再流进循环微结构4的循环腔室422。混合腔室421中的另一部分培养基从第一出口413流入肾小球芯片的进液流道212,通过流道流进5个肾小球内皮细胞培养腔室(仿生流道213),培养腔室的入口与出口宽度之比为2:1。根据伯努利定律可知,出口和入口有压强差,除大分子蛋白外,培养基中的部分水、无机盐、葡萄糖、尿素等从肾小球内皮细胞上的小孔过滤。滤液通过第一过滤膜210、过滤液通道(中间流道222)、第二过滤膜220,收集在滤液腔室232中。流过肾小球内皮细胞表面而没有被过滤的液体从出液流道214流出。出液流道214与循环微结构4的第一进口415连接,未过滤的液体流进循环腔室422。待滤液达到一定量的时候会从滤液流道233、第二贯通孔223和出口流道215流出,并从图1的肾小管芯片的进液通道311流到底层三个圆形的huvecs培养腔室。滤液中约67%(百分比的分母是滤液中某物质的总量,分子是被重吸收的某物质的量,以下同理)na+、cl-、k+和水,还有85%的hco3-以及葡萄糖、氨基酸,都在顶层的近端肾小管上皮细胞的作用下被重吸收。这部分液体通过第二多孔膜320、过渡结构(中间部芯片32)、第一多孔膜310进入近端肾小管上皮细胞培养腔室。肾小管的出口(排液通道315)与循环微结构4的入口(第三进口416)相连。重吸收的液体从排液通道315进入第三进口416,最后流向循环腔室422。不能被重吸收的成分(如部分尿素、肌酐)等随着溶液从肾小管底层出口(底层采样柱332)、过渡层出口(第二贯通孔322)、顶层出口流出,收集在容器中。从肝芯片、肾小球、肾小管中回到循环腔室422的液体中,当液体高度超过循环腔室422的1/2时,三种液体已混合均匀,并流向混合腔室421。新鲜的培养基和循环液体在混合腔室421中混合并流向肝芯片和肾小管、肾小球芯片,路径同上。
药物流通路径同培养基。药物的浓度是20μm/ml,用培养基稀释再通入到系统中。药物会对细胞产生毒性,导致细胞产生的谷草转氨酶(ast)、谷丙转氨酶(alt)、碱性磷酸酶(alp)、乳酸脱氧氢酶(ldh)、炎症因子tnf-α、白介素-1/6等含量上升,这些指标存在细胞的组织液中,可以收集培养液来测试,可以从循环微结构4的收集口(取样管道417)、肾小管芯片的出口(底层采样柱332、第二贯通孔322)收集给药前和给药后的细胞培养液,离心后,用试剂盒测出上述毒性指标的含量,给药后毒性指标含量超过给药前的量越多,说明毒性越大。
总之,本申请的装置包括利用生物3d打印及微流控芯片构建的三维肝小叶模型器官芯片、利用多层流道结构和多孔膜模拟肾单位的器官芯片,利用实现两者之间的血液循环以构建药物毒性评估平台。生物3d打印技术可以得到多细胞仿生有序排列的类肝小叶结构模型,微流控芯片内部微流道为细胞提供生长微环境,两者结合可获得功能完备的肝脏微结构。在微流控流道中利用高度差以及修饰的多孔膜模拟渗透压先实现肾小球生理过滤,再通过流道内培养的上皮细胞完成重吸收,实现肾脏的排泄功能。循环系统通过微泵和微流道实现,药物和营养液通过支路分别流经肝脏和肾脏模型,肝脏流出物和肾脏重吸收部分汇入循环腔室,利用微泵在系统内持续循环,以模拟人体肝肾药物代谢。对肝肾细胞形态和代谢物进行检测来评估药物毒性,为新药研发提供了快速有效的体外测试平台。
本申请已由上述相关实施例加以描述,然而上述实施例仅为实施本申请的范例。必需指出的是,已公开的实施例并未限制本申请的范围。相反地,包含于权利要求书的精神及范围的修改及均等设置均包括于本申请的范围内。
- 还没有人留言评论。精彩留言会获得点赞!