人肠癌原代细胞及其培养方法、应用与流程
1.本发明涉及生物技术领域,特别涉及人肠癌原代细胞及其培养方法、应用。
背景技术:
2.肠癌是消化系统肿瘤中常见的恶性肿瘤之一,严重危害人类健康。目前,为研究其发病机制和治疗方案,大多以商品化的细胞株为材料。但细胞株经长期培养,其生物学特性易发生变异而不利于发病机制和治疗方案的研究。
3.肿瘤原代细胞培养是指从肿瘤患者体内通过手术切除肿瘤组织,获得肿瘤细胞,并在体外进行短期培养的过程。与细胞株不同,原代培养的肿瘤细胞由于组织刚刚离体,其生物学特性未发生很大变化,仍保留原遗传特性,其性状与体内相似,适用于生化分子、药物敏感性及机制探究相关实验,其数据更具有说服力。可见,人肠癌原代细胞的培养尤为必要。
技术实现要素:
4.本发明实施例提供了人肠癌原代细胞及其培养方法、应用。
5.为了达到上述目的,本发明是通过如下技术方案实现的:
6.第一方面,本发明提供了一种人肠癌原代细胞,命名为人肠癌细胞hcoc
‑
685,已于2020年12月3日保藏于中国微生物菌种保藏管理委员会普通微生物中心(china general microbiological culture collection center,cgmcc),保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码为100101,保藏编号为cgmcc no.21097。
7.第二方面,本发明提供了培养上述第一方面所述的人肠癌原代细胞的方法,包括:
8.步骤1,用样本保存液保存收集的新鲜人肠癌组织;
9.其中,所述样本保存液包括胎牛血清、抗生素和df培养基,所述抗生素包括青霉素、硫酸卡那霉素、两性霉素b和万古霉素;
10.步骤2,用清洗液清洗步骤1保存的肠癌组织;
11.其中,所述清洗液包括含所述抗生素的生理盐水;
12.步骤3,取步骤2清洗处理后的肠癌组织,用含血清培养基进行原代分离培养;
13.其中,所述含血清培养基包括胎牛血清、所述抗生素和df培养基;
14.步骤4,取步骤3原代分离培养出的细胞,用无血清培养基进行纯化及传代培养,得到人肠癌原代细胞;
15.其中,所述无血清培养基包括添加物、所述抗生素和df培养基;
16.所述添加物包括谷氨酰胺、胰岛素、转铁蛋白、亚硒酸钠、表皮生长因子(epidermal growth factor,egf)、烟酰胺nicotinamide和b27。
17.详细地,df培养基为本领域常见的dme/f
‑
12 1:1培养基(美国hyclone)。b27为无血清液体添加剂。
18.优选地,所述无血清培养基包括:1
‑
5mm谷氨酰胺、5
‑
30mg/l胰岛素、5
‑
20mg/l转铁
蛋白、5
‑
20μg/l亚硒酸钠、5
‑
20μg/l egf、5
‑
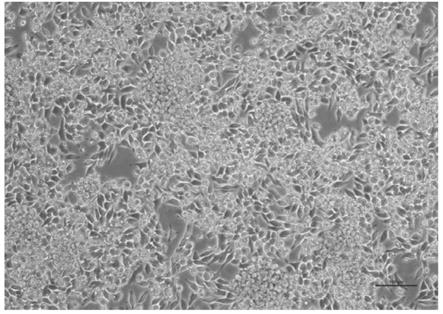
30mm nicotinamide、1
‑
3%b27、10
‑
60μg/ml青霉素、10
‑
60μg/ml硫酸卡那霉素、0.15
‑
0.5μg/ml两性霉素b、0.5
‑
5μg/ml万古霉素。
19.优选地,所述含血清培养基包括:10
‑
60μg/ml青霉素、10
‑
60μg/ml硫酸卡那霉素、0.15
‑
0.5μg/ml两性霉素b、0.5
‑
5μg/ml万古霉素。
20.优选地,所述清洗液包括:0.1
‑
0.8mg/ml青霉素、0.1
‑
0.8mg/ml硫酸卡那霉素、1.5
‑
5μg/ml两性霉素b、1
‑
5μg/ml万古霉素。
21.第三方面,本发明提供了上述第一方面所述的人肠癌原代细胞在药物敏感性研究及检测中的应用。
22.第四方面,本发明提供了上述第一方面所述的人肠癌原代细胞在构建肠癌动物模型中的应用。
23.第五方面,本发明提供了上述第一方面所述的人肠癌原代细胞在开发抑制肠癌药物中的应用。
24.第六方面,本发明提供了上述第一方面所述的人肠癌原代细胞在肠癌体外研究中的应用。
25.需要说明的是,本发明提供的人肠癌原代细胞的应用,为非疾病的诊断与治疗目的。
26.本发明提供的人肠癌细胞hcoc
‑
685至少具有以下特征:
27.特征1:原代分离培养自中国人的肠癌组织,该细胞未导入任何外源基因。
28.特征2:显微镜下观察人肠癌细胞hcoc
‑
685,上皮样细胞形态,细胞界限清晰,癌细胞增殖较快,细胞大小、形态不等,呈不规则形或多角形,失去极性,排列紊乱,无接触抑制,互相挤压,呈堆叠状或多层生长现象,具有恶性肿瘤细胞的形态特征。
29.特征3:人肠癌细胞hcoc
‑
685的细胞群体倍增时间为34小时,细胞增殖速度快,细胞生长活跃,细胞活性状态佳,细胞培养稳定性高,体外培养具有稳定的细胞生长特性。
30.特征4:人肠癌细胞hcoc
‑
685经免疫荧光鉴定为上皮来源的肿瘤细胞标记物ck(cytokeratin,细胞角蛋白)强表达。
31.特征5:人肠癌细胞hcoc
‑
685经核型分析鉴定为癌细胞异型核型,细胞的染色体数目为47条,超二倍体核型,符合人源恶性肿瘤的遗传特性。
32.特征6:人肠癌细胞hcoc
‑
685经str(short tandem repeat,短串联重复序列)基因分型鉴定,其为单一人类来源且无交叉污染的细胞,是一株新获得的肠癌原代细胞。
33.特征7:人肠癌细胞hcoc
‑
685,可用于药物敏感性研究及检测、构建肠癌动物模型、开发抑制肠癌药物、肠癌体外研究的用途。
34.细胞保藏信息
35.本发明所涉及的人肠癌细胞hcoc
‑
685,已于2020年12月3日保藏于中国微生物菌种保藏管理委员会普通微生物中心(china general microbiological culture collection center,cgmcc),保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码为100101,保藏编号为cgmcc no.21097。
附图说明
36.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现
有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
37.图1是本发明一实施例提供的人肠癌细胞hcoc
‑
685的细胞形态图;
38.图2是本发明一实施例提供的人肠癌细胞hcoc
‑
685的生长曲线图;
39.图3是本发明一实施例提供的人肠癌细胞hcoc
‑
685的免疫荧光鉴定结果图;
40.图4是本发明一实施例提供的人肠癌细胞hcoc
‑
685的染色体核型分析图;
41.图5是本发明一实施例提供的人肠癌细胞hcoc
‑
685的str基因分型图。
具体实施方式
42.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
43.实施例1
44.本发明实施例提供了一种人肠癌原代细胞,命名为人肠癌细胞hcoc
‑
685,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.21097。
45.该人肠癌细胞hcoc
‑
685原代分离培养自中国人的肠癌组织,该细胞未导入任何外源基因。
46.下面,分别针对人肠癌细胞hcoc
‑
685的各生物学特性进行说明。
47.1.1细胞形态学观察
48.在倒置显微镜下观察人肠癌细胞hcoc
‑
685,发现上皮样细胞形态,细胞界限清晰,癌细胞增殖较快,细胞大小、形态不等,呈不规则形或多角形,失去极性,排列紊乱,无接触抑制,互相挤压,呈堆叠状或多层生长现象,具有恶性肿瘤细胞的形态特征。形态学观察结果如图1所示。
49.1.2生长曲线和倍增时间的测定
50.1.2.1生长曲线测定步骤
51.(1)人肠癌细胞hcoc
‑
685的细胞汇合度达到70
‑
90%时,移除无血清培养基,用pbs(0.01m,ph7.4)洗涤细胞至少两次,以去除旧的无血清培养基和飘浮的状态差的细胞,用1
‑
2ml edta
‑
trypsin(胰蛋白酶
‑
edta消化液)消化处理,并用df10培养基(df培养基和10%fbs)终止消化。
52.其中,edta(ethylenediaminetetraacetic acid)为乙二胺四乙酸,trypsin为胰蛋白酶。
53.(2)细胞以5
×
104/ml接种至96孔板,200μl/孔。
54.(3)24h后开始进行测定,之后每隔24h测定一次,每2天更换一次培养基,分别进行吸光度测定,计算平均值。
55.(4)测定时用终浓度为100μg/ml的中性红染色2h,再用pbs清洗3次后加入中性红洗脱液(水:乙醇:乙酸=49:50:1)振荡混匀10min,于550nm处测吸光光度值,连续测定9天,得到下述表1所示的生长曲线数据。
56.1.2.2生长曲线测定结果
57.表1示出了连续测定9天所得到的生长曲线数据。
58.表1
59.时间(天)相对od值(平均)(550nm)误差10.026670.0121720.048480.01318930.0750.01516240.133750.02242350.240580.04758560.273470.06488170.505440.08234580.856980.1492990.842910.112564
60.基于表1中的生长曲线数据,得到如图2所示的生长曲线示意图。图2的横坐标为培养时间,纵坐标为相对od值。
61.请参考表1中的生长曲线数据及图2所示的生长曲线示意图,可以看出人肠癌细胞hcoc
‑
685连续9天生长良好。
62.1.2.3细胞群体倍增时间
63.肿瘤细胞的群体倍增时间的计算公式为:dt=t
×
[lg2/(lgnt
‑
lgno)]。其中,dt为倍增时间,t为时间间隔,no为起始细胞数,nt为终末细胞数。
[0064]
经计算,人肠癌细胞hcoc
‑
685的细胞群体倍增时间为34h。
[0065]
综上可知,人肠癌细胞hcoc
‑
685的细胞增殖速度快,细胞生长活跃,细胞活性状态佳,细胞培养稳定性高,体外培养具有稳定的细胞生长特性。
[0066]
1.3免疫荧光鉴定
[0067]
1.3.1免疫荧光鉴定步骤
[0068]
(1)人肠癌细胞hcoc
‑
685汇合度达到70
‑
90%左右,移除无血清培养基,用pbs(0.01m,ph7.4)洗涤细胞至少两次,以去除旧的无血清培养基和飘浮的状态差的细胞,用1
‑
2ml edta
‑
trypsin消化,接种至48孔板。
[0069]
(2)当细胞汇合度达70
‑
90%时,去除无血清培养基,pbs清洗3次,加入500μl/孔的冰甲醇,固定30min后移除。
[0070]
(3)加入200μl/孔2.5%bsa封闭液,室温封闭60min后吸出封闭液。
[0071]
(4)加入150μl/孔的一抗(keratin 18(dc10)mouse mab,1:800稀释;anti
‑
calretinin antibody produced in rabbit,1:1000稀释),4℃过夜孵育后吸出。
[0072]
(5)加入150μl/孔的荧光二抗(二抗anti
‑
mouse igg(whole molecule)
‑
fitc antibody produced in rabbit,1:100稀释;cy3标记山羊抗兔igg,1:500稀释),室温避光孵育1h,吸出二抗,pbs洗涤3次。
[0073]
(6)加入150μl/孔的pbs,荧光拍照,物镜
×
目镜(20
×
10),得到免疫荧光鉴定结果。
[0074]
1.3.2免疫荧光鉴定结果
[0075]
细胞角蛋白(cytokeratin,ck)是上皮细胞的常见标志物,上皮细胞及上皮来源的肿瘤细胞中表达ck,而不表达钙视网膜蛋白(calretinin,cr)。
[0076]
免疫荧光鉴定结果如图3所示。请参考图3,经免疫荧光鉴定发现,该人肠癌细胞hcoc
‑
685ck强表达,cr不表达,说明该人肠癌细胞hcoc
‑
685来源于上皮细胞。
[0077]
1.4染色体核型分析鉴定
[0078]
1.4.1染色体核型分析鉴定步骤
[0079]
(1)细胞培养
[0080]
当人肠癌细胞hcoc
‑
685汇合度达到70
‑
90%时,移除无血清培养基培养,用pbs(0.01m,ph7.4)洗涤细胞至少两次,以去除旧的无血清培养基和脱落的状态差的细胞,用1
‑
2ml edta
‑
trypsin消化处理,显微镜下观察,边消化边收集消化处理后的细胞,收集的细胞用df10培养基终止消化,直至所有细胞均消化完成。1000rpm离心5min,移除上清液。
[0081]
(2)秋水仙素处理
[0082]
向细胞沉淀中加入浓度为300μg/ml的秋水仙素20
‑
25μl,37℃培养箱中处理25min。
[0083]
(3)低渗处理
[0084]
秋水仙素处理完毕后,离心(1300rpm,10min),弃上清液。然后加入37℃水浴的0.075mol/l的kcl溶液低渗液至10ml,用吸管吹打成细胞悬液,置37℃水浴处理30
‑
35min。
[0085]
(4)预固定
[0086]
低渗处理结束在每个离心管中加入1ml的固定液,继续37℃水浴5min。
[0087]
(5)离心
[0088]
1300rpm离心10min,弃上清液。
[0089]
(6)固定
[0090]
在离心管中加入固定液6
‑
8ml,立即用吸管轻轻吹打成单个细胞悬液,在37℃水浴中固定30min后,1300rpm离心10min,弃上清液。
[0091]
(7)第二次固定
[0092]
在离心管中加入固定液6
‑
8ml,立即用吸管轻轻吹打成单个细胞悬液,在37℃水浴中固定15min后,1300rpm离心10min,弃上清液。
[0093]
(8)制片
[0094]
在离心管中加入新固定液0.2ml左右,用吸管轻轻吹打成细胞悬液,从冰箱的冷冻室内取出冰片,调到合适悬液,每片滴加悬液1
‑
2滴,75℃烤3h。
[0095]
(9)染色
[0096]
用6%giemsa染液染色10min,然后用镊子夹出玻片,用自来水轻轻冲洗两面,室温干燥后镜检。
[0097]
(10)镜检
[0098]
待玻片干后,在显微镜下检查。先用低倍镜寻找良好的分裂相,然后用高倍油镜观察,得到染色体核型分析鉴定结果。
[0099]
1.4.2染色体核型分析鉴定结果
[0100]
染色体核型分析鉴定结果如图4所示。请参考图4,经染色体核型分析鉴定,人肠癌细胞hcoc
‑
685为癌细胞异型核型,为超二倍体核型的肿瘤细胞,染色体数为47条,不同于人
体正常细胞的核型,符合人恶性肿瘤的遗传特性。
[0101]
1.5str鉴定
[0102]
1.5.1str鉴定步骤
[0103]
(1)将贴壁生长的人肠癌细胞hcoc
‑
685(1
×
106个)用pbs(0.01m,ph7.4)洗涤细胞两次,顺次用1
‑
2ml edta
‑
trypsin消化3
‑
30min,10ml df10培养基终止消化反应。
[0104]
(2)10000rpm离心1min,弃上清液,加200μl缓冲液ga(细胞/组织基因组dna提取试剂盒dp304,天根公司),振荡至彻底悬浮。
[0105]
(3)加入20μl proteinase k溶液,混匀。
[0106]
(4)加入200μl缓冲液gb(细胞/组织基因组dna提取试剂盒dp304,天根公司),充分颠倒混匀,70℃放置10min,简短离心。
[0107]
(5)加入200μl无水乙醇,充分振荡混匀15s,简短离心。
[0108]
(6)将所得溶液和絮状沉淀都加入一个吸附柱中(细胞/组织基因组dna提取试剂盒dp304,天根公司),12000rpm离心30s,去废液。
[0109]
(7)向吸附柱中加入500μl缓冲液gd(细胞/组织基因组dna提取试剂盒dp304,天根公司),12000rpm离心30s,去废液。
[0110]
(8)向吸附柱中加入600μl漂洗液pw(细胞/组织基因组dna提取试剂盒dp304,天根公司),12000rpm离心30s,去废液。
[0111]
(9)将吸附柱转入另一离心管中,向吸附膜的中间部位滴加50
‑
200μl洗脱缓冲液te(细胞/组织基因组dna提取试剂盒dp304,天根公司),室温放置2
‑
5min,12000rpm离心2min,将提取的dna溶液收集到离心管中。
[0112]
(10)采用goldeneye
tm
20a str复合扩增试剂盒进行扩增,在abi 3100型遗传分析仪上连续对21个已知的str位点和性别基因amelogenin进行检测分析。
[0113]
(11)使用genemapper3.2软件分析样本数据,进行自动基因分型,得到str分型结果。
[0114]
1.5.2str鉴定结果
[0115]
str分型结果如图5所示。请参考图5,检测21个基因座,以“基因座/等位基因长度”来表示:d19s433/13/14,d5s818/10/12,d21s11/32.2/33.2,d18s51/13/21,d6s1043/11/18,amel/x/x,d3s1358/15/16,d13s317/8/10,d7s820/9/14,d16s539/9/12,csfipo/10/13,pentad/9/10,d2s441/11/12,vwa/18/18,d8s1179/10/17,tpox/8/8,pentae/12/13,th01/7/9,d12s391/18/18,d2s1338/19/23,fga/24/25。
[0116]
由上可知,经str基因分型鉴定,可以得出以下结论:
[0117]
(1)人肠癌细胞hcoc
‑
685在各基因座均未出现三等位基因现象,细胞中未发现人类细胞交叉污染。
[0118]
(2)将人肠癌细胞hcoc
‑
685的str数据与atcc(美国模式菌种收集中心)和dsmz(德国的国家菌种保藏中心)的str数据库中数据相对比,可知在atcc和dsmz细胞库中,均未找到与人肠癌细胞hcoc
‑
685的细胞分型100%相匹配的细胞。
[0119]
(3)将人肠癌细胞hcoc
‑
685的str数据与atcc和dsmz的str数据库中数据相对比,可知其与nci
‑
h838(crl
‑
5844)细胞的str数据匹配率相对最高,为73%。
[0120]
综上,经对人肠癌细胞hcoc
‑
685进行str基因分型鉴定,结果证实其为单一人类来
源且无交叉污染的细胞,是一株新获得的肠癌原代细胞。
[0121]
1.6细胞用途
[0122]
1.6.1用于药物敏感性研究及检测
[0123]
1.6.1.1药敏检测步骤(cd
‑
dst方法)
[0124]
(1)胶原凝胶滴培养
[0125]
取人肠癌细胞hcoc
‑
685与凝胶构成液(ⅰ:ⅱ:ⅲ=8:1:1)混合均匀,按照30μl/胶滴,3个胶滴/孔,将细胞悬液接种于6孔板中,同时在另一6孔板中接种3个胶滴,作为0
‑
time对照组。1
‑
2h后待胶滴凝固加入3ml含10%胎牛血清的df培养基,于37℃、5%co2培养箱中过夜培养。
[0126]
(2)抗癌药物接触与清洗
[0127]
上述步骤(1)的人肠癌原代细胞培养24h后加入抗癌药物,设未用药物的阴性对照孔(control),及临床肠癌常用药(需要说明的是,通常可根据细胞来源患者的主要临床表现进行药物选择)处理的阳性对照孔,同时将0
‑
time组进行染色固定。培养相应时间后,用df培养基清洗2次,每次15min,然后用无血清培养基继续培养5天,其中第3天更换一次培养基。
[0128]
(3)染色固定与扫描
[0129]
第8天进行染色固定,终浓度为50μg/ml的中性红染色2h,pbs清洗细胞3次,每次5min,中性福尔马林固定45min,蒸馏水清洗15min,通风干燥,获得具有活性的肿瘤细胞。然后用primage图像分析系统对胶滴进行扫描分析,得到药敏检测结果。
[0130]
1.6.1.2药敏检测结果
[0131]
人肠癌细胞hcoc
‑
685的药敏检测(cd
‑
dst法)结果见下述表2。
[0132]
表2
[0133]
药物名称细胞存活率氟尿嘧啶(持续静脉输注)(5
‑
fu)85.65%氟尿嘧啶+甲酰四氢叶酸(5
‑
fu/lv)42.11%卡培他滨(cap)8.15%伊立替康(cpt
‑
11)16.10%奥沙利铂(l
‑
ohp)5.91%
[0134]
其中,若细胞存活率小于50%,可以说明个体肿瘤细胞对相应药物的敏感度较高(即高敏感);若细胞存活率为50
‑
60%,可以说明个体肿瘤细胞对相应药物的敏感度处于高敏感与低敏感的临界范围(即临界);若细胞存活率大于60%,可以说明个体肿瘤细胞对相应药物的敏感度较低(即耐药)。
[0135]
请参考表2可知,人肠癌细胞hcoc
‑
685对尿嘧啶+甲酰四氢叶酸(5
‑
fu/lv)、卡培他滨(cap)、伊立替康(cpt
‑
11)和奥沙利铂(l
‑
ohp)均高敏感,而对氟尿嘧啶(持续静脉输注)(5
‑
fu)则为低敏感,故而可用于表2中所述的临床肠癌常用药、联药方案的有效性评价。经该药敏检测实验,可以更有针对性的为相关肠癌患者(如人肠癌细胞hcoc
‑
685的肠癌患者、具有相同或相似临床表现或药物敏感特点的其他肠癌患者或肠癌转移病灶患者等)进行临床用药指导,对其个性化治疗具有重要意义。
[0136]
1.6.2用于构建肠癌动物模型
[0137]
将处于对数生长期的人肠癌细胞hcoc
‑
685按照规定剂量,接种于哺乳动物(如裸鼠)体内,并培养若干天数以构建肠癌动物模型。该肠癌动物模型可用于肠癌的发展研究、转移机理的研究、放化疗药物临床治疗的疗效评价等。
[0138]
1.6.3用于开发抑制肠癌药物
[0139]
人肠癌细胞hcoc
‑
685培养自刚刚离体的肠癌组织,其生物学特性变化小,保留原遗传特性,故而可应用于筛选或评估治疗肠癌的药物。
[0140]
通过向人肠癌细胞hcoc
‑
685培养基中添加不同化疗药物,观察细胞生长增殖、死亡、周期等变化,获得初步有效的候选药物。再将候选药物用于肠癌动物模型,检测药物的体内作用,观察动物的一般情况、存活时间、肿瘤大小改变,以及药物作用后动物机体变化情况,从而对候选药物进行疗效评估和机制分析。
[0141]
1.6.4用于肠癌体外研究
[0142]
人肠癌细胞hcoc
‑
685培养自刚刚离体的肠癌组织,其生物学特性变化小,保留原遗传特性,可作为人肠癌发病机制及个体化治疗体外研究的细胞材料,进而为人肠癌发生机理模型的建立以及抗人肠癌药物的制备、筛选、评价等提供基础。
[0143]
综上所述,本发明实施例提供的人肠癌细胞hcoc
‑
685至少具有以下特征:
[0144]
特征1:原代分离培养自中国人的肠癌组织,该细胞未导入任何外源基因。
[0145]
特征2:显微镜下观察人肠癌细胞hcoc
‑
685,上皮样细胞形态,细胞界限清晰,癌细胞增殖较快,细胞大小、形态不等,呈不规则形或多角形,失去极性,排列紊乱,无接触抑制,互相挤压,呈堆叠状或多层生长现象,具有恶性肿瘤细胞的形态特征。
[0146]
特征3:人肠癌细胞hcoc
‑
685的细胞群体倍增时间为34小时,细胞增殖速度快,细胞生长活跃,细胞活性状态佳,细胞培养稳定性高,体外培养具有稳定的细胞生长特性。
[0147]
特征4:人肠癌细胞hcoc
‑
685经免疫荧光鉴定为上皮来源的肿瘤细胞标记物ck(cytokeratin,细胞角蛋白)强表达。
[0148]
特征5:人肠癌细胞hcoc
‑
685经核型分析鉴定为癌细胞异型核型,细胞的染色体数目为47条,超二倍体核型,符合人源恶性肿瘤的遗传特性。
[0149]
特征6:人肠癌细胞hcoc
‑
685经str(short tandem repeat,短串联重复序列)基因分型鉴定,其为单一人类来源且无交叉污染的细胞,是一株新获得的肠癌原代细胞。
[0150]
特征7:人肠癌细胞hcoc
‑
685,可用于药物敏感性研究及检测、构建肠癌动物模型、开发抑制肠癌药物、肠癌体外研究的用途。该用途为非疾病的诊断与治疗目的。
[0151]
实施例2
[0152]
本实施例用于说明人肠癌细胞hcoc
‑
685的培养方法,包括下述步骤1
‑
步骤4。
[0153]
步骤1,用样本保存液保存收集的新鲜人肠癌组织。其中,所述样本保存液包括胎牛血清、抗生素和df培养基。
[0154]
步骤2,用清洗液清洗步骤1保存的肠癌组织。其中,所述清洗液包括含所述抗生素的生理盐水。
[0155]
步骤3,取步骤2清洗处理后的肠癌组织,用含血清培养基进行原代分离培养。其中,所述含血清培养基包括胎牛血清、所述抗生素和df培养基。
[0156]
步骤4,取步骤3原代分离培养出的细胞,用无血清培养基进行纯化及传代培养,得到人肠癌原代细胞。其中,所述无血清培养基包括添加物、所述抗生素和df培养基。
[0157]
本实施例中,所述抗生素包括青霉素、硫酸卡那霉素、两性霉素b和万古霉素。在保存、清洗肠癌组织以及在培养肿瘤细胞时,抗生素的存在可起到抑菌杀菌作用,以保护原代细胞免受微生物污染,其对革兰氏阳性菌、革兰氏阴性菌、支原体和真菌均有杀伤作用。
[0158]
本实施例中,所述添加物包括谷氨酰胺、胰岛素、转铁蛋白、亚硒酸钠、表皮生长因子、nicotinamide和b27。
[0159]
优选地,所述清洗液包括:0.1
‑
0.8mg/ml青霉素、0.1
‑
0.8mg/ml硫酸卡那霉素、1.5
‑
5μg/ml两性霉素b、1
‑
5μg/ml万古霉素。
[0160]
比如,清洗液中,青霉素的浓度可为0.1、0.3、0.5、0.7或0.8mg/ml,硫酸卡那霉素的浓度可为0.1、0.3、0.5、0.7或0.8mg/ml,两性霉素b的浓度可为1.5、2、2.5、3、3.5、4、4.5或5μg/ml,万古霉素的浓度可为1、1.5、2.5、3.5、4.5或5μg/ml。
[0161]
优选地,所述含血清培养基包括:10
‑
60μg/ml青霉素、10
‑
60μg/ml硫酸卡那霉素、0.15
‑
0.5μg/ml两性霉素b、0.5
‑
5μg/ml万古霉素。
[0162]
比如,含血清培养基中,青霉素的浓度可为10、20、30、40、50或60μg/ml,硫酸卡那霉素的浓度可为10、20、30、40、50或60μg/ml,两性霉素b的浓度可为0.15、0.2、0.25、0.3、0.35、0.4或0.5μg/ml,万古霉素的浓度可为0.5、0.8、1.2、1.5、1.8、2、2.5、3、4或5μg/ml。
[0163]
优选地,所述无血清培养基包括:1
‑
5mm谷氨酰胺、5
‑
30mg/l胰岛素、5
‑
20mg/l转铁蛋白、5
‑
20μg/l亚硒酸钠、5
‑
20μg/l egf、5
‑
30mm nicotinamide、1
‑
3%(体积百分含量)b27、10
‑
60μg/ml青霉素、10
‑
60μg/ml硫酸卡那霉素、0.15
‑
0.5μg/ml两性霉素b、0.5
‑
5μg/ml万古霉素。该无血清培养基能够有效地促进人肠癌原代细胞生长,抑制成纤维细胞等杂质细胞。
[0164]
比如,无血清培养基中,谷氨酰胺的浓度可为1、2、3、4或5mm,胰岛素的浓度可为5、10、15、20、25或30mg/l,转铁蛋白的浓度可为5、10、15或20mg/l,亚硒酸钠的浓度可为5、11、15或20μg/l,egf的浓度可为5、10、15或20μg/l,nicotinamide的浓度可为5、10、15、20、25或30mm,b27的体积百分含量可为1、1.5、2、2.5或3%,青霉素的浓度可为10、20、30、40、50或60μg/ml,硫酸卡那霉素的浓度可为10、20、30、40、50或60μg/ml,两性霉素b的浓度可为0.15、0.2、0.25、0.3、0.35、0.4或0.5μg/ml,万古霉素的浓度可为0.5、0.8、1.2、1.5、1.8、2、2.5、3、4或5μg/ml。
[0165]
下面,分别对上述步骤1
‑
步骤4的具体实现进行说明。
[0166]
对于步骤1:
[0167]
在步骤1中,用样本保存液保存收集的新鲜人肠癌组织,其具体实现请参见下述步骤1.1
‑
步骤1.2:
[0168]
步骤1.1,在病人或病人监护人知情同意的情况下,收集病人手术时切除的部分肠癌组织。
[0169]
步骤1.2,用样本保存液保存步骤1.1收集的肠癌组织。
[0170]
对于步骤2:
[0171]
在步骤2中,用清洗液清洗步骤1保存的肠癌组织,其具体实现请参见下述步骤2.1
‑
步骤2.2:
[0172]
步骤2.1,将步骤1.2保存的肠癌组织转移至细胞培养皿中,用清洗液冲洗8次,去除脂肪、粘膜等非癌组织杂质。
[0173]
步骤2.2,将步骤2.1中清洗处理后的肠癌组织转移至新的培养皿中。
[0174]
对于步骤3:
[0175]
在步骤3中,取步骤2清洗处理后的肠癌组织,用含血清培养基进行原代分离培养,其具体实现请参见下述步骤3.1
‑
步骤3.6:
[0176]
步骤3.1,用剪刀和刀片将步骤2.2中清洗处理后的肠癌组织剪成小块并剁成碎泥状。
[0177]
该步骤中,为了便于肠癌组织消化成适宜大小的肿瘤细胞,在肠癌组织消化前需要将其剁成碎泥状。
[0178]
步骤3.2,将步骤3.1中碎泥状的肠癌组织转移至50ml离心管中,在1300rpm离心6min,移除上清液(以去除肠癌组织中的杂质,例如,脂肪组织、粘膜组织、结缔组织以及坏死组织),顺次加入9ml df培养基进行重悬,顺次再加入1ml含有10mg/ml的胶原酶ⅰ和2mg/ml透明质酸酶的细胞分散酶,在37℃、5%co2培养箱中低速振荡消化1h以分散肠癌组织,防止细胞结块。细胞分散酶反应结束后,加入20ml df10培养基终止反应,吹散混匀,并在1000rpm离心5min,移除上清液,取细胞沉淀。
[0179]
步骤3.3,向步骤3.2得到的细胞沉淀中加入5ml egta
‑
trypsin溶液,混匀,室温静置4min,顺次加入20ml df10培养基终止反应,吹散混匀,得到细胞消化液消化后的细胞。
[0180]
该步骤中,egta
‑
trypsin溶液为细胞消化液,其消化时间可为3
‑
5min。
[0181]
步骤3.4,将步骤3.3得到的细胞通过300μm尼龙膜过滤,将过滤后细胞液收集到50ml离心管中,1000rpm离心5min,移除上清液,取细胞沉淀。
[0182]
步骤3.5,将步骤3.4得到的细胞沉淀用10ml含血清培养基重悬接种至25cm2的培养瓶中,顺次置于37℃、5%co2培养箱中过夜(24h)培养。
[0183]
步骤3.6,当步骤3.5培养的细胞完全贴壁生长后,将含血清培养基换为无血清培养基,并置于37℃、5%co2培养箱中继续培养。
[0184]
其中,步骤3.6中培养得到的细胞,即为原代分离培养出的细胞。
[0185]
对于步骤4:
[0186]
在步骤4中,取步骤3原代分离培养出的细胞,用无血清培养基进行纯化及传代培养,得到人肠癌原代细胞,其具体实现请参见下述步骤4.1
‑
步骤4.5(步骤4.1
‑
步骤4.3为纯化培养过程,步骤4.4
‑
步骤4.6为传代培养过程):
[0187]
步骤4.1,当步骤3.6中培养的细胞的汇合度达到70
‑
90%时,移除无血清培养基,用1
‑
2ml edta
‑
trypsin消化处理。
[0188]
步骤4.2,显微镜下观察,待细胞从培养瓶中脱离下来,弃掉edta
‑
trypsin先消化下来的成纤维细胞,再边消化边收集消化处理后的细胞。将每次收集的细胞均转移至放置有df10培养基的离心管中,以便及时终止消化,直至所有细胞均消化完成。
[0189]
该步骤中,通过及时终止消化,可以避免因过度消化而导致细胞状态差或者死亡。
[0190]
步骤4.3,1000rpm离心5min,移除上清液,用无血清培养基重悬,并在37℃、5%co2细胞培养箱中放置1.5h,成纤维细胞贴壁后再将未贴壁的细胞收集起来,转入新的培养瓶继续培养,反复贴壁5次,以全部清除成纤维细胞,得到已纯化的人肠癌原代细胞。
[0191]
基于上述内容,本培养方法通过采用胰酶差时消化法、差时贴壁法、反复贴壁法相结合的方式进行细胞纯化,可避免纯化过程中因过度消化导致细胞状态差或者死亡,以得
到状态良好、无成纤维细胞等杂质细胞的人肠癌原代细胞,提高人肠癌原代细胞培养的成功率。
[0192]
步骤4.4,用无血清培养基培养步骤4.3得到的人肠癌原代细胞,当细胞汇合度达到70
‑
90%时,用1倍浓度(1
×
)磷酸缓冲盐溶液pbs(0.01m,ph7.4)洗涤细胞至少两次,以去除旧的无血清培养基和脱落的状态差的细胞,再用1
‑
2ml edta
‑
trypsin消化3
‑
30min。
[0193]
步骤4.5,显微镜下观察,边消化边收集消化处理后的细胞,收集的细胞及时用df10培养基终止消化,直至所有细胞均消化完成。
[0194]
步骤4.6,在800
‑
1500rpm下离心5
‑
10min,移除上清液,再用无血清培养基重悬,接种于新的培养瓶中,顺次在37℃、5%co2细胞培养箱中培养,得到传代后的人肠癌原代细胞。
[0195]
之后,按需重复上述步骤4.4
‑
步骤4.6,区别在于非首次执行步骤4.4时,步骤4.4中培养的人肠癌原代细胞不再为步骤4.3得到的人肠癌原代细胞,而为上一个步骤4.6得到的人肠癌原代细胞(即上一代的人肠癌原代细胞)。
[0196]
需要说明的是,由于均原代分离培养自同一肠癌组织,故步骤4.3和每一次步骤4.6所得到的细胞均为人肠癌原代细胞,均具有相同的细胞特性,区别仅在于细胞代数不同。如此,基于本实施例提供的培养方法所培养出的任一代人肠癌原代细胞,均具有与上述人肠癌细胞hcoc
‑
685相同的细胞特性。
[0197]
基于上述内容,对于步骤4.3和每一次步骤4.6中得到的人肠癌原代细胞,必要时可将(1
×
106个)人肠癌原代细胞重悬于1
‑
2ml的细胞冻存液(90%胎牛血清和10%dmso,v/v)中,储存于液氮中备用。其中,dmso(dimethyl sulfoxide)为二甲基亚砜。
[0198]
需要说明的是,上述培养方法中所用到的无血清培养基包括:df培养基、3mm谷氨酰胺、20mg/l胰岛素、10mg/l转铁蛋白、11μg/l亚硒酸钠、10μg/l egf,10mm nicotinamide、2%b27、50μg/ml青霉素、50μg/ml硫酸卡那霉素、0.25μg/ml两性霉素b和0.8μg/ml万古霉素。
[0199]
上述培养方法中所用到的含血清培养基包括:df培养基、10%fbs(fetal bovine serum,胎牛血清)、50μg/ml青霉素、50μg/ml硫酸卡那霉素、0.25μg/ml两性霉素b和0.8μg/ml万古霉素。
[0200]
df培养基即dme/f
‑
12 1:1培养基。
[0201]
上述培养方法中所用到的清洗液包括:生理盐水、0.5mg/ml青霉素、0.5mg/ml硫酸卡那霉素、2.5μg/ml两性霉素b、3.5μg/ml万古霉素。
[0202]
需要说明的是,本实施例提供的人肠癌原代细胞培养方法不仅可以用于肠癌原代肿瘤细胞的培养,也可用于肠癌转移病灶原代肿瘤细胞的培养。
[0203]
实施例3
[0204]
本实施例用于说明人肠癌细胞hcoc
‑
685的非疾病的诊断与治疗目的的用途。
[0205]
本发明实施例提供的人肠癌细胞hcoc
‑
685的用途,具体可以用于药物敏感性研究及检测、构建肠癌动物模型、开发抑制肠癌药物、肠癌体外研究等。
[0206]
最后需要说明的是:以上所述仅为本发明的较佳实施例,仅用于说明本发明的技术方案,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内所做的任何修改、等同替换、改进等,均包含在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1