拟穴青蟹抗菌多肽Spampcin56-86及其应用
本发明属于海洋分子生物学技术领域,具体涉及一种拟穴青蟹抗菌多肽spampcin56-86及其应用。
背景技术:
据报道,目前我国是全球最大的抗生素生产国和消费国,也是细菌耐药最严重的国家之一,抗生素大量不规范、不合理的使用引发一系列如:细菌耐药性增强、抑制动物免疫、影响人类健康以至破坏生态环境等问题。因此,开发新型高效的抗细菌药物,寻找抗生素有效的替代品成为亟待解决的问题。
抗菌肽(antibacterialpeptides,amps)是一类小分子抗微生物多肽,广泛分布于动植物体内,作为第一道防线以抵御各类病原微生物的感染,是先天性免疫系统中的重要组成部分。主要的抗病机理是作用于病原微生物的细胞膜,使得病原微生物不易对其产生抗性,因而避免耐药性问题的产生且拥有广谱的抗细菌、抗霉菌、抗病毒、抗寄生虫等活性。此外抗菌肽还具备免疫调节剂、信号分子、抗肿瘤等多重角色使其成为极具吸引力的传统抗生素替代品和开发新型抗细菌药物的重要候选材料,并且在转化应用方面也具有相当大的前景。
根据二级结构不同将抗菌肽分为α-抗菌肽、β-抗菌肽和延伸环状抗菌肽;根据携带电荷数的不同将其分为阳离子抗菌肽和阴离子抗菌肽。截至目前,抗微生物肽(campr3)数据库收集到10247条天然肽和合成肽,从海洋动物中也发现并已成功分离了多种具有广谱抗微生物活性的抗菌肽,如crustins、alfs、从对虾血淋巴中分离的penaeidins、源于组蛋白h2a的sphistin、富含甘氨酸的新型抗菌肽spgly-amp以及从青蟹性腺中分离并具有生殖免疫功能的scygonadin和scy2等。海洋动物处于极端的海洋环境,缺乏获得性免疫,病原感染时主要依靠先天性免疫中的抗菌肽以及免疫效应因子的响应以对抗病原菌。近年来随着海洋生态环境的不断恶化,海水养殖病害频发的问题也日趋明显,因此,加速研发新型的抗菌多肽仍具有重要意义。
技术实现要素:
本发明的目的在于提供一种拟穴青蟹抗菌多肽spampcin56-86。
本发明的另一目的在于提供上述拟穴青蟹抗菌多肽spampcin56-86的应用。
本发明的技术方案之一如下:
一种拟穴青蟹抗菌多肽spampcin56-86,其分子式为c227h373n71o62s1,其氨基酸序列如seqidno:01所示。
本发明的技术方案之二如下:
上述拟穴青蟹抗菌多肽spampcin56-86在制备抗细菌药物中的应用,该抗细菌药物对金黄色葡萄球菌及其耐药菌、李斯特菌、粪肠球菌、屎肠球菌、表皮葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌及其耐药菌、温和气单胞菌、嗜水气单胞菌、大肠埃希氏菌及其耐药菌、迟缓爱德华氏菌和荧光假单胞菌具有抑制和杀灭作用。
本发明的技术方案之三如下:
一种抗细菌药物,其有效成分包括上述拟穴青蟹抗菌多肽spampcin56-86。
在本发明的一个优选实施方案中,其有效成分为上述拟穴青蟹抗菌多肽spampcin56-86。
本发明的技术方案之四如下:
上述拟穴青蟹抗菌多肽spampcin56-86在制备防霉菌药物中的应用,该防霉菌药物对尖孢镰孢菌、禾谷镰孢菌和腐皮镰孢菌具有抑制和杀灭作用。
本发明的技术方案之五如下:
一种制备防霉菌药物,其有效成分包括上述拟穴青蟹抗菌多肽spampcin56-86。
在本发明的一个优选实施方案中,其有效成分为上述拟穴青蟹抗菌多肽spampcin56-86。
本发明的技术方案之六如下:
上述拟穴青蟹抗菌多肽spampcin56-86在制备水产饲料添加剂中的应用。
本发明的技术方案之七如下:
一种水产饲料添加剂,其有效成分包括上述拟穴青蟹抗菌多肽spampcin56-86。
在本发明的一个优选实施方案中,其有效成分为上述拟穴青蟹抗菌多肽spampcin56-86。
本发明的有益效果是:
1、本发明的拟穴青蟹抗菌多肽spampcin56-86由31个氨基酸组成,分子式为c154h256n54o33s3,分子量为3488.25道尔顿,其中含有7个带正电的氨基酸残基和0个带负电的氨基酸残基,根据氨基酸残基电荷预测该抗菌肽等电点为11.71,亲水性平均系数为-0.410,是一种带有正电荷的阳离子多肽。
2、本发明的拟穴青蟹抗菌多肽spampcin56-86对革兰氏阳性菌、革兰氏阴性菌、霉菌均有显著的抗菌效果,此外,spampcin56-86对正常拟穴青蟹血细胞、正常哺乳动物细胞如小鼠肝实质细胞和人正常肝细胞不具有细胞毒性作用。
3、本发明的拟穴青蟹抗菌多肽spampcin56-86具有较强的抗细菌活性及抗霉菌活性,抗菌效果好,抗菌谱广,杀菌速率快,其来源于甲壳动物,既可以研制成为抗细菌药物和抗霉菌药物,又可以应用于水产饲料添加剂,具有广泛的应用前景。
附图说明
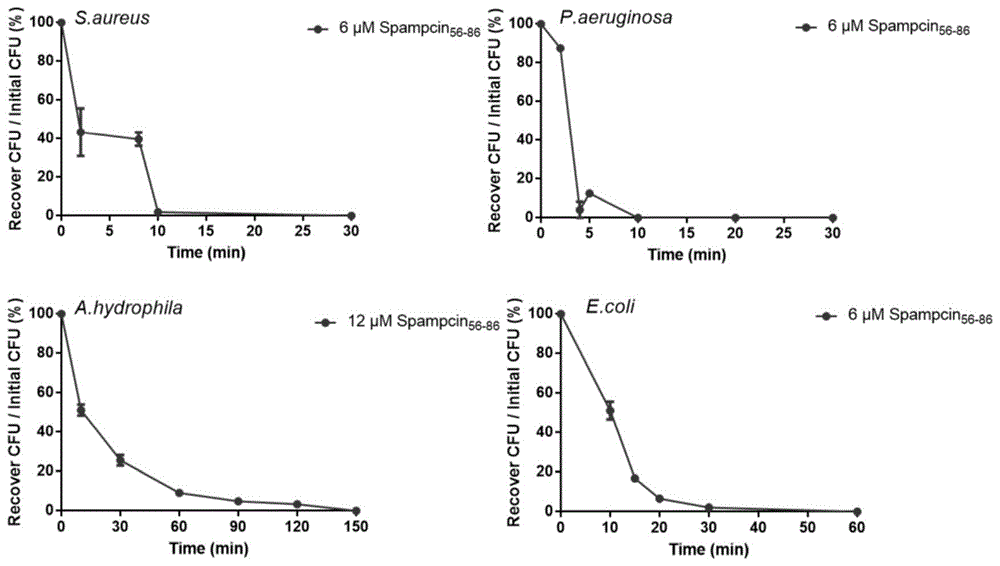
图1为本发明实施例3中拟穴青蟹抗菌多肽spampcin56-86对金黄色葡萄球菌、铜绿假单胞菌、嗜水气单胞菌、大肠埃希氏菌的杀菌动力学图;其中,横坐标为时间(min),纵坐标为杀菌指数(%)。
图2为本发明实施例4中拟穴青蟹抗菌多肽spampcin56-86对金黄色葡萄球菌、铜绿假单胞菌抗菌热稳定性图;其中,横坐标为时间(h),纵坐标为od600值。
图3为本发明实施例5中拟穴青蟹抗菌多肽spampcin56-86抑制禾谷镰孢菌孢子萌发实验图;其中,拟穴青蟹抗菌多肽spampcin56-86浓度为:a:0μm,b:6μm,c:12μm;
图4为本发明实施例5中拟穴青蟹抗菌多肽spampcin56-86抑制尖孢镰孢菌孢子萌发实验图;其中,拟穴青蟹抗菌多肽spampcin56-86浓度为:a:0μm,b:6μm,c:12μm;
图5为本发明实施例6中拟穴青蟹抗菌多肽spampcin56-86与金黄色葡萄球菌作用后的扫描电镜观察图;其中,a:金黄色葡萄球菌,b:金黄色葡萄球菌+12μmspampcin56-86。
图6为本发明实施例6中拟穴青蟹抗菌多肽spampcin56-86与铜绿假单胞菌作用后的扫描电镜观察图;其中,a:铜绿假单胞菌,b:铜绿假单胞菌+12μmspampcin56-86。
图7为mts-pms法检测拟穴青蟹抗菌多肽spampcin56-86细胞毒性实验图;其中,横坐标为spampcin56-86蛋白浓度(μm),纵坐标为细胞增殖率(%)。
具体实施方式
以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述。
实施例1拟穴青蟹抗菌多肽spampcin56-86的制备
所述拟穴青蟹抗菌多肽spampcin56-86的氨基酸序列为:
arg-arg-ala-ala-his-gly-leu-leu-pro-arg-leu-arg-ala-pro-pro-pro-phe-his-lys-arg-cys-val-cys-leu-cys-arg-thr-ala-pro-pro-pro(seqidno:01)
采用现有的固相化学合成的方法即可得到纯度达95%以上拟穴青蟹抗菌多肽spampcin56-86。本实施例中的拟穴青蟹抗菌多肽spampcin56-86委托金斯瑞(江苏)有限公司以固相合成方法合成获得并提供多肽分子量、hplc等检测信息。拟穴青蟹抗菌多肽spampcin56-86理化参数如表1所示:
表1拟穴青蟹抗菌多肽spampcin56-86理化参数
由表1可知spampcin56-86分子量小、稳定性较好,是一种带有正电荷的阳离子多肽。
实施例2拟穴青蟹抗菌多肽spampcin56-86最小抑菌浓度(mic)和最小杀菌浓度(mbc)的测定
本实施例中所涉及到的菌株有:金黄色葡萄球菌(staphylococcusaureus)、表皮葡萄球菌(staphylococcusepidermidis)、屎肠球菌(enterococcusfaecium)、粪肠球菌(enterococcusfaecalis)、李斯特菌(listeriamonocytogenes)、大肠埃希氏菌(escherichiacoli)、铜绿假单胞菌(pseudomonashydrophila)、嗜水气单胞菌(aeromonashydrophila)、温和气单胞菌(aeromonassobria)、迟缓爱德华氏菌(edwardsiellatarda)、荧光假单胞菌(pseudomonasfluorescens)、鲍曼不动杆菌(acinetobacterbaumannii)、耐药金黄色葡萄球菌(staphylococcusaureus)、耐药鲍曼不动杆菌(acinetobacterbaumannii)、耐药大肠埃希氏菌(escherichiacoli)、尖孢镰孢菌(fusariumoxysporum)、禾谷镰孢菌(fusariumgraminearum)、腐皮镰孢菌(fusariumsolani)。其中温和气单胞菌、迟缓爱德华氏菌来源福建省水产研究所赠送,临床分离菌株耐药金黄色葡萄球菌、耐药鲍曼不动杆菌及耐药大肠埃希氏菌来源福建医科大学附属第二医院检验科,其余菌株均购自中国科学院微生物研究所菌种保藏中心,由本实验室保种贮藏。
具体方法如下:
(1)将保种的金黄色葡萄球菌、表皮葡萄球菌、李斯特菌、屎肠球菌、粪肠球菌、大肠埃希氏菌、铜绿假单胞菌、嗜水气单胞菌、温和气单胞菌、迟缓爱德华氏菌、荧光假单胞菌、鲍曼不动杆菌、耐药金黄色葡萄球菌、耐药鲍曼不动杆和耐药大肠埃希氏菌涂布于营养肉汤平板上,在各适宜温度倒置培养18-24h;尖孢镰孢菌、禾谷镰孢菌、腐皮镰孢菌涂布于马铃薯葡萄糖平板上,于28℃倒置培养1-7d。
(2)从各平板上挑取菌落接种于相应的培养基斜面上,细菌继续培养18-24h,用10mm磷酸钠缓冲液(ph=7.4)将细菌从斜面上冲下,调整菌悬液浓度。用mh液体培养基和磷酸钠缓冲液混合液稀释细菌,使得菌体的最终浓度为3.3×104cfu/ml。用10mm磷酸钠缓冲液(ph=7.4)将霉菌孢子从斜面上冲下,用马铃薯葡萄糖液体培养基和磷酸钠缓冲液混合液稀释孢子,利用血球计数板在光学显微镜下对孢子计数,调整孢子浓度,使得霉菌孢子最终浓度为5×104个/ml。
(3)将已合成的拟穴青蟹抗菌多肽spampcin56-86粉末分别用灭菌miliiq水溶解,经过0.22μm滤膜过滤后,倍比稀释蛋白浓度至3μm、6μm、12μm、24μm、48μm、96μm,置于冰上备用。
(4)在96孔细胞培养板上,每种待测菌设置空白对照组、阴性对照组和待测实验组,每组设置三个平行:
a空白对照组:50μl待测蛋白样品和50μl培养基
b阴性对照组:50μl无菌milliq水和50μl菌悬液
c待测实验组:50μl待测蛋白样品和50μl菌悬液
(5)将96孔细胞培养板置于28℃培养箱中,培养1-2d,观察待测实验组中mic结果;将待测实验组吹打混匀后,吸取适量的菌液滴于相应固体培养基平板上,于适宜温度倒置培养1-2d,观察mbc结果。
拟穴青蟹抗菌多肽spampcin56-86的mic、mbc观察结果如表2所示
表2拟穴青蟹抗菌多肽spampcin56-86的抗细菌和抗霉菌活性
注:mic:最小抑菌浓度(μm),用a-b表示。a:肉眼可见菌体生长的最高蛋白浓度;b:肉眼未见菌体生长的最低蛋白浓度。
mbc:最小杀菌浓度(μm),用a-b表示。a:平板可见菌落生长的最高蛋白浓度;b:平板未见菌落生长的最低蛋白浓度。
实施例3拟穴青蟹抗菌多肽spampcin56-86杀菌动力学曲线
选取金黄色葡萄球菌、铜绿假单胞菌、嗜水气单胞菌和大肠埃希氏菌作为待测菌,对拟穴青蟹抗菌多肽spampcin56-86的杀菌动力学进行测定。
具体方法如实施例2中所述的抗菌活性测定类似。调整拟穴青蟹抗菌多肽spampcin56-86终浓度至1倍mbc(金黄色葡萄球菌:6μm;铜绿假单胞菌:6μm;嗜水气单胞菌:12μm;大肠埃希氏菌:6μm;)。在共孵后2min、8min、10min、20min、25min、30min,将96孔细胞培养板取空白对照组、阴性对照组、待测实验组混匀,吸取6μl金黄色葡萄球菌菌悬液稀释至600μldpbs中,混匀后吸取20μl涂布至营养肉汤平板上,37℃倒置培养1-2d,记录金黄色葡萄球菌单克隆数量,计算杀菌指数。在共孵后2min、4min、5min、10min、15min、20min、30min,将96孔细胞培养板取空白对照组、阴性对照组、待测实验组混匀,吸取6μl铜绿假单胞菌菌悬液稀释至600μldpbs中,吸取40μl铜绿假单胞菌菌悬液涂布至营养肉汤平板上,37℃倒置培养1-2d,记录铜绿假单胞菌单克隆数量,计算杀菌指数。在共孵后10min、30min、60min、120min、150min,将96孔细胞培养板取空白对照组、阴性对照组、待测实验组混匀,吸取6μl嗜水气单胞菌菌悬液稀释至720μldpbs中,吸取20μl嗜水气单胞菌菌悬液涂布至营养肉汤平板上,28℃倒置培养1-2d,记录嗜水气单胞菌单克隆数量,计算杀菌指数。在共孵后10min、15min、20min、30min、60min,将96孔细胞培养板取空白对照组、阴性对照组、待测实验组混匀,吸取6μl大肠埃希氏菌菌悬液稀释至720μldpbs中,吸取20μl大肠埃希氏菌菌悬液涂布至营养肉汤平板上,37℃倒置培养1-2d,记录大肠埃希氏菌单克隆数量,计算杀菌指数。杀菌指数是指经过一定时间共孵后,待测实验组的克隆数与阴性对照组克隆数的比值,用百分比表示,结果如图1所示。
实施例4拟穴青蟹抗菌多肽spampcin56-86抗菌活性热稳定性
选取金黄色葡萄球菌和铜绿假单胞菌作为待测菌,对拟穴青蟹抗菌肽spampcin56-86的抗菌活性热稳定性进行测定。
具体方法如实施例2中所述的抗菌活性测定类似。调整拟穴青蟹抗菌肽spampcin56-86终浓度至1倍mbc(金黄色葡萄球菌:6μm,铜绿假单胞菌:6μm),分别在100℃沸水中水浴10min、20min、30min后置于冰上备用。将spampcin56-86与待测菌共同孵育,在0h、12h、24h、36h、48h时用酶标仪测定od600的值,结果如图2所示。
实施例5拟穴青蟹抗菌多肽spampcin56-86作用后霉菌孢子萌发显微镜观察
选取尖孢镰孢、禾谷镰孢作为待测菌,观察拟穴青蟹抗菌肽spampcin56-86对霉菌孢子萌发的影响。
具体方法如实施例2中所述的抗菌活性测定类似。调整拟穴青蟹抗菌肽spampcin56-86蛋白浓度为6μm、12μm,置于冰上备用;调整各霉菌孢子最终浓度为5×104个/ml。将等体积各浓度spampcin56-86与各霉菌孢子于96孔细胞培养板混匀,置于28℃培养箱中,静置培养24h,在光学显微镜下观察霉菌孢子萌发情况,结果如图3和图4所示。
实施例6拟穴青蟹抗菌多肽spampcin56-86与细菌作用后的扫描电镜观察
选取金黄色葡萄球菌、铜绿假单胞菌作为待测菌株,扫描电镜样品的制备按以下步骤进行:
(1)如实施例2所述制备金黄色葡萄球菌、铜绿假单胞菌菌悬液(od600=0.4)冰上放置备用。
(2)用灭菌纯水溶解合成拟穴青蟹抗菌多肽spampcin56-86,并调整蛋白浓度为12μm,冰上放置备用。
(3)菌悬液和蛋白等体积混合后在适宜温度孵育适宜时间。其中金黄色葡萄球菌菌悬液与12μm拟穴青蟹抗菌多肽spampcin56-86于37℃孵育10min;铜绿假单胞菌菌悬液与12μm拟穴青蟹抗菌多肽spampcin56-86于37℃孵育30min。
(4)加入等体积戊二醛固定液,4℃固定2h后,1000g离心10min。
(5)去尽上清,pbs清洗一次,1000g离心10min。
(6)去除大部分上清,留约10μl液体,将剩余悬液滴在玻片上,4℃静置过夜。
(7)pbs清洗一次。
(8)30%-50%-70%-80%-90%-95%-100%-100%(v/v)乙醇逐级脱水,每级脱水15min。
(9)临界点干燥法干燥样品。
(10)喷金后用扫描电子显微镜观察及拍照,结果如图5和图6所示。
实施例7拟穴青蟹抗菌多肽spampcin56-86细胞毒性测定
选取人肾上皮细胞(hek-293t)和拟穴青蟹正常血细胞,对拟穴青蟹抗菌肽spampcin56-86细胞毒性进行测定。具体如下:
(1)收集生长状态良好的拟穴青蟹血细胞、人肾上皮细胞,调整细胞浓度为1×105个/ml,将细胞均匀吹散,在96孔细胞培养板中每孔加入100μl细胞悬液,置于适宜温度培养箱培养至80%以上细胞贴壁。
(2)小心吸出培养基,加入含有不同浓度(0μm、3μm、6μm、12μm、24μm、48μm)拟穴青蟹抗菌多肽spampcin56-86的培养基,置于适宜温度培养箱培养24h。
(3)加入20μlmts-pms溶液后避光孵育2h后,使用酶标仪测得od492值,评价拟穴青蟹抗菌多肽spampcin56-86的细胞毒性,结果如图7所示。
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
序列表
<110>厦门大学
<120>拟穴青蟹抗菌多肽spampcin56-86及其应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>30
<212>prt
<213>拟穴青蟹(scyllaparamamosain)
<400>1
argargalaalahisglyleuleuproargleuargalapropropro
151015
phehislysargcysvalcysleucysargthralapropro
202530
- 还没有人留言评论。精彩留言会获得点赞!