一种多氯联苯降解菌株P52-2及其应用
一种多氯联苯降解菌株p52
‑
2及其应用
技术领域:
1.本发明属于有机污染物降解领域,具体涉及一种多氯联苯降解菌株p52
‑
2及其应用。
背景技术:
2.随着现代工业过程的快速发展,工业废水污染日益严重,使得工业废水和底泥中存有各种持久性有机污染物(pops)。其中,多氯联苯(pcbs)是一类典型的pops,也是当前国际上受到广泛关注的12重pops之一。pcbs作为工业原料主要组分在国内外广泛生产,在早期氯代联苯的应用过程中,有大量的氯代联苯泄漏到环境中,造成环境的长期污染。由于这类物质具有潜在的致癌、致畸、致突变性及生物累积性等特性,能够对生态环境和人类健康构成重大危害。因此,早在2001年,pcbs就被列入了斯德哥儿摩公约,并将其确定为禁止使用的“毒性极强的污染物”,同时规定到2025年必须将其从环境中消除。
3.环境中有毒有害有机污染物的自然衰减主要依赖相关微生物代谢作用,生物修复技术具有成本低、效果好、无二次污染等优点,因此该方法是目前多氯联苯污染修复最具潜力的修复手段。目前,已报道的多氯联苯降解菌株较少,主要包括厌氧降解细菌desulfitobacterium、dehalospirillum multivorans、desulfomonile tiedjei、dehalobacter restricus、desulforomonas chloroethenica和好氧降解菌burkholderia xenovorans、alcaligenes sp.和sphingomonas paucimobilis。然而,大部分降解细菌都属于严格厌氧细菌,需要在严格的厌氧条件下对高氯pcbs(四氯以上的高氯联苯)进行脱氯,降解成低氯联苯。低氯联苯很少进行厌氧脱氯过程,大部分低氯联苯可以直接被好氧降解菌经过联苯降解途径转化为氯代苯甲酸,产生的氯代苯甲酸通过其他好氧菌进一步矿化为二氧化碳和水。由于环境中的大部分微生物都是不可培养的,很多微生物尤其是具有特定功能的微生物都不能通过纯培养的方式分离获得。因此,筛选出能有效降解多氯联苯的菌株具有重要的应用价值和现实意义。
技术实现要素:
4.本发明的第一个目的是提供一种具有多氯联苯降解能力的ochrobactrum haematophilum p52
‑
2。该菌于2021年6月2日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市先烈中路100号大院59号楼5楼,邮编:510070,保藏编号为:gdmcc no:61708。
5.本发明的第二个目的是提供ochrobactrum haematophilum p52
‑
2在降解多氯联苯中的应用。
6.优选是将ochrobactrum haematophilum p52
‑
2应用在多氯联苯污染的环境中对多氯联苯进行降解。
7.本发明的第三个目的是提供一种多氯联苯降解菌剂,其包含ochrobactrum haematophilum p52
‑
2作为活性成分。
8.优选,所述的多氯联苯是pcb9。
9.本发明从广东省清远市某电子垃圾回收厂污水底泥中驯化和分离得到1株以高浓度多氯联苯(pcb9)作为碳源的菌株p52
‑
2,对其进行鉴定,并研究其生长特性和对pcb9的降解特性,为pcbs污染环境的生物修复提供参考。
10.ochrobactrum haematophilum p52
‑
2于2021年6月2日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市先烈中路100号大院59号楼5楼,邮编:510070,保藏编号为:gdmcc no:61708。
附图说明:
11.图1是在以多氯联苯为碳源的无机盐固体培养基上生长的p52
‑
2。
12.图2是p52
‑
2和其相关菌的基于16s rrna基因序列的系统发生关系,构建方法为邻接法,自展值设定重复1000次,图中仅展示了自展值大于50%的结果,比例尺0.005代表每个核苷酸的替换率。
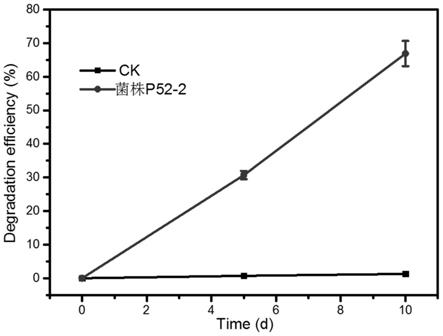
13.图3是菌株p52
‑
2在高浓度pcb9的无机盐培养基中的降解效率(初始浓度10mg
·
l
‑1)。
具体实施方式:
14.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
15.实施例1:ochrobactrum haematophilum p52
‑
2的分离和鉴定
16.1、材料与方法
17.1.1样品来源
18.从广东清远某电子垃圾回收厂污水底泥中采集污水样品,以高浓度多氯联苯(pcb9)为碳源进行长期驯化,通过多次筛选和分离纯化得到高效的多氯联苯降解菌。
19.1.2培养基
20.1.2.1无机盐培养基
21.无机盐培养基用于样品中微生物的富集培养和纯菌条件下多氯联苯降解实验。该培养基配方见表1(含多氯联苯溶液),其配制方法是将各成分加入到溶剂水中,混合均匀,灭菌制得。
22.表1无机盐培养基配方
23.[0024][0025]
1.2.2营养培养基
[0026]
营养培养基用于细菌的分离、纯化、保藏、活化等常规微生物的培养。本实验所用的液体营养培养基种类及成分见表2。若实验需要配制固体培养基,仅需在原有培养基配方的基础上增添1.5
‑
2%的琼脂粉。若菌株的培养条件无特别说明,培养基ph均调节至7.0。具体配制方法是将各成分加入到溶剂水中,混合均匀,调ph值,灭菌制得。
[0027]
表2luria
‑
bertani培养基(lb)成分
[0028][0029]
1.3菌株的驯化、筛选和分离
[0030]
将采集的污水加入到富集培养基(无机盐培养基)中,分别以浓度为10mg
·
l
‑1的多氯联苯作为降解的底物,放置于30℃培养箱中避光震荡培养。利用以多氯联苯为碳源的无机盐培养基进行菌株驯化,7d为一个驯化周期。取体积比10%的接种量转接到具有相同培养体系的新鲜富集培养基中并重复上述富集过程,如此重复三次。
[0031]
将上述获得的第四代富集培养样品以稀释平板法进行涂布分离,样品用营养培养基分离。将涂布好的样品置于原培养温度条件下培养,经过48小时左右,培养基表面形成明显的单菌落,根据菌落的形态大小、颜色、透明度等特征挑取不相同的若干单菌落,并在营养培养基平板上进行划线纯化,培养。若经过划线纯化的平板上仍能观察到不同特征的单菌落,将其再次进行划线分离,直至在同一平板上只能观察到相同特征的单菌落为止。实验中筛选得到1株对多氯联苯有高效降解性能的菌株p52
‑
2。挑取纯化后的单菌落到相应液体营养培养基中培养至对数期,将菌液和无菌的甘油混合分装至无菌的2ml冻存管中(甘油浓度为15%),放置于
‑
80℃长期保存。
[0032]
a、形态特征
[0033]
菌株p52
‑
2是一株从广东清远某电子垃圾回收厂污水底泥中分离出的细菌,经活化以后,在30℃有氧的条件下该无机盐培养基制成的平板上生长48h后,能形成直径为1.5
‑
2.0mm米色、圆形、表面光滑、向上凸起的、革兰氏染色呈阴性、菌株个体为杆状的菌落。该菌为专性好氧菌,氧化酶阳性,其在无机盐上生长的群落图见图1。
[0034]
b、菌株p52
‑
2的分子生物学特征
[0035]
分子生物学特性鉴定主要包括测序及系统发育树的构建。在进行测序和构建系统发育树的之前,需先需要提取细菌的dna(实验使用的细菌基因组dna快速提取试剂盒来自北京艾德莱生物科技有限公司)。为了对细菌的分类学进行研究,通常需要扩增16s rrna基因以及构建系统发育树,扩增的基因为原核生物中编码rrna所组成部分中的一段dna,因其具有高度的保守性、特异性和较合适的序列长度,通常被用于检测和鉴定细菌。
[0036]
聚合酶链式反应(pcr)主要是用来扩增不同的基因片段,pcr需要不同的引物(27f和1492r),pcr扩增反应的体系:10
×
buffer 2.5μl,mg2+(25mmol/l)1.5μl,dntp(25mmol/l)0.3μl,正向引物(10mmol/l)0.5μl,反向引物(10mmol/l)0.5μl,taq酶:0.25μl,dna组模板0.1μl,去离子水19.35μl。pcr扩增反应条件:95℃条件下变性,55℃的条件下退火,72℃的条件下延伸,这个过程循环30次,72℃的条件下延伸10min,pcr反应结束后于4℃条件下保存。扩增所需基因后用0.75
‑
1%的琼脂糖并加入核酸染色剂gelred配制成凝胶块,在凝胶块中加入pcr产物和包含各种长度片段的dna标记物(maker)并放置于电泳仪内,电泳仪内装入tbe(tris硼酸)缓冲液,使电泳仪在一定的电压下工作20min后取出,放置于300nm的紫外灯下进行观察以确定pcr产物扩增反应成功。然后将扩增成功的pcr产物送往华大基因科技有限公司测序,测序引物与扩增引物相同。
[0037]
将测序所得的细菌16s rrna基因序列上传到eztaxon
‑
e(http://eztaxon
‑
e.ezbiocloud.net/;)上,此网站会将提交的序列与已被公认种的典型菌株的16s rrna基因序列进行比对,得到序列间的相似度信息。根据序列比对的结果分析即可选取相应的典型菌株作为本实验分离菌株的模式菌,同时还可以获得模式菌的16s rrna基因序列,构建系统发育分析以证明模式菌与实验分离菌株具有差异,从而来鉴定分离的菌株。构建系统发育树利用mega 5.05程序,通常采用邻接法、最小进化法和最大简约法构建进化树,其中最常用的为邻接法,自展值常设定为重复1000次计算。
[0038]
通过pcr和基因测序得到该菌株的16s rrna基因序列。通过16s rrna基因比对发现,该菌株与ochrobactrum haematophilum jn54(kf150363.1)和ochrobactrum haematophilum l54(ln890050.1)的基因相似度为100%。
[0039]
利用p52
‑
2的16s rrna基因序列和与其相似度较高的16s rrna基因序列制作系统发育树,从而获得其16s rrna基因与其相似性较高的16s rrna基因之间的同源性结果。采用邻位相接法构建的系统发育树见图2。
[0040]
由以上结果可得出本实验所分离的细菌p52
‑
2为ochrobactrum haematophilum这个种。因此将其命名为ochrobactrum haematophilum p52
‑
2,于2021年6月2日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广东省广州市先烈中路100号大院59号楼5楼,邮编:510070,保藏编号为:gdmcc no:61708。
[0041]
目前,在环境领域内关于该菌株的应用鲜有报道。因此,得到高效的多氯联苯降解
菌对含pcbs污染水体、底泥和土壤的处理和深度修复有重要的理论和实际意义。
[0042]
实施例2:ochrobactrum haematophilum p52
‑
2的生长条件
[0043]
生长温度的测定:配置菌株生长所需的液体营养培养基(实施例1中的lb营养培养基),配好后拿到灭菌锅进行灭菌。将活化好的ochrobactrum haematophilum p52
‑
2接入到10ml lb营养培养基(按体积比1%的比例添加)内(实验组),用不接种细菌的营养培养基做为对照(对照组),将培养基放入不同温度下培养18h,对照组和每个温度对应的实验组均有三个重复,每天都需观察细菌的生长情况,当遇到肉眼难以区分的结果时,用可见
‑
紫外分光光度计测定培养基在波长λ=600nm处的吸光值,最后得出新菌可生长温度和最适生长温度范围。测试温度如下:4℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃和55℃。
[0044]
在lb营养培养基中,p52
‑
2能够在20
‑
40℃的温度条件下生长,最适生长温度为该菌的富集温度30℃。
[0045]
实施例3:生长ph的测定
[0046]
配置菌株生长所需的液体营养培养基(lb),用如下缓冲体系调节培养液的ph,ph 4.0
‑
5.0,0.1mol/l柠檬酸钠和0.1mol/l柠檬酸;ph 6.0
–
8.0,0.1mol/l naoh和0.1mol/l kh2po4;ph 9.0
–
10.0,0.1mol/l nahco3和0.1mol/l na2co3;ph 11.0,0.1mol/l naoh和0.05mol/l na2hpo4,然后灭菌消毒。将活化好的ochrobactrum haematophilum p52
‑
2接入到10ml培养基内(按体积比1%的比例添加),每个ph做三个重复,用不接种细菌的培养基作为对照,将培养基放入新菌生长最适温度30℃下培养7d,每天都需观察细菌的生长情况,当遇到肉眼难以区分的结果时,用可见
‑
紫外分光光度计测定培养基在波长λ=600nm处的吸光值,最后得出新菌可生长ph和最适生长ph范围。测试的ph如下:3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0。该菌能够在4.0
‑
9.0的ph条件下生长,最适生长ph为7.0。
[0047]
综上所述,确定ochrobactrum haematophilum p52
‑
2的最佳生长条件为温度30℃,ph 7.0。ochrobactrum haematophilum p52
‑
2在高浓度多氯联苯(pcb9)中的降解实验均在这个条件下进行。
[0048]
实施例4:多氯联苯(pcb9)降解实验
[0049]
将处于对数生长期的ochrobactrum haematophilum p52
‑
2按体积比10%的接种量分别接种于含有初始为10mg/l的pcb9的无机盐培养基(实施例1)中,振荡培养10d,并做平行实验3次。
[0050]
取各处理样品用于化学分析,具体步骤如下:(1)样品预处理:将各培养样品加入二氯甲烷萃取,同时添加5μl浓度为200mg/l的回收率指示剂(
13
c
‑
pcb9),充分震荡后转入分液漏斗中静置。分层后收集有机相,把下层液体放回摇瓶再用等体积二氯甲烷重复萃取,合并萃取液,并将其转移至含有适量已活化铜片的平底烧瓶中进行旋转蒸发,浓缩至约2ml,加入少量正己烷(约5ml),旋转蒸发至2ml,重复洗三次,将有机溶剂置换为正己烷。置换后的浓缩液用玻璃填充柱(直径约为9mm)净化。柱填料自下而上为3cm 3%去活化中性氧化铝,3cm 3%去活化硅胶和1cm的无水硫酸钠。用适量正己烷活化柱子,15ml正己烷/二氯甲烷(体积比为1:1)混合试剂淋洗填充柱,并用棕色试剂瓶收集洗脱液约15ml,氮吹使其浓缩至约0.5ml,最后转移至1.5ml细胞瓶中,冷冻保存。(2)仪器分析:采用安捷伦7890气相色谱仪
‑
5975质谱仪联用测定各处理样品中pcbs含量。使用的色谱柱为安捷伦db 5
‑
ms毛细管色谱柱(柱长30m,内径0.25mm,膜厚度0.25μm)。所得数据用安捷伦色谱工作站处理,多氯联苯
定量用6点校正曲线和内标法进行。微生物细胞浓度的测定采用光电比浊法,以od来表示,即波长为600nm时紫外光透过所测定菌液样品的光密度值。
[0051]
根据gc
‑
ms测定并分析得出菌株p52
‑
2能够降解多氯联苯,并且在含有10mg/l浓度pcb9的无机盐培养液中培养10天后,降解率可达到65%以上(图3)。说明菌株p52
‑
2是一种能够降解多氯联苯,且耐受多氯联苯能力很强的菌株,对pcbs适应性强。
[0052]
结论:从广东清远某电子垃圾回收厂污水底泥中富集分离获得1株能以多氯联苯为碳源生长的多氯联苯降解菌p52
‑
2。该菌株为革兰氏染色呈阴性菌,能形成直径为1.0
‑
2.0mm、米色、圆形、表面光滑、向上凸起的、革兰氏染色呈阴性、菌株个体为杆状的菌落。根据分子生物学手段分析,可得出本实验所分离的细菌p52
‑
2为ochrobactrum haematophilum,并绘制了其进化树。目前针对该菌株应用的报道十分少见,尤其是利用其降多氯联苯的研究尚未见报道。菌株的最佳生长条件为确定菌株的最佳生长条件为温度30℃,ph 7.0。菌株p52
‑
2能够利用多氯联苯作为碳源对其进行降解,在pcb9初始浓度在10mg
·
l
‑1的无机盐培养液中培养10天后,降解率可达到65%以上。综上,p52
‑
2是一种能够降解多氯联苯且对多氯联苯具有很强耐受能力的菌株,对多氯联苯适应性强,在生物修复方面具有较好的应用潜力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1