菌株及其发酵生产麦角生物碱的应用
1.本发明涉及微生物工程技术领域,特别涉及菌株及其发酵生产麦角生物碱的应用。
背景技术:
2.帕金森氏症(parkinson’s disease,pd)是一种进展性的、神经退行性的运动障碍类疾病,是由可以生成多巴胺的脑细胞缺失造成,严重影响患者的日常生活和工作。据统计,中国有将近300万的pd患者,占全球pd患者的一半,是世界上该病患者最多的国家。而我国每年新增患者约10万,65岁以上发病率为1.7%,70岁患病率达3%
‑
5%,是排在肿瘤、心脑血管病之后中老年人的“第三杀手”。pd的治疗,目前主要以左旋多巴类药物为主,但是长期服用,会导致患者运动和非运动症状(开关现象)。然而pd的新药研发难度较大,例如2018年1月,全球最大的制药公司辉瑞(pfizer)发表声明,宣布因技术能力不足将暂停治疗pd的药物研发。这导致pd患者仍然需要使用左旋多巴和多巴胺激动剂药物去控制自己的病情。因此,高效获取和开发能够治疗帕金森病的改良药物,不仅可以缓解患者的病痛,同时也具有重要的社会贡献和经济价值。
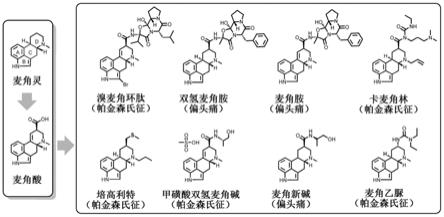
3.微生物来源的药物在人类对抗疾病危害中扮演着重要角色,如降血脂药洛伐他汀及其衍生物,广谱抗细菌药物青霉素和头孢类抗生素,免疫抑制药物环孢素和胶霉毒素等。麦角生物碱是由麦角菌属(claviceps)侵染禾本科植物而产生的次级代谢产物,被誉为最重要的天然药物分子之一。研究表明,由于麦角生物碱核心结构中的麦角灵四并环(图1) 与神经递质(多巴胺、色胺、5
‑
羟色胺等)的结构比较类似,可以特异性结合人脑中的各种神经递质受体,激活或抑制相关神经信号传导。因此,麦角生物碱药物作为多巴胺受体激动剂,在医药市场上被广泛用来治疗帕金森氏症,这些药物主要有溴麦角环肽 (bromocriptine)、培高利特(pergolide)、卡麦角林(cabergoline)等(图1)。如图1 所示,麦角生物碱类药物多以麦角酸为核心骨架,经过化学修饰半合成得到[3]。相比于传统的左旋多巴类药物,麦角酸具有更加复杂的环系结构,为药物活性提升和改良提供更多的靶点。因此,麦角酸的获取方式,决定了以麦角酸为先导化合物的帕金森病药物的研发与生产成本,以及该类药物的产量。
[0004]
目前,麦角酸的获取方式主要有两种:直接化学合成法与天然产物提取加化学处理法。直接化学合成法的合成步骤繁琐,仅核心骨架的合成就需多达三十多步,终产物得率最高仅12%。天然产物提取加化学处理法是目前工业上常用的生产方法。该方法使用c.purpurea 大规模感染黑麦或使用特殊的c.purpurea菌株进行浅水静置培养,然后从感染的黑麦或生产菌株中提取天然麦角生物碱,再经过化学转化获得麦角酸。这种方法周期冗长,产量低,菌株容易退化;发酵产物中存在大量的麦角生物碱结构类似物,分离难度大,且严重依赖于化学手段。更重要的是,国内发酵菌株产量低下,国际麦角原料药市场由跨国企业垄断,发达国家设置的菌种专利保护壁垒严重制约了我们对麦角生物碱药物的研发与优化;以尼麦角林为例,龙灯瑞迪制药公司和辉瑞公司占据了大部分市场份额。综上所述,
开发麦角酸生产的新方法,是摆脱对国外技术依赖的关键,也是提高生产效率、降低生产与研发成本的核心所在,具有重要科学意义和应用前景。
[0005]
微生物细胞工厂(microbial cell factory)是指利用微生物细胞作为生产底盘,通过遗传改造、异源重建生物合成途径等方式,实现目标化合物在微生物细胞中的高效生产。例如,青蒿素每年销售额多达15亿美元,传统的生产方式主要依靠从黄花蒿中直接提取。 2003年,美国加州大学伯克利分校jay d.keasling教授研究组在nat.biotech.上报道了将青蒿素前体紫穗槐
‑
4,11
‑
二烯的生物合成途径构建在大肠杆菌中,紫穗槐二烯产量达到了 112mg/l;2013年,他们进一步利用酵母细胞工厂实现了微生物发酵法生产青蒿素前体青蒿酸,然后利用单线态氧成功将青蒿酸转化为青蒿素。在不到100m3的发酵车间可年产青蒿素达35t,相当于近5万亩耕地的种植产量,因此该工作被认为是合成生物学的里程碑工作。又如,吗啡等阿片类药物是临床重要的镇痛药,其生产主要来自于罂粟植物提取,产能较低。美国斯坦福大学的christina smolke教授通过功能元件挖掘与优化,将来源于细菌、植物、动物以及酵母的功能基因导入酵母细胞中,重构生物合成途径,实现了吗啡等阿片类植物药的微生物发酵法生产,相关工作发表在science上,被评为2015年“全球生命科学的十大进展”之一。此外,近几年国内研究者在本领域也取得令世人瞩目的研究成果,先后实现了丹参酮关键前体miltiradiene、人参皂苷前体原人参二醇等产品的细胞工厂构建与优化。以上案例均表明,构建天然药物的微生物细胞工厂,是当今合成生物学的一个重要的前沿领域,可以有效降低药物生产成本、产生巨大的经济效益,并促进包括帕金森氏症在内的人类疾病的新药研发。
[0006]
丝状真菌作为真核来源的天然药物生产的细胞工厂底盘,具有独特的优势:
①
具有内含子剪接系统,可直接表达基因组dna(gdna),而不必像大肠杆菌和酿酒酵母那样需要先获取cdna;
②
具有磷酸泛酰巯基乙胺基转移酶(pptase),可直接表达聚酮和非核糖体肽的生物合成基因;
③
可表达真菌天然产物的完整生物合成基因簇(十几到几十kb),实现产物的一步异源合成;
④
初级代谢系统强大,可利用淀粉、蔗糖等廉价碳源,实现对工农业废料的再利用;
⑤
对生长环境要求宽容,对较大范围的温度、ph与小分子产物具有较强耐受性。目前多种丝状真菌已经成功作为底盘细胞在酶制剂、食品和制药工业被广泛应用,包括构巢曲霉(aspergillus nidulans)、产黄青霉(penicillium chrysogenum)、米曲霉(aspergillus oryzae)和黑曲霉(aspergillus niger)等。
[0007]
构巢曲霉(a.nidulans)具有极强的次级代谢产物生产能力,含有56个次级代谢产物生物合成基因簇;并且构巢曲霉原生质体为单核细胞,已经建立了高效的遗传操作体系。 nancy keller教授、clay wang教授和berl oakley教授联合改造获得的构巢曲霉突变株 lo8030,删除了包括杂色曲霉素(sterigmatocystin)和苔色酸(orsellinic acid)在内的8 个主要的次级代谢产物生物合成基因簇,精简了基因组244061bp,极大地降低了代谢产物谱的复杂性,使其成为极有潜力的细胞工厂底盘细胞。
技术实现要素:
[0008]
有鉴于此,本发明实现了在构巢曲霉中异源高产麦角生物碱类化合物。
[0009]
为了实现上述发明目的,本发明提供以下技术方案:
[0010]
本发明提供了基因或基因的过表达在发酵生产麦角生物碱或构建发酵生产麦角
生物碱的菌株中的应用;
[0011]
所述基因包括:
[0012]
(i):easf、dmaw、ease(a.fum)thmgr、sams或trps中的一个或多个;和/或
[0013]
(ii):dmaw、easf、ease(a.fum)或easc(a.fum)中的一个或多个;和/或
[0014]
(iii):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)或easc(a.jap)中的一个或多个;和/或
[0015]
(iv):dmaw、easf、easd、ease(a.fum)、easc(a.jap)或easa(a.fum)中的一个或多个,且敲除或敲低easg(a.fum);和/或
[0016]
(v):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)、cloa(c.afr)、cpr(a.ory)或cyb5中的一个或多个;和/或
[0017]
(vi):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)、cloa(c.pur)、cpr(c.pur)、cpr(a.ter)或cyb5中的一个或多个;和/或
[0018]
(vii):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easa(a.fum)、 cloa(c.afr)、cpr(c.pur)或cyb5中的一个或多个。
[0019]
在本发明的一些具体实施方案中,所述基因包括:
[0020]
(a):easf、dmaw、ease(a.fum)thmgr、sams和trps;和/或
[0021]
(b):dmaw、easf、ease(a.fum)和easc(a.fum);和/或
[0022]
(c):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)和easc(a.jap);和/或
[0023]
(d):dmaw、easf、easd、ease(a.fum)、easc(a.jap)和easa(a.fum),且敲除或敲低easg(a.fum);和/或
[0024]
(e):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)、cloa(c.afr)、cpr(a.ory)和cyb5;和/或
[0025]
(f):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)、cloa(c.pur)、cpr(c.pur)、cpr(a.ter)和cyb5;和/或
[0026]
(g):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easa(a.fum)、cloa (c.afr)、cpr(c.pur)和cyb5。
[0027]
在本发明的一些具体实施方案中,所述麦角生物碱包括n
‑
me
‑
dmat、prechanoclavine (pcc)、chanoclavine(cc)、agroclavine(ac)、festuclavine(fc)、pyroclavine(pc)、 6
‑
nor
‑
agroclavine(6
‑
nor
‑
ac)、elymoclavine(ec)、lysergic acid(la)、dihydroelysergol (dhlg)、dihydrolysergic acid(dhla)中的一种或多种。
[0028]
在本发明的一些具体实施方案中,所述菌株的出发菌株包括构巢曲霉。
[0029]
本发明还提供了发酵生产麦角生物碱的基因元件,包括以下任意元件或组合:
[0030]
(a):easf、dmaw、ease(a.fum)thmgr、sams和trps;和/或
[0031]
(b):dmaw、easf、ease(a.fum)和easc(a.fum);和/或
[0032]
(c):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)和easc(a.jap);和/或
[0033]
(d):dmaw、easf、easd、ease(a.fum)、easc(a.jap)和easa(a.fum),且敲除或敲低easg(a.fum);和/或
[0034]
(e):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)、cloa(c.afr)、cpr(a.ory)和cyb5;和/或
[0035]
(f):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easg(a.fum)、easa (c.pur)、cloa(c.pur)、cpr(c.pur)、cpr(a.ter)和cyb5;和/或
[0036]
(g):dmaw、easf、easd、ease(a.fum)、easc(a.fum)、easa(a.fum)、cloa (c.afr)、cpr(c.pur)和cyb5。
[0037]
基于上述研究,本发明还提供了所述基因元件构建的表达载体。
[0038]
在本发明的一些具体实施方案中,所述表达载体包括如下任意质粒或组合;
[0039]
pea01质粒,pytu+easf;和/或
[0040]
pea02质粒,pytr+dmaw;和/或
[0041]
pea03质粒,pytp+ease(a.fum);和/或
[0042]
pea10质粒,pytu+dmaw+easf;和/或
[0043]
pea12质粒,pytu+dmaw+easf+ease(a.fum)+easc(a.fum);和/或
[0044]
pea13质粒,pytp+easf+ease(a.fum)+easc(a.fum);和/或
[0045]
pea14质粒,pytr+dmaw+ease(a.fum)+easc(a.fum);和/或
[0046]
pea15质粒,pytr+easd+ease(a.fum)+easc(a.fum);和/或
[0047]
pea16质粒,pytp+easg(a.fum)+easa(c.pur);和/或
[0048]
pea31质粒,pytp+easg(a.fum)+easa(a.fum);和/或
[0049]
pea38质粒,pytp+easg(a.fum)+easa(c.pur)+cloa(c.afr);和/或
[0050]
pea39质粒,pytp+easg(a.fum)+easa(c.pur)+cloa(c.pur);和/或
[0051]
pea41质粒,pytp+easa(a.fum)+cloa(c.afr)。
[0052]
更重要的是,本发明还提供了转化有所述表达载体的宿主。
[0053]
在本发明的一些具体实施方案中,所述宿主包括如下菌株或其组合:
[0054]
菌株an06,转化有pea01质粒、pea02质粒和pea03质粒,引入额外的easf、dmaw 和ease(a.fum)基因拷贝,且过表达构巢曲霉内源基因thmgr、sams和trps;和/或
[0055]
菌株an10,转化有pea12质粒、pea13质粒和pea14质粒;和/或
[0056]
菌株an27,转化有pea10质粒、pea15质粒和pea16质粒;将easc(a.fum)替换为easc(a.jap);所述菌株an27包含两个拷贝的ease(a.fum)和easc(a.jap);和/ 或
[0057]
菌株an32,转化有pea10质粒、pea15质粒和pea31;且敲除或敲低easg基因,将 easc(a.fum)替换为easc(a.jap);所述菌株an32,包含3个ease(a.fum)拷贝和两个easc(a.jap)拷贝;和/或
[0058]
菌株an54,转化有pea10质粒、pea15质粒和pea38质粒;所述pea38质粒中的 cloa(c.afr)与cpr(a.ory)适配;且过表达构巢曲霉内源性的cyb5基因;和/或
[0059]
菌株an55,转化有pea10质粒、pea15质粒和pea39质粒;所述pea39质粒中的 cloa(c.pur)与cpr(c.pur)重配;且过表达构巢曲霉内源性的cyb5基因;和/或
[0060]
菌株an56,转化有pea10质粒、pea15质粒和pea39质粒;所述pea39质粒中的 cloa(c.pur)与cpr(a.ter)适配;且过表达构巢曲霉内源性的cyb5基因;
[0061]
所述菌株的出发菌株包括构巢曲霉。
[0062]
基于上述研究,本发明还提供了所述基因元件、所述表达载体、所述宿主在发酵生
产麦角生物碱中的应用;所述麦角生物碱包括n
‑
me
‑
dmat、prechanoclavine(pcc)、 chanoclavine(cc)、agroclavine(ac)、festuclavine(fc)、pyroclavine(pc)、6
‑
nor
‑
agroclavine (6
‑
nor
‑
ac)、elymoclavine(ec)、lysergic acid(la)、dihydroelysergol(dhlg)、 dihydrolysergic acid(dhla)中的一种或多种。
[0063]
此外,本发明还提供了发酵生产麦角生物碱的方法,以所述宿主,发酵,收集发酵液,纯化,获得麦角生物碱。
[0064]
本发明以构巢曲霉为底盘细胞,异源重构的麦角生物碱的生物合成途径,获得了10 种不同结构的麦角生物碱化合物和2种途径中间体。通过途径优化、前体供应、p450电子传递链优化获得多株麦角生物碱高产菌株。基于上述,本发明实现了在构巢曲霉中异源高产麦角生物碱类化合物。
附图说明
[0065]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0066]
图1示麦角生物碱活性骨架及麦角生物碱类药物;
[0067]
图2示ac和fc构巢曲霉生产菌株;其中,图2(a)示连续改造的ac生产菌株中 n
‑
me
‑
dmat、pcc、cc和ac的产量;图2(b)示含有不同ease基因的菌株中pcc的产量;图2(c)示含有不同easc基因的菌株中cc的产量;图2(d)示菌株an27摇瓶培养6天后 n
‑
me
‑
dmat、pcc、cc和ac的产量;图2(e)示连续改造的fc生产菌株中n
‑
me
‑
dmat、 pcc、cc和fc的产量;图2(f)示菌株an32摇瓶培养6天后n
‑
me
‑
dmat、pcc、cc和fc 的产量;
[0068]
图3示la和dhla构巢曲霉生产菌株;其中,图3(a)示p450 cloa连续氧化ac和fc 生成la和dhla;图3(b)示含有不同cloa基因的菌株中ec的产量;图3(c)示含有不同cloa基因的菌株中dhlg的产量;图3(d)示含有cloa(c.afr)和不同来源的cpr基因的菌株中ec的产量;图3(e)示含有cloa(c.pur)和不同来源的cpr基因的菌株中ec的产量;图3(f)示含有cloa(c.afr)和不同来源的cpr基因的菌株中dhlg的产量;
[0069]
图4示在构巢曲霉中异源重构麦角生物碱生物合成途径;
[0070]
图5示lc
‑
ms检测含有不同450cloa基因的菌株中的ec和la;其中,图5(a)示不同菌株中[m+h]
+
=255(ec)的检测结果;图5(b)示不同菌株中[m+h]
+
=269(la)的检测结果;图5(c)示ec和la的ms图谱;
[0071]
图6示lc
‑
ms检测含有不同450 cloa基因的菌株中的dhlg和dhla;图6(a)示不同菌株中[m+h]
+
=257(dhlg)的检测结果;图6(b)示不同菌株中[m+h]
+
=271(dhla) 的检测结果;图6(c)示dhlg和dhla的ms图谱;
[0072]
图7示氘代甲醇中化合物ac的氢谱(500mhz);
[0073]
图8示氘代dmso中化合物6
‑
nor
‑
ac的氢谱(500mhz);
[0074]
图9示氘代甲醇中化合物fc的氢谱(500mhz);
[0075]
图10示氘代甲醇中化合物pc的氢谱(500mhz);
[0076]
图11示氘代甲醇中化合物ec的氢谱(500mhz);
[0077]
图12示氘代dmso中化合物dhlg的氢谱(500mhz)。
具体实施方式
[0078]
本发明公开了菌株及其发酵生产麦角生物碱的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
[0079]
本发明使用的基因来源菌株aspergillus fumigatus 3.772,a.oryzae 3.334,a.niger 3.1454, a.terreus 3.15736,and claviceps purpurea 3.1003,是本发明申请人所在的中国科学院微生物研究所有。本发明使用的基因表达启动子为glaa、gpda、amyb、tef1。本发明所有的基因表达均在质粒载体上实施。本发明所涉及的基因列于表1。本发明所构建的质粒列于表 2。本发明所构建的菌株列于表3。本发明所有引物序列列于表4。
[0080]
表1本发明所涉及的基因
[0081]
[0082][0083]
表2本发明构建的质粒
[0084]
[0085]
[0086]
[0087][0088]
表3本发明构建的菌株
[0089]
[0090]
[0091]
[0092][0093]
表4本发明所涉及的引物
[0094]
[0095]
[0096]
[0097][0098]
本发明保护的菌株及其发酵生产麦角生物碱的应用中,所用原料及试剂均可由市场购得。
[0099]
下面结合实施例,进一步阐述本发明:
[0100]
实施例1
[0101]
(1)真菌基因组dna的提取
[0102]
取真菌菌株,在pda平板上培养3天,刮取表面菌丝,蒸馏水洗涤两次后冷冻干燥并保存于
‑
20℃。使用液氮预冷的研钵将冻干的菌丝体研磨成细粉,重悬于500μl的裂解缓冲液(40μmol/l tris
‑
乙酸盐,20μmol/l乙酸钠,1μmol/l edta,1%w/v sds,ph 7.8)中,移液枪吸打直至悬浮液的粘度显着降低且形成泡沫。加入rna酶a并在37℃孵育5分钟,再加入165μl的5μmol/l nacl溶液并混合。13 000rpm离心20min,立即将上清液转移至新试管中,并加入400μl的氯仿和400μl的苯酚。轻轻颠倒试管直至溶液变成乳状。离心20分钟后以除去水相,并用等体积的氯仿萃取。用两个体积的95%乙醇沉淀上清液中的 dna。沉淀的dna用70%冰冷的乙醇洗涤3次,干燥并溶解在50μl te缓冲液(10μmmol/ltris
‑
hcl,0.1μmmol/l edta ph 7.8)中,并保存在
‑
20℃。
[0103]
(2)目的片段的扩增
[0104]
根据烟曲霉aspergillus fumigatus麦角生物碱生物合成基因簇上各基因的序列设计引物,pcr扩增得到基因片段,用于后续质粒的构建。
[0105]
(3)pytu、pytr和pytp载体的提取
[0106]
使用全式金质粒小提试剂盒(trans easypure plasmid miniprep kit)提取pytu、pytr 和pytp载体,具体步骤如下:
[0107]
①
含有pytu、pytr和pytp载体大肠杆菌分别过夜培养,取2
‑
4ml菌液,10000rpm 离心1min,尽可能倒干净上清液。
[0108]
②
向收集的菌体中加入250μl的rb溶液(含rnase a),漩涡震荡直至菌体完全重悬。
[0109]
③
向离心管中再加入250μl的lb溶液,离心管上下颠倒5
‑
6次,室温静置3
‑
5min。
[0110]
④
向离心管中加入350μl的nb溶液,离心管上下颠倒4
‑
6次,室温静置2min。
[0111]
⑤
最大转速离心10min,小心吸取上清加入到离心柱中,10000
×
g离心1min,倒掉收集管废液。
[0112]
⑥
向离心柱中加入650μl的wb溶液(使用前需先加入80ml无水乙醇),12000
×
g 离心1min,倒掉收集管废液。重复一次。
[0113]
⑦
将离心柱放入干净的1.5ml离心管中向离心柱中加入40μl的eb溶液或无菌水 (60
‑
70℃下预热),室温静置2min。
[0114]
⑧
12000
×
g离心1min,将离心管放于
‑
20℃保存。
[0115]
(4)载体的酶切以及载体和目的片段的回收
[0116]
pytp/pytr载体使用swai和bamhi两种内切酶酶切,酶切缓冲液为nebuffer 3.1。 pytu载体使用swai和noti双酶切,酶切缓冲液为nebuffer 3.1。其中swai酶切温度为 25℃,bamhi和noti酶切温度为37℃,酶切时间均为4h。酶切体系如下:
[0117][0118]
酶切后的载体和目的片段均使用omega试剂盒(gel extraction kit)回收。具体步骤如下:
[0119]
①
将切下的凝胶块放入2ml离心管中,加入等体积的binding buffer(xp2),在60℃下加热直至凝胶完全溶解。
[0120]
②
将溶液转移至dna结合柱中,12000
×
g离心1min,倒掉收集管废液。
[0121]
③
向dna结合柱中加700μl spw wash buffer(spw wash buffer使用前需加100 ml乙醇),12000
×
g离心1min,倒掉收集管废液。重复一次。
[0122]
④
空的dna结合柱放入收集管,12000
×
g离心2min。
[0123]
⑤
将dna结合柱放入干净的1.5ml离心管中,加入15
‑
30ml的eb缓冲液或蒸馏水 (65℃预热),室温静置2min。
[0124]
⑥
12000
×
g离心1min,装有dna的离心管放于
‑
20℃保存。
[0125]
(5)酶切后的载体与目的片段连接
[0126]
酶切后的pytu、pytr和pytp载体、启动子片段、和基因片段混合,通过酵母组装得到质粒。
[0127]
(6)酵母感受态制备
[0128]
制作酵母菌株bj5464的感受态,感受态制备参照试剂盒:zymo research
‑
yeast transformation ii kit catalog no:t2001。详细步骤:
[0129]
①
30℃,220rpm,接15ul酵母菌体于10ml ypd培养酵母至对数期,培养18
‑
22h,到od600 处于0.8
‑
1.0;
[0130]
②
室温,500g离心4min收集酵母;
[0131]
③
室温,5ml ez 1solution清洗酵母沉淀,500g离心4min收集酵母;
[0132]
④
室温,5ml ez 1solution再次清洗酵母沉淀,500g离心4min收集酵母;
[0133]
⑤
室温,1ml ez 2solution重悬酵母沉淀,25ul每支分装,装入塑封袋,注明名称和时间,直接冻存于
‑
70℃或者更低储存备用。
[0134]
(7)酵母同源重组
[0135]
①
室温融化感受态;
[0136]
②
向25ul感受态中加入0.2
‑
1ug(最多5ug)的带转化dna,加入300ul的ez 3solution,震荡充分混匀;
[0137]
③
30℃,孵育1个小时,期间每15分钟votex振荡混匀一次;孵育时间可延长到2小时。
[0138]
④
将转化体系全部涂布,30℃,培养2
‑
4天。
[0139]
(8)转化子鉴定
[0140]
挑取4
‑
5个转化子进行鉴定,鉴定采用菌落pcr的方式。每一个克隆转接1x1 cm2转板,一天后,将扩大培养的酵母单克隆转化子进行pcr菌落验证。酵母菌落pcr菌体预处理方法:
[0141]
①
配制试剂:0.2mm乙酸锂溶于1%sds溶液、100%乙醇、70%乙醇
[0142]
②
从平板上刮取酵母单克隆于1.5ml ep管中,将细胞悬浮于100ul溶于含有1%sds的0.2 mm乙酸锂溶液中,70度孵育5min
[0143]
③
再往1.5ml ep加入300ul 96
‑
100%乙醇,涡旋仪混匀
[0144]
④
1.5ml ep放入离心机中,转速15000g,离心3min
[0145]
⑤
将上清倒掉,往1.5ml ep的沉淀中加入200ul 70%乙醇洗涤残余物,离心机使用15000g 转速离心2
‑
3min,弃上清,将沉淀物在65度烘箱5min,使乙醇挥发
[0146]
⑥
最后,用15ul h2o重悬残余物,在涡旋仪上充分混匀,离心机使用15000g转速,离心 15s
[0147]
⑦
取1ul上清做pcr模板进行质粒组装验证
[0148]
pea01质粒使用pytu
‑
sf/sr引物验证;pea01质粒使用pytr
‑
sf/sr引物验证, pea03质粒使用pytp
‑
sf/sr引物验证,引物序列如下:
[0149]
表5
[0150][0151]
将验证正确的酵母转化子进行酵母质粒提取。
[0152]
(9)酵母质粒抽提
[0153]
将鉴定正确的质粒,从1x1 cm2平板上刮取酵母,提取过程参照试剂盒:zymo research zymoprep ii yeast plasmid miniprep ii kit catalog no:d2004
[0154]
(10)酵母质粒转化到大肠杆杆菌
[0155]
将酵母质粒导入到大肠杆菌top10中进行质粒扩增,方法如下:
[0156]
①
从
‑
80℃冰箱中取出商业化化学感受态,放到冰上解冻。
[0157]
②
加入6μl酵母质粒,轻轻晃动混匀,冰上放置30min。
[0158]
③
放入42℃水浴中60
‑
90s,取出后放到冰上2min。
[0159]
④
加入200μl lb培养基(10g/l蛋白胨,5g/l酵母粉,10g/l nacl),放到37℃的摇床中孵育1h。
[0160]
⑤
将培养基涂布到含100μg/ml氨苄抗性的lb固体平板上,过夜培养。
[0161]
⑥
将长出来的克隆用含100μg/ml氨苄抗性的lb液体培养基培养12h,提质粒。
[0162]
⑦
将提取的质粒进行测序,引物和酵母验证引物一致。
[0163]
⑧
测序得到的序列与目标序列比对,序列一致则表示构建的质粒正确。
[0164]
(11)将质粒转入构巢曲霉
[0165]
①
构巢曲霉原生质体如下:
[0166]
a.a.nidulans δstδem菌种涂布或者划线于含0.5ug/mlpyridoxine hcl,0.125ug/mlriboflavin,10mm urdine的solid cd medium,37℃,4天左右,待长满平板后,用2ml 0.1% tween
‑
80。
[0167]
b.棉签刮取半个平板左右的孢子,使用孢子过滤器过滤;进行镜检。
[0168]
c.37℃,250rpm,100ml,孢子浓度约为107个/ml liquid cd medium(含0.5ug/mlpyridoxine hcl,0.125ug/ml riboflavin,10mm urdine营养素)震荡培养6.5h,萌发孢子,孢子萌发的最好状态是菌丝体长到3倍于膨胀孢子大小,孢子先聚集后萌发。
[0169]
d.使用离心机8000rpm转速离心培养基中的菌丝,加入15ml osmotic medium,重复洗涤3次。
[0170]
e.加入10ml的混合酶解液(30mg lysing enzyme,20mg yatalase溶解在10ml osmoticmedium buffer中),30℃,80rpm摇床中培养,显微镜观察菌丝酶解情况,酶解好的原生质体约为孢子体积的两倍,形态均一,呈现薄壁状态。酶解时间一般在约2.5h。
[0171]
f.加入等体积trapping buffer,2000rpm离心10min,收集中间层的原生质体
[0172]
g.加入3倍体积stc buffer,5000rpm离心10min,去除液体
[0173]
h.加入少量stc buffer重悬,使原生质体浓度约为108‑
109个/ml,分装到1.5ml离心管中,每管100μl。以上所有操作均在冰上或4℃。
[0174]
②
将质粒共同转化原生质体,步骤如下:
[0175]
a.取质粒各5μg,加入到100μl原生质体中,轻轻混匀,于冰上放置60min。
[0176]
b.加入1.25ml 60%peg solution,用移液枪轻轻混匀,室温放置20min。
[0177]
c.轻柔涂布于solid cd
‑
sorbitol medium(加入相应的营养素)平板,混匀涂布过程务必轻柔。37℃正置培养1d,再倒置培养1
‑
2天,待克隆长出。
[0178]
(12)构巢曲霉产物鉴定
[0179]
①
取单克隆转化子至solid cd medium,37℃培养转化子菌株用于保种;
[0180]
②
上述步骤取菌体接种到liquid cd
‑
st medium的液体培养基中,37℃,250rpm,培养三天;
[0181]
③
萃取检测产物。菌丝和上清液分别用乙酸乙酯萃取检测3次,合并有机相。30℃旋转蒸发至完全干燥,加入300μl甲醇溶解,0.22μm滤膜过滤。检测方法为hplc或lc
‑
ms。
[0182]
④
hplc检测条件:在shimadzu lc
‑
2030c 3d plus system(shimadzu,japan)系统上进行分析,流动相为乙腈(v/v,0.1%甲酸)和水(v/v,0.1%甲酸),流速1ml/min。 0
‑
25min,10%
‑
100%乙腈;25
‑
30min,100%乙腈;10%乙腈平衡8min。进样量5μl。
[0183]
⑤
lc
‑
ms检测条件:在agilent
‑
1200hplc/6520qtofms(usa)系统上进行lc
‑
ms 分析,流动相为乙腈(v/v,0.1%甲酸)和水(v/v,0.1%甲酸),流速0.3ml/min。0
‑
15min, 10%
‑
100%乙腈;15
‑
20min,100%乙腈。10%乙腈平衡5min。进样量5μl。q
‑
tof使用双重esi作为离子源接口,并且esi源以正电离模式运行。扫描范围是m/z 100
‑
1000。
[0184]
实施例2在构巢曲霉中异源生产n
‑
me
‑
dmat和prechanoclavine(pcc)
[0185]
根据烟曲霉aspergillus fumigatus麦角生物碱生物合成基因簇上各基因的序列设计引物,pcr扩增得到dmaw、easf、ease(a.fum)基因片段,分别用于pea01、pea02、pea03 质粒的构建。
[0186]
酶切后的pytu、pytr和pytp载体和分别和基因片段easf、dmaw、ease(a.fum) 混合,通过酵母组装得到pea01、pea02、pea03质粒。然后测序验证正确的质粒混合转入构巢曲霉,得到转化菌株an01,发酵进行产物检测和定量。
[0187]
在菌株an01的基础上引入额外的easf、dmaw、ease(a.fum)基因拷贝,得到菌株 an02;在菌株an02的基础上分别过表达构巢曲霉内源基因thmgr、sams、trps,得到菌株an03、an04、an05;将构巢曲霉内源基因thmgr、sams、trps共同过表达于菌株an02,得到新的菌株an06。
[0188]
对上述菌株进行发酵,发酵条件为10ml液体cd
‑
st培养基装于50ml falcon tube 中,37℃,250rpm培养三天,进行产物检测及定量。发现菌株an06中n
‑
me
‑
dmat和 prechanoclavine产量最高。然后对菌株an06进行摇瓶发酵,100ml液体cd
‑
st培养基装于250ml三角瓶中,37℃,250rpm培养六天,得到n
‑
me
‑
dmat和prechanoclavine(pcc) 产量分别为260.1mg/l,and 333.8mg/l。
[0189]
实施例3在构巢曲霉中异源生产chanoclavine(cc)
[0190]
根据烟曲霉aspergillus fumigatus麦角生物碱生物合成基因簇上各基因的序列设计引物,pcr扩增得到dmaw、easf、ease(a.fum)、easc(a.fum)基因片段,用于
channoclavine 表达所需质粒的构建。将dmaw、easf共同构建到pytu得到质粒pea10;将easc(a.fum) 构建到pytr得到质粒pea11;将dmaw、easf、ease(a.fum)、easc(a.fum)共同构建到pytu得到质粒pea12;将easf、ease(a.fum)、easc(a.fum)共同构建到pytp得到质粒pea13;将dmaw、ease(a.fum)、easc(a.fum)共同构建到pytr得到质粒pea14。
[0191]
将测序验证正确的质粒混合转入构巢曲霉,其中:pea10,pea03,pea11共转化得到菌株an07;pea12,pea13共转化得到菌株an08;pea12,pea13,pea09共转化得到菌株 an09;pea12,pea13,pea14共转化得到菌株an10。
[0192]
对上述菌株进行发酵,发酵条件为10ml液体cd
‑
st培养基装于50ml falcon tube 中,37℃,250rpm培养三天,进行产物检测及定量。发现菌株an10中channoclavine(cc) 产量最高。然后对菌株an10进行摇瓶发酵,100ml液体cd
‑
st培养基装于250ml三角瓶中,37℃,250rpm培养六天,得到cc产量为240.1mg/l。
[0193]
实施例4在构巢曲霉中异源生产agroclavine(ac)
[0194]
根据烟曲霉aspergillus fumigatus麦角生物碱生物合成基因簇上各基因的序列设计引物,pcr扩增得到dmaw、easf、ease(a.fum)、easc(a.fum)easd、easg(a.fum) 基因片段。根据claviceps purpurea麦角生物碱生物合成基因簇上各基因的序列设计引物,扩增得到easa(c.pur)基因片段,用于化合物ac表达所需质粒的构建。将easd、ease (a.fum)、easc(a.fum)共同构建到pytr得到质粒pea15;将easg(a.fum)、easa (c.pur)共同构建到pytp得到质粒pea16。
[0195]
将测序验证正确的质粒混合转入构巢曲霉,其中:pea10,pea15,pea16共转化得到菌株an11。
[0196]
对上述菌株进行发酵,发酵条件为100ml液体cd
‑
st培养基装于250ml三角瓶中, 37℃,250rpm培养三天,进行产物检测及定量。发现菌株an11中ac产量为20.2mg/l,同时积累了较多的n
‑
me
‑
dmat(18.6mg/l)和pcc(18.9mg/l)(图2a),表明ease和easc 为ac生产的限速步骤。为了解决该限速步骤,我们从不同ea生产菌株中克隆得到ease 和easc的同源基因。首先用ease同源基因替换pcc生产菌株an01中的ease(a.fum),通过测定终产物pcc的产量,得到构巢曲霉中活性最优的ease(a.fum)基因(图2b)。然后用easc同源基因替换cc生产菌株an07中的easc(a.fum),通过测定终产物cc 的产量,得到构巢曲霉中活性最优的easc(a.jap)基因(图2c)。接下来使用easc(a.jap) 替换菌株an11中的easc(a.fum),并测试不同拷贝数的ease(a.fum)和easc(a.jap) 对终产物ac产量的影响。最终得到ac的高产菌株an27,包含两个拷贝的ease(a.fum) 和easc(a.jap)。然后对菌株an27进行摇瓶发酵,100ml液体cd
‑
st培养基装于250ml 三角瓶中,37℃,250rpm培养六天,得到ac产量为78.7mg/l(图2d)。此外,我们还在菌株an27中分离得到了化合物6
‑
nor
‑
agroclavine(6
‑
nor
‑
ac)。
[0197]
氘代甲醇中化合物ac的氢谱(500mhz)如图7所示;氘代dmso中化合物6
‑
nor
‑
ac 的氢谱(500mhz)如图8所示。
[0198]
实施例5在构巢曲霉中异源生产festuclavine(fc)
[0199]
根据烟曲霉aspergillus fumigatus麦角生物碱生物合成基因簇上各基因的序列设计引物,pcr扩增得到dmaw、easf、ease(a.fum)、easc(a.fum)easd、easg(a.fum)、 easa(a.fum)基因片段,用于化合物fc表达所需质粒的构建。将easg(a.fum)、easa (a.fum)共同构建到pytp得到质粒pea31。
[0200]
将测序验证正确的质粒混合转入构巢曲霉,其中:pea10,pea15,pea31共转化得到菌株an28。
[0201]
对上述菌株进行发酵,发酵条件为100ml液体cd
‑
st培养基装于250ml三角瓶中, 37℃,250rpm培养三天,进行产物检测及定量。发现菌株an28中fc产量较少,主产物为fc的手性异构体pyroclavine(24.5mg/l)。我们尝试更换不同来源的easg,发现主产物仍然是pc。最后,我们将菌株an28中的easg基因删掉,得到菌株an31,发现该菌株主产物为fc。接着我们将菌株an31中的easc(a.fum)替换为easc(a.jap),并对ease (a.fum)和easc(a.jap)进行多拷贝测试,最终得到菌株an32,该菌株的fc产量最大 (图2e),该菌株包含了3个ease(a.fum)拷贝和两个easc(a.jap)拷贝。对菌株an32 进行摇瓶发酵,100ml液体cd
‑
st培养基装于250ml三角瓶中,37℃,250rpm培养六天,得到fc产量为99.2mg/l(图2f)。
[0202]
氘代甲醇中化合物fc的氢谱(500mhz)如图9所示。氘代甲醇中化合物pc的氢谱 (500mhz)如图10所示。
[0203]
实施例6在构巢曲霉中异源生产elymoclavine(ec)和lysergic acid(la)
[0204]
根据烟曲霉aspergillus fumigatus麦角生物碱生物合成基因簇上各基因的序列设计引物,pcr扩增得到dmaw、easf、ease(a.fum)、easc(a.fum)easd、easg(a.fum) 基因片段。根据claviceps purpurea麦角生物碱生物合成基因簇上各基因的序列设计引物,扩增得到easa(c.pur)基因片段。根据文献报道,合成有功能的细胞色素p450基因cloa (e.typ)、cloa(c.afr)、cloa(c.pur)的cdna序列,用于化合物ec和la表达所需质粒的构建。将easg(a.fum)、easa(c.pur)、cloa(e.typ)共同构建到pytp得到质粒pea37;将easg(a.fum)、easa(c.pur)、cloa(c.afr)共同构建到pytp得到质粒 pea38;将easg(a.fum)、easa(c.pur)、cloa(c.pur)共同构建到pytp得到质粒pea39。
[0205]
将测序验证正确的质粒混合转入构巢曲霉,其中:pea10,pea15,pea37共转化得到菌株an33;pea10,pea15,pea38共转化得到菌株an34。pea10,pea15,pea39共转化得到菌株an35。
[0206]
对上述菌株进行发酵,发酵条件为100ml液体cd
‑
st培养基装于250ml三角瓶中, 37℃,250rpm培养三天,进行产物检测及定量。发现三个菌株都可以生产ec(图3b),并且菌株an34和an35可以检测到少量la。该结果表明合成的cloa基因均可以在构巢曲霉中发挥功能。
[0207]
真菌细胞色素p450蛋白在行使氧化催化功能时,往往需要伴侣蛋白cpr从nadph 传递电子给催化底物,此外还可能包含第三个蛋白cyb5同样可以传递电子(图3a)。虽然构巢曲霉含有内源性的cpr,但是可能与异源的cloa适配性不好,造成ec和la产量低。因此,为了提高ec的产量,我们为cloa(c.afr)和cloa(c.pur)筛选适配的 cpr。首先pcr扩增得到不同来源的cpr,然后将其分别克隆到菌株an34和an35中。结果发现,三个菌株an43(cloa(c.afr)
‑
cpr(a.ory)),an44(cloa(c.pur)
‑
cpr(c.pur)), and an46(cloa(c.pur)
‑
cpr(a.ter))中ec的产量明显提高,分别达到了1.7mg/l,2.0 mg/l,和1.9mg/l(图3d和3e),分别是出发菌株的1.9倍,2.8倍和2.9倍。接着将构巢曲霉内源性的cyb5基因在菌株an43,an44,an46中进行过表达,得到新的菌株an54, an55,an56,化合物ec的产量进一步提高到2.1mg/l(an54),8.2mg/l(an55),and 2.8 mg/l(an56)(图3d和3e)。
[0208]
ec和la的检测结果见图5,其中,图5(a)示不同菌株中[m+h]
+
=255(ec)的检测结
果;图5(b)示不同菌株中[m+h]
+
=269(la)的检测结果;图5(c)示ec和la 的ms图谱。
[0209]
其中,氘代甲醇中化合物ec的氢谱(500mhz)如图11所示。
[0210]
实施例7在构巢曲霉中异源生产dihydroelysergol(dhlg)和dihydrolysergic acid (dhla)
[0211]
根据烟曲霉aspergillus fumigatus麦角生物碱生物合成基因簇上各基因的序列设计引物,pcr扩增得到dmaw、eaxf、ease(a.fum)、easc(a.fum)easd、easa(a.fum) 基因片段。根据文献报道,合成有功能的细胞色素p450基因cloa(e.typ)、cloa(c.afr)、 cloa(c.pur)的cdna序列,用于化合物dhlg和dhla表达所需质粒的构建。将easa (a.fum)、cloa(e.typ)共同构建到pytp得到质粒pea40;将easa(a.fum)、cloa(c.afr) 共同构建到pytp得到质粒pea41;将easa(a.fum)、cloa(c.pur)共同构建到pytp 得到质粒pea42。
[0212]
将测序验证正确的质粒混合转入构巢曲霉,其中:pea10,pea15,pea40共转化得到菌株an36;pea10,pea15,pea41共转化得到菌株an37。pea10,pea15,pea42共转化得到菌株an38。
[0213]
对上述菌株进行发酵,发酵条件为100ml液体cd
‑
st培养基装于250ml三角瓶中, 37℃,250rpm培养三天,进行产物检测及定量。发现菌株an37和an38可以生产dhlg (图3c),并且菌株an37可以检测到少量dhla。
[0214]
为了提高dhlg的产量,我们为cloa(c.afr)筛选适配的cpr。首先pcr扩增得到不同来源的cpr,然后将其分别克隆到菌株an37中。结果发现菌株an49(cloa(c. afr)
‑
cpr(c.pur))中dhlg的产量明显提高,达到了1.36mg/l(图3f),是出发菌株的2.5 倍。接着将构巢曲霉内源性的cyb5基因在菌株an49中进行过表达,得到新的菌株an57,化合物dhlg的产量进一步提高到4.0mg/l,是菌株an37的7.3倍(图3f)。
[0215]
dhlg和dhla的检测结果见图6。其中,图6(a)示不同菌株中[m+h]
+
=257(dhlg) 的检测结果;图6(b)示不同菌株中[m+h]
+
=271(dhla)的检测结果;图6(c)示dhlg 和dhla的ms图谱。
[0216]
氘代dmso中化合物dhlg的氢谱(500mhz)如图12所示。
[0217]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1