一种增强免疫细胞抗肿瘤效果的方法
1.本发明涉及细胞培养技术与免疫治疗技术领域,具体涉及一种增强免疫细胞抗肿瘤效果的方法。
背景技术:
2.亚精胺(spermidine)又称三盐酸亚精胺,是多胺类物质的一种。多胺是一种小的、脂肪类的、多阳离子(
‑
nh
3+
)的生物分子。哺乳动物中主要存在精胺(spermine)、亚精胺(spermidine)、腐胺(putrescine)和尸胺(cadaverine)四种多胺。精胺属四胺类,亚精胺属三胺类,腐胺和尸胺是二胺类,氨基数量不同使其具有不同的生理特性。亚精胺是含有3个胺基的低分子量脂肪族碳化物,是存在于所有生物体中的天然多胺之一,是一种重要的药物合成原料,被广泛应用于医药中间体的合成。亚精胺参与生物体内许多的生物学过程,如调控细胞增殖、细胞衰老、器官发育、免疫以及癌症等生理和病理过程。近年的研究表明,对于神经系统中突触可塑性、氧化应激及自噬等过程,亚精胺具有重要的调控作用。亚精胺可维持细胞膜稳定性,增加抗氧化酶活性,改善光系统ii(psii)以及相关基因表达。2009年,发表在nature cell biology上题为“亚精胺诱导自噬从而延长寿命”的文章引发了亚精胺抗衰老的轰动。
3.t细胞免疫治疗主要包括嵌合抗原受体基因修饰t细胞(car
‑
t), t细胞受体基因修饰t细胞(tcr
‑
t)和肿瘤浸润t细胞(tils),上述三种疗法在部分肿瘤治疗领域展现一定的临床治疗效果,但是在大部分实体瘤中,其治疗效果有待进一步提高。由于上述三种疗法均显著依赖肿瘤患者t细胞(外周血t细胞和肿瘤浸润t细胞),因此亟需探索显著提高肿瘤患者t细胞功能的方法。
4.前期研究发现衰老t细胞的代谢和功能均下降。由于大部分肿瘤患者不仅年纪较高,而且会同时接受放化疗等多种治疗方法,因此,肿瘤患者t细胞效应功能会比健康人群的t细胞效应功能有进一步的受损。因此恢复和提高肿瘤患者t细胞功能,进而提高对应car
‑
t,tcr
‑
t和tils抗肿瘤效果有利于增强免疫细胞的抗肿瘤效果,为肿瘤患者带来福音。
技术实现要素:
5.本发明的目的是提供一种增强免疫细胞抗肿瘤效果的方法,是在免疫细胞的体外培养过程中,向免疫细胞的培养基中加入亚精胺。
6.细胞免疫的临床治疗中,肿瘤患者的car
‑
t,tcr
‑
t和tils在用于治疗前,一般都需要7
‑
10天的体外培养扩增,发明人在肿瘤患者外周血t细胞和tils体外培养过程中,意外发现培养基中加入亚精胺可以增强t细胞的效应功能并提高对应car
‑
t,tcr
‑
t和tils抗肿瘤功能,进而提高其体内外杀伤肿瘤细胞的能力。
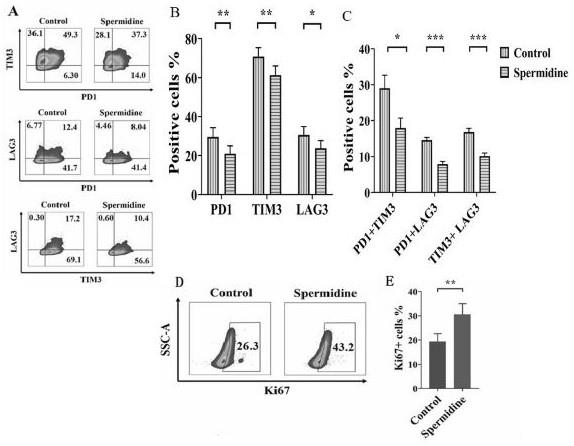
7.具体来说,当肿瘤患者的肿瘤组织经手术切除后,将肿瘤组织切碎到1
‑
2毫米的小块,每一小块肿瘤组织分别放置于24孔细胞培养板的一个孔内,然后加入t细胞培养基。本发明实施例所用的t细胞培养基为含有il2 (50u/ml; peprotech, usa), okt3 抗体
(50ng/ml; acro, usa) and cd28 抗体(1ug/ml; t&l biotechnology, china)的x
‑
vivo 无血清培养基(lonza, usa)。将上述小块肿瘤组织在细胞培养箱培养,直到获得最终tils。将tils分成两组,一组(对照组)经t细胞培养基培养7天,一组(亚精胺组)经含亚精胺 (10um) (cayman chemical, usa)的t细胞培养基培养7天。研究结果发现亚精胺组tils的免疫抑制受体(pd1,tim3,lag3)的表达水平显著下降,而增殖能力、分泌ifn
‑
γ,体内外杀伤自体肿瘤细胞能力显著增强。
8.本发明还验证了经亚精胺处理的tcr
‑
t的效果。合成靶向食管癌肿瘤细胞的tcr1(j immunother cancer. 2019 aug 28;7(1):232.)基因,并将其克隆至慢病毒载体,随后转染宿主细胞(如293ft细胞)并制备了浓缩后慢病毒。携带tcr1慢病毒感染外周血t细胞后生成对应的tcr1
‑
t细胞,一组tcr1
‑
t(对照组)经t细胞培养基培养7天,一组(亚精胺组)经含亚精胺(10um) (cayman chemical, usa)的t细胞培养基培养7天。研究结果发现亚精胺组tcr1感染效率提高,免疫抑制受体(pd1,tim3,lag3)的表达水平显著下降,tcr1
‑
t增殖能力、分泌ifn
‑
γ,体内外杀伤自体肿瘤细胞能力显著增强。
9.本发明还验证了经亚精胺处理的car
‑
t的效果。合成靶向mesothelin(msln)car基因,并将其克隆至慢病毒载体,随后转染宿主细胞(如293ft细胞)并制备了浓缩后慢病毒。携带msln car慢病毒感染外周血t细胞后生成对应的msln car
‑
t细胞,一组msln car
‑
t(对照组)经t细胞培养基培养7天,一组(亚精胺组)经含亚精胺 (10um) (cayman chemical, usa)的t细胞培养基培养7天。研究结果发现spermidine组msln car感染效率提高,msln car
‑
t的增殖能力、免疫抑制受体(pd1,tim3,lag3)的表达水平显著下降,分泌ifn
‑
γ和体内外杀伤自体肿瘤细胞能力显著增强。
10.基于本发明的上述研究,本发明首先提供了亚精胺的新用途:具体为以下任一所述的用途:(1)在体外培养免疫细胞、提高免疫细胞增殖能力、提高免疫细胞体内外杀伤肿瘤细胞能力中的应用。
11.(2)在制备免疫细胞培养基中的应用。
12.(3)在制备能提高免疫细胞体内外杀伤肿瘤细胞能力的细胞培养基、药物或制剂中的应用。
13.(4)在制备降低免疫细胞的免疫抑制受体表达量的细胞培养基、药物或制剂中的应用。
14.(5)在制备提高免疫细胞分泌ifn
‑
γ量的细胞培养基、药物或制剂中的应用。
15.(6)在制备提高免疫细胞增殖能力的细胞培养基、药物或制剂中的应用。
16.(7)在制备提高car
‑
t和tcr
‑
t感染效率培养基中的应用。
17.(8)在提高免疫细胞体内外杀伤肿瘤细胞能力中的应用。
18.(9)在治疗肿瘤或提高免疫细胞抗肿瘤效果中的应用。
19.上述的任一种应用中,所述免疫细胞包括car
‑
t,tcr
‑
t或tils。
20.上述任一应用中,制备获得的免疫细胞属于本发明的保护范围。
21.亚精胺在体外培养免疫细胞时,其浓度为5
‑
100um,培养时间为5
‑
14天。优选地,亚精胺在体外培养免疫细胞时,其浓度为10 um,培养时间为7天。
22.本发明还提供了一种t细胞培养基,其为含有il2、okt3抗体、抗cd28抗体、亚精胺
的x
‑
vivo 无血清培养基。
23.或,所述t细胞培养基为含有il2、预涂 cd3 和 cd28 激动剂抗体的磁珠(磁珠和t细胞比例为1
‑
3:1)、亚精胺的x
‑
vivo 无血清培养基。
24.或,所述t细胞培养基为含有il2、okt3抗体、抗cd28抗体、亚精胺的aim
‑
v
®ꢀ
medium cts
™
培养基。
25.或,所述t细胞培养基为含有il2、预涂 cd3 和 cd28 激动剂抗体的磁珠(磁珠和t细胞比例为1
‑
3:1)、亚精胺的aim
‑
v
®ꢀ
medium cts
™
培养基。
26.优选所述t细胞培养基中il2浓度为50
‑
6000 u/ml; okt3 抗体浓度为20
‑
200ng/ml;抗cd28抗体浓度为0.5
‑
5ug/ml。
27.更优选,所述t细胞培养基中il2浓度为50 u/ml; okt3 抗体浓度为50 ng/ml;抗cd28抗体浓度为1 ug/ml。
28.上述t细胞培养基培养获得的t细胞属于本发明的保护范围。
29.本发明提供了上述t细胞培养基的以下任一所述的应用:(1)提高免疫细胞体内外杀伤肿瘤细胞能力;(2)降低免疫细胞的免疫抑制受体表达量;(3)提高免疫细胞分泌ifn
‑
γ量;(4)提高免疫细胞增殖能力;(5)提高car
‑
t和tcr
‑
t感染效率;(6)体外培养免疫细胞。
30.本发明进行了大量试验,在体外培养免疫细胞的培养基中加入亚精胺,均证实了该方法可以提高car
‑
t,tcr
‑
t和tils功能效应,表现为:tils, car
‑
t和tcr
‑
t免疫抑制受体表达水平下降,增殖能力增强、分泌ifn
‑
γ水平提高,体内外杀伤自体肿瘤细胞能力显著增强,同时发现car
‑
t和tcr
‑
t感染效率也显著提高,因此采用亚精胺体外处理的car
‑
t、tcr
‑
t和tils具有更好的治疗癌症的效果。本发明为亚精胺提供了新的应用方向,为肿瘤治疗提供了新的方法,临床应用前景良好。
附图说明
31.图1为亚精胺的处理显著降低tils免疫抑制受体的表达,增强其增殖能力示意图。a,流式图描述亚精胺处理与否的tils免疫抑制受体(pd1,tim3,lag3)的表达水平, b,免疫抑制受体单独阳性比例的统计结果,c,免疫抑制受体共阳性比例的统计结果。d,代表性流式图描述亚精胺处理与否的tils表达ki67的比例,e ,ki67阳性比例的统计结果图。
32.图2为亚精胺处理与否的tils分泌ifn
‑
γ的水平和体外杀伤靶细胞的能力,a,亚精胺处理与否的tils与对应肿瘤细胞共孵育的模式图。b, 亚精胺处理与否的tils与对应靶细胞共孵育后表达ifn
‑
γ的水平。c, 亚精胺处理与否的tils杀伤对应靶细胞的能力。
33.图3为亚精胺处理与否的tils体内杀伤对应肿瘤细胞的能力结果,分别表示亚精胺处理与否的tils体内杀伤对应肿瘤细胞的模式,接受亚精胺处理与否的tils治疗移植瘤小鼠的肿瘤体积结果,接受亚精胺处理与否的tils治疗移植瘤小鼠的肿瘤质量结果。
34.图4为亚精胺处理与否的tcr1
‑
t细胞体内外功能评价。a,亚精胺处理与否的tcr1
‑
t感染效率的统计结果。b, 亚精胺处理与否的tcr1
‑
t与靶细胞共孵育分泌ifn
‑
γ的统计结
果。c,亚精胺处理与否的tcr1
‑
t体外杀伤靶细胞能力的统计结果。d,亚精胺处理与否的tcr1
‑
t回输移植瘤小鼠后,肿瘤体积的统计结果。
35.图5为亚精胺处理与否的msln car
‑
t细胞体内外功能评价。a,亚精胺处理与否的msln car
‑
t感染效率的统计结果。b, 亚精胺处理与否的msln car
‑
t与靶细胞共孵育分泌ifn
‑
γ的统计结果。c,亚精胺处理与否的msln car
‑
t体外杀伤靶细胞能力的统计结果。d,亚精胺处理与否的msln car
‑
t回输移植瘤小鼠后,肿瘤体积的统计结果。
36.图6为实施例6中tils在无任何细胞因子培养条件下(只有x
‑
vivo),一组加亚精胺(亚精胺组),一组不加亚精胺(对照组)的tils免疫抑制受体(pd1,tim3,lag3)的表达水平流式图、免疫抑制受体共阳性比例的统计结果和免疫抑制受体单独阳性比例的统计结果图。
37.图7为实施例6中亚精胺处理与否的tils与对应靶细胞共孵育后表达ifn
‑
γ的水平。
38.图8为实施例6中亚精胺处理与否的tils杀伤对应靶细胞的能力。
39.图9
‑
图12为在仅包含okt3(50 ng/ml)x
‑
vivo培养基培养条件下,亚精胺的处理表现为显著降低tils免疫抑制受体的表达,增强其增殖能力示意图。图9为流式图描述亚精胺处理与否的tils免疫抑制受体(pd1,tim3,lag3)的表达水平结果图、免疫抑制受体单独阳性比例的统计结果和免疫抑制受体共阳性比例的统计结果;图10代表性流式图描述亚精胺处理与否的tils表达ki67的比例(左图),ki67阳性比例的统计结果图(右图),图11为亚精胺处理与否的tils与对应靶细胞共孵育后表达ifn
‑
γ的水平。图12为亚精胺处理与否的tils杀伤对应靶细胞的能力示意图。
40.图13
‑
图15为在仅包含okt3(50 ng/ml)x
‑
vivo培养基培养条件下,亚精胺处理与否的tcr1
‑
t细胞体外功能评价。图13为亚精胺处理与否的tcr1
‑
t感染效率的统计结果。图14为亚精胺处理与否的tcr1
‑
t与靶细胞共孵育分泌ifn
‑
γ的统计结果。图15为亚精胺处理与否的tcr1
‑
t体外杀伤靶细胞能力的统计结果。
41.图16
‑
图18为在仅包含okt3(50 ng/ml)x
‑
vivo培养基培养条件下,亚精胺处理与否的msln car
‑
t细胞体外功能评价。图16为亚精胺处理与否的msln car
‑
t感染效率的统计结果。图17为亚精胺处理与否的msln car
‑
t与靶细胞共孵育分泌ifn
‑
γ的统计结果。图18为亚精胺处理与否的msln car
‑
t体外杀伤靶细胞能力的统计结果。
具体实施方式
42.以下实施例用于说明本发明,但不用来限制本发明的范围。
43.下述实施例中的所有技术和科学术语,如无特殊说明,均为本发明所属领域普通技术人员通常所理解的相同含义。除非有相反指明,本发明所使用或提及的技术均为本领域普通技术人员公认的标准技术。所述试验材料,如无特别注明,均为本发明领域通用的试验材料。下述实施例中所用的试验试剂,如无特殊说明,均为自常规生化试剂商店购买得到的。
44.慢病毒包装质粒(pmdl,vsv
‑
g,rev)、载体pcdh
‑
ef1
‑
luc2
‑
t2a
‑
tdtomato质粒购自武汉淼灵生物科技有限公司。xbai和sali内切酶购自new england biolabs (beijing) ltd.。flag抗体和pei购自sigma公司。x
‑
vivo培养基购自lonza公司。opti
‑
mem培养基购自
thermofisherscientific公司。il
‑
2细胞因子购自peprotech公司。okt3购自acrobiosystems有限公司。cd28抗体购自同立海源公司。293ft细胞购自atcc。pd1,tim3,lag3,cfse,pi,ki67等流式抗体购自bd公司。抗鼠源tcrβ链恒定区流式抗体购自ebioscience公司。tcr1
‑
t细胞对应的食管癌移植瘤模型(jimmunothercancer.2019aug28;7(1):232.)和mslncar
‑
t细胞对应的肺癌移植瘤模型(构建方法参照食管癌移植瘤模型)均为本实验构建。nod/scid免疫缺陷小鼠购自北京维通利华实验动物技术有限公司。
45.实施例1tils的获得肿瘤患者的肿瘤组织经手术切除后,将肿瘤组织切碎到1
‑
2毫米的小块,每一小块肿瘤组织分别放置于24孔细胞培养板的一个孔内,然后加入t细胞培养基。
46.t细胞培养基为x
‑
vivo无血清培养基(lonza,usa)的基础上添加il2(终浓度50u/ml;peprotech,usa),okt3抗体(终浓度50ng/ml;acro,usa)andanti
‑
cd28抗体(终浓度1ug/ml;t&lbiotechnology,china)。该小块肿瘤组织在细胞培养箱培养,直到获得最终tils。
47.实施例2亚精胺处理的tils耗竭指标表达显著下降,增殖能力能增强将实施例1获得的tils分成两组,对照组(control)经实施例1述及的t细胞培养基培养7天,亚精胺组(spermidine)经含亚精胺(10um)(caymanchemical,usa)的实施例1述及的t细胞培养基培养7天。
48.通过流式抗体对两组tils进行染色并进行数据分析,研究结果发现亚精胺组tils单独表达pd1,tim3和lag3的比例分别约为:20%,60%,20%,而对照组tils单独表达pd1,tim3和lag3的比例分别约为:30%,70%,30%,由此可知,亚精胺组tils单独表达免疫抑制受体(pd1,tim3,lag3)的比例显著下降。同时研究发现,亚精胺组tils共表达pd1+tim3,pd1+lag3和tim3+lag3的比例分别为18%,8%,10%,而对照组tils共表达pd1+tim3,pd1+lag3和tim3+lag3的比例分别为30%,15%,18%,由此可知,亚精胺组tils免疫抑制受体(pd1,tim3,lag3)共阳性的比例亦发生显著下降(图1的a
‑
c图,*表示p<0.05,**表示p<0.01,***表示p<0.001)。同时我们发现亚精胺组ki67阳性tils比例约为30%,而对照组ki67阳性tils比例约为18%,由此可知亚精胺组ki67阳性t细胞比例显著增加,即t细胞增殖能力显著增强(图1的d
‑
e图,**表示p<0.01)。
49.实施例3亚精胺处理的tils体内外抗肿瘤能力显著增强将实施例1获得的tils分成两组,对照组(control)经实施例1述及的t细胞培养基培养7天,亚精胺组(spermidine)经添加了亚精胺(10um)(caymanchemical,usa)的实施例1述及的t细胞培养基培养7天。
50.1、将亚精胺处理与否的tils与105个自体肺癌肿瘤细胞以1:1的效靶比共孵育24小时之后检测上清ifn
‑
γ浓度(检测方法参见文献:jimmunothercancer.2019aug28;7(1):232.)。结果表明,亚精胺处理的tils分泌的ifn
‑
γ显著高于未处理组tils(图2的a和b)。
51.2、亚精胺处理与否的tils分别与cfse预标记的自体肿瘤细胞以20:1,10:1,5:1效靶比共孵育,流式鉴定cfse标记的靶细胞中细胞死亡比例(pi
+
靶细胞百分比)。结果显示,亚精胺处理的tils特异性识别并杀伤靶细胞功能显著高于未处理tils,杀伤效率提高超过
10%(图2的c)。
52.3、亚精胺处理与否的tils(5
×
106)回输对应肿瘤细胞构建的移植瘤小鼠模型,结果显示,亚精胺处理的tils体内杀伤对应肿瘤细胞能力显著强于未经亚精胺处理的tils,移植瘤接种29天时,未回输tils组(control)的移植瘤体积约为140 mm3,质量约为0.9g, 回输未经亚精胺处理的tils组(tils)移植瘤体积约为100 mm3,质量约为0.7g,回输亚精胺处理的tils组(stils)移植瘤体积约为70 mm
3 ,质量约为0.5g。(图3)。
53.实施例4靶向食管癌肿瘤细胞的tcr1
‑
t细胞的慢病毒载体的构建(1)合成tcr1的核苷酸序列(seq id no:1)(j immunother cancer. 2019 aug 28;7(1):232.),并在这段核苷酸序列的两端分别添加xbai和sali酶切位点,并克隆到puc57载体上;(2)用xbai和sali双酶切包含目的基因的puc57载体,切胶回收目的基因片段;(3)用xbai和sali双酶切原始载体pcdh
‑
ef1
‑
luc2
‑
t2a
‑
tdtomato,切胶回收约6.5kb的载体片段;(4)用dna连接酶连接回收的目的基因片段和载体片段,即得携带tcr1的重组慢病毒载体。
54.慢病毒的制备将上述步骤制得的慢病毒载体通过转染试剂(pei)转染293ft细胞产生慢病毒。具体方法包括:包装质粒混合物(pmdl:vsv
‑
g:rev=5:3:2,质量比)和tcr1慢病毒载体按1:1的质量比加入500 μl无血清培养基opti
‑
mem中,涡旋至充分混匀。将32g pei加入500 μl无血清培养基opti
‑
mem中,涡旋至充分混匀。然后将500ul质粒混合物与500ul pei混合,并将其加入汇合度约90%的293ft细胞中,48小时后收集病毒上清,超速离心后,对病毒进行100倍浓缩,进而获得浓缩后病毒。
55.细胞的制备分选外周血t细胞,在t细胞培养基(为实施例1述及的t细胞培养基,即含有il2、okt3抗体、抗cd28抗体的x
‑
vivo 无血清培养基)中培养,一组加入亚精胺(10um),一组不加亚精胺,用浓缩后病毒感染激活的t细胞,moi=10:1。感染72小时之后,亚精胺组tcr1感染效率(约60%)显著高于未经亚精胺处理组(约50%)(图4的a图)。以抗鼠源tcrβ链恒定区流式抗体检测tcr1表达。
56.细胞体内外功能鉴定通过流式抗体对亚精胺处理与否的tcr1
‑
t细胞进行染色并进行数据分析,研究结果发现亚精胺组tcr1
‑
t单独表达pd1,tim3和lag3的比例分别约为:12%,18%,8%,而对照组tcr1
‑
t单独表达pd1,tim3和lag3的比例分别约为:22%,28%,14%,由此可知,亚精胺组tcr1
‑
t单独表达免疫抑制受体(pd1,tim3,lag3)的比例显著下降。同时发现亚精胺组ki67阳性tcr1
‑
t比例约为60%,而对照组ki67阳性tcr1
‑
ts比例约为45%,由此可知亚精胺组ki67阳性t细胞比例显著增加,即t细胞增殖能力显著增强。
57.将亚精胺处理与否的tcr1
‑
t细胞与105个自体食管癌肿瘤细胞以1:1的效靶比共孵育24小时之后检测上清ifn
‑
γ浓度,结果图4的b图。结果表明,亚精胺处理的tcr1
‑
t细胞
分泌的ifn
‑
γ(约700pg/ml)显著高于未处理组(约500 pg/ml)。
58.亚精胺处理与否的tcr1
‑
t细胞分别与cfse预标记的自体食管癌肿瘤细胞以10:1,5:1,1:1效靶比共孵育,流式鉴定cfse标记的靶细胞中细胞死亡比例(pi
+ 靶细胞百分比)。结果显示,在效靶比10:1条件下,亚精胺处理的tcr1
‑
t杀伤靶细胞效率约60%,而未经亚精胺处理的tcr1
‑
t细胞杀伤效率约40%,该结果显示亚精胺处理的tcr1
‑
t细胞特异性识别并杀伤靶细胞能力显著高于未处理tcr1
‑
t细胞(图4的c图)。
59.亚精胺处理与否的tcr1
‑
t细胞(5
×
106)回输对应食管癌肿瘤细胞构建的移植瘤小鼠模型,结果显示,在移植瘤接种第25天,回输未经亚精胺处理的tcr1
‑
t细胞的移植瘤小鼠的肿瘤体积约为700 mm3,回输亚精胺处理的tcr1
‑
t细胞的移植瘤小鼠的肿瘤体积约为300 mm3,由此可知,亚精胺处理的tcr1
‑
t细胞体内杀伤对应肿瘤细胞能力显著强于未经亚精胺处理的tcr1
‑
t细胞(图4的d图)。
60.实施例5靶向msln car慢病毒载体的构建car的设计包含cd8α信号肽,flag
‑
tag, anti
‑
msln 轻链可变区,连接接头,anti
‑
msln重链可变区,cd8α铰链区,cd8α跨膜区,4
‑
1bb和cd3 ζ胞内信号区,并进行全基因合成。将合成的基因(seq id no:2)通过xbai与sali双酶切,克隆到慢病毒载体 pcdh
‑
ef1
‑
luc2
‑
t2a
‑
tdtomato中,并命名为pcdh
‑
ef1
‑
msln car。
61.重组慢病毒载体的构建方法包括:(1)合成靶向msln car的核苷酸序列(seq id no:2),并在这段核苷酸序列的两端分别添加xbai和sali酶切位点,并克隆到puc57载体上;(2)用xbai和sali双酶切包含目的基因的puc57载体,切胶回收目的基因片段;(3)用xbai和sali双酶切原始载体pcdh
‑
ef1
‑
luc2
‑
t2a
‑
tdtomato,切胶回收约6.5kb的载体片段;(4)用dna连接酶连接回收的目的基因片段和载体片段,即得携带msln car的重组慢病毒载体。
62.慢病毒的制备将上述步骤制得的重组慢病毒载体通过转染试剂(pei)转染293ft细胞产生慢病毒。具体方法包括:包装质粒混合物(pmdl:vsv
‑
g:rev=5:3:2,质量比)和msln car慢病毒载体按1:1的质量比加入500 μl无血清培养基opti
‑
mem中,涡旋至充分混匀。将32g pei加入500 μl无血清培养基opti
‑
mem中,涡旋至充分混匀。然后将500ul质粒混合物与500ul pei混合,并将其加入汇合度约90%的293ft细胞中,48小时后收集病毒上清,超速离心后,对病毒进行100倍浓缩,进而获得浓缩后病毒。
63.细胞的制备分选外周血t细胞,在t细胞培养基(为实施例1述及的t细胞培养基,即含有il2、okt3抗体、抗cd28抗体的x
‑
vivo 无血清培养基)中培养,一组加入亚精胺(10um),一组不加亚精胺,用浓缩后病毒感染激活的t细胞,moi=10:1。感染72小时之后,以flag抗体检测msln car表达,亚精胺组car感染效率(约60%)显著高于未经亚精胺处理组(约45%),亚精胺组msln car感染效率显著高于未经亚精胺处理组(图5的a图)。
64.细胞体内外功能鉴定通过流式抗体对亚精胺处理与否的msln car
‑
t细胞进行染色并进行数据分析,研究结果发现亚精胺组msln car
‑
t单独表达pd1,tim3和lag3的比例分别约为:14%,20%,5%,而对照组msln car
‑
t单独表达pd1,tim3和lag3的比例分别约为:22%,34%,8%,由此可知,亚精胺组tils单独表达免疫抑制受体(pd1,tim3,lag3)的比例显著下降。同时发现亚精胺组ki67阳性msln car
‑
t比例约为55%,而对照组ki67阳性msln car
‑
t比例约为40%,由此可知亚精胺组ki67阳性t细胞比例显著增加,即t细胞增殖能力显著增强。
65.将亚精胺处理与否的msln car
‑
t细胞与105个msln 阳性肿瘤细胞以1:1的效靶比共孵育24小时之后检测上清ifn
‑
γ浓度,结果见图5的b图。结果表明,亚精胺处理的msln car
‑
t细胞分泌的ifn
‑
γ(约2500 pg/ml)显著高于未处理组(约1800 pg/ml)。
66.亚精胺处理与否的msln car
‑
t细胞分别与cfse预标记的msln阳性肿瘤细胞以5:1,2:1,1:1效靶比共孵育,流式鉴定cfse标记的靶细胞中细胞死亡比例(pi
+ 靶细胞百分比)。图5的c图结果显示,在效靶比5:1条件下,亚精胺处理的msln car
‑
t杀伤靶细胞效率约60%,而未经亚精胺处理的msln car
‑
t细胞杀伤效率约45%,该结果显示亚精胺处理的msln car
‑
t细胞特异性识别并杀伤靶细胞能力显著高于未处理msln car
‑
t细胞。
67.亚精胺处理与否的msln car
‑
t细胞(5
×
106)回输对应msln阳性肿瘤细胞构建的移植瘤小鼠模型,结果显示,在移植瘤接种第30天,回输未经亚精胺处理的msln car
‑
t细胞的移植瘤小鼠的肿瘤体积约为300 mm3,回输亚精胺处理的msln car
‑
t细胞的移植瘤小鼠的肿瘤体积约为150 mm3,由此可知,亚精胺处理的msln car
‑
t细胞体内杀伤对应肿瘤细胞能力显著强于未经亚精胺处理的msln car
‑
t细胞(图5的d图)。
68.实施例6本发明使用不添加任何il2、okt3抗体、抗cd28抗体的培养基(即相对于实施例1的t细胞培养基缺少il2、okt3抗体、抗cd28抗体)培养tils和外周血t细胞7天发现,tils和外周血的活率只有30%,而添加上述三种组分的培养基培养7天,tils和外周血的活率90%。其中没添加任何il2、okt3抗体、抗cd28抗体的但添加spermidine的培养基培养tils和外周血t细胞7天,细胞活率约40%。但是由于没加任何il2、okt3抗体、抗cd28抗体,因此car和tcr慢病毒感染t细胞效率低,无法评估后面的功能,tils由于不涉及感染效率,因此虽然活率较低,但是活的tils识别和杀伤靶细胞的功能依然正常。
69.本实施例验证了tils在无任何细胞因子培养条件下(仅为x
‑
vivo培养基),一组加spermidine (10 um),一组不加spermidine的培养结果。结果说明(见图6,图7,图8)。将实施例1获得的tils分成两组,对照组(control)经x
‑
vivo培养基培养7天,亚精胺组(spermidine)经含亚精胺(10um) (cayman chemical, usa)的x
‑
vivo培养基培养7天。
70.通过流式抗体对两组tils进行染色并进行数据分析,研究结果发现亚精胺组tils单独表达pd1,tim3和lag3的比例分别约为:20%,35%,10%,而对照组tils单独表达pd1,tim3和lag3的比例分别约为:30%,50%,20%,由此可知,亚精胺组tils单独表达免疫抑制受体(pd1,tim3,lag3)的比例显著下降。同时研究发现,亚精胺组tils共表达pd1+tim3,pd1+lag3和tim3+lag3的比例分别为8%,5%,8%,而对照组tils共表达pd1+tim3,pd1+lag3和tim3+lag3的比例分别为15%,10%,15%,由此可知,亚精胺组tils免疫抑制受体(pd1,tim3,lag3)共阳性的比例亦发生显著下降(图6,*表示p<0.05, **表示p<0.01)。
71.将亚精胺处理与否的tils与105个自体肺癌肿瘤细胞以1:1的效靶比共孵育24小时之后检测上清ifn
‑
γ浓度(检测方法参见文献:j immunother cancer. 2019 aug 28;7(1):232.)。结果表明,亚精胺处理的tils分泌的ifn
‑
γ显著高于未处理组tils(图7)。亚精胺处理与否的tils分别与cfse预标记的自体肿瘤细胞以20:1,10:1,5:1效靶比共孵育,流式鉴定cfse标记的靶细胞中细胞死亡比例(pi
+ 靶细胞百分比)。结果显示,亚精胺处理的tils特异性识别并杀伤靶细胞功能显著高于未处理tils,杀伤效率提高约10%(图8)。
72.实施例7 本实施例研究了t细胞培养基(x
‑
vivo)中只加入okt3(50 ng/ml),一组不加亚精胺,一组加亚精胺(10 um),两组在培养tils,tcr1
‑
t,car
‑
t细胞方面的比较结果见图9
‑
图12,图13
‑
图15,图16
‑
图18。
73.通过流式抗体对两组tils进行染色并进行数据分析,研究结果发现亚精胺组tils单独表达pd1,tim3和lag3的比例分别约为:25%,35%,10%,而对照组tils单独表达pd1,tim3和lag3的比例分别约为:35%,45%,20%,由此可知,亚精胺组tils单独表达免疫抑制受体(pd1,tim3,lag3)的比例显著下降。同时研究发现,亚精胺组tils共表达pd1+tim3,pd1+lag3和tim3+lag3的比例分别为8%,5%,6%,而对照组tils共表达pd1+tim3,pd1+lag3和tim3+lag3的比例分别为14%,9%,12%,由此可知,亚精胺组tils免疫抑制受体(pd1,tim3,lag3)共阳性的比例亦发生显著下降(图9,*表示p<0.05, **表示p<0.01)。同时本发明发现亚精胺组ki67阳性tils比例约为32%,而对照组ki67阳性tils比例约为24%,由此可知亚精胺组ki67阳性t细胞比例显著增加,即t细胞增殖能力显著增强(图10,*表示p<0.05)。
74.将亚精胺处理与否的tils与105个自体肺癌肿瘤细胞以1:1的效靶比共孵育24小时之后检测上清ifn
‑
γ浓度(检测方法参见文献:j immunother cancer. 2019 aug 28;7(1):232.)。结果表明,亚精胺处理的tils分泌的ifn
‑
γ显著高于未处理组tils(图11,**表示p<0.01)。亚精胺处理与否的tils分别与cfse预标记的自体肿瘤细胞以20:1,10:1,5:1效靶比共孵育,流式鉴定cfse标记的靶细胞中细胞死亡比例(pi
+ 靶细胞百分比)。结果显示,亚精胺处理的tils特异性识别并杀伤靶细胞功能显著高于未处理tils,杀伤效率提高约10%(图12,**表示p<0.01)。
75.分选外周血t细胞,在t细胞培养基(含有okt3抗体的x
‑
vivo培养基)中培养,一组加入亚精胺(10um),一组不加亚精胺,用浓缩后tcr1病毒感染激活的t细胞,moi=10:1。感染72小时之后,亚精胺组tcr1感染效率(约55%)显著高于未经亚精胺处理组(约40%)(图13)。以抗鼠源tcrβ链恒定区流式抗体检测tcr1表达。
76.通过流式抗体对亚精胺处理与否的tcr1
‑
t细胞进行染色并进行数据分析,研究结果发现亚精胺组tcr1
‑
t单独表达pd1,tim3和lag3的比例分别约为:13%,18%,7%,而对照组tcr1
‑
t单独表达pd1,tim3和lag3的比例分别约为:20%,26%,15%,由此可知,亚精胺组tcr1
‑
t单独表达免疫抑制受体(pd1,tim3,lag3)的比例显著下降。同时发现亚精胺组ki67阳性tcr1
‑
t比例约为60%,而对照组ki67阳性tcr1
‑
t比例约为43%,由此可知亚精胺组ki67阳性t细胞比例显著增加,即t细胞增殖能力显著增强。
77.将亚精胺处理与否的tcr1
‑
t细胞与105个自体食管癌肿瘤细胞以1:1的效靶比共孵育24小时之后检测上清ifn
‑
γ浓度,结果见图14。结果表明,亚精胺处理的tcr1
‑
t细胞分泌的ifn
‑
γ(约600pg/ml)显著高于未处理组(约400pg/ml)。
78.亚精胺处理与否的tcr1
‑
t细胞分别与cfse预标记的自体食管癌肿瘤细胞以10:1,5:1,1:1效靶比共孵育,流式鉴定cfse标记的靶细胞中细胞死亡比例(pi
+ 靶细胞百分比)。结果显示,在效靶比10:1条件下,亚精胺处理的tcr1
‑
t杀伤靶细胞效率约55%,而未经亚精胺处理的tcr1
‑
t细胞杀伤效率约40%,该结果显示亚精胺处理的tcr1
‑
t细胞特异性识别并杀伤靶细胞能力显著高于未处理tcr1
‑
t细胞(图15)。
79.分选外周血t细胞,在t细胞培养基(含有okt3抗体的x
‑
vivo培养基),一组加入亚精胺(10um),一组不加亚精胺,用浓缩后msln car病毒感染激活的t细胞,moi=10:1。感染72小时之后,以flag抗体检测msln car表达,亚精胺组car感染效率(约55%)显著高于未经亚精胺处理组(约40%)(图16)。
80.通过流式抗体对亚精胺处理与否的msln car
‑
t细胞进行染色并进行数据分析,研究结果发现亚精胺组msln car
‑
t单独表达pd1,tim3和lag3的比例分别约为:10%,18%,5%,而对照组msln car
‑
t单独表达pd1,tim3和lag3的比例分别约为:18%,32%,8%,由此可知,亚精胺组tils单独表达免疫抑制受体(pd1,tim3,lag3)的比例显著下降。同时发现亚精胺组ki67阳性msln car
‑
t比例约为62%,而对照组ki67阳性msln car
‑
t比例约为50%,由此可知亚精胺组ki67阳性t细胞比例显著增加,即t细胞增殖能力显著增强。
81.将亚精胺处理与否的msln car
‑
t细胞与105个msln 阳性肿瘤细胞以1:1的效靶比共孵育24小时之后检测上清ifn
‑
γ浓度,结果见图17。结果表明,亚精胺处理的msln car
‑
t细胞分泌的ifn
‑
γ(约2400 pg/ml)显著高于未处理组(约1700 pg/ml)。
82.亚精胺处理与否的msln car
‑
t细胞分别与cfse预标记的msln阳性肿瘤细胞以5:1,2:1,1:1效靶比共孵育,流式鉴定cfse标记的靶细胞中细胞死亡比例(pi
+ 靶细胞百分比)。图18结果显示,亚精胺处理的msln car
‑
t细胞特异性识别并杀伤靶细胞功能显著高于未处理msln car
‑
t细胞,在效靶比5:1条件下,亚精胺处理的msln car
‑
t杀伤靶细胞效率约60%,而未经亚精胺处理的msln car
‑
t细胞杀伤效率约50%,该结果显示亚精胺处理的msln car
‑
t细胞特异性识别并杀伤靶细胞能力显著高于未处理msln car
‑
t细胞。
83.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1