高韧性的聚己内酯可重塑形状记忆材料及其制备方法
1.本发明属于形状记忆材料领域,具体涉及一种高韧性的聚己内酯可重塑形状记忆材料及其制备方法。
背景技术:
2.机械化学(mechanochemical)在化学反应水平中主要是指通过剪切、磨擦、冲击、挤压等手段,对固体、液体等凝聚态物质施加机械能,诱导其结构及物理化学性质发生变化,并诱发化学反应。与普通热化学反应不同,机械化学反应的动力是机械能而非热能,因而反应无须高温、高压等苛刻条件即可完成。近年来,利用机械化学来指导聚合物的结构转变已经产生了一系列工程分子响应,这些响应跨越了光学、机械、电子和热特性,广泛应用于材料科学、聚合物物理、力学和增材制造。聚合物机械化学已经发展成为一种响应宏观影响诱导分子再构的高精度工具,一种创新响应材料设计方法的新机会。
3.通过常规的热化学反应虽然也可以精确调控聚合物的分子结构,但是涉及产物分离与提纯,合成步骤繁琐,且需要大量的溶剂,难以做到高效环保的要求。为了防止形状记忆循环中聚合物分子链的滑移导致的记忆性能降低,需要将其交联以固定其永久形状,但是常规的共价交联方式难以制备网络均匀的交联结构,导致应力分布不均,且无法二次加工。
技术实现要素:
4.针对上述问题,本发明提出一种高韧性的聚己内酯可重塑形状记忆材料及其制备方法。
5.实现上述技术目的,达到上述技术效果,本发明通过以下技术方案实现:
6.一种高韧性的聚己内酯可重塑形状记忆材料的制备方法,包括以下步骤:
7.s1:以乙二醇为引发剂、辛酸亚锡为催化剂,引发ε
‑
己内酯开环制备线性聚己内酯(pcl);
8.s2:合成4
‑
((4
‑
甲基
‑2‑
氧代
‑
2h
‑
铬
‑7‑
基)氧基)丁酸(cou
‑
cooh),并采用steglich酯化反应将pcl的端羟基改性为香豆素基团;
9.s3:将s2中改性后的pcl与二苯甲酮混合均匀,并压制成片状,于紫外光下照射使其发生扩链反应,之后将光照扩链后的pcl配置成溶液,进行超声处理,制备主链上含有共轭双键的pcl(也称pcl交联网络前体);
10.s4:选用α
‑
环糊精(α
‑
cd)为主体,聚乙二醇二胺(peg
‑
nh2)为客体制备聚轮烷(pr),并对聚轮烷上的分子环进行改性,制备含有双键的聚轮烷基交联剂;
11.s5:将s3中制得的主链上含有共轭双键的pcl和s4中制得的聚轮烷基交联剂混合均匀,在反应温度下发生diels
‑
alder反应而交联(反应温度优选70℃),制得高韧性的聚己内酯可重塑形状记忆材料。
12.进一步,s5中,聚合物交联体系中,pcl上共轭双键的数量与聚轮烷上双键的摩尔
比为:1:1,该比例可以保证热交联反应的完全进行。
13.进一步,s4中,聚乙二醇二胺的分子量分别为10kda~35kda,聚轮烷制备中选用大位阻封端剂n
‑
苄氧羰基
‑
l
‑
酪氨酸。
14.进一步,s4中,含有双键的聚轮烷基交联剂通过如下方法制得:先用环氧丙烷对pr上的α
‑
cd基团进行羟丙基活化,再用2
‑
乙基丙烯基异氰酸乙酯接上双键。
15.进一步,s3中,二苯甲酮的量与改性后的pcl末端香豆素基团的摩尔比为1:1~1:2,该比例保证足够的紫外光吸收强度。
16.进一步,s3中配置的光照扩链后的pcl溶液浓度为0.1~1mg/ml。
17.进一步,s2中,4
‑
((4
‑
甲基
‑2‑
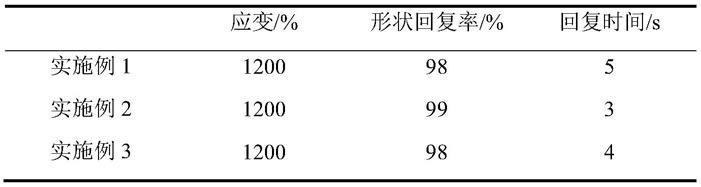
氧代
‑
2h
‑
铬
‑7‑
基)氧基)丁酸的合成方法为:选用4
‑
甲基伞形酮为原料,用4
‑
溴丁酸乙酯取代,之后于碱性条件下水解制备羧基化香豆素,也即4
‑
((4
‑
甲基
‑2‑
氧代
‑
2h
‑
铬
‑7‑
基)氧基)丁酸。
18.进一步,s1中,ε
‑
己内酯开环聚合反应中,乙二醇与ε
‑
己内酯的摩尔比为1:50~1:100。
19.本发明还提供了一种基于以上制备方法所制备的一种高韧性的聚己内酯可重塑形状记忆材料。
20.本发明的有益效果是:
21.(1)本发明通过紫外光与超声等处理方法,合成了分子链上共轭双键位置可控的pcl交联网络前体,证明了超声处理的方法可以将光二聚产生的丁内环重构为共轭双键。所用的机械化学手段条件温和,相较于传统的热化学反应,同样可以精确调控聚合物的分子结构,且更加的安全与环保;
22.(2)本发明所选用的交联方式为热可逆的da反应,材料可以在70℃定型,于140℃网络解交联,使材料具备热可重塑性能;
23.(3)本发明所选用的交联结点为可滑动的聚轮烷,可以有效改善应力循环中材料内应力分布不均的缺陷,使材料具有高韧性及高形状回复速率的特点。
附图说明
24.此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
25.图1为实施例1所制备的4
‑
me
‑7‑
oh
‑
cou和cou
‑
cooh的核磁氢谱与碳谱对比图;
26.图2为实施例1所制备的纯pcl和pcl
‑
cou的1h nmr核磁谱图;
27.图3为实施例3所制备的纯pcl、pcl
‑
cou和超声处理后的pcl
‑
cou
‑
bp的凝胶渗透色谱对比图;
28.图4为实施例1、2和3所制备的聚轮烷的1h nmr核磁谱图
29.图5为pcl
‑
cou在紫外与超声处理下制备共轭双键位置明确的pcl反应方程式。
具体实施方式
30.本发明不局限于下列具体实施方式,本领域一般技术人员根据本发明公开的内容,可以采用其他多种具体实施方式实施本发明的,或者凡是采用本发明的设计结构和思路,做简单变化或更改的,都落入本发明的保护范围。需要说明的是,在不冲突的情况下,本
发明中的实施例及实施例中的特征可以相互组合。
31.本发明下面结合实施例作进一步详述:
32.一、本发明所使用的试剂均为市购,检测仪器有:
33.红外光谱(ftir):使用傅立叶变换红外光谱仪(型号avatar 370)(热电尼高力仪器公司,美国),使用制备完成的样品进行红外测试并分析,ftir通过记录4000和500cm
‑1之间32次扫描得到,分辨率为2cm
‑1。
34.核磁共振波谱(1h
‑
nmr):所用核磁共振波谱仪为瑞士布鲁克公司bruker arx
‑
500产品,分辨率<0.2hz;灵敏度>100。本实验采用核磁共振氢谱分析,以氘代氯仿和氘代二甲基亚砜作溶剂,500mhz的工作频率,7.05t的磁场强度,在常温下测试。
35.凝胶渗透色谱(gpc):采用美国wyatt公司waters515型凝胶渗透色谱测定聚合物的分子量,包括water515型高压液相色谱泵、2414ri型检测器,shodex kd
‑
806m色谱柱(孔径104 105,106nm),thf为流动相,流速为1ml/min,测试温度为35℃,以单分散的聚苯乙烯为标样进行校准。
36.二、制备具有高韧性的聚己内酯可重塑形状记忆材料的方法,包括以下步骤:
37.s1:以乙二醇为引发剂、辛酸亚锡为催化剂,引发ε
‑
己内酯开环制备线性聚己内酯(pcl);
38.s2:合成4
‑
((4
‑
甲基
‑2‑
氧代
‑
2h
‑
铬
‑7‑
基)氧基)丁酸(cou
‑
cooh),并采用steglich酯化反应将pcl的端羟基改性为香豆素基团;
39.s3:将s2中改性后的pcl与二苯甲酮混合均匀,并压制成片状,于紫外光下照射使其发生扩链反应,之后将光照扩链后的pcl配置成溶液,进行超声处理,制备主链上含有共轭双键的pcl(也称pcl交联网络前体);
40.s4:选用α
‑
环糊精(α
‑
cd)为主体,聚乙二醇二胺(peg
‑
nh2)为客体制备聚轮烷(pr),并对聚轮烷上的分子环进行改性,制备含有双键的聚轮烷基交联剂;
41.s5:将s3中制得的主链上含有共轭双键的pcl和s4中制得的聚轮烷基交联剂混合均匀,在反应温度下发生diels
‑
alder反应而交联,制得高韧性的聚己内酯可重塑形状记忆材料。
42.具体如下:
43.s1、开环聚合在氮气氛围下使用催化剂异辛酸亚锡(sn(oct)2)进行。引发剂乙二醇和单体ε
‑
己内酯按照摩尔比1:50~1:100计算所需的量,催化剂sn(oct)2的含量为1wt%。将反应瓶置于预先加热到140℃的油浴锅中搅拌,反应至磁力搅拌子停止转动后结束。再用正己烷沉淀回收聚合物,置于40℃真空干燥箱中干燥24h得端羟基的pcl
‑
oh。
44.s2、按顺序将4
‑
甲基伞形酮(cou
‑
oh,5g,28.4mmol)、碳酸钾(k2co3,5.9g,42.7mmol)和碘化钾(ki,0.2g,1.2mmol)与100ml无水丙酮置于250ml三颈圆底烧瓶中在氮气气氛下充分搅拌,随后向悬浮液中逐滴添加4
‑
溴丁酸乙酯(5.1ml,35.5mmol),反应混合物在58℃下回流20h,反应结束后将冷却的反应混合物在减压下过滤浓缩,然后在40℃真空干燥箱中干燥24h。干燥结束后用乙醇重结晶两次得到中间体4
‑
me
‑7‑
oh
‑
cou。
45.将得到的4
‑
me
‑7‑
oh
‑
cou(3g,10.3mmol)溶于58ml异丙醇溶液,加入40ml naoh(4.1g,103mmol)水溶液,在90℃下搅拌12h。冷却至室温后,将溶液转入冰水浴中,然后用浓hcl酸化调节ph至2左右。用乙醇对析出物进行两次重结晶后于30℃真空干燥箱中干燥24h
得到羧基化香豆素(cou
‑
cooh)。
46.在氮气气氛下,将设计量的pcl
‑
oh(1.71g,4
×
10
‑4mol)、dcc(0.206g,1
×
10
‑3mol)和dmap(3wt%)溶解在无水dcm中充分搅拌。之后,将cou
‑
cooh(0.262g,1
×
10
‑3mol)的无水n,n
‑
二甲基甲酰胺溶液(dmf)滴加到反应溶液中搅拌至完全溶解,于30℃下搅拌反应48h。最后,通过抽滤除去不溶副产物,于无水乙醚中沉降,离心收集后再次用无水乙醚洗涤1~2次,于30℃真空干燥箱中干燥24h,得到末端为香豆素的线性聚己内酯(pcl
‑
cou)。
47.s3、将的pcl
‑
cou和二苯甲酮溶解在10ml二氯甲烷中(二苯甲酮的量与pcl
‑
cou上香豆素基团的摩尔比为1:1),通过旋蒸去除溶剂,于50℃真空干燥箱中干燥24h,然后将干燥后的样品放入特制膜具中,在80℃下通过平板硫化机压模进行处理制成片状。随后将板材固定在石英板之间,置于60℃加热板上加热并且在365nm紫外箱中光照6h,光照结束后称取一定量的样品溶于100ml二氯甲烷中,配置0.1~1mg/ml的稀溶液。稀溶液于超声仪中超声30min使其在机械力作用下pcl分子重构成共轭双键结构,得到主链上含有共轭双键的pcl交联网络前体。
48.s4、将不同分子量peg
‑
nh2(2.3
×
10
‑5mol)加入到α
‑
cd的饱和溶液中(7.25g/50ml超纯水),于室温下搅拌溶液24h,得到白色凝胶状固体。之后在低温冰箱中放置12h将样品完全冻住,并在冻干机中冷冻干燥,获得包合物。然后在预先干燥的真空反应瓶中依次加入0.82g的n
‑
苄氧羰基
‑
l
‑
酪氨酸(2.6
×
10
‑3mol),1.15g卡特缩合剂bop(2.6
×
10
‑3mol),0.35g hobt(2.6
×
10
‑3mol),0.45mln,n
‑
二异丙基乙胺diea(2.6
×
10
‑3mol),并溶于15ml无水dmf,之后将冻干的包合物添加到溶液中,于室温下搅拌悬浮液24h。将悬浮液于过量乙醚中沉淀得到粗产物,并通过在室温下以7000转/分钟离心5分钟收集沉淀物。最后分别在大量丙酮、甲醇和水中连续搅拌3h,离心收集的沉淀于50℃真空干燥48h,得聚轮烷(pr),其中实施例1制得的聚轮烷记为pr(10),实施例2制得的聚轮烷记为pr(20),实施例3制得的聚轮烷记为pr(35),即实施例1制得的pr分子量为10kda,实施例2制得的pr分子量为20kda,实施例3制得的pr分子量为35kda。
49.聚轮烷(500mg)溶于50ml 1mol/l的氢氧化钠溶液中,在冰浴条件下向溶液中逐滴添加4.6ml环氧丙烷(66mmol),并将混合物搅拌过夜。随着溶液中冰的融化,反应温度逐渐升高到室温。羟丙基化后,用去离子水透析纯化样品。为了去除羟丙基化过程中分解产生的游离peg,将冻干样品倒入100ml ch2cl2中并搅拌过夜以滤出peg,随后添加丙酮(100ml)搅拌3h,以7000转/分钟离心5min收集沉淀物,离心收集的沉淀于50℃真空干燥48h,得羟丙基化聚轮烷。
50.将羟丙基化聚轮烷(500mg)、dbtdl(1滴)和bht(0.78mg)溶解于30ml无水dmso中。2
‑
丙烯酰氧乙基异氰酸酯(78mg)在10ml无水二甲基亚砜中溶解,在没有光的情况下,将溶液滴入混合料中,搅拌剧烈。然后在40℃下连续搅拌混合物一夜,以确保反应完成。分别用过量甲醇或丙酮从反应混合物中重新沉淀,并对沉淀产物进行冷藏。用甲醇和丙酮洗涤产品并多次干燥得双键改性的聚轮烷基交联剂。
51.s5、将聚轮烷基交联剂与pcl交联网络前体混合形成透明溶液,然后将其倒入直径为80mm的敞口聚四氟乙烯圆模具中。让该溶液在70℃下热交联反应10h,溶剂部分蒸发,得到凝胶。然后,凝胶在70℃真空下再干燥50h,得具有高韧性的聚己内酯可重塑形状记忆材料。
52.具体的,各实施例中按表1所示的参数进行
53.表1:实施例1
‑
3对应的实验参数
[0054] 试剂实施例1实施例2实施例3pcl的合成eg:ε
‑
cl/摩尔比1:501:751:100pr的合成peg
‑
nh2分子量/kda102035
[0055]
三、结构表征与性能测试
[0056]
如图1所示为4
‑
me
‑7‑
buoac
‑
cou和cooh
‑
cou的核磁氢谱(
ⅰ
)和碳谱(
ⅱ
),在核磁氢谱中,cooh
‑
cou的氢谱上化学位移为7.4~7.7ppm处的峰对应于苯环上靠近甲基处的质子峰;化学位移为6.8~7.0ppm处的峰对应于苯环上靠近醚键处的质子峰;化学位移为6.1~6.2ppm处的峰对应于酯键与甲基中间双键上的质子峰;化学位移为4.0~4.2ppm处的峰对应于靠近苯环邻位氧的亚甲基上的质子峰;化学位移为2.4~2.6ppm处的峰对应于酯键和醚键之间靠近酯键处亚甲基上的质子峰以及酯键邻位双键上甲基的质子峰;相较于cooh
‑
cou的氢谱,4
‑
me
‑7‑
buoac
‑
cou的谱图与其基本一致,仅多出化学位移4.0ppm左右酯键邻位亚甲基质子峰和化学位移1.3ppm左右甲基的质子峰,且各组峰面积积分结果比例与理论比例相同。在核磁碳谱中,4
‑
me
‑7‑
buoac
‑
cou和cooh
‑
cou的谱图出峰位置基本一致,仅4
‑
me
‑7‑
buoac
‑
cou多出酯键邻位靠近氧原子的化学位移60.0ppm左右的碳峰和甲基上的碳峰,与理论预测一致。由4
‑
me
‑7‑
buoac
‑
cou和cooh
‑
cou的核磁氢谱与碳谱可证明含羧基的香豆素被成功地制备。
[0057]
如图2所示为合成的pcl(
ⅰ
)和pcl
‑
cou(
ⅱ
)的核磁氢谱谱图,图(
ⅰ
)中化学位移为1.32ppm处的峰对应于己内酯链段上最中间的亚甲基上的质子峰;化学位移为1.58ppm处的峰对应于己内酯链段中与中间碳原子相邻的亚甲基上的质子峰;化学位移为2.24ppm处的峰对应于己内酯链段羰基邻位碳上的质子峰;化学位移为3.98ppm处的峰对应于己内酯链段氧原子邻位碳上的质子峰。这四个位移值都是pcl五个亚甲基的特征峰,这表明线性pcl制备成功。而图(
ⅱ
)中出现的7.42ppm、6.78ppm、6.73ppm、6.07ppm、2.46ppm、2.08ppm以及1.85ppm这几个峰值都是香豆素基团的质子峰位移值,代表羧基香豆素基团成功接枝到pcl上。
[0058]
如图3所示为纯pcl、pcl
‑
cou和光照后的pcl
‑
cou
‑
bp的凝胶渗透色谱对比图。可以得出纯pcl的数均分子量为15000左右,对其端基改性后分子量变为18000左右,比预设的分子量大;光照后pcl
‑
cou
‑
bp的分子量成倍的变大,说明扩链反应的成功进行。
[0059]
如图4所示为选用不同分子量peg
‑
nh2合成的pr核磁对比图。对4.8ppm和3.5ppm处的特征峰进行积分,计算单个pr上的α
‑
cd个数n
(α
‑
cd)
,并得出平均多少个peg结构单元上有一个α
‑
cd,其数量用n
(eg)
表示。如图4所示为选用不同分子量peg
‑
nh2合成的pr凝胶渗透色谱对比图,可以得出不同pr的分子量,并将其与核磁氢谱计算得出的pr分子量进行对比。由此可以得出pr(10)上α
‑
cd有47个,平均每5个peg结构单元上有一个α
‑
cd;pr(20)上α
‑
cd有143个,平均每3个peg结构单元上有一个α
‑
cd;而pr(35)上α
‑
cd有179个,平均每4.5个peg结构单元上有一个α
‑
cd。但是凝胶渗透色谱测出的分子量明显比由核磁氢谱计算出来的分子量小得多,猜测是由于pr上大量的氢键相互作用使得pr易于吸附在色谱柱上,导致其流出时间变长,凝胶渗透色谱测出的分子量偏小。
[0060]
将s5中制得的具有高韧性的聚己内酯可重塑形状记忆材料样品裁成10
×5×
0.8mm3的矩形样条,样条拉伸至1200%的应变后,在该应变条件下于冷水中冷却固定,之后将样条放入70℃的热水中,记录其形状回复率及回复时间,得到如下形状记忆性能测试表,详见表2。
[0061]
表2形状记忆性能测试表
[0062][0063]
由表2可以看出在高达1200%的应变下,材料依然具有优异的形状记忆性能,其形状回复率都在98%以上,形状回复速率都在5s以内,说明该方法制备的形状记忆材料有效提高了pcl形状记忆材料的韧性及回复性。
[0064]
将s5中制得的具有高韧性的聚己内酯可重塑形状记忆材料样品放入定制模具中,于140℃下加热12h,之后采用索氏抽提法测量材料的凝胶含量变化,凝胶含量的测试数据详见表3。
[0065]
表3凝胶含量的测试数据如下表
[0066][0067]
由表3可以看出,140℃的高温热处理后,材料的凝胶含量大幅降低,表明d
‑
a反应的逆向进行,交联网络的部分解构使得材料在固态条件下具备永久形状重构的能力。
[0068]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1