新型阳离子脂质化合物的制作方法
1.本发明提供新型阳离子脂质,其可用于与其他脂质组分(如中性脂质、类固醇和聚合物缀合的脂质)结合,以便形成一种核酸mrna脂质纳米粒子组合物将一种或多种治疗剂和/或预防剂递送至哺乳动物细胞或器官和/或在哺乳动物细胞或器官中产生多肽的方法。除新型脂质外,本发明的脂质纳米粒子组合物还可以包括呈特定比例的一种或多种阳离子性和/或可离子化氨基脂质、包括多不饱和脂质在内的中性脂质、聚合物缀合的脂质、类固醇、和/或治疗剂和/或预防剂。
背景技术:
2.生物活性物质如小分子药物、蛋白质和核酸的有效靶向递送提出了一个持久的医学难题。确切地说,将核酸递送至细胞因这些物种的相对不稳定性和低细胞渗透性而变得困难。因此,需要开发有助于将治疗剂和/或预防剂如核酸递送至细胞的方法和组合物。
3.经研究证明,利用含脂质的纳米颗粒组合物、脂质体和脂质体复合物作运输媒介,可有效地将生物活性物质如小分子药物、蛋白质和核酸运送至细胞和/ 或细胞内隔室中。这些组合物一般包含一种或多种"阳离子性"脂质,包括多不饱和脂质在内的中性脂质(如磷脂)、结构性脂质(如类固醇)和/或含聚乙二醇的脂质(聚合物缀合的脂质)。阳离子脂质包括如可容易地质子化的含胺脂质。
4.然而,在治疗环境中使用寡核苷酸目前面临着两个问题。第一,游离的rna 易于在血浆中核酸酶消化。第二,游离rna进入存在相关翻译机制的细胞内隔室的能力受限。由阳离子脂质与其他脂质组分(如中性脂质、胆固醇、peg、 peg化的脂质和寡核苷酸)形成的脂质纳米颗粒已用于阻止rna在血浆中的降解并促进寡核苷酸的细胞摄取。
5.仍然有必要改进的用于递送寡核苷酸的阳离子脂质和脂质纳米颗粒。改进的脂质纳米颗粒会提供优化的药物递送,保护核酸不在血清中被降解和清除,其适于全身或局部递送,并且提供核酸的细胞内递送。另外,这些优选的脂质
‑ꢀ
核酸颗粒应当是耐受良好的,并且提供足够的治疗指数,使得在有效剂量的核酸下的患者治疗不会对患者产生不可接受的毒性和/或风险。本发明提供这些优点和相关的优点。
6.公开内容
7.本发明提供以下新型化合物和涉及这些化合物的方法:
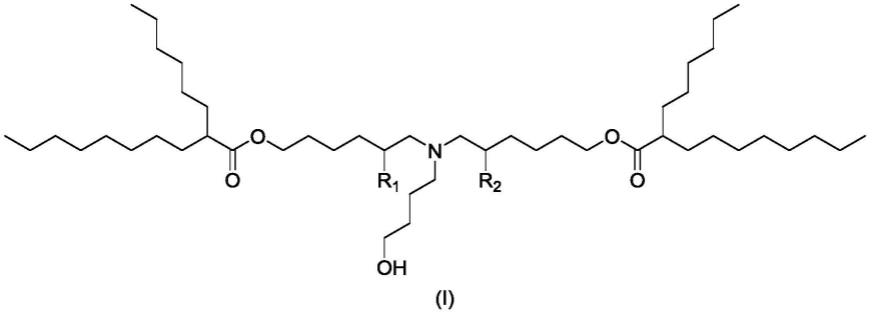
8.第一方面,本发明涉及以下结构式(i)的化合物:
[0009][0010]
或其盐或其异构体或其n-氧化物,其中:
[0011]
r1、r2为独立的氢或羟基,其中至少含有一个为羟基
[0012]
在各个不同的实施方案中,所述化合物具有以下表1中所示的结构之一
[0013]
表1代表性化合物
[0014][0015][0016]
在一些实施方案中,提供了包含结构式(i)的化合物中的任一种或多种和治疗剂和/或预防剂的组合物。
[0017]
在一些实施方案中,提供了包含结构(i)的化合物中的任一种或多种和治疗剂和/或预防剂的组合物。在一些实施方案中,所述组合物包含结构(i)的化合物中的任一种和治疗剂和/或预防剂以及一种或多种选自中性脂质、类固醇和聚合物缀合的脂质的赋形剂。其
他药物可接受的赋形剂和/或载体也包括在组合物的各种实施方案内。
[0018]
在一些实施方案中,中性脂质选自1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱 (dspc)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-二肉豆寇基-sn
‑ꢀ
甘油-磷酸胆碱(dmpc)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱(popc)、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、鞘磷脂(sm)和其混合。在一些实施方案中,优选中性脂质为 1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)。
[0019]
在一些实施方案中,类固醇选自胆固醇、粪固醇、谷固醇、麦角固醇、菜油固醇、豆固醇、菜籽固醇、番茄碱、熊果酸、α-生育酚和其混合。在一些实施方案中,优选类固醇为胆固醇。
[0020]
在一些实施方案中,聚乙二醇化脂质为1,2-二肉豆蔻酰基-sn-甘油甲氧基聚乙二醇(peg-dmg)
[0021]
在一些实施方案中,所述组合物比例以下范围:约10~60mol%所述化合物、约0~30mol%中性脂质、约10~55mol%类固醇和约0~10mol%聚合物缀合的脂质。
[0022]
在一些前述组合物的实施方案中,治疗剂和/或预防剂包括核酸。其中核酸为rna,其选自以下组成:sirna、airna、mirna、dsrna、shrna、mrna 以及其混合物。在一些实施方案中,所述rna选自mrna。
[0023]
在其他不同的实施方案中,本发明涉及向有需要的受试者施用治疗剂和/或预防剂的方法,该方法包括制备或提供上述组合物中的任一种并向受试者施用该组合物。
[0024]
出于施用的目的,本发明的化合物(通常是脂质纳米颗粒与治疗剂和/或预防剂结合的形式)可以以原料药施用,或者可以配制为药物组合物。本发明的药物组合物包含结构(i)的化合物和一种或多种药物可接受的载体、稀释剂或赋形剂。结构(i)的化合物以有效形成脂质纳米颗粒并递送治疗剂和/或预防剂。本领域技术人员可以容易地确定适当的浓度和剂量。
[0025]
本发明组合物的施用可以通过任何用于类似效用的试剂的可接受施用方式来进行。本发明的药物组合物可以配制成固体、半固体、液体或气体形式的制剂,例如片剂、胶囊、粉末、颗粒、软膏、溶液、悬浮液、栓剂、注射剂、吸入剂、凝胶、微球和气溶胶。施用这类药物组合物的典型途径包括,但不限于,口服、局部、经皮、吸入、胃肠外、舌下、口含、直肠、阴道和鼻内途径。本文使用的术语胃肠外包括皮下注射,静脉内、肌内、皮内、胸骨内注射或输注技术。配制本发明的药物组合物以便允许经过对受试者施用该组合物后其中含有的活性成分是生物可利用的。待向对象或患者施用的组合物是一个或多个剂量单位的形式,其中,片剂可以是单剂量单位,而本发明气溶胶形式的化合物的容器可以容纳多个剂量单位。制备这些剂型的现行的方法是己知的,或者对于本领域技术人员是显而易见的。在任何情况下,待施用的组合物将会含有治疗有效量的本发明化合物或其药物可接受的盐,以便根据本发明的教导治疗相关的疾病或病况。
[0026]
本发明的药物组合物可以是固体或液体的形式。一方面,载体是微粒,使得组合物是片剂或粉末形式。载体可以是液体,此时组合物是口服糖浆或可注射液体或气溶胶,所述气溶胶适用于吸入施用。
[0027]
当意图用于口服施用时,药物组合物优选为固体或液体形式,其中本文认为是固体或液体的形式包括半固体、半液体、悬浮液和凝胶形式。
[0028]
作为用于口服施用的固体组合物,药物组合物可以配制成粉末、颗粒、压缩的片剂、丸剂、胶囊、咀嚼胶、薄片等形式。这类固体组合物通常将含有一种或多种惰性稀释剂或可食用载体。另外,可以存在以下的一种或多种:粘合剂,如明胶、纤维素等;赋形剂,如乳糖等;崩解剂,如海藻酸等;润滑剂,如硬脂酸镁等;助流剂,如硅胶等;甜味剂,如蔗糖或糖精;调昧剂,如薄荷等;以及着色剂。
[0029]
当药物组合物是胶囊形式时,其可以含有上述类型材料之外的液体载体,如聚乙二醇或油。
[0030]
药物组合物可以是液体的形式,如糖浆、溶液、乳液或悬浮液。作为两种实例,液体可以用于口服施用或用于注射递送。当意图用于口服施用时,优边的组合物含有,除本发明化合物之外的,甜味剂、防腐剂、染色/着色剂和增昧剂中的一种或多种。在通过注射施用的组合物中,可以包括表面活性剂、防腐剂、润湿剂、分散剂、悬浮剂、缓冲剂、稳定剂和等渗剂中的一种或多种。
[0031]
本发明的液体药物组合物,不论其为溶液、悬浮液还是其他类似的形式,可以包括以下佐剂中的一种或多种:无菌稀释剂,如注射用水、盐水溶液、优选生理盐水、林格氏溶液、等渗氯化钠;不挥发性油类,如可用作溶剂或悬浮介质的合成的单甘酯或双甘酯,聚乙二醇、甘油、丙二醇或其他溶剂;抗菌剂,如尼泊金甲醋等;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二肢四乙酸;缓冲剂,如乙酸盐、拧棱酸盐或磷酸盐;以及用于调节张力的试剂,如氯化钠或葡萄糖;用作冷冻保护剂的试剂,如蔗糖或海藻糖。胃肠外制剂可以封装在玻璃或塑料制作的安瓿、一次性注射器或多剂量瓶中。生理盐水是优选的佐剂。可注射的药物组合物优选为无菌的。
[0032]
本发明的药物组合物可以由可作为气溶胶施用的剂量单位组成。术语气溶胶用于表示从胶体性质的系统到由加压包装组成的系统的各种系统。可以通过液化气或压缩气来递送,或者通过分散活性成分的适合的泵系统来递送。本发明化合物的气溶胶可以以单相、双相系统或三相系统来递送,以便递送活性成分。气溶胶的递送包括必要的容器、活化剂、阀、子容器等,其在一起可以形成试剂盒。本领域技术人员不需过度实验即可确定优选的气溶胶。
[0033]
本发明的药物组合物可以通过制药领域熟知的方法来制备。意图通过注射施用的药物组合物可以通过将本发明的脂质纳米颗粒与无菌的蒸馏水或其他载体结合成溶液来制备。可以加入表面活性剂以促进形成均匀的溶液或悬浮液。表面活性剂是与本发明化合物非共价地相互作用,以便促进所述化合物在水性递送系统中溶解或均匀悬浮的化合物。
[0034]
本发明的组合物或其药物可接受的盐以治疗有效量施用,所述量将会根据多种因素变化,包括使用的具体治疗剂的活性;治疗剂的代谢稳定性和作用时长;受试者的年龄、体重、一般健康状况、性别和饮食;施用的方式和时间;排泄速率;药物组合;具体病例的严重性等。
[0035]
本发明的组合物也可以在施用一种或多种其他治疗剂的同时、之前或之后施用。这类组合治疗包括施用本发明组合物和一种或多种另外的活性剂的单一药物剂量制剂,以及施用本发明组合物和各个在其自身单独药物剂量制剂中的活性剂。例如,本发明组合物和其他活性剂可以以单一口服剂量组合物(如片剂或胶囊)一起向受试者施用,或者各个试剂以不同的口服剂量制剂施用。当使用不同的剂量制剂时,本发明化合物和一种或多种另
外的活性剂可以在基本同一时间施用,或者在相互交错的时间依次施用;应理解组合治疗包括所有的这些给药方案。
[0036]
上述新型阳离子脂质化合物的结构修饰和设计,实现了更有优势的理化性质,包括更合适的pka和更好的化学稳定性,用于mrna纳米脂质体组合物,可实现对离子类核酸药物更有效结合并递送,同时其化学结构更稳定,便于合成和有利开发为药用辅料。
[0037]
上述化合物和组合物的制备方法在下文描述,和/或在本领域已知。
[0038]
本领域的技术人员将会认识到,在本文描述的方法中,中间化合物的官能团可能需要通过适合的保护基保护。这类官能团包括羟基、氨基和羧酸。用于羟基的适合的保护基包括三烷基甲硅烷基或二芳基烷基甲硅烷基、四氢呋喃基、苄基等。用于氨基的适合的保护基包括叔丁氧基羰基、苄氧基羰基等。用于羧酸的适合的保护基包括烃基、芳基或芳烃基酯。保护基可以根据标准技术添加或去除,所述标准技术是本领域技术人员已知的合本文中描述的。
[0039]
本领域技术人员还将认识到,虽然本发明化合物的这类经保护的衍生物可以不由此具有药物活性,但其可以对哺乳动物施用并且之后在体内代谢形成具有药理活性的本发明化合物。这类衍生物因此可以被描述为“前药”。所以本发明化合物的前药包括在本发明的范围内。
[0040]
此外,所有以游离碱或游离酸形式存在的本发明化合物可以根据本领域技术人员已知的方法用适当的无机或有机的碱或酸处理来转化为其药物可接受的盐。本发明化合物的盐可以通过标准技术转化为其游离碱或酸形成。
[0041]
提供了以下实施例,其目的在于举例展示,并非限定。
[0042]
以下实施例,除非另外指出,否则使用的所有溶剂和试剂都是商购得到并且以原样使用。
[0043]
以下描述的程序可用于合成化合物a与b。
[0044]
本文采用了以下缩写:
[0045]
edc.hcl:1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐
[0046]
dcm:二氯甲烷
[0047]
dmap:4-二甲氨基吡啶
[0048]
diea:n,n-二异丙基乙胺
具体实施方式
[0049]
实施例1:
[0050]
代表性路线
[0051]
化合物1的合成
[0052][0053]
1)化合物a的合成
[0054][0055]
化学式:c
22h42
o3[0056]
分子量:354.58
[0057]
依次向2-已基癸酸(2.5g,9.8mmol)和4-环氧乙基-1-丁醇(1.4g,12.1mmol) 的dcm混合液中加入edc.hcl(2.3g,12.0mmol),diea(5.0g,38.7mmol), dmap(0.2g,1.6mmol)。在室温下反应24h,后用dcm稀释体系,依次用饱和碳酸氢钠水溶液、稀盐酸水溶液洗涤,硫酸钠干燥后,过滤浓缩,所得残余物通过柱层析(乙酸乙酯/正己烷)纯化。得化合物a(2.0g,5.6mmol,57%)。
[0058]
2)化合物b的合成
[0059][0060]
化学式:c
28h53
no4[0061]
分子量:443.71
[0062]
将化合物a(2.0g,5.6mmol)与4-氨基-1-丁醇(2.0g,22.4mmol)混合,密闭升温至90℃反应3天。降温冷却,加入乙酸乙酯和水,分出有机相后使用无水硫酸钠进行干燥,真空浓缩,残余物通过硅胶柱(氨水/甲醇/dcm)纯化。得化合物b(0.8g,1.8mmol,32%)。
[0063]
3)化合物c的合成
[0064][0065]
化学式:c
21h41
bro2[0066]
分子量:405.46
[0067]
依次向2-已基癸酸(2.5g,9.8mmol)和6-溴己醇(2.0g,12.0mmol)的dcm混合液中加入edc.hcl(2.3g,12.0mmol),diea(5.0g,38.7mmol), dmap(0.2g,1.6mmol)。在室温下反
应24h,后用dcm稀释体系,依次用饱和碳酸氢钠水溶液、稀盐酸水溶液洗涤,硫酸钠干燥后,过滤浓缩,所得残余物通过柱层析(乙酸乙酯/正己烷)纯化。得化合物c(3.2g,7.9mmol,81%)。
[0068]
4)化合物1的合成
[0069][0070]
化学式:c
48h95
no6[0071]
分子量:782.29
[0072]
依次向化合物b(0.8g,1.8mmol)和化合物c(1.0g,2.5mmol)的乙醇混合物中加入diea(0.4g,3.2mmol)升温至65℃,搅拌24h,降温减压浓缩溶剂,残余物溶于乙酸乙酯,使用碳酸氢钠水溶液洗涤有机相。经过无水硫酸钠干燥后,真空浓缩。残余物通过硅胶柱(氨水/甲醇/dcm)纯化,得化合物1 (0.56g,0.7mmol,39%)。
[0073]c48h95
no6,ms m/z:[m+h
+
]783;1h-nmr(300mhz,cdcl3)δ:ppm 4.08(4h, t),3.48~3.42(3h,m),2.75~2.32(6h,m),2.30~2.00(2h,m),1.80~1.50 (14h,m),1.35~1.10(52h,m),0.92~0.78(12h,m)。
[0074]
实施例2:
[0075]
化合物2:
[0076][0077]
化学式:c
48h95
no7[0078]
分子量:798.29
[0079]
化合物b可根据实施例1描述的代表性路线合成。
[0080]c48h95
no7,ms m/z:[m+h
+
]799;1h-nmr(300mhz,cdcl3)δ:ppm 4.12(4h, t),3.50~3.40(4h,m),2.62~2.32(6h,m),2.30~2.00(2h,m),1.70~1.35 (20h,m),1.35~1.10(44h,m),0.95~0.80(12h,m)。
[0081]
实施例3
[0082]
利用脂质纳米颗粒组合物的荧光素酶mrna体内评价
[0083]
将阳离子脂质、dspc、胆固醇和peg-脂质以50:10:38:2或48:10:40:2的摩尔比溶解在乙醇中。以约10:1至30:1的总脂质与mrna的重量比制备脂质纳米颗粒(lnp)。简而言
之,将mrna在10ml至50ml柠檬酸盐缓冲液(ph=4) 稀释至0.15mg/m l。使用注射器泵,将脂质的乙醇溶液与mrna水溶液以约 1:5至1:3(体积/体积)的比例混合,总流速为10ml/min以上。然后去除乙醇,并通过透析用pbs替代外部的缓冲液。最后,将脂质纳米颗粒通过0.2um孔径的无菌过滤器过滤。使用malvern zetasizer nano zs通过准弹性光散射测定的脂质纳米颗粒的粒径为直径大约65-105nm,并且在一些情况下,直径大约75-100 nm。
[0084]
根据国家科学技术委员会制定的指南,在6-8周龄的雌性c57bl/6小鼠, 8-10周龄cd-1小鼠上进行研究。通过尾静脉注射全身性给予不同剂量的mrna 脂质纳米颗粒,并在给药后的特定时间点(例如5小时)使动物安乐死。将肝脏和脾脏收集在预先称重的管中,确定重量,立即在液氮中快速冷冻,并且在-80℃下储存,直至用于分析。
[0085]
对于肝脏,切割约50mg以便在2ml fastprep管(mp biomedicals,solonoh)中进行分析。向各个管中加入1/4"陶瓷球(mp biomedicals),并将平衡至室温的500μl的glo裂解缓冲液-glb(promega,madison wi)加入到肝脏组织中。使用fastprep24仪器(mp biomedicals)将肝脏组织在2x6.0 m/s下均匀化15 秒。将匀浆在室温下孵育5分钟,然后在glb中进行1:4稀释,并使用steadyglo 荧光素酶测定系统(promega)进行评估。具体地,将50ul的稀释的组织匀浆与50μl的steadyglo底物反应,摇振10秒,接着孵育5分钟,然后使用 spectramax_l化学发光型酶标仪(美谷分子仪器(上海)有限公司)定量。通过使用bca蛋白质定量试剂盒(上海易色医疗科技有限公司)来确定测定的蛋白质的量。然后将相对发光度单位(rlu)归一化成所测定蛋白质的总ug。为了将 rlu转化成μg荧光素酶,用quantilum重组荧光素酶(promega)生成了标准曲线。
[0086]
来自trilink biotechnologies的fluc mrna(l-6107)将表达荧光素酶蛋白,其最初从萤火虫(photinus pyralis)中分离出来。fluc通常用于哺乳动物细胞培养物中以测量基因表达和细胞活力。其在底物萤光素存在下发射出生物性光。这种加帽并且聚腺昔酸化的mrna被5-甲基胞苷和假尿苷完全取代。
[0087]
实施例4
[0088]
所配制得脂质的pka的测定
[0089]
所配制的阳离子脂质的pka与用于递送核酸的lnp的效果相关。优选的 pka范围是5~7。使用基于2-(对甲苯胺基)-6-荼磺酸(tns)的荧光的分析,在脂质纳米颗粒中测定各阳离子脂质的pka。如实施例3中所述,使用有序的方法来制备在pbs中的浓度为0.4mm总脂质的包含阳离子脂质/dspc/胆固醇/peg 脂质(50/10/38/2mol%)的脂质纳米颗粒。将tns在蒸馏水中制备成100um储备溶液。将囊泡稀释成在2ml缓冲溶液中含24um脂质,所述缓冲溶液含有10 mm hepes、10mm mes、10mm乙酸按、130mm nacl,其中ph值为2.5~11。加入等份的tns溶液以产生l um的终浓度,并且在涡旋混合之后,在室温下使用321nm和445nm的激发波长和发射波长在slm aminco series 2发光分光光度计中测量荧光强度。对荧光数据应用s形最佳拟合分析,并将pka测量为产生半数最大荧光强度的ph。
[0090]
实施例5
[0091]
使用体内荧光素酶mrna表达的啮齿动物模型测定含有各种阳离子脂质的脂质纳米颗粒制剂的效能
[0092]
为了比较的目的,如实施例3所述,使用有序混合方法,将这些脂质也用于配制含有fluc mrna(l-6107)的脂质纳米颗粒。使用以下摩尔比来配制脂质纳米颗粒:50%阳离子
脂质/10%二硬脂酰磷脂酰胆碱(dspc)/38%胆固醇 /2%peg脂质("peg-dmg",即,(1-(单甲氧基一聚乙二醇)-2,3一二肉豆蔻酰基甘油,平均peg分子量为2000)。如实施例3所述,在经由尾静脉注射施用之后的5小时,通过测量肝脏中的荧光素酶表达来确定相对活性。在0.3和 1.0mg mrna/kg的剂量下比较所述活性,并表达成在如实施例3所述的施用之后5小时测量的ng荧光素酶/g肝脏。实施例3及4结果如表2所示。
[0093]
表2与mrna表现出活性的比较脂质
[0094][0095]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0096]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对公开专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1