一种基于CRISPR/Cas12a蛋白对基因的表面增强拉曼光谱检测方法
一种基于crispr/cas12a蛋白对基因的表面增强拉曼光谱检测方法
技术领域
1.本发明属于基因检测技术领域,具体涉及一种基于crispr/cas12a蛋白和表面增强拉曼散射(sers)、用于病毒基因的光谱检测方法。
背景技术:
2.快速诊断病毒类型能够有效减少病毒性传染疾病的大面积传播与感染,为其预防和控制政策及时提供重要的科学依据。传统病毒核酸检测方法普遍存在检测条件苛刻、花费昂贵或检测耗时长、灵敏度有待提高等问题,因此亟待开发用于病毒核酸快速、高灵敏、特异性的检测技术。
3.近年来,表面增强拉曼散射(surface
‑
enhanced raman scattering,sers)生物传感技术因具有超高的灵敏度和sers光谱的“指纹”特性,被广泛应用于生物检测和分析。sers光谱是一种能够在分子尺度上获得物质丰富结构信息的分析方法,由于其在分析中快速、简单、无损伤、高灵敏的优势,使其在生物、医药、环境检测、爆炸物检测等领域得到了广泛的应用。sers技术在病毒基因检测应用中有以下几点优势:(1)sers检测技术灵敏度非常高,达到了单分子检测的水平;(2)sers检测对待测样品需求量很小,是一种微量检测技术;(3)水的拉曼散射非常弱,即使水溶液中分析物的浓度很小也能被原位识别和鉴定,不需要复杂的样品前处理过程;(4)相比于荧光技术,sers不易发生光漂白。将sers技术用在核酸检测中已有报道,大多基于核酸杂交引起的金属纳米粒子聚集形态改变,从而引起sers信号的增强或减弱。例如harpster等人构建了一个以金纳米颗粒胶体为sers基底的病毒dna sers传感器,该传感器以金纳米颗粒胶体为sers基底,亚甲基蓝作为拉曼报告分子,当加入西尼罗河病毒(wnv)rna后,同时与修饰有亚甲基蓝的探针分子(reporter probe)和修饰有巯基的捕获探针(capture probe)杂交,该结构通过au
‑
s键被固定到金纳米颗粒上产生sers信号。ngo等人构建了一种基于“三明治”结构的磁性纳米颗粒胶体基底sers传感策略,用于实现对登革病毒的超灵敏检测。通过目标dna将磁性纳米颗粒与制备的纳米金银核壳结构sers探针(拉曼分子被包含在金银核壳中间)连接起来,再由磁性纳米颗粒将sers探针聚集起来,通过sers信号来检测目标核酸。
4.crispr/cas系统是细菌和古细菌抵抗外源物质的一种适应性免疫防御机制。crispr/cas系统作为一种基因编辑工具,在食品工业、人类健康等领域引起了广泛关注。最近,越来越多的研究表明,某些cas蛋白在对靶标双链脱氧核糖核酸序列(dsdna)的特异性切割(称为顺式切割)后可以激活对附近的单链dna(ssdna)的非特异性切割的功能(称为反式切割)。在众多crispr蛋白中,cas12a(也称为cpf1)是一种核糖核酸(rna)依赖的核酸内切酶,可反式切割附近的非目标单链dna。cas12a蛋白在设计的crrna的协助下可以特异性的识别并切割富含t的靶标dsdna,cas12a是由单个42
‑
44nt的crrna引导的蛋白识别靶标dna,无需反式作用的crispr rna(tracrrna)。图1表示了cas12a切割原理示意图:cas12a在crrna的引导下,识别富含t的靶标dna,切割形成粘性末端。目前,利用crispr/cas12a对病
毒核酸的检测有很多的应用。例如,申请公布号cn110453011a的发明专利介绍了基于crispr/cas12a快速精准检测非洲猪瘟病毒的方法及应用;以及申请专利号cn201910364284.5的发明专利介绍了基于crispr/cas12a的特异性hpv核酸检测方法;以及申请公开号cn113046450a的发明专利介绍了一种基于crispr/cas12a点切割可视化检测植原体的方法。但目前利用crispr/cas12a对病毒核酸的检测的信号输出主要依靠的是荧光与比色的方法。将crispr/cas12a与sers技术相结合用于基因检测,到目前为止已查到三篇报道:(1)hongki kim等人将crispr/dcas9与sers技术相结合用于金黄色葡萄球菌(staphylococcus aureus),鲍氏不动杆菌(acinetobacter baumannii)等的检测,该文章充分利用了磁金复合的纳米粒子对在复杂体系中dna的捕获然后简单的磁分离以及拉曼信号分子的增强(acs nano 2020,14,17241
‑
17253)。(2)jin ha choi等人利用了crispr/cas12a与sers技术的结合用于病毒核酸的检测。该文章主要开发了一种基于crispr@cas12a的免核酸扩增的生物传感器通过sers辅助超灵敏检测系统。通过病毒dna的存在激活crispr@cas12a对固定在氧化石墨烯(go)/三角形金sers活性基底与拉曼报告分子功能化的金纳米颗粒之间的ssdna的剪切,引起sers信号的变化(acs nano 2021,15,13475
‑
13485)。(3)jianghua liu等人报道了一种多功能的基于crispr@cas12a介导的脂质体sers信号放大与肉眼比色检测的策略(anal.chem.2021,93,10167
‑
10174)。
5.本发明将crispr/cas12a与sers技术相结合用于基因的快速准确检测。与已经报道的方法相比,本发明将crispr@cas12a与sers技术结合最大的优势是避免繁琐的修饰制备过程,sers探针可以长期稳定存在。该方法在信号放大关键的步骤(即反式切割步骤)发生在ssdna的溶液相,而非以往报道的纳米组装体的界面上,因此具有更稳定和更高反式切割效率,可保障该检测方法的灵敏度和重复性。
技术实现要素:
6.本发明公开了一种基于crispr/cas12a与sers技术结合快速精准检测dsdna的方法及应用。
7.本发明利用目标病毒核酸与cas12a、crrna形成三元复合体,该复合物中cas12a的ruvc结构域行使核酸酶活性,开启切割体系中的底物(即:ssdna)。ssdna是探针1和探针2上dna1和dna2的桥连互补序列,可使探针1和探针2有效桥连。若ssdna被切割,则探针1和探针2呈现分散状态。而探针1和探针2是否被桥连可引起sers信号的变化,即可得知待检样品中是否含有目标核酸。利用特异性的crrna可以实现对病毒核酸的准确快速检测。
8.本发明的技术方案如下:
9.准备溶液3的具体步骤
10.(1)制备金纳米粒子(aunps)
11.金纳米粒子制备参考文献(j.am.chem.soc.2009,131,17042)方法。具体为:向干净的三颈瓶中加入100ml 0.01%的haucl4水溶液,并加热搅拌至微沸。向其中加入1ml 1%柠檬酸钠水溶液,控制微沸回流。可观察到溶液颜色从淡黄色到黑色,再到酒红色。降温至90℃,保持该温度40min使粒子熟化。之后停止加热和搅拌。待溶液恢复至室温,即获得金纳米粒子的溶液。该溶液保存于4℃下备用。
12.(2)制备探针1和探针2
13.探针1和探针2是通过在金纳米粒子表面修饰含巯基的dna序列(dna1和dna2)与拉曼报告分子实现的,制备参考文献方法(nature protocols,2006,247)。具体为:
14.(2
‑
1)向10μl 5μm dna1溶液中加入ph=5.2、500mm醋酸钠缓冲溶液1.5μl和1μl 10mm tcep,在室温下孵育1小时活化dna1的巯基。
15.(2
‑
2)将(2
‑
1)中tcep处理过的sh
‑
dna1加入5ml合成的金纳米粒子溶液中并在室温下避光储存24小时。
16.(2
‑
3)向(2
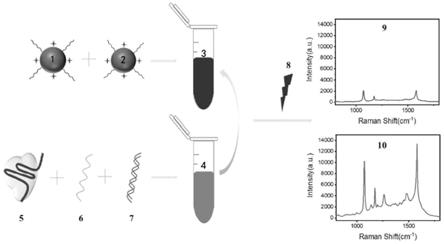
‑
2)溶液中加入500mm、ph=8.2的tris
‑
醋酸缓冲溶液50μl使得tris
‑
醋酸缓冲溶液最终浓度为5mm。
17.(2
‑
4)待溶液混合均匀后加入5m nacl老化。每次加入10μl,重复该过程五次每次间隔至少1h避免由于加入nacl速度过快造成纳米粒子的聚集,在室温下反应至少24小时。
18.(2
‑
5)以6400rpm离心(2
‑
4)反应完毕的溶液,用缓冲液(150mm氯化钠和25mm tris
‑
醋酸,ph=8.2)洗涤两次。
19.(2
‑
6)将(2
‑
5)离心之后的纳米颗粒分散在2.5ml水中以备后续实验所用。
20.(2
‑
7)取(2
‑
6)中成功制备的sh
‑
dna1@aunps 1ml,然后加入5μl 1mm的拉曼报告分子(例如4
‑
巯基苯甲腈,简称:mbn),静止反应过夜。
21.(2
‑
8)离心(2
‑
7)中的溶液两次去除未结合的拉曼报告分子重新分散至1ml缓冲溶液中,保存于4℃冰箱,以便后续使用。
22.探针2的制备方法除dna链采用dna2之外,其他的与探针1的制备过程相同。
23.(2
‑
9)将成功制备的探针1与探针2混合实现溶液3的制备,保存于4℃冰箱,以便后续使用。
24.准备溶液4的具体步骤(3)crispr/cas12a@crrna@dna三元复合物的形成
25.(3
‑
1)在20μl的体系中加入1μl cas12a蛋白,1μl对应的crrna,4μl靶标dna。
26.(3
‑
2)向(3
‑
1)溶液中加入缓冲液(20mm tris
‑
hcl ph=7.5 100mm kcl 5mm mgcl2),37℃反应30min。
27.(3
‑
3)将反应完毕的(3
‑
2)溶液中加入桥联的底物ssdna 4μl,在37℃反应30min。
28.(3
‑
4)将(3
‑
3)反应完毕的溶液水浴85℃,10min去除蛋白,使得该体系的反应停止。
29.应用sers对病毒核酸的检测
30.(4
‑
1)将(3
‑
4)反应完毕的溶液4取5μl加入40μl(2
‑
9)制备的溶液3中50摄氏度水浴2min,然后进行以下的sers检测。
31.(4
‑
2)将(4
‑
1)反应完成的溶液在超声机中超声分散5min。然后取10μl滴到清洗干净的玻璃或石英片上。利用共聚焦拉曼谱仪测试。该方法是通过探针1和探针2上的拉曼报告分子的信号强度检测,说明该检测体系中是否存在底物ssdna。测试时,激发光源为633nm,激发光与拉曼散射光是通过50
×
的目镜收集的,收集的拉曼光谱的范围是200cm
‑1到2400cm
‑1,积分时间为10s。
32.(4
‑
3)对照组样品测试,除将准备溶液4的具体步骤(3
‑
1)中的靶标dna换成h2o作为对照以外,其余的溶液5的反应与上述步骤(3)完全相同,然后取5μl该溶液加入40μl(2
‑
9)制备的溶液3中50摄氏度水浴2min,然后进行sers检测。
33.(5)检测结果判别
34.当体系中没有靶标dna存在时,就无法形成cas12a@crrna@dna的三元复合物,即无法开启反式剪切功能。因而,体系中的底物ssdna完整保留,可促使探针1和探针2的有效聚集结构,相应的sers信号较强。反之,当靶标dna存在时,可以形成cas12a@crrna@dna的三元复合物,然后激活对附近底物ssdna的剪切功能,所以体系中的底物ssdna被大量降解消耗,无法形成探针1和探针2的有效聚集结构,获得的sers信号比较弱。
35.(5
‑
1)将(4
‑
2)和(4
‑
3)中得到的拉曼数据处理做图。
36.(5
‑
2)若(4
‑
2)组sers信号强度与(4
‑
3)组信号相当,为阴性结果。
37.(5
‑
3)若(4
‑
2)组sers信号强度弱于(4
‑
3)组信号,为阳性结果。
38.本发明相对与现有技术具有的效果:
39.1)本发明能高效、精准地检测病毒基因序列,具有操作简单的优点,对疾病早期监测诊断与防控具有重要意义。
40.2)本发明的方法测量干扰小,这主要是由于反式剪切发生在溶液相中无修饰的游离ssdna上,剪切不受界面的影响,成功率高;且所需样品量少,信号强且灵敏度高,并可以实现对低浓度病毒核酸的高灵敏度检测。
附图说明
41.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式描述中所需要使用的附图作简单地介绍。
42.图1为crispr/cas12a结合靶标dna的原理图。
43.图2为探针1(aunps@dna1@mbn)和探针2(aunps@dna2@mbn)的制备示意图以及加入底物ssdna引起纳米粒子耦合的示意图。
44.图3为crispr/cas12a与sers技术结合检测实验流程图。
45.其中各部分名称为:纳米粒子探针1、纳米粒子探针2、由纳米粒子探针1与纳米粒子探针2混合制备的溶液3、cas12a蛋白与对应的crrna 5、底物ssdna6、待测的病毒dna 7、由cas12a蛋白、crrna、底物ssdna、待测的病毒dna形成的溶液4、将溶液4加入溶液3中进行sers检测8、具有靶标dna的阳性sers结果图9、没有靶标dna的阴性sers结果图10。
46.图4为实施例1和实施例2中制备的金纳米粒子的紫外结果。
47.图5为实施例1和实施例2中制备的金纳米粒子的透射电镜图结果。
48.图6为实施例1和实施例2中探针1(aunps@dna1@mbn)和探针2(aunps@dna2@mbn)的紫外吸收结果。
49.图7为实施例1和实施例2中拉曼信号检测对比结果。
50.图8为实施例1中hpv 16 dna拉曼信号阳性检测结果。
51.图9为实施例2中hpv 18 dna拉曼信号阴性检测结果。
具体实施方式
52.实施例1crispr/cas12a与sers技术相结合用于hpv16核酸的检测
53.在该实施例中,所述金属纳米粒子探针为金纳米粒子探针。
54.在该实施例中,所述拉曼信号分子为mbn。
55.在该实施例中,所述dna1的序列为sh
‑
aaaaaaaaaacacactcacacacac。
56.在该实施例中,所述dna2的序列为sh
‑
aaaaaaaaaacctcaccaccaacac。
57.在该实施例中,所述底物ssdna的序列为gtgtgagtgtgtgtggtgttggtggtgagg。
58.在该实施例中,所述靶标核酸为hpv 16 dna具体序列为ctatggattacaaacaaacacaattgtgtttaattggttgcaaaccacctataggggaacactggggcaaaggatccccatgtaccaatgttgcagtaaatccaggtgattgtccaccattagagttaataaacacagttattcaggatggtgatatggttgatactggctttggtgctatggactttactacattacaggctaacaaaagtgaagttccactggatatttgtacatcta。
59.在该实施例中,所述crrna为hpv 16的对应crrna
16
,具体序列为uaauuucuacuaaguguagaucuacauuacaggcuaacaaa。
60.(1)制备金纳米粒子(aunps)
61.金纳米粒子制备参考柠檬酸钠水热还原氯金酸的方法。具体为:向干净的三颈瓶中加入100ml 0.01%的haucl4水溶液,并加热搅拌至微沸。向其中加入1ml 1%柠檬酸钠水溶液,控制微沸回流。可观察到溶液颜色从淡黄色到黑色,再到酒红色。降温至90℃,保持该温度40min使粒子熟化。之后停止加热和搅拌。待溶液恢复至室温,即获得金纳米粒子的溶液。该溶液保存于4℃下备用。
62.(2)制备探针1(aunps@dna1@mbn)和探针2(aunps@dna2@mbn)
63.探针1和探针2是通过在金纳米粒子表面修饰含巯基的dna序列(dna1和dna2)与拉曼报告分子实现的,具体为:
64.(2
‑
1)向10μl 5μm dna1溶液中加入ph=5.2、500mm醋酸钠缓冲溶液1.5μl和1μl 10mm tcep,在室温下孵育1小时活化dna1的巯基。
65.(2
‑
2)将tcep处理过的sh
‑
dna1加入5ml合成的金纳米粒子溶液中并在室温下避光储存24小时。
66.(2
‑
3)加入500mm、ph=8.2的tris
‑
醋酸缓冲溶液50μl使得tris
‑
醋酸缓冲溶液最终浓度为5mm。
67.(2
‑
4)待(2
‑
3)中溶液混合均匀后加入5m nacl老化。每次加入10μl,重复该过程五次每次间隔至少1h避免由于加入nacl速度过快造成纳米粒子的聚集,在室温下反应至少24小时。
68.(2
‑
5)以6400rpm离心(2
‑
4)中的溶液,用缓冲液(150mm氯化钠和25mm tris
‑
醋酸,ph=8.2)洗涤两次。
69.(2
‑
6)将(2
‑
5)中离心洗涤完成的纳米颗粒分散在2.5ml水中以备后续实验所用。
70.接下来在修饰了dna的金纳米粒子表面接枝拉曼报告分子(例如mbn),方法如下:
71.(2
‑
7)取成功制备的sh
‑
dna1@aunps 1ml,然后加入5μl 1mm的mbn拉曼探针分子,静止反应过夜。
72.(2
‑
8)离心两次去除未结合的拉曼探针分子重新分散至1ml缓冲溶液中,保存于4℃冰箱,以便后续使用。
73.探针2(sh
‑
dna2@aunps@mbn)的制备方法除dna的链不同之外其他的与上述过程相同。将成功制备的探针1与探针2混合实现溶液3的制备,保存于4℃冰箱,以便后续使用。
74.(3)crispr/cas12a对hpv 16 dna的识别与切割
75.(3
‑
1)制备反应溶液4与溶液5,在20μl的体系中加入1μl cas12a蛋白,1μl crrna(hpv 16的crrna
16
),其中溶液4中加入4μl靶标dna(hpv 16 dna),溶液5中加入4μl水作为对
照。
76.(3
‑
2)向(3
‑
1)溶液中加入缓冲液(20mm tris
‑
hcl ph=7.5 100mm kcl 5mm mgcl2),37℃反应30min。
77.(3
‑
3)将反应完毕的(3
‑
2)溶液中加入桥联的底物ssdna 4μl,在37℃反应30min。
78.(3
‑
4)将(3
‑
3)反应完毕的溶液水浴85℃,10min去除蛋白,使得该体系的反应停止。
79.(3
‑
5)将反应完毕的溶液4与溶液5各取5μl加入到等体积制备的溶液3(40μl)中50摄氏度水浴2min,然后进行以下的sers检测。
80.(3
‑
6)将(3
‑
5)反应完成的溶液超声5min,提高粒子在溶液中的分散性,然后取10μl滴到清洗干净的玻璃片上,利用共聚焦拉曼谱仪测试,激发光源为633nm,7.1mw,激发光与拉曼散射光是通过50
×
的目镜收集的,收集的拉曼光谱的范围是200cm
‑1到2400cm
‑1,积分时间为10s。
81.(4)检测结果判别
82.将(3
‑
6)中得到的拉曼数据处理做图,可知检测强度低于2500计数,且低于对照组。该检测结果为阳性结果。
83.实施例2 crispr/cas12a与sers技术相结合用于hpv18核酸的检测
84.在该实施例中,所述金属纳米粒子探针为金纳米粒子探针。
85.在该实施例中,所述拉曼信号分子为mbn。
86.在该实施例中,所述dna1的序列为sh
‑
aaaaaaaaaacacactcacacacac。
87.在该实施例中,所述dna2的序列为sh
‑
aaaaaaaaaacctcaccaccaacac。
88.在该实施例中,所述底物ssdna的序列为gtgtgagtgtgtgtggtgttggtggtgagg。
89.在该实施例中,所述靶标核酸为hpv 18 dna片段,具体序列为gggaacactgggctaaaggcactgcttgtaaatcgcgtcctttatcacagggcgattgcccccctttagaacttaaaaacacagttttggaagatggtgatatggtagatactggatatggtgccatggactttagtacattgcaagatactaaatgtgaggtaccattggatatttgtcagtctatttgtaaatatcctgattatttacaaatgtctgcagatccttatggggattcca。
90.在该实施例中,所述crrna为hpv 18 crrna
18
,具体序列为uaauuucuacuaaguguagauguacauugcaagauacuaaa。
91.(1)、(2)步骤制备金纳米粒子(aunps)以及制备探针1(aunps@dna1@mbn)和探针2(aunps@dna2@mbn)与实例1相同。
92.(3)crispr/cas12a对hpv 18 dna的识别与切割
93.(3
‑
1)制备反应溶液4与溶液5,在20μl的体系中加入1μl cas12a蛋白,1μl crrna(hpv 18 crrna
18
),溶液4中加入4μl靶标dna(hpv 18 dna),溶液5中加入4μl水作为对照。
94.(3
‑
2)向(3
‑
1)溶液中加入缓冲液(20mm tris
‑
hcl ph=7.5 100mm kcl 5mm mgcl2),37℃反应30min。
95.(3
‑
3)将反应完毕的(3
‑
2)溶液中加入桥联的底物ssdna 4μl,在37℃反应30min。
96.(3
‑
4)将(3
‑
3)反应完毕的溶液水浴85℃,10min去除蛋白,使得该体系的反应停止。
97.(3
‑
5)将反应完毕的溶液4与溶液5各取5μl加入到等体积制备的溶液3(40μl)中50摄氏度水浴2min,然后进行以下的sers检测。
98.(3
‑
6)将(3
‑
5)反应完成的溶液超声,提高粒子在溶液中的分散性,然后取10μl滴到清洗干净的玻璃片上,利用共聚焦拉曼谱仪测试,激发光源为633nm,7.1mw,激发光与拉曼散射光是通过50
×
的目镜收集的,收集的拉曼光谱的范围是200cm
‑1到2400cm
‑1,积分时间为10s。
99.(4)检测结果判别
100.将(3
‑
6)中得到的拉曼数据处理做图。由于信号强度高于10000,且与对照组相当。可判定体系中无法形成cas12a@crrna 18
@hpv 18 dna的三元复合物,所以体系中的底物ssdna完整存在,使探针1和探针2形成聚集形态,带来强sers信号。因此可判定该检测结果为阴性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1