Crisaborole溶剂化物的晶型及其制备方法和用途与流程
crisaborole溶剂化物的晶型及其制备方法和用途
技术领域
1.本发明涉及药物晶体技术领域,具体涉及克立硼罗(本文有时称为“crisaborole”或“克瑞沙硼”)溶剂化物的晶型及其制备方法和用途。
背景技术:
2.皮肤炎症相关疾病中,牛皮癣和特应性皮炎(ad),尤其是特应性皮炎具有易罹患哮喘、过敏性鼻炎、湿疹的家族性倾向,同时对异种蛋白过敏,并且血液嗜酸性粒细胞增多,是一种慢性、复发性的炎症性皮肤病,部分患者还常合并过敏性哮喘、过敏性鼻炎和过敏性结膜炎等其他特应性疾病。近年来,尽管在临床治疗方面取得了不少突破性进展,但相关药物的研发仍面临着诸多挑战。
3.2016年12月,美国食品药品管理局(fda)批准anacor公司的crisaborole(商品名为eucrisa)软膏上市,成为fda在过去15年内批准治疗ad的首个新分子实体。该药是一种磷酸二酯酶4(phosphodiesterase
‑
4,pde
‑
4)抑制剂,其通过抑制磷酸二酯酶4(pde4)发挥抗炎作用,可用于治疗特应性皮炎,其结构式如下:
[0004][0005]
而目前现有技术中共公开了数种crisaborole晶型的相关报道,例如cn108884111a公开了crisaborole水合物以及无水物晶型,其中无水物晶型具有易引湿性。
[0006]
再例如,wo2017203514a1公开了crisaborole乙醇化物及其制备方法,in201941003851a公开了正丁醇化物及其制备方法,不过上述晶型制备方法中的溶残均超ich要求。
[0007]
目前仍存在开发新晶型以解决crisaborole溶剂化物在制备药物制剂时存在的水溶性、稳定性低等问题的需求。另外,crisaborole溶剂化物的晶型性能和制备高纯度晶型仍需进一步提高。
[0008]
背景技术中的信息仅仅在于说明本发明的总体背景,不应视为承认或以任何形式暗示这些信息构成本领域一般技术人员所公知的现有技术。
技术实现要素:
[0009]
为解决现有技术中的至少部分技术问题,本发明提供crisaborole溶剂化物的特定晶型,其具有更适于制备药物制剂的优异性质。例如,更高的水溶性、制剂稳定性以及更高的生物利用率。具体地,本发明包括以下内容。
[0010]
本发明的第一方面,提供结构式如下式(i)所示的crisaborole吡啶溶剂化物晶型,
[0011][0012]
在以衍射角2θ表示的x射线粉末衍射图谱中,具有选自5.33
±
0.2
°
、14.58
±
0.2
°
、16.47
±
0.2
°
和23.23
±
0.2
°
中的至少三个特征衍射峰。
[0013]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,优选地,在以衍射角2θ表示的x射线粉末衍射图谱中,进一步具有选自18.76
±
0.2
°
、23.77
±
0.2
°
、25.71
±
0.2
°
和27.99
±
0.2
°
中的至少一个特征衍射峰。
[0014]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,优选地,在以衍射角2θ表示的x射线粉末衍射图谱中,进一步具有选自19.31
±
0.2
°
、21.21
±
0.2
°
、22.21
±
0.2
°
和22.87
±
0.2
°
中的至少一个特征衍射峰。
[0015]
优选地,本发明第一方面所述的晶型的x射线粉末衍射数据如表1所示。
[0016]
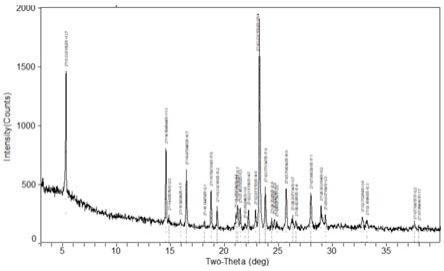
优选地,本发明第一方面所述的晶型具有基本上如图1所示的x射线粉末衍射图谱。
[0017]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,优选地,在傅里叶红外光谱中,在选自2228.14
±
2cm
‑
1、1425.72
±
2cm
‑
1、1360.35
±
2cm
‑
1和1164.51
±
2cm
‑
1中的至少之一处具有特征峰。
[0018]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,优选地,在傅里叶红外光谱中,进一步在选自3382.93
±
2cm
‑
1、1592.10
±
2cm
‑
1、1442.40
±
2cm
‑
1、1238.26
±
2cm
‑
1、1052.51
±
2cm
‑
1、982.57
±
2cm
‑
1、852.96
±
2cm
‑
1和699.19
±
2cm
‑
1中的至少之一处具有特征峰。
[0019]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,优选地,所述晶型具有如图5所示的傅里叶红外光谱。
[0020]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,优选地,所述晶型为fb
‑
2,其中,吡啶在该crisaborole溶剂化物中的含量为23.96%,其在tga图谱中显示75℃之前具有失重台阶,失重率不高于12%。
[0021]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,优选地,所述晶型的dsc图谱中显示具有66
±
2℃的熔点。
[0022]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,所述crisaborole溶剂化物的晶型具有基本上如图2所示的tga图谱。
[0023]
根据本发明第一方面所述的crisaborole吡啶溶剂化物晶型,优选地,所述crisaborole吡啶溶剂化物晶型具有基本上如图3所示的dsc图谱。
[0024]
本发明的第二方面,提供结构式如下式(ii)所示的crisaborole半1,3
‑
丙二醇溶剂化物晶型,
[0025]
[0026]
在以衍射角2θ表示的x射线粉末衍射图谱中,具有选自10.39
±
0.2
°
、12.40
±
0.2
°
、19.23
±
0.2
°
和22.53
±
0.2
°
中的至少三个特征衍射峰。
[0027]
根据本发明第二方面所述的crisaborole半1,3
‑
丙二醇溶剂化物晶型,优选地,在以衍射角2θ表示的x射线粉末衍射图谱中,进一步具有选自15.97
±
0.2
°
、21.15
±
0.2
°
、23.09
±
0.2
°
和23.89
±
0.2
°
中的至少一个特征衍射峰。
[0028]
根据本发明第二方面所述的crisaborole半1,3
‑
丙二醇溶剂化物晶型,优选地,在以衍射角2θ表示的x射线粉末衍射图谱中,进一步具有选自16.91
±
0.2
°
、17.81
±
0.2
°
、20.31
±
0.2
°
和27.43
±
0.2
°
中的至少一个特征衍射峰。
[0029]
优选地,本发明第二方面所述的晶型的x射线粉末衍射数据如表2所示。
[0030]
优选地,本发明第二方面所述的晶型具有基本上如图7所示的x射线粉末衍射图谱。
[0031]
根据本发明第二方面所述的crisaborole半1,3
‑
丙二醇溶剂化物晶型,优选地,在傅里叶红外光谱中,在选自2232.00
±
2cm
‑
1、1618.12
±
2cm
‑
1、1596.57
±
2cm
‑
1和1240.11
±
2cm
‑
1中的至少之一处具有特征峰。
[0032]
根据本发明第二方面所述的crisaborole半1,3
‑
丙二醇溶剂化物晶型,优选地,在傅里叶红外光谱中,进一步在选自1492.74
±
2cm
‑
1、1371.03
±
2cm
‑
1、1171.75
±
2cm
‑
1、1112.92
±
2cm
‑
1、1011.36
±
2cm
‑
1、938.40
±
2cm
‑
1、839.58
±
2cm
‑
1和639.79
±
2cm
‑
1中的至少之一处具有特征峰。
[0033]
根据本发明第二方面所述的crisaborole半1,3
‑
丙二醇溶剂化物晶型,优选地,所述晶型具有如图11所示的傅里叶红外光谱。
[0034]
根据本发明第二方面所述的crisaborole溶剂化物的晶型,优选地,所述crisaborole半1,3
‑
丙二醇溶剂化物晶型为fb
‑
3,其中,1,3
‑
丙二醇在该crisaborole半1,3
‑
丙二醇溶剂化物中的含量为13.16%,其在tga图谱中显示150℃之前失重不高于15%。
[0035]
根据本发明第二方面所述的crisaborole半1,3
‑
丙二醇溶剂化物晶型,所述crisaborole半1,3
‑
丙二醇溶剂化物晶型具有基本上如图8所示的tga图谱。
[0036]
根据本发明第二方面所述的crisaborole溶剂化物的晶型,优选地,所述crisaborole半1,3
‑
丙二醇溶剂化物晶型具有基本上如图9所示的dsc图谱。
[0037]
本发明的crisaborole溶剂化物的晶型具有以下技术效果:
[0038]
1)本发明提供的晶型具有更好的水溶性。本发明的晶型与现有技术相比,在生物介质中的水溶性均有显著的提高。本发明的晶型的水溶性的显著提高将有助于提高药物的生物利用度,从而提高药物的成药性及药效;在保证药物疗效的同时,降低药品的剂量,从而降低药品的副作用并提高药品的安全性。
[0039]
2)本发明晶型具有较好的稳定性。尤其是1,3
‑
丙二醇溶剂化物的晶型在以醇类溶剂存在的药物制剂(如软膏剂)中具有高度的晶型稳定性。作为药物中最关键的活性成分,晶型具有良好的物理和化学稳定性至关重要。晶型具有良好的物理稳定性,保证原料药在存储和制剂工艺过程中,不容易转变成其它晶型,从而保证样品的质量一致可控。晶型具有良好的化学稳定性,储存过程中纯度基本不变,对保证药物疗效和安全性,防止药物不良反应的发生具有重要意义。此外,稳定的晶型在结晶工艺过程中更加可控,不容易出现杂质和混晶,尤其是具有更少的溶剂残留,利于工业化生产。
[0040]
本发明的第三方面,提供第一方面所述的crisaborole吡啶溶剂化物晶型的制备方法。
[0041]
根据本发明第三方面所述的制备方法,优选地,其包括以下方法中的任意一种:
[0042]
方法(1),其包括将溶剂与crisaborole的吡啶溶清液混合,直至析出固体,得到crisaborole溶剂化物的晶型;
[0043]
方法(2),其包括将crisaborole在溶剂和吡啶的混合溶剂中溶清,变温处理后直至析出固体,得到crisaborole溶剂化物的晶型。
[0044]
根据本发明第三方面所述的制备方法,优选地,溶剂为水,或水与选自聚丙烯酸、聚乙二醇、聚氧化乙烯、聚维酮的溶清液。
[0045]
根据本发明第三方面所述的制备方法,优选地,方法(1)中,crisaborole和吡啶化合物的比为50
‑
70:1,还优选为55
‑
65:1。进一步优选为58
‑
62:1;
[0046]
根据本发明第三方面所述的制备方法,优选地,吡啶与水的体积比为1:1
‑
4。还优选为1:1.5
‑
3.5,还优选为1:2.5
‑
3.3。
[0047]
根据本发明第三方面所述的制备方法,优选地,溶清溶液通过升温至55
‑
70℃得到,优选58
‑
65℃的温度,还优选为59
‑
62℃的温度。
[0048]
根据本发明第三方面所述的制备方法,优选地,变温处理是指溶清后依次升温、保温及降温的过程,还优选为升温至40
‑
60℃,降温至4
‑
30℃。
[0049]
根据本发明第三方面所述的制备方法,优选地,方法(2)中,所述crisaborole在溶清溶液中的浓度为25
‑
40mg/ml,还优选为26
‑
35mg/ml,进一步优选为30
‑
34mg/ml。
[0050]
根据本发明第三方面所述的制备方法,优选地,所述聚丙烯酸、聚乙二醇、聚氧化乙烯、聚维酮在溶清溶液中的浓度为0
‑
10mg/ml,还优选为0
‑
8mg/ml,进一步优选为0
‑
7mg/ml。
[0051]
本发明的第四方面,提供第二方面所述的crisaborole半1,3
‑
丙二醇溶剂化物晶型的制备方法。
[0052]
根据本发明第四方面所述的制备方法,优选地,其包括以下方法(1)或(2):
[0053]
方法(1),其包括取crisaborole,加入1,3
‑
丙二醇后,在第一温度下搅拌12
‑
36h,随后在第二温度下搅拌12
‑
36h,然后在第三温度下搅拌12
‑
36h,得到所述晶型;
[0054]
方法(2),其包括取crisaborole,加入1,3
‑
丙二醇后,加入方法(1)得到的晶型晶种,室温搅拌36h以上,得到所述晶型。
[0055]
根据本发明第四方面所述的制备方法,优选地,crisaborole在1,3
‑
丙二醇溶液的浓度为0.1
‑
0.5g/ml,还优选为0.15
‑
0.45mg/ml,进一步优选为0.18
‑
0.35mg/ml。
[0056]
根据本发明第四方面所述的制备方法,优选地,所述第一温度是指8
‑
15℃的温度条件,优选9
‑
12℃的温度;所述第二温度是指20
‑
30℃的温度条件,优选22
‑
28℃的温度;所述第三温度是指32
‑
40℃的温度条件,优选35
‑
38℃的温度。
[0057]
本发明的第五方面,提供一种药物组合物,其包含根据第一方面所述的crisaborole吡啶溶剂化物晶型、或根据第二方面所述的crisaborole1,3
‑
丙二醇溶剂化物晶型、或根据第三方面所述的制备方法得到的晶型、或根据第四方面所述的制备方法得到的晶型、或这些晶型的任意组合,以及至少一种药学上可接受的载体。
[0058]
本发明中药学上可接受的载体包括稀释剂或赋形剂或其他添加剂,其实例包括但
不限于,例如润湿剂、崩解剂、润滑剂、粘结剂、表面活性剂等。其他添加剂的实例包括但不限于,例如紫胶、阿拉伯树胶、滑石、氧化钛、糖(例如,蔗糖)、明胶、水、多糖诸如乳糖或葡萄糖、石蜡(例如,石油馏分)、植物油(例如,花生油或芝麻油)、以及药学上可接受的有机溶剂如醇(例如,乙醇或甘油)、天然矿物粉末(例如,高岭土、粘土、滑石和白垩)、合成矿物粉末(例如,高度分散的硅酸和硅酸盐)、乳化剂(例如,木素、亚硫酸盐溶液、甲基纤维素、淀粉和聚乙烯基吡咯烷酮)、硬脂酸镁、硬脂酸、月桂基硫酸钠等。
[0059]
本发明的药物组合物可制备为各种剂型,包括但不限于,例如适用于局部皮肤给药的半固体药物制剂,例如软膏剂、凝胶剂等,或适于口服给药的药物制剂,例如固体口服制剂包括片剂、包衣剂、胶囊剂、颗粒剂、散剂、丸剂、粉剂等,或液体口服制剂包括溶液剂、糖浆剂、混悬剂、乳液剂等;适于肠胃外给药的药物制剂,例如静脉滴注制剂,肌肉或皮下注射制剂,经直肠给药的栓剂,经鼻内给药的吸入制剂,或另外的局部给药的透皮贴剂形式。在制剂生产中,还可包括另外的辅料,优选辅料的加入不引起晶型的转变。
[0060]
本发明的第六方面,提供第一方面所述的crisaborole吡啶溶剂化物晶型、或第二方面所述的crisaborole1,3
‑
丙二醇溶剂化物晶型、或根据第三方面所述的制备方法得到的晶型、或根据第四方面所述的制备方法得到的晶型、或这些晶型的任意组合在制备用于治疗炎症相关疾病或病症的局部药物制剂中的用途,其中,所述炎症相关疾病或病症包括牛皮癣和特应性皮炎。
[0061]
优选地,本发明提供所述晶型在制备用于预防或治疗磷酸二酯酶4(pde
‑
4)相关疾病的药物中的用途。
[0062]
本发明的第七方面,提供一种用于预防或治疗疾病的方法,所述方法包括向有需要的受试者给予第一方面所述的crisaborole吡啶溶剂化物晶型、或第二方面所述的crisaborole1,3
‑
丙二醇溶剂化物晶型、或根据第三方面所述的制备方法得到的晶型、或根据第四方面所述的制备方法得到的晶型、或这些晶型的任意组合、或第五方面所述的药物组合物的步骤,其中所述疾病为磷酸二酯酶4相关疾病,其包括牛皮癣和特应性皮炎的炎症相关疾病。优选地,所述药物组合物包含预防和/或治疗有效量的所述晶型。
[0063]
本发明的第八方面,提供根据第一方面所述的crisaborole吡啶溶剂化物晶型、或第二方面所述的crisaborole1,3
‑
丙二醇溶剂化物晶型、或根据第三方面所述的制备方法得到的晶型、或根据第四方面所述的制备方法得到的晶型、或这些晶型的任意组合、或第五方面所述的药物组合物与其他药物活性成分的联合应用(提供下其他药物活性成分的实例)。
附图说明
[0064]
图1为根据实施例1制备得到的crisaborole溶剂化物晶型fb
‑
2的xrpd图谱。
[0065]
图2为根据实施例1制备得到的crisaborole溶剂化物晶型fb
‑
2的tga图谱。
[0066]
图3为根据实施例1制备得到的crisaborole溶剂化物晶型fb
‑
2的dsc图谱。
[0067]
图4为根据实施例1制备得到的crisaborole溶剂化物晶型fb
‑
2的plm图谱。
[0068]
图5为根据实施例1制备得到的crisaborole溶剂化物晶型fb
‑
2的傅里叶红外光谱。
[0069]
图6为根据实施例1制备得到的crisaborole溶剂化物晶型fb
‑
2的1hnmr图谱。
[0070]
图7为根据实施例4制备得到的crisaborole溶剂化物晶型fb
‑
3的xrpd图谱。
[0071]
图8为根据实施例4制备得到的crisaborole溶剂化物晶型fb
‑
3的tga图谱。
[0072]
图9为根据实施例4制备得到的crisaborole溶剂化物晶型fb
‑
3的dsc图谱。
[0073]
图10为根据实施例4制备得到的crisaborole溶剂化物晶型fb
‑
3的plm图谱。
[0074]
图11为根据实施例4制备得到的crisaborole溶剂化物晶型fb
‑
3的傅里叶红外光谱。
[0075]
图12为根据实施例4制备得到的crisaborole溶剂化物晶型fb
‑
3的1hnmr图谱。
具体实施方式
[0076]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
[0077]
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0078]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。除非另有说明,否则“%”为基于重量的百分数。
[0079]
本发明的方法中,一般以crisaborole晶型i作为起始物料制备本发明的晶型,也可以采用crisaborole其他任何形式的化合物及盐作为起始物料,作为起始物料的crisaborole晶型i可通过市售产品获得,也可通过wo2017/193917a1或cn108884111a中提到的方法制备得到。
[0080]
本文所用术语“受试者”包括哺乳动物。哺乳动物可为例如任何哺乳动物,例如,人、灵长类动物、鸟、小鼠、大鼠、家禽、狗、猫、牛、马、山羊、骆驼、绵羊或猪。优选哺乳动物为人。
[0081]
本文所用术语“室温”一般指10
‑
30℃,较佳地指20
±
5℃。
[0082]
本发明中,术语“晶型”是指晶体物质的某种晶格构型。本领域已知的是,晶型在制药中和稳定性、溶出性和机械性有关。相同物质的不同晶型通常具有其特有的不同物理性质的不同的晶格(例如晶胞)。不同的晶型可通过本领域已知的方法进行表征。例如,可通过固态表征方法例如通过x射线粉末衍射(xrpd)来鉴定。其它表征方法包括示差扫描量热法(dsc)、热解重量分析(tga)、动态蒸汽吸附(dvs)、固态nmr等。可以使用上述任一种方法对晶型进行表征,或者组合使用两种以上的方法进行表征。
[0083]
除本发明特别说明外,其他实验方法均为本领域公知的方法,这些方法可参考例如《中华人民共和国药典》等。其中,进行检测的参数设置如下:
[0084]
xrpd(x
‑
射线粉末衍射)测的具体条件为:bruker d8,cu
‑
kα辐射,检测范围3
°‑
40
°
2θ,步长0.02
°
2θ,扫描速率0.2s.step
‑
1,电流电压40ma,40kv。
[0085]
tga(热重分析)测试条件为:取1
‑
15mg的样品放置于白金坩埚内,采用分段高分辨检测的方式,10.00℃/min从室温到350℃;对于tga图,保留温度点及失重值。
[0086]
差示量热扫描分析的测试条件为:取1
‑
10mg的样品放置于打孔的铂金坩埚内,平衡在0℃,以10℃/min升至300℃;对于dsc图,保留温度点及热焓值。
[0087]
动态水分吸附分析检测方法为:取1~10mg的样品放置于白金坩埚内,检测相对湿度从0%到80%到0%变化过程中的重量变化。
[0088]
偏振光显微镜(plm)图谱采自于xp
‑
500e偏振光显微镜。取少量粉末样品置于载玻片上,滴加少量矿物油分散样品,盖上盖玻片,放置在载物台上进行观测并拍照。
[0089]
傅里叶红外光谱的测试条件为:bruker tensor 27,atr法,采集范围600cm
‑1‑
4000cm
‑
1,分辨率4cm
‑
1。
[0090]
本发明中,术语“性能”或“晶型性能”或“性质”或“药学性质”包括其物理和化学性质,评价指标包括但不限于,例如熔点、水溶性、溶出度、机械特性、稳定性、药动学或药效学、引湿性、流动性、可压性、竞争性等。
[0091]
实施例中所用的各种试剂如无特别说明均为商购获得。除非另有说明,实施例均在室温下操作。
[0092]
实施例1
[0093]
取约90mg crisaborole晶型,加入1.5mg吡啶,升温至60℃溶清,得到溶液1;取约6mg聚乙二醇,加入4.5ml水溶清,得到溶液2;将溶液2滴加到溶液1中,析出固体,继续搅拌过夜,离心,得到fb
‑
2。
[0094]
取实施例1样品进行表征,具体如下。
[0095]
1、xrpd图谱图谱分析
[0096]
图1为fb
‑
2的xrpd图谱,表1示出了fb
‑
2的x射线粉末衍射数据。
[0097]
表1:fb
‑
2的x射线粉末衍射数据
[0098][0099][0100]
2、tga图谱分析
[0101]
tga(热重分析)结果如图2所示。在75℃前具有失重台阶,失重率为11.3%,其分解温度为273℃。
[0102]
3、dsc图谱分析
[0103]
差示量热扫描分析结果如图3所示。晶型fb
‑
2具有在66℃的熔点。
[0104]
4、plm分析
[0105]
偏振光显微镜(plm)结果如图4所示。显示为细小颗粒。
[0106]
6、ft
‑
ir分析
[0107]
傅里叶红外光谱结果如图5所示。晶型fb
‑
2存在如下特征峰:
[0108]
fb
‑
2晶型2228.14
±
2cm
‑
1、1425.72
±
2cm
‑
1、1360.35
±
2cm
‑
1、1164.51
±
2cm
‑
1处
有特征衍射峰;另外,在3382.93
±
2cm
‑
1、1592.10
±
2cm
‑
1、1442.40
±
2cm
‑
1、1238.26
±
2cm
‑
1、1052.51
±
2cm
‑
1、982.57
±
2cm
‑
1、852.96
±
2cm
‑
1、699.19
±
2cm
‑
1处有特征衍射峰。考虑到不同条件下波数的变化,一般认为在
±
2的范围内是可接受的。
[0109]
晶型fb
‑
2的1hnmr图如图6所示。
[0110]
实施例2
[0111]
取约30mgcrisaborole,加入0.5ml吡啶,升温至60℃溶清,向其中滴加1.5ml水,析出固体,继续搅拌过夜,得到fb
‑
2。
[0112]
实施例3
[0113]
取约90mgcrisaborole,加入0.8ml吡啶和2ml水,60℃溶清后过滤,滤液保温20min,然后将滤液置于4℃搅拌过夜,析出固体,得到fb
‑
2。
[0114]
实施例4
[0115]
取约1.3 gcrisaborole,加入5ml 1,3
‑
丙二醇,在10℃搅拌24h;将步骤1中的体系转移至25℃搅拌24h;再将上一步骤中体系转移至37℃搅拌24h,出现大量白色固体,得到fb
‑
3。
[0116]
取实施例4样品进行表征,具体如下。
[0117]
1、xrpd图谱图谱分析
[0118]
图7为fb
‑
3的xrpd图谱,表2示出了fb
‑
3的x射线粉末衍射数据。
[0119]
表2:fb
‑
3的x射线粉末衍射数据
[0120]
[0121][0122]
2、tga图谱分析
[0123]
tga(热重分析)结果如图8所示。在150℃前失重为14.1%,其分解温度为265℃。
[0124]
3、dsc图谱分析
[0125]
差示量热扫描分析结果如图9所示。晶型fb
‑
3具有在58℃的熔点。
[0126]
4、plm分析
[0127]
偏振光显微镜(plm)结果如图10所示。显示为细小颗粒。
[0128]
6、ft
‑
ir分析
[0129]
傅里叶红外光谱结果如图11所示。晶型fb
‑
3存在如下特征峰:
[0130]
fb
‑
3晶型在2232.00
±
2cm
‑
1、1618.12
±
2cm
‑
1、1596.57
±
2cm
‑
1、1240.11
±
2cm
‑
1处有特征衍射峰;另外,在1492.74
±
2cm
‑
1、1371.03
±
2cm
‑
1、1171.75
±
2cm
‑
1、1112.92
±
2cm
‑
1、1011.36
±
2cm
‑
1、938.40
±
2cm
‑
1、839.58
±
2cm
‑
1、636.79
±
2cm
‑
1处有特征衍射峰。考虑到不同条件下波数的变化,一般认为在
±
2的范围内是可接受的。
[0131]
晶型fb
‑
3的1hnmr图如图12所示。
[0132]
实施例5
[0133]
取1.5gcrisaborole,加入5ml 1,3
‑
丙二醇,加入实施例4中获得晶型晶种适量,室温搅拌2天,得到fb
‑
3。
[0134]
尽管本发明已经参考示例性实施方案进行了描述,但应理解本发明不限于公开的示例性实施方案。在不背离本发明的范围或精神的情况下,可对本发明说明书的示例性实施方案做多种调整或变化。权利要求的范围应基于最宽的解释以涵盖所有修改和等同结构与功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1