一种人血清白蛋白的生产方法、核苷酸序列、表达载体及表达系统
1.本发明属于人血清白蛋白的生产领域,具体涉及一种人血清白蛋白的生产方法、核苷酸序列、表达载体及表达系统。
背景技术:
2.人血清白蛋白(human serum albumin,hsa)是人血浆中的蛋白质。在体液中人血清白蛋白可以运输脂肪酸、胆色素、氨基酸、类固醇激素、金属离子和许多治疗分子等:同时维持血液正常的渗透压。在临床上人血清白蛋白可用于治疗休克与烧伤,用于补充因手术、意外事故或大出血所致的血液丢失,也可以作为血浆增容剂。人血清白蛋白主要从血浆中提取,由于血浆来源有限,加上血液传播的疾病如艾滋病、肝炎等的威胁,使得人们对应用血浆中提取的血清白蛋白作为医药用途产生了巨大的担忧。
3.重组蛋白药物是应用基因工程技术产生的蛋白质药物,近年来,重组蛋白药物已经成为生物药物的重要组成部分。重组蛋白药物的生产主要包括四大系统:原核蛋白表达,酵母蛋白表达、昆虫细胞蛋白表达及哺乳动物细胞蛋白表达。目前已经有白蛋白在大肠杆菌、酵母、动物细胞和水稻来表达生产人血清白蛋白。和其他表达系统相比较,哺乳动物细胞生产的重组蛋白质能够进行正确折叠、装配和翻译后修饰,具有与人源蛋白分子结构更为接近的优势,因此哺乳动物细胞已经成为蛋白药物的主要表达宿主。目前近70%批准上市的重组蛋白药物来自于中国仓鼠卵巢细胞(chinese hamster ovary cells,cho)。但cho生产的hsa表达水平仍较低、获得高表达工程细胞株所需的时间长、细胞大规模培养的成本高等导致哺乳动物细胞生产蛋白质类药物的成本较高。这就需要改善哺乳动物细胞表达系统,进一步提高重组蛋白的表达量、增强细胞株的稳定性、降低生产成本的同时确保产品的质量和安全。
4.如专利公布号为cn106220726a的中国发明专利申请中公开了重组人血白蛋白及其表达载体的构建方法,表达载体优化后,hsa表达量达150~180mg/l。cho细胞生产重组蛋白的关键环节除了表达载体外,下游的细胞培养及工艺更具工业生产意义。
技术实现要素:
5.本发明的目的在于提供一种核苷酸序列,可以实现hsa目的基因在cho细胞的高效表达。
6.本发明的第二个目的在提供上述核苷酸序列的表达载体。
7.本发明的第三个目的在于提供含上述表达载体的表达系统。
8.本发明的第四个目的在于提供一种提高cho细胞重组人血清白蛋白表达的方法。
9.为实现上述目的,本发明的核苷酸序列的技术方案是:
10.一种核苷酸序列,所述核苷酸序列如seq id no.1所示。
11.本发明的核苷酸序列,根据cho细胞密码子偏爱性,对人血清白蛋白基因进行密码
子优化,能够提高目的基因的基础表达量。
12.本发明的表达载体的技术方案是:
13.包含上述核苷酸序列的表达载体。
14.所述表达载体可以通过本领域常规方法将seq id no:1所示基因序列插入出发载体的多克隆位点构建获得。具体的,人工合成如seq id no:1所示的hsa基因序列,用克隆技术将hsa基因序列连接至出发载体,通过序列鉴定筛选,获得重组表达载体。
15.优选的,构建所述表达载体的出发载体为pwty9.3。
16.本发明的表达系统的技术方案是:
17.包含上述表达载体的表达系统,使用所述表达载体转染cho细胞获得。
18.优选的,所述cho细胞为cho
‑
s、cho
‑
k1、cho
‑
dg44中的一种或多种。
19.将上述含pwty9.3
‑
hsa载体转染cho
‑
s细胞株,通过培养、筛选获得稳定cho
‑
hsa细胞池。稳定cho
‑
hsa细胞池能够高表达hsa。
20.本发明的人血清白蛋白的生产方法的技术方案是:
21.一种人血清白蛋白的生产方法,包括以下步骤:
22.(1)构建含seq id no.1所示核苷酸序列的表达载体;
23.(2)将表达载体转染cho细胞株,通过培养、筛选获得稳定cho
‑
hsa细胞池;
24.(3)将稳定cho
‑
hsa细胞池进行悬浮无血清培养。
25.本发明的人血清白蛋白的生产方法,通过构建含有所述hsa编码基因的表达载体,构建稳定cho
‑
hsa细胞池,实现hsa目的基因在cho细胞的高效表达。
26.cho
‑
hsa细胞池的培养方法是将细胞株从96孔板到24孔板再到6孔板扩大培养,采用悬浮无血清培养。优选的,步骤(3)中,先将稳定cho
‑
hsa细胞池在37℃下培养到对数期,然后转到33℃低温培养。
27.优选的,步骤(3)中,进行所述悬浮无血清培养时添加丁酸钠和氢化肉桂酸。进一步优选的,添加丁酸钠和氢化肉桂酸的终浓度分别为1.0~3.0mol/l和0.2~1.0mol/l。
28.可选用现有常规cho细胞培养基,优选的,步骤(3)中,进行所述悬浮无血清培养时所用的培养基为cho pro grow无血清培养基。
29.试验证明,hsa能够在cho细胞成功表达,并且在同等条件下,基于低温和小分子添加剂能够显著提高cho细胞重组hsa蛋白的表达水平。
30.本发明的哺乳动物细胞生产重组人血清蛋白的方法,具有和人类细胞完全一致的o
‑
糖基化翻译后修饰方式,从而克服目前酵母、水稻生产的人血清白蛋白和来自人源细胞白蛋白不完全一致的翻译后修饰方式,提高人血清白蛋白的功能。
附图说明
31.图1为本发明实施例所用的表达载体pwty9.3模式图;
32.图2为本发明中hsa在cho细胞表达的western blot结果;
33.图3为本发明中hsa在不同温度调节下的细胞密度图;
34.图4为本发明中hsa在不同温度调节下的细胞活性图;
35.图5为本发明中hsa在不同温度调节下的hsa表达水平图;
36.图6为本发明中hsa在不同的添加剂作用下的细胞密度图;
37.图7为本发明中hsa在不同的添加剂作用下的细胞活性图;
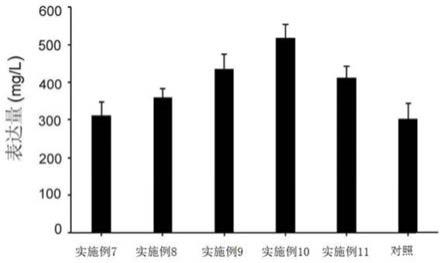
38.图8为本发明中hsa在不同的添加剂作用下的hsa表达水平图。
具体实施方式
39.下面结合具体实施方式对本发明作进一步描述,但本发明的保护范围并不仅限于此;实施例及试验例中所用的各类培养基、试剂、大肠杆菌(e.coli jm109)、细胞系试剂、工具酶等均为市售商品。pwty9.3质粒为河南普诺易生物制品研究院有限公司产品。未特别指明的,实施例及试验例中相关操作均为领域内常规技术手段,比如参照sambrook等编著的分子克隆实验手册(sambrook j&russell dw.molecular cloning:a laboratory manual.2001),或者产品制造厂商提供的说明书等。
40.一、核苷酸序列实施例
41.实施例1hsa基因序列
42.根据文献报道的hsa氨基酸序列(genbank no:caa01491);根据cho细胞密码子偏爱性,进行密码子优化,优化后hsa基因序列的密码子适应指数(codon adaptation index,cai)为0.97,gc含量为0.59,表达量较优化前提高1.5倍,其序列如seq id no.1所示。引入如seq id no.2所示信号肽序列。
43.优化前的hsa基因序列如seq id no.3所示。
44.重组人血清白蛋白的氨基酸序列如seq id no.4所示。
45.二、表达载体的实施例
46.实施例2含hsa基因重组表达载体的构建
47.本实施例提供包含hsa编码基因的重组表达载体的构建方法,包括如下步骤:
48.人工合成seq id no.1,为实现定向克隆,在合成序列的5
′
端、3
′
端分别引入hindiii(aagctt)、nhei(gctagc)酶切位点,并在hindiii酶切位点下游加入kozak序列,由通用生物系统(安徽)有限公司合成。
49.用hindiii/nhei分别双酶切合成的hsa序列,同时用hindiii/nhei双酶切pwty9.3质粒dna载体(载体结构见图1)。琼脂糖凝胶电泳鉴定酶切结果,凝胶回收酶切后的hsa序列片段和pwty9.3线形质粒dna。
50.hsa序列的双酶切体系为:hsa序列10μl(1μg/μl),10
×
nebuffer 2.1buffer 3.0μl,hindiii/nhei(10u/μl)各1.0μl,补足水至30μl;酶切条件为:37℃,酶切3h。
51.pwty9.3质粒的双酶切体系为:pires
‑
neo质粒5μl(1μg/μl),10
×
nebuffer 2.1buffer2.0μl,hindiii/nhei(10u/μl)各0.5μl,补足水至20μl;酶切条件为:37℃,酶切3h。
52.取酶切后的hsa序列片段和pwty9.3线形质粒dna(摩尔比5:1),使用neb公司tm的连接试剂盒,25℃连接5min。将连接产物加入到大肠杆菌(e.coli)jm109菌株感受态细胞悬液中转化,取150μl转化菌液接种到含有氨苄青霉素的lb平板上,37℃培养过夜,挑取单菌落继代培养。提取重组质粒并进行双酶切(hindiii/nhei)验证,取酶切验证正确的质粒进行测序验证,构建正确的质粒分别命名为pwty9.3
‑
hsa。
53.三、表达系统的实施例
54.实施例3细胞转染及稳定细胞池筛选
55.本实施例表达系统的构建过程如下:
56.(1)用含10%胎牛血清的完全培养基培养cho细胞,待细胞处于对数生长期时,收集细胞以15万/ml接种到24孔板。次日细胞快长满时用1μl脂质体转染试剂转染含有载体1μg的pwty9.3
‑
hsa。
57.(2)转染过载体的cho细胞用含有杀稻瘟菌素(15μg/ml)的dmem/f12培养基进行加压筛选。待未转染的对照细胞用杀稻瘟菌素完全杀死后,实验组存活的细胞为稳定转染的细胞株。降低培养基杀稻瘟菌素浓度为10μg/ml进行传代扩大培养,此过程细胞一直在37℃、5%co2培养箱中培养,培养到20代,获得稳定转染hsa的cho细胞池,western bolt分析hsa的表达,结果见图2。从图2结果可以看出,hsa在稳定cho细胞池成功表达。
58.本实施例所使用的cho细胞为cho
‑
s细胞。在其他实施情形下,可使用cho
‑
k1、cho
‑
dg44细胞系,可达到相应的改善效果。
59.四、人血清白蛋白的生产方法的实施例
60.实施例4
61.本实施例的人血清白蛋白的生产方法,包括以下步骤:
62.将实施例3稳定转染hsa的cho细胞池(稳定cho
‑
hsa细胞池)转入125ml悬浮培养瓶中,初始细胞量为5~6
×
106个/ml,加入30ml cho pro grow无血清培养基,120rpm悬浮培养,每天用血清细胞计数器分析细胞密度,台盼蓝染色分析细胞的活性。
63.本实施例为常温37℃培养;培养至第七天收集细胞上清,elisa检测各组hsa的表达量。
64.实施例5
65.本实施例的人血清白蛋白的生产方法,与实施例4介绍的方法基本相同,区别仅在于,先将稳定cho
‑
hsa细胞池在37℃下培养到对数期,然后转到33℃低温培养。具体地,常温37℃培养到第四天转到33℃低温培养。
66.实施例6
67.本实施例的人血清白蛋白的生产方法,与实施例4介绍的方法基本相同,区别仅在于,培养条件为低温33℃培养。
68.实施例7~实施例11
69.按照实施例5的培养方法,进行稳定cho
‑
hsa细胞池的培养和分析,在细胞培养第二天分别加入丁酸钠和氢化肉桂酸,各实施例的加量终浓度如下表1所示。每天用血清细胞计数器分析细胞密度,台盼蓝染色分析细胞的活性。培养至第七天收集细胞上清,elisa检测各组hsa的表达量。
70.表1实施例7~实施例11中丁酸钠和氢化肉桂酸的加量
[0071][0072]
五、实验例
[0073]
本实验例测试稳定cho
‑
hsa细胞池在不同培养条件下的细胞密度、细胞活性以及hsa的表达量差异。
[0074]
(1)不同培养温度
[0075]
对比实施例4~6的方法的细胞密度、细胞活性、hsa体积表达量,结果如图3~图5所示。
[0076]
由图3~图5可知,实施例4的方法的细胞密度稍高,各组的细胞活性没有显著差异。实施例4、实施例5、实施例6三组hsa的体积表达量分别为190.15mg/l、304.46mg/l、213.55mg/l,实施例5的表达量最高,其次是实施例6。
[0077]
(2)是否添加小分子添加物
[0078]
对比实施例7~11的方法的细胞密度、细胞活性、hsa体积表达量,结果如图6~图8所示。
[0079]
由图6~图8可知,各组细胞的细胞密度、细胞活性没有显著差异。实施例7~11共六组hsa的体积表达量分别为311.05mg/l、359.46mg/l、436.34mg/l、517.49mg/l、412.06mg/l、303.14mg/l,和对照组比较,第四组(实施例10)表达量最高,其次是三组(实施例9)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1