新木脂素类化合物及其制备方法和应用
1.本发明专利涉及医药技术领域,尤其是指新木脂素类化合物及其制备方法和应用。
背景技术:
2.海风藤是胡椒科(piperaceae)胡椒属植物风藤(piper kadsura(choisy)ohwi)的干燥藤茎。其主要分布于福建、浙江、广东、台湾、湖南、湖北、四川、贵州等地,具有祛风湿、通经络、止痹痛的功效。目前已从海风藤中分离得到的化合物主要类型有木脂素、生物碱、黄酮类等化合物,其中木脂素类化合物是海风藤的主要成分。
3.炎症释放各种炎症介质,放大各种细胞反应,导致组织或器官功能丧失在多种疾病中均可见到,如慢性支气管炎、哮喘、肾炎、细菌病毒感染疾病、心机梗死和缺血再灌注损伤灌注损伤等。炎症与癌症的发生发展也密切相关。抑制炎症对多种疾病的预防和治疗起到非常重要的作用。一些中草药具有很好的抗炎效果,从其中挖掘活性化合物,开发抗炎新药具有明显优势。
4.因此,开发新的活性化合物显得很有必要。
技术实现要素:
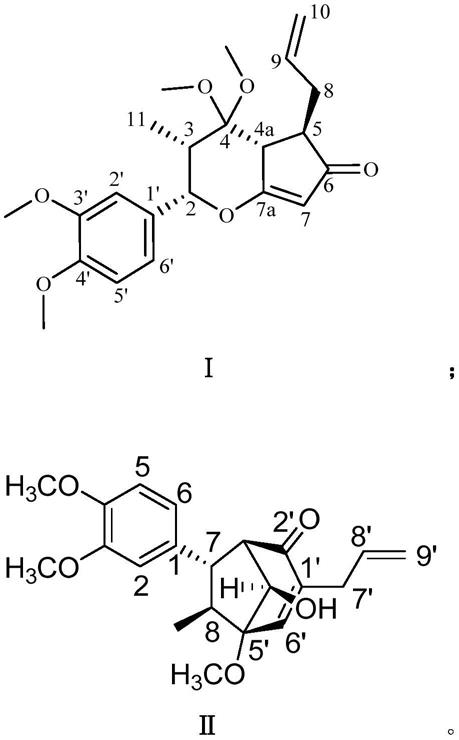
5.本发明旨在至少在一定程度上解决现有技术中存在的技术问题之一,由此,在本发明的第一方面,本发明提供一种新木脂素类化合物,所述新木脂素类化合物的结构式选自如下结构中的一种:
6.[0007][0008]
在本发明的第二方面,本发明提供一种本发明的第一方面所述的新木脂素类化合物的制备方法,所述新木脂素类化合物由海风藤提取分离得到。
[0009]
在本发明的一个或多个实施例中,所述的新木脂素类化合物的制备方法,包括如下步骤:
[0010]
步骤1):将海风藤粉碎,用第一溶剂提取,得到提取液,浓缩提取液,得到浸膏;
[0011]
步骤2):将所述步骤1)得到的浸膏用水混悬,并使用第二溶剂萃取,得萃取物;
[0012]
步骤3):将所述步骤2)所得的萃取物经柱色谱分离,得到所述新木脂素类化合物。
[0013]
在本发明的一个或多个实施例中,所述步骤1)中,第一溶剂选自甲醇和乙醇中的一种或两种。
[0014]
在本发明的一个或多个实施例中,所述步骤2)中,第二溶剂选自石油醚、正己烷、环己烷和乙酸乙酯中的一种或多种。
[0015]
在本发明的一个或多个实施例中,所述步骤3)中,柱色谱选自大孔树脂柱色谱、硅胶柱色谱、凝胶柱色谱、反相硅胶柱色谱和高效液相制备色谱中的一种或多种。
[0016]
在本发明的一个或多个实施例中,所述步骤3)中,将所述步骤2)所得的萃取物依次经大孔树脂柱色谱、硅胶柱色谱、凝胶柱色谱、高效液相制备色谱或硅胶柱色谱分离。
[0017]
在本发明的一个或多个实施例中,所述步骤3)中,柱色谱分离采用两种或多种第三溶剂进行洗脱,所述第三溶剂选自水、甲醇、乙腈、丙酮、乙酸乙酯、石油醚、环己烷和二氯甲烷。
[0018]
在本发明的第三方面,本发明提供一种本发明的第一方面所述的新木脂素类化合物在制备抗炎药物中的应用。
[0019]
在本发明的第四方面,本发明提供一种药物制剂,所述药物制剂包括式ⅰ所示化合物和/或式ⅱ所示化合物,式ⅰ所示化合物结构式如下:
[0020][0021]
式ⅱ所示化合物结构式如下:
[0022][0023]
在本发明的一个或多个实施例中,所述药物制剂为气雾剂、凝胶剂、膜剂、散剂、膏剂、丸剂、胶囊剂、片剂或颗粒剂。
[0024]
相比于现有技术,本发明的有益效果在于:
[0025]
1、本发明提供一种新木脂素类化合物,其为新化合物。
[0026]
2、本发明提供上述新木脂素类化合物的制备方法,其制备工艺简单。
[0027]
3、本发明提供上述新木脂素类化合物在制备抗炎药物中的应用。
附图说明
[0028]
图1为从海风藤中分离制备式ⅰ所示化合物和式ⅱ所示化合物的流程示意图。
具体实施方式
[0029]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。以下实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行,使用的方法如无特别说明,均为本领域公知的常规方法,使用的耗材和试剂如无特别说明,均为市场购得。除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。
[0030]
实施例1:化合物1(式ⅰ所示化合物)、化合物2(式ⅱ所示化合物)的制备
for c
22
h
29
o6,389.1959)。
[0042]
化合物2(式ⅱ所示化合物):黄色油状液体;uv(meoh)λ
max
(logε)202.0(3.65),228.5(3.44)nm;ir(kbr)ν
max 2930,2834,1464,1268,1145,1093,1026cm
‑1;ecd[λ
max
(δε)]204(+22.40),236(
‑
7.86),260(+2.64),298(
‑
0.22)nm;1h和
13
c nmr数据,见表2;hresims[m+na]
+
m/z381.1686[m+na]
+
(calcd for c
25
h
26
o5na,381.1678)。
[0043]
表1.化合物1的1h nmr(400mhz)和
13
c nmr(100mhz)数据(recorded in cdcl3,δ:ppm)
[0044][0045][0046]
表2.化合物2的1h nmr(400mhz)和
13
c nmr(100mhz)数据(recorded in in cdcl3,δ:ppm)
[0047][0048]
实施例3:化合物1(式ⅰ所示化合物)、化合物2(式ⅱ所示化合物)的抗炎活性测试
[0049]
抗炎试验:采用griess法对样品进行抗炎活性评估。首先以raw 264.7小鼠巨噬细胞,采用mtt法评价待测化合物的细胞毒性,然后确定对该细胞没有毒性的浓度进行化合物抗炎活性评价。raw 264.7小鼠巨噬细胞采用dmem培养基培养,接种于96孔培养板中,30000个/孔,细胞贴壁24h后,用不同浓度的待测样品及lps溶液处理细胞24小时,取反应过后的培养基加griess试剂混合,于室温反应10分钟,在540nm下测得吸光度。试验设空白对照组、造模组以及加入吲哚美辛的阳性对照组,每个试验重复3次,评价对一氧化氮(no)的抑制作用。其no抑制率按如下公式计算:
[0050]
no抑制率=(a
造模组
‑
a
药物组
)/(a
造模组
‑
a
空白组
)
×
100%
[0051]
结果如表3所示。
[0052]
表3.化合物1(式ⅰ所示化合物)、化合物2(式ⅱ所示化合物)的抗炎活性
[0053][0054]
实验结论:化合物1(式ⅰ所示化合物)、化合物2(式ⅱ所示化合物)均能抑制由lps刺激的raw264.7巨噬细胞中no的释放,具有抗炎活性,有开发为抗炎药物的潜力。
[0055]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例
性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1