金刚烷胺半抗原、金刚烷胺抗原、制备方法以及金刚烷胺单克隆抗体及金刚烷胺检测试剂盒与流程
1.本发明涉及金刚烷胺半抗原、金刚烷胺抗原、其制备方法、及其免疫筛选的杂交瘤细胞、单克隆抗体,以及用金刚烷胺抗原、单克隆抗体制备的金刚烷胺elisa检测试剂盒、金刚烷胺生物芯片检测试剂盒、制备方法与应用,属于生物技术领域。
背景技术:
2.金刚烷胺(amantadine)属于三环胺类,是最早用于治疗流感的抗病毒药物。美国于1966年批准其作为预防用药,1976年在预防药的基础上确认其为治疗用药。在畜禽养殖中,其主要用于治疗和预防鸡禽流感以及猪传染性胃肠炎的防治,但是长期服用金刚烷胺会导致嗜睡、眩晕、抑郁、恶心等毒副作用,我国原农业部560号公告中己明令禁止金刚烷胺和金刚乙胺等抗病毒药物用于畜禽养殖业,美国fad也已明确禁止在畜禽养殖中使用此类药物。然而,2012年媒体曝出国内养殖的“速生鸡”从孵出到端上餐桌只需45天,不法商贩为了进一步缩短养殖周期,让原本已经是速成品种的白羽鸡长得更快,偷偷喂食了包括金刚烷胺等抗病毒药品和地塞米松等激素类药品,使得禽肉等消费产品对人的食品安全造成严重威胁。
3.传统的金刚烷胺药物残留的检测方法主要是高效液相-质谱检测法、气相色谱法、高效液相法、气相-质谱联用检测法等,但由于其需要复杂的前处理过程和昂贵的仪器设备,且需要专业的操作人员等,使得这些方法都无法满足现场检测对快速、准确的要求。
4.免疫分析法可以弥补上述检测方法的缺点。免疫分析法是基于抗原抗体特异性结合的反应,检测各种物质(如药物、激素、蛋白质、微生物等)的分析方法,具有高灵敏度和高选择性等特点,且其检测成本低、速度快、准确,适用于现场的大量样本的快速筛选。但金刚烷胺作为禁用药物,现有的关于免疫分析方法的文献资料报道和市场产品中,鲜有产品的灵敏度高于国标检测方法的最低检测限(1ppb)的,因此迫切需要建立更加快速、简便、价廉、灵敏、特异的金刚烷胺筛选方法。
技术实现要素:
5.为解决现有技术的不足,本发明提供了金刚烷胺半抗原、其能制备金刚烷胺抗原。
6.本发明还提供了金刚烷胺抗原,其能制备与金刚烷胺进行抗原抗体反应的单克隆抗体,以及作为制备金刚烷胺检测试剂盒的包被原。
7.本发明还提供了能高灵敏度和高特异性结合金刚烷胺的单克隆抗体。
8.本发明还提供了能高灵敏度和高特异性结合金刚烷胺的可变区序列。
9.本发明还提供了能高灵敏度和高特异性结合金刚烷胺的抗体和抗体片段。
10.本发明还提供了能分泌高灵敏度和高特异性结合金刚烷胺的单克隆抗体的杂交瘤细胞株。
11.本发明还提供了能高灵敏度和高特异性检测金刚烷胺的金刚烷胺elisa检测试剂
盒。
12.本发明还提供了灵敏度高于国标检测方法的最低检测限(1ppb)的检测金刚烷胺的金刚烷胺elisa检测试剂盒。
13.本发明还提供了能高灵敏度和高特异性检测金刚烷胺的金刚烷胺生物芯片检测试剂盒。
14.本发明还提供了灵敏度高于国标检测方法的最低检测限(1ppb)的检测金刚烷胺的金刚烷胺生物芯片检测试剂盒。
附图说明
15.图1为金刚烷胺半抗原a的质谱;
16.图2为金刚烷胺半抗原b的质谱;
17.图3为牛血清白蛋白bsa的maldi-tof-ms;
18.图4为金刚烷胺抗原a的maldi-tof-ms;
19.图5为金刚烷胺抗原b的maldi-tof-ms;
20.图6为实施例4制备的金刚烷胺elisa检测试剂盒中金刚烷胺的标准曲线;
21.图7为金刚烷胺生物芯片检测试剂盒中芯片上每个芯片孔的点样模式示意,图7中7a、7b、7c、7d、7e分别表示了不同的点样模式,其局部放大显示了一个金刚烷胺检测芯片亚单元的检测芯片,图7中7f、7g、7h分别为具有一个、三个、多个抗体检测芯片亚单元的试剂盒;
22.图8为金刚烷胺生物芯片检测试剂盒中后台网站内置标曲。
23.附图标记
24.1为质控点1、2为质控点2、3为质控点3、4为空白对照点、5为金刚烷胺抗原检测点。
具体实施方式
25.定义
26.术语“金刚烷胺”分子式c
10h17
n,中文别名:金刚胺、三环炔胺、1-氨基金刚烷、1-金刚烷胺、1-胺基金刚烷,英文别名1-adamantanamine、1-aminoadamantane、symadine、symmetrel、tricyclo[3.3.1.1(3,7)]decane-1-amine、adamantan-1-amine。
[0027]
在做半抗原与载体蛋白的连接时,使用的载体蛋白包括但不限于ova、bsa、klh、bgg、rsa、psa、lph、has与pll等。其中,bsa是牛血清白蛋白(bovine serum albumin),属于最稳定的和可溶的白蛋白,分子量为67
×
103da(含有59个lys),大约有30-35个主要氨基可用于与链接剂发生共轭反应,使得bsa成为一种很流行的弱抗原化合物载体蛋白。ova是鸡卵白蛋白(ovalbumin),分子量为45
×
103da,一般作为第二载体蛋白去验证抗体是否特异性地只针对多肽而并非载体蛋白(如bsa)。klh是血蓝蛋白(keyhole limpet hemocyanin),是在某些软体动物、节肢动物(蜘蛛和甲壳虫)的血淋巴中发现的一种游离的蓝色呼吸色素,血蓝蛋白含两个直接连接多肽链的铜离子,与含铁的血红蛋白类似,易于氧结合,也易与氧解离,是已知的唯一可与氧可逆结合的铜蛋白,氧化时呈青绿色、还原时呈白色,其分子量450000~130000。
[0028]
术语“单克隆抗体”是指获自基本上同源的抗体群的抗体,即组成该群体的抗体个
体都相同,除了可能存在少量可能的自发突变。因此,修饰语“单克隆”是指该抗体的性质不是离散抗体的混合物。优选地,所述单克隆抗体包括单价的或是单链抗体、双链抗体、嵌合抗体、人源化抗体以及上述抗体的衍生物、功能等同物和同源物,也包括抗体片段和含有抗原结合结构域的任何多肽。抗体为涵盖具有所需特异性的结合结构域的任意特异性结合因子,因而,这个术语涵盖了与之同源的抗体片段、衍生物、人源化抗体以及抗体的功能等同物和同源物,也包括含有抗原结合结构域的任何多肽,无论是天然的还是合成产生的。抗体的实例是免疫球蛋白亚型(如igg,ige,igm,igd和iga)及其亚型亚类;也可以是包含抗原结合结构域的片段如fab、scfv、fv、dab、fd;和双链抗体(diabodies)。融合至另一多肽的、包含抗原结合结构域的嵌合体分子或者等同物也包括在其中。嵌合抗体的克隆与表达在ep.a.0120694和ep.a.0125023中描述。抗体可以通过许多方式修饰,可用dna重组技术来产生保留原来抗体特异性的其它抗体或嵌合分子。这种技术可以包括将编码抗体的免疫球蛋白可变区或互补性决定区(cdrs)的dna引入不同免疫球蛋白的恒定区或恒定区加框架区,参见ep.a.184187,gb2188638a或ep.a.239400。还可以对杂交瘤细胞或产生抗体的其它细胞进行遗传突变或其它改变,这可以改变或者不改变所产生抗体的结合特异性。用于本发明的“单克隆抗体”也可用杂交瘤方法制得,因为编码本发明鼠源化抗体的dna序列可用本领域技术人员熟知的常规手段,如根据本发明公开的氨基酸序列人工合成核苷酸序列或用pcr法扩增得到,因而也可用重组dna方法,可用本领域熟知的各种方法将该序列连入合适的表达载体中。最后,在适合本发明抗体表达的条件下,培养转化所得的宿主细胞,然后本领域技术人员应用熟知的常规分离纯化手段纯化得到本发明的单克隆抗体。抗体包含通过二硫桥连接在一起的多肽链几何体,称为轻链和重链的两条多肽主链构成抗体的所有主要结构类别(同型物)。重链和轻链都进一步可分为称作可变区和恒定区的一些亚区。重链包括单个的可变区和三个不同的恒定区,轻链则包括单个可变区(不同于重链的可变区)和单个恒定区(不同于重链的恒定区)。重链和轻链的可变区负责抗体的结合特异性。
[0029]
术语“重链可变区”是指一种多肽,其长度为110至125个氨基酸,其氨基酸顺序相应于本发明单克隆抗体从重链n末端氨基酸开始的重链氨基酸顺序。同样,术语“轻链可变区”是指一种多肽,其长度为95至115个氨基酸,其氨基酸顺序相应于本发明单克隆抗体从轻链n末端氨基酸开始的轻链氨基酸顺序。本领域普通技术人员显然知晓,在本发明所具体公开的单克隆抗体的重链可变区和轻链可变区氨基酸序列基础上,可以通过常规基因工程和蛋白质工程方法进行一个或多个氨基酸的添加、删除、替换等修饰,获得保守性变异体,而仍能够保持与犬轮状病毒特异性结合。本发明中的单克隆抗体还包括其活性片段或保守性变异体。
[0030]
术语“保守性变异体”是指基本上保留了其母本的特性,如基本的免疫学生物特性、结构特性、调节特性或生化特性的变异体。一般地,多肽的保守性变异体之氨基酸序列不同于母本多肽,但是差异是有限的,以使与母本多肽之序列与保守性变异体总体上非常相似,并且在许多区域是相同的。保守性变异体和母本多肽氨基酸序列上的差异可以是例如:一个或多个氨基酸残基及其任意组合的替换、添加和删除。替换或插入的氨基酸残基可由遗传密码编码,也可不由遗传密码编码。多肽的保守性变异体可以自然产生,或者它可以是非自然产生的变异体。多肽之非自然产生的保守性变异体可通过诱变技术或直接合成而产生。
[0031]
术语“ic
50”是指半抑制浓度(或称半抑制率)。在间接竞争elisa(简称ic-elisa)标准曲线中是一个非常重要的数据。ic-elisa中不添加抑制物质的对照孔的od值为b0,添加了抑制物质的孔的od值为b,b/b0就叫做结合率,在结合率为50%时所对应的抑制物质的浓度就叫做ic
50
。
[0032]
术语“ppb”是一个浓度单位,1ppb=1/1000ppm=1μg/kg=1ng/ml=1ng/g。
[0033]
术语“cv”是指变异系数,是测定结果的标准差与平均值百分比。
[0034]
发明详述
[0035]
本发明提供了金刚烷胺半抗原a或b,其分别具有如结构式(
ⅴ
)或结构(ⅶ)所示的化学结构:
[0036][0037]
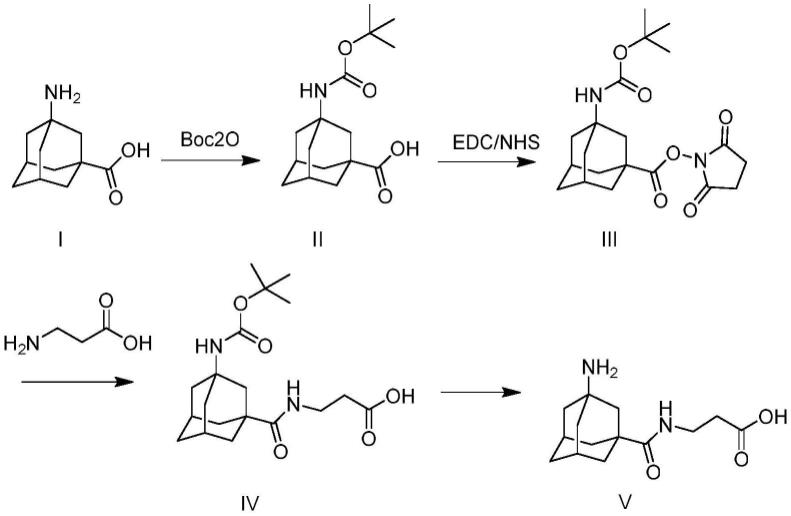
本发明还提供了一种制备所述的金刚烷胺半抗原a的方法,其中,所述方法包括:步骤(1)称取2g-10g 3-氨基金刚烷-1-甲酸和1.92g-9.6g boc酸酐加入单口瓶中,加入0.05g-0.26g 4-二甲氨基吡啶,用30ml叔丁醇溶解,在70~80℃反应5~8小时;步骤(2)将反应后液体减压旋蒸,除去溶剂叔丁醇,得到大量淡黄色的油状物,即为粗品化合物2;步骤(3)将所述粗品化合物2溶解在乙酸乙酯中,使用0.1m硫酸溶液和纯水洗涤两遍后,收集有机相,减压旋蒸,得到化合物2;步骤(4)将0.5g-2g所述化合物2溶解在10ml 80%的甲醇水溶液中,加入0.3g-1.3g edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和0.25g-1.0g nhs(n-羟基丁二酰亚胺),20~25℃反应1小时,得到中间体化合物3的溶液;将0.9g-3.6gβ-丙氨酸的50%m/v水溶液缓慢滴加至反应液中,继续在20~25℃反应过夜;步骤(5)将所述反应后溶液减压旋蒸除去甲醇和水,再重新加入30ml水和30ml乙酸乙酯,搅拌30分钟后分层,收集有机相,旋蒸后得到粗品化合物4,并将所述粗品化合物4过柱纯化,得到其纯品0.5g;步骤(6)将0.2-1.0g所述纯化的化合物4溶解在1ml甲醇中,加入0.5ml浓盐酸,在20~25℃搅拌3~5小时,用0.5m氢氧化钠溶液调节ph至6,然后减压旋蒸除去溶剂甲醇和水后,得到0.1g-0.6g粗品化合物5;以及步骤(7)将所述粗品化合物5重新用甲醇溶解后,过滤除去无机盐,滤液减压旋蒸后得到较为纯净的化合物5,使用柱硅胶继续分离纯化,得到所述金刚烷胺半抗原a。
[0038]
作为本发明的一种实施方式,本发明所述制备所述的金刚烷胺半抗原a的方法包括:所述步骤(1)称取5g 3-氨基金刚烷-1-甲酸和4.8g boc酸酐加入单口瓶中,加入0.13g 4-二甲氨基吡啶,用30ml叔丁醇溶解,在70~80℃反应5~8小时;所述步骤(2)将反应后液体减压旋蒸,除去溶剂叔丁醇,得到大量淡黄色的油状物,即为粗品化合物2;所述步骤(3)将所述粗品化合物2溶解在乙酸乙酯中,使用0.1m硫酸溶液和纯水洗涤两遍后,收集有机相,减压旋蒸,得到化合物2;所述步骤(4)将1g所述化合物2溶解在10ml 80%的甲醇水溶液中,加入0.65g edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和0.5g nhs(n-羟基丁二酰亚胺),20~25℃反应1小时,得到中间体化合物3的溶液;将1.8gβ-丙氨酸的50%m/v水溶液缓慢滴加至反应液中,继续在20~25℃反应过夜;所述步骤(5)将所述反应后溶液减压
旋蒸除去甲醇和水,再重新加入30ml水和30ml乙酸乙酯,搅拌30分钟后分层,收集有机相,旋蒸后得到粗品化合物4,并将所述粗品化合物4过柱纯化,得到其纯品0.5g;所述步骤(6)将0.5g所述粗品化合物4溶解在1ml甲醇中,加入0.5ml浓盐酸,在20~25℃搅拌3~5小时,用0.5m氢氧化钠溶液调节ph至6,然后减压旋蒸除去溶剂甲醇和水后,得到0.6g粗品化合物5;以及所述步骤(7)将所述粗品化合物5重新用甲醇溶解后,过滤除去无机盐,滤液减压旋蒸后得到较为纯净的化合物5,使用柱硅胶继续分离纯化,得到所述金刚烷胺半抗原a。
[0039]
本发明还提供了一种制备所述的金刚烷胺半抗原b的方法,其中,所述方法包括:步骤(1)将1g-5g金刚烷胺与0.98g-2.94g乙醛酸溶解在20ml二氯甲烷中,在室温搅拌反应24小时;以及步骤(2)将所述反应后液体减压旋蒸,除去二氯甲烷后,得到大量白色固体化合物,加入20ml 2m盐酸溶解后,在100℃回流5~8小时后,减压旋蒸除去水,得到0.5g-3.2g所述半抗原b。
[0040]
作为本发明的一种实施方式,本发明所述制备所述的金刚烷胺半抗原b的方法包括:所述步骤(1)将2g金刚烷胺与1.96g乙醛酸溶解在20ml二氯甲烷中,在室温搅拌反应24小时;以及所述步骤(2)将所述反应后液体减压旋蒸,除去二氯甲烷后,得到大量白色固体化合物,加入20ml 2m盐酸溶解后,在100℃回流5~8小时后,减压旋蒸除去水,即得到1.6g所述半抗原b。
[0041]
本发明还提供了一种金刚烷胺抗原a或b的制备方法,其中,所述制备方法包括:步骤(1)所述金刚烷胺半抗原a或者半抗原b4mg-16mg溶解在1ml dmf中,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)1.5mg~6.0mg和0.9mg~3.6mg n-羟基琥珀酰亚胺(nhs),25℃反应1~2小时,形成溶液1;步骤(2)称取10mg-30mg bsa、ova、klh、bgg、rsa、psa、lph或has载体蛋白溶解在1ml 0.01m nahco3缓冲液中,形成溶液2;步骤(3)将所述步骤(1)的所述金刚烷胺半抗原a或b的溶液1缓慢滴加入所述步骤(2)的溶液2中,4℃搅拌反应过夜;以及步骤(4)将所述步骤(3)的所述反应液用0.01m pbs溶液在4℃透析3天,每天更换两次透析液;将透析液离心后,取出上清液,即为所述金刚烷胺抗原a或b。
[0042]
作为本发明的一种实施方式,本发明所述金刚烷胺抗原a或b的制备方法包括:步骤(1)所述金刚烷胺半抗原a或者半抗原b 4mg溶解在1ml dmf中,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)2.9mg和1.8mg n-羟基琥珀酰亚胺(nhs),25℃反应1~2小时,形成溶液1;步骤(2)称取13.5mg ova溶解在1ml 0.01mnahco3缓冲液中,形成溶液2;步骤(3)将所述步骤(1)的所述金刚烷胺半抗原a或b的溶液1缓慢滴加入所述步骤(2)的溶液2中,4℃搅拌反应过夜;以及步骤(4)将所述步骤(3)的所述反应液用0.01m pbs溶液在4℃透析3天,每天更换两次透析液;将透析液离心后,取出上清液,即为金刚烷胺抗原a或b。
[0043]
本发明还提供了所述金刚烷胺抗原a或b的制备方法制备的金刚烷胺抗原a或b。
[0044]
本发明还提供了金刚烷胺单克隆抗体3g7,其中,所述单克隆抗体3g7的重链可变区为seq.id no 1或其简并序列所编码,其轻链可变区为seq.id no 2或其简并序列所编码。所述金刚烷胺单克隆抗体3g7对金刚烷胺的ic
50
为0.7~1.2,亲和力为1.52
×
109l/mol,与金刚烷胺具有良好的反应性。
[0045]
本发明还涉及一种特异性结合金刚烷胺的单克隆抗体3g7的可变区序列,其中,所述单克隆抗体3g7重链可变区为seq.id no.1或其简并序列所编码;所述单克隆抗体3g7轻链可变区为seq.id no.2或其简并序列所编码;其中,所述金刚烷胺单克隆抗体3g7由所述
金刚烷胺抗原a免疫后筛选所得。
[0046]
本发明还涉及一种杂交瘤细胞3g7株,所述杂交瘤细胞3g7株分泌所述单克隆抗体3g7。
[0047]
本发明还提供了一种金刚烷胺elisa检测试剂盒,其中,所述金刚烷胺elisa检测试剂盒包括包被了所述金刚烷胺抗原a的支持介质、酶标工作液、金刚烷胺抗体工作液、金刚烷标准品溶液;其中,所述金刚烷胺抗原a的包被浓度为0.10μg/ml~0.25μg/ml;所述酶标工作液为hrp-羊抗鼠igg的溶液,优选为1∶5000~1∶8000v/v稀释;所述金刚烷胺抗体工作液为所述的金刚烷胺单克隆抗体3g7的溶液,所述金刚烷胺单克隆抗体3g7的含量为0.04μg/ml;所述金刚烷标准品溶液是将金刚烷胺标准品用0.01m pbs稀释液梯度稀释为0、0.2ng/ml、0.6ng/ml、1.8ng/ml、5.4ng/ml、16.2ng/ml各浓度;其中,所述支持介质为微量滴定板,所述金刚烷胺抗原a包被100μl/孔;所述酶标工作液还含有:1l水中含氯化钠8g、磷酸氢二钠2.9g、磷酸二氢钾0.24g、氯化钾0.2g、新生牛血清200ml、proclin3001ml;所述金刚烷胺抗体工作液还含有:1l水中含氯化钠8g、磷酸氢二钠2.9g、磷酸二氢钾0.24g、氯化钾0.2g、10g牛血清白蛋白、proclin300 1ml;所述试剂盒还包括洗涤液、tmb显色液、终止液、提取剂、纯化剂、样品稀释液;所述洗涤液为含0.1%v/v吐温-20的0.01m pbs溶液;所述tmb显色液包括a液和b液,其中a液为ph值为5的柠檬酸-磷酸二氢钠的缓溶液,其为在100ml水含有1.5g柠檬酸和6.6g磷酸氢二钠、1.0g过氧化脲,b液为0.8%m/v的3,3,5,5-四甲基联苯胺的柠檬酸-磷酸二氢钠的缓冲溶液;所述终止液为2mol/l的硫酸溶液;所述提取剂为乙腈;所述纯化剂为正己烷;以及所述样品稀释液为0.01m pbs溶液。
[0048]
本发明还提供了一种金刚烷胺生物芯片检测试剂盒,其中,所述生物芯片检测试剂盒包括一个或多个金刚烷胺芯片、抗体工作液、酶标工作液,所述金刚烷胺芯片包被有所述金刚烷胺抗原a、质控品、空白对照点;其中,所述质控品为鼠igg,所述空白对照点为检测背景值;所述空白对照点为5%甘油溶液、5%山梨醇溶液、0.05%曲拉通溶液、dmso、pbs(ph6.8)溶液按10∶15∶0.1∶50∶100的体积比混合均匀后的点样点;所述抗体工作液为含所述金刚烷胺单克隆抗体3g7的溶液,所述金刚烷胺单克隆抗体3g7的浓度为0.06μg/ml;所述酶标工作液为含hrp-羊抗鼠igg的溶液,按1:200~1:2000v/v稀释hrp-羊抗鼠igg;所述金刚烷胺抗原a包被量为0.6~1.0ng/点;所述鼠igg的包被量为1~4ng/点;所述质控品点共三个点,质控品点(1)的包被量为大于等于1ng/点而小于2ng/点;质控品点(2)的包被量为2ng/点;质控品点(3)的包被量为大于2ng/点而小于等于4ng/点。
[0049]
与传统elisa试剂盒均设有标准品作为试剂盒内质控品相比,标准品要求较高、制备较难、费用昂贵,本发明所述生物芯片检测试剂盒通过技术提升,在反应载体上设有质控品,该质控品为商品化鼠igg,还大大提升试剂盒操作便捷性及准确性。本发明经研究发现在一定含量范围内的鼠igg可作为质控品,无需设阴性对照、阳性对照,鼠igg的作用在于作为单个检测孔内无抗体反应时的反应对照,用于评估试验的有效性,体现无阻断时酶标试剂的反应程度。而鼠igg可以商业上购买或通过常规方法制备,操作简便。
[0050]
作为本发明的一种实施方式,其中,所述生物芯片检测试剂盒中所述金刚烷胺芯片包被所述金刚烷胺抗原的包被量为0.6ng/点~1.0ng/点,所述点样体积为20nl/点。
[0051]
所述金刚烷胺抗原的包被量可以为0.60ng/点、0.61ng/点、0.62ng/点、0.63ng/点、0.64ng/点、0.65ng/点、0.66ng/点、0.67ng/点、0.68ng/点、0.69ng/点、0.70ng/点、
0.71ng/点、0.72ng/点、0.73ng/点、0.74ng/点、0.75ng/点、0.76ng/点、0.77ng/点、0.78ng/点、0.79ng/点、0.80ng/点、0.81ng/点、0.82ng/点、0.83ng/点、0.84ng/点、0.85ng/点、0.86ng/点、0.87ng/点、0.88ng/点、0.89ng/点、0.90ng/点、0.91ng/点、0.92ng/点、0.93ng/点、0.94ng/点、0.95ng/点、0.96ng/点、0.97ng/点、0.98ng/点、0.99ng/点、1.0ng/点。
[0052]
所述鼠igg包被量可以为1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0ng/点。
[0053]
作为本发明的一种实施方式,所述的生物芯片检测试剂盒还包括提取剂、纯化剂、tmb底物液、洗涤液、样品稀释液;所述洗涤液为含0.1%v/v吐温-20的0.01m pbs溶液;所述tmb显色液包括a液和b液,其中a液为ph值为5的柠檬酸-磷酸二氢钠的缓溶液,其为在100ml水含有1.5g柠檬酸和6.6g磷酸氢二钠、1.0g过氧化脲,b液为0.8%m/v的3,3,5,5-四甲基联苯胺的柠檬酸-磷酸二氢钠的缓冲溶液;所述终止液为2mol/l的硫酸溶液;所述提取剂为乙腈;所述纯化剂为正己烷;以及所述样品稀释液为0.01m pbs溶液。
[0054]
作为本发明的一种实施方式,所述质控品点(1)的包被量为1ng/点;所述质控品点(2)的包被量为2ng/点;所述质控品点(3)的包被量为4ng/点;将点样液作为空白对照点样于空白对照点样点(4),将所述金刚烷胺抗原a点样于点(5);所述质控品点(1)、所述质控品点(2)、所述质控品点(3)、所述空白对照点样点(4)分别固定于检测芯片的左上角、左下角、右下角、右上角,所述点(5)点样于所述检测芯片其他位置,与其他任一点的边缘相距≥700μm,而所述点样点(1)至(5)中点与点边缘之间的最短距离也为≥700μm;所述质控品点(1)、所述质控品点(2)、所述质控品点(3)、所述空白对照点样点(4)到检测芯片亚单元上边缘、下边缘的距离≥8mm,到检测芯片亚单元左边缘、右边缘的距离≥5mm;所述金刚烷胺生物芯片试剂盒包括一个或多个金刚烷胺生物芯片亚单元,由底端、上格栅、设置于其间由所述底端、上格栅夹紧的金刚烷胺生物芯片组成独立的检测孔,所述一个检测孔为一个所述金刚烷胺生物芯片亚单元,当所述抗体联检试剂盒包括多个金刚烷胺生物芯片亚单元时,各个所述独立的检测芯片亚单元集成为微阵列芯片。
[0055]
本发明的有益效果:
[0056]
本发明的含所述金刚烷胺抗原、金刚烷胺单克隆抗体的elisa试剂盒、生物芯片试剂盒克服了现有技术检测限低的问题,避免了弱阳性样品漏检、假阴性现象的发生,具有快速、简便、准确的优势,更有利于临床的推广应用。
[0057]
本发明的elisa试剂盒、生物芯片试剂盒均可检测鸡肉、鸡蛋、猪/牛/羊肉等多种靶标,且检测准确性高,特别是生物芯片试剂盒,30分钟内即可完成检测,无需重新建立标准曲线进行复杂计算,可以通过板内内置标曲,直接读取检测结果。
[0058]
本发明公开的金刚烷胺半抗原和抗原可以作为酶联免疫方法的原料,得到高亲和力的抗体,其制备的elisa试剂盒、生物芯片试剂盒的灵敏度均可达到0.2ng/ml。
[0059]
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0060]
本发明实施例中所用到的化学试剂均为分析纯,购自国药集团。
[0061]
pbs是磷酸盐缓冲液,其配置方法如下:称取8.0g nacl、0.2g kcl、1.44g na2hpo4、0.24g kh2po4溶于800ml蒸馏水中,用hcl调节溶液至7.4,最后加蒸馏水定容至1l即可得0.01m pbs缓冲液。
[0062]
本发明所述的实验方法,若无特殊说明,均为常规方法;所述的生物材料,若无特殊说明,均可从商业途径获得。
[0063]
实施例1金刚烷胺半抗原的制备及鉴定
[0064]
1.1半抗原a的制备
[0065]
金刚烷胺半抗原a的合成路线如下:
[0066][0067]
半抗原a的制备方法如下:
[0068]
(1)称取5g 3-氨基金刚烷-1-甲酸(结构式为合成路线中式ⅰ)和4.8g boc酸酐加入单口瓶中,加入0.13g 4-二甲氨基吡啶,用30ml叔丁醇溶解,在70~80℃反应5~8小时;
[0069]
(2)将反应后液体减压旋蒸,除去溶剂叔丁醇,得到大量淡黄色的油状物,即为粗品化合物2(结构式为合成路线中式ⅱ);
[0070]
(3)将粗品化合物2溶解在乙酸乙酯中,使用0.1m硫酸溶液和纯水洗涤两遍后,收集有机相,减压旋蒸,得到较纯的化合物2;
[0071]
(4)将1g较纯的化合物2溶解在10ml 80%的甲醇水溶液中,加入0.65g edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和0.5g nhs(n-羟基丁二酰亚胺),20~25℃反应1小时,得到中间体化合物3(结构式为合成路线中式iii);将1.8gβ-丙氨酸的水溶液(50%)缓慢滴加至反应液中,继续在20~25℃反应过夜;
[0072]
(5)将反应后溶液减压旋蒸除去甲醇和水,再重新加入30ml水和30ml乙酸乙酯,搅拌30分钟后分层,收集有机相,旋蒸后得到粗品化合物4(结构式为合成路线中式ⅳ),并将粗品化合物4过柱纯化,得到其纯品0.5g;
[0073]
(6)将0.5g粗品化合物4溶解在1ml甲醇中,加入0.5ml浓盐酸,在20~25℃搅拌3~5小时,用0.5m氢氧化钠溶液调节ph至6,然后减压旋蒸除去溶剂甲醇和水后,得到0.6g粗品化合物5(结构式为合成路线中式
ⅴ
);
[0074]
(7)将粗品化合物5重新用甲醇溶解后,过滤除去无机盐,滤液减压旋蒸后得到较为纯净的化合物5,使用柱硅胶继续分离纯化,可得到纯品金刚烷胺半抗原a(结构式为合成路线中式
ⅴ
)。
[0075]
1.2半抗原b的制备方法
[0076]
金刚烷胺半抗原b的合成路线如下:
[0077][0078]
半抗原b的制备方法步骤如下:
[0079]
1)将2g金刚烷胺(结构式为合成路线中式ⅵ)与1.96g乙醛酸溶解在20ml二氯甲烷中,在室温搅拌24小时;
[0080]
2)将反应后液体减压旋蒸,除去二氯甲烷后,得到大量白色固体化合物,加入20ml 2m盐酸溶解后,在100℃回流5~8小时后,减压旋蒸除去水,即得到1.6g纯品半抗原b(结构式为合成路线中式ⅶ)。
[0081]
1.3半抗原a、b的鉴定
[0082]
半抗原a的分子量为266.3,从图1可以看出,半抗原a在esi源质谱仪(赛默飞)中负离子模式出现了分子量[m-h
+
]=265.27,与理论的分子量266.3相吻合,从而确定为半抗原a;
[0083]
半抗原b的分子量为209.29,从图2可以看出,半抗原b在esi源质谱仪中负离子模式出现了分子量[m-h
+
]=208.4,与理论的分子量209.29相吻合,从而确定为半抗原b。
[0084]
通过上述方法,将连接臂连接在金刚烷胺的不同位置,进而制备出不同结构的金刚烷胺半抗原a、半抗原b,为后期比较不同半抗原制备的抗原免疫效果提供原材料。
[0085]
实施例2金刚烷胺抗原的制备方法及鉴定
[0086]
2.1免疫原的制备方法及鉴定
[0087]
2.2.1免疫原的制备方法
[0088]
称取实施例1制备的金刚烷胺半抗原a或者半抗原b 4mg溶解在1ml dmf中,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)2.9mg和1.8mg n-羟基琥珀酰亚胺(nhs),25℃反应1~2小时,形成溶液1;称取20mg bsa溶解在1ml 0.01m nahco3缓冲液中,形成溶液2;将溶液1缓慢滴加入溶液2中,4℃搅拌过夜;将反应液用0.01mpbs溶液在4℃透析3天,每天更换两次透析液;将透析液离心后,取出上清液,即为金刚烷胺的免疫原,无菌过滤后-20℃保存。
[0089]
2.2.2免疫原的鉴定
[0090]
用蛋白定量试剂盒如bca试剂盒(碧云天生物技术有限公司)检测蛋白浓度,免疫原a的蛋白浓度为8.5mg/ml,免疫原b的蛋白浓度为8.9mg/ml;
[0091]
载体蛋白bsa、制备的免疫原a、免疫原b经maldi-tof-ms鉴定(见图3、4、5),免疫原a和b的相对分子质量均比载体蛋白bsa的质量有所增加,表明抗原偶联成功,半抗原a与载体蛋白的偶联比为10∶1~14∶1,半抗原b与载体蛋白的偶联比为11∶1~14∶1。
[0092]
2.2包被原的制备方法及鉴定
[0093]
2.2.1包被原的制备方法
[0094]
称取金刚烷胺半抗原a或者半抗原b 4mg溶解在1ml dmf中,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)2.9mg和1.8mg n-羟基琥珀酰亚胺(nhs),25℃反应1~2小时,形成溶液1;称取13.5mg ova(卵清白蛋白)溶解在1ml 0.01m nahco3缓冲液中,形成溶液2;将溶液1缓慢滴加入溶液2中,4℃搅拌过夜;将反应液使用0.01m pbs溶液在4℃透析3天,每天更换两次透析液;将透析液离心后,取出上清液,即为金刚烷胺的包被原,无菌过滤后-20℃保存。
[0095]
2.2.2包被原的鉴定
[0096]
用蛋白定量试剂盒如bca试剂盒(碧云天生物技术有限公司)检测蛋白浓度,包被原a的蛋白浓度为5.3mg/ml,包被原b的蛋白浓度为4.8mg/ml。
[0097]
实施例3金刚烷胺单克隆抗体的制备及鉴定
[0098]
3.1动物免疫
[0099]
实验选用6~8周龄健康的雌性balb/c小鼠,每组6只小鼠,免疫程序为:首免用1
×
pbs稀释免疫原后与弗氏完全佐剂等体积混合乳化,在小鼠颈背部皮下多点注射,以50μg/只剂量免疫小鼠;首免后间隔2~3周加强免疫,用1
×
pbs稀释免疫原后与弗氏不完全佐剂等体积混合乳化,在小鼠颈背部皮下多点注射,以50μg/只剂量免疫小鼠。第3次免疫一周后,采血,用间接elisa和间接竞争elisa分别监测血清的效价及抑制变化,详情见实施例3.2。第5次免疫后一周,采用生理盐水稀释的免疫原,以50μg/只剂量在小鼠腹部冲击免疫,3天后进行细胞融合。
[0100]
3.2免疫血清效价及抑制性评价
[0101]
每只小鼠脸颊采血50μl,分离收集血清后稀释1000倍后再进行3倍倍比稀释,再按间接elisa、间接竞争elisa即icelisa的方法进行评价。
[0102]
间接elisa:
[0103]
步骤1)按50μl/孔加入pbs,再加入倍比稀释后的血清样品50μl;
[0104]
步骤2)孵育,37℃孵育60分钟;
[0105]
步骤3)洗涤,弃去孔内液体,将每孔加入250μl 1
×
洗涤液(将1l0.01m pbs溶液中,加入1ml吐温-20,混匀后即为洗涤液),重复洗涤4~5次,拍干;
[0106]
步骤4)按100μl/孔加入酶标工作液(用酶标稀释液按1∶5000~1∶8000v/v稀释hrp-羊抗鼠igg。其中酶标稀释液配制方法为:取氯化钠8g、磷酸氢二钠2.9g、磷酸二氢钾0.24g、氯化钾0.2g、纯化水600ml、新生牛血清200ml、proclin300 1ml,完全溶解后用纯水定容至1l,混匀后即为酶标抗体稀释液);
[0107]
步骤5)孵育,37℃孵育30分钟;
[0108]
步骤6)洗涤,弃去孔内液体,将每孔加入250μl 1
×
洗涤液,重复洗涤4~5次,拍干;
[0109]
步骤7)显色,加入100μl tmb显色液(a液与b液以1∶1v/v混匀),室温反应15分钟;
[0110]
步骤8)终止,每孔加入50μl终止液,轻微振荡混匀;
[0111]
步骤9)读od值,用酶标仪在450nm或者450/630nm波长读取每孔的吸光值b0。
[0112]
把b0≥0.15作为血清效价成立的判断标准。
[0113]
间接竞争elisa(ic-elisa):
[0114]
步骤1)按50μl/孔加入30ppb浓度的金刚烷胺标品溶液,再加入倍比稀释后的血清样品50μl;
[0115]
步骤2)孵育,37℃孵育60分钟;
[0116]
步骤3)洗涤,弃去孔内液体,将每孔加入250μl 1
×
洗涤液(将1l0.01m pbs溶液中,加入1ml吐温-20,混匀后即为洗涤液),重复洗涤4~5次,拍干;
[0117]
步骤4)按100μl/孔加入酶标工作液(用酶标稀释液按1∶5000~1∶8000v/v稀释hrp-羊抗鼠igg。其中酶标稀释液配制方法为:取氯化钠8g、磷酸氢二钠2.9g、磷酸二氢钾0.24g、氯化钾0.2g、纯化水600ml、新生牛血清200ml、proclin300 1ml,完全溶解后用纯水定容至1l,混匀后即为酶标抗体稀释液);
[0118]
步骤5)孵育,37℃孵育30分钟;
[0119]
步骤6)洗涤,弃去孔内液体,将每孔加入250μl 1
×
洗涤液,重复洗涤4~5次,拍干;
[0120]
步骤7)显色,加入100μl tmb显色液(a液与b液以1∶1v/v混匀),室温反应15分钟;
[0121]
步骤8)终止,每孔加入50μl终止液,轻微振荡混匀;
[0122]
步骤9)读od值,用酶标仪在450nm或者450/630nm波长读取每孔的吸光值b。
[0123]
血清效价的判断以及抑制性检测,有利于实时监测小鼠的真实免疫情况,效价越高,说明免疫原免疫效果越好;抑制性越强,证明小分子化合物(金刚烷胺)与抗体的反应越好,这样制备出高灵敏抗体的可能性更大。
[0124]
第四次加强免疫的小鼠血清的部分检测结果(见表1):间接elisa方法检测免疫原a的免疫小鼠的血清效价最高为1:27000,免疫原b的免疫小鼠的血清效价最高为1:27000;间接竞争elisa方法(ic-elisa)检测免疫原a的抑制率远高于免疫原b(抑制率=1-ic-elisa/elisa)。
[0125]
表1小鼠血清效价及抑制性评价
[0126][0127]
综上所述:免疫原a与免疫原b的效价基本一致,但金刚烷胺对免疫原a的小鼠血清和抗原的阻断作用更明显,表明金刚烷胺半抗原a制备的免疫原a更适合用于免疫动物,后续用半抗原a经实施例2.2制备的包被原a、经实施例2.1制备的免疫原a进行试验。
[0128]
3.3单克隆抗体的筛选
[0129]
挑选效价高且抑制性最好的小鼠,取小鼠脾脏细胞与处于对数生长期的骨髓瘤细胞按照1∶5~1∶10的比例进行混合后,在1分钟内使用37℃预热的融合剂(peg1500)进行细胞融合。用ic-elisa方法进行杂交瘤细胞的筛选,经多次筛选及亚克隆后,获得三株评价结
果较好的杂交瘤细胞株1h4、3g7、5b1,分别制备腹水,经过protein g层析柱纯化后得到三种纯的抗体,用ic-elisa对3株单克隆抗体进行鉴定。
[0130]
3.4单克隆抗体的制备及鉴定
[0131]
3.4.1纯度及蛋白含量测定
[0132]
用sds-page凝胶电泳对纯化后的单克隆抗体1h4、3g7、5b1进行鉴定,结果:3株单克隆抗体的纯度均不低于85%。
[0133]
用bca蛋白定量试剂盒定量纯化后单克隆抗体的含量,结果:单克隆抗体1h4、3g7、5b1的蛋白含量分别为2.5mg/ml、1.8mg/ml、2.2mg/ml。
[0134]
3.4.2ic
50
检测
[0135]
用实施例3.2所述间接竞争elisa方法检测单克隆抗体1h4、3g7、5b1的ic
50
,结果(见表2):杂交瘤细胞株3g7分泌的单克隆抗体的ic50最低,说明小分子化合物对抗原/抗体反应的抑制率最高,作为试剂盒原料时,检测的灵敏度最好;因此把3g7细胞株分泌的抗体作为制备试剂盒的原料,测定3g7细胞株分泌的单克隆抗体对ama的半抑制浓度为1.2ng/ml,灵敏度为0.2ng/ml。
[0136]
表2半抑制浓度(ic
50
)测定
[0137][0138]
3.4.3特异性鉴定
[0139]
用实施例3.2所述间接elisa方法鉴定单克隆抗体3g7与金刚烷胺类药物的特异性,结果(见表3):单克隆抗体3g7与金刚烷胺的交叉反应率为100%,与金刚乙胺的交叉反应率≤7%,而与其他同类药物如乙酰氨基酚、利巴韦林、氧氟沙星/氯霉素、四环素、喹乙醇代谢物等抗生素均无交叉反应,表明特异性良好。
[0140]
表3金刚烷胺单克隆抗体的特异性测定
[0141][0142]
综上所述,杂交瘤细胞株3g7所分泌的单克隆抗体不仅灵敏度高于其他两株细胞的单克隆抗体,且特异性良好,优先作为试剂盒的原料使用。
[0143]
3.4.4单克隆抗体类型及亚型的鉴定
[0144]
用单克隆抗体亚型鉴定试剂盒,对单克隆抗体3g7进行类型及亚型的鉴定,结果:单克隆抗体3g7亚型为igg1,轻链为κ链。
[0145]
3.4.5单克隆抗体的亲和力鉴定
[0146]
使用ic-elisa法测定单克隆抗体的亲和力,操作步骤如下:
[0147]
步骤1)按0.1μg/ml的经实施例2.2制备的包被原a浓度包被抗原板,然后用1%的ova于37℃封闭2h,pbs洗涤。
[0148]
步骤2)在微孔板中,利用有限稀释法建立从0.1nmol/l~1μmol/l浓度梯度的抗原pbs溶液,加入抗体溶液(浓度≤0.5μmol/l)使总体积为100μl。
[0149]
步骤3)室温孵育30min后,加90μl反应混合物到前述已包被抗原的微孔中,微孔中预先加入pbs 10μl后孵育8分钟,但时间不宜超过10min(时间不宜过长,过长会导致混合物中反应平衡体系被破坏,最终实验数据不准确)。充分洗涤抗原板。
[0150]
步骤4)加入酶标二抗,孵育1h,pbs洗涤。
[0151]
步骤5)加入显色底物显色,显色30min后加入终止液停止反应,进行od值读数,。
[0152]
将测得的od值记录,结合梯度稀释的抗原浓度绘制拟合曲线,最终找到最强信号一半的点,对应的抗原浓度的倒数即亲和力常数ka;平行测样三次,结果分别为1.52
×
109l/mol、1.46
×
109l/mol、1.58
×
109l/mol,其结果取平均值,其亲和力为1.52
×
109l/mol。
[0153]
3.4.6单克隆抗体可变区序列测定
[0154]
根据鼠源单克隆抗体的序列特征,设计重链可变区引物序列:
[0155]
p1:5
’‑
actagttgacgtggtctctagggtcactttagttttcct-3’[0156]
p2:5
’‑
cggaagcttccagcgrccarkccatatacigrtgg-3’[0157]
设计轻链可变区引物序列:
[0158]
p3:5
’‑
gccatctcatgragwcattkwcycaagtcttt-3’[0159]
p4:5
’‑
cggacgcttactgcctggtaagaagatgga-3’[0160]
收集杂交瘤细胞3g7,提取rna后反转录作为模板,用上述引物对可变区序列进行扩增,将扩增后的产物经琼脂糖凝胶电泳纯化鉴定后送苏州金维智生物科技有限公司进行测序。结果:单克隆抗体3g7的重链可变区的基因序列如seq id no.1所示,轻链可变区的基因序列如seq id no.2所示。
[0161]
实施例4金刚烷胺elisa检测试剂盒的制备及检测方法的建立
[0162]
4.1金刚烷胺elisa检测试剂盒的制备
[0163]
洗涤液:将1l 0.01m pbs溶液中,加入1ml吐温-20,混匀后即为洗涤液。
[0164]
包被板:将经实施例2.2制备的包被原a用0.05m cbs缓冲液稀释至0.10~0.25μg/ml,每孔100μl,4℃包被过夜或37℃包被1~3小时;经0.01m pbst洗涤液洗涤,每孔250μl,洗4次后加入1%ova溶液37℃封闭2小时,再用250μl/孔0.01m pbst洗涤液洗涤4次后拍干,在25℃干燥6~8小时,再经铝箔袋真空包装。
[0165]
酶标工作液:用酶标稀释液按1∶5000~1∶8000v/v稀释hrp-羊抗鼠igg。其中酶标稀释液配制方法为:取氯化钠8g、磷酸氢二钠2.9g、磷酸二氢钾0.24g、氯化钾0.2g、纯化水600ml、新生牛血清200ml、proclin300 1ml,完全溶解后用纯水定容至1l,混匀后即为酶标抗体稀释液。
[0166]
金刚烷胺抗体工作液:将实施例3纯化后的金刚烷胺单克隆抗体3g7用抗体稀释液稀释至0.04μg/ml。其中抗体稀释液配制方法为:取氯化钠8g、磷酸氢二钠2.9g、磷酸二氢钾0.24g、氯化钾0.2g、纯化水600ml、10g牛血清白蛋白、proclin300 1ml,完全溶解后用纯水定容至1l,混匀后即为抗体稀释液。
[0167]
金刚烷胺标准品溶液:将金刚烷胺标准品用0.01m pbs稀释液梯度稀释为0、0.2ng/ml、0.6ng/ml、1.8ng/ml、5.4ng/ml、16.2ng/ml。
[0168]
tmb显色液:包括a液和b液,其中a液为ph值为5的柠檬酸-磷酸二氢钠的缓溶液(1.5g柠檬酸和6.6g磷酸氢二钠溶于100ml纯水,再加入1.0g过氧化脲),b液为0.8%m/v的3,3,5,5-四甲基联苯胺的柠檬酸-磷酸二氢钠的缓溶液。
[0169]
终止液:2mol/l的硫酸溶液。
[0170]
提取剂:乙腈(分析纯)。
[0171]
纯化剂:正己烷(分析纯)。
[0172]
样品稀释液:0.01m pbs溶液。
[0173]
将以上组分组装成试剂盒,即为金刚烷胺elisa检测试剂盒,简称试剂盒1。
[0174]
4.2金刚烷胺elisa检测试剂盒检测方法的建立
[0175]
检测前先对样品进行前处理,前处理方法为:
[0176]
将3.0
±
0.03g样品(如鸡肉、鱼肉、鸡肝、鸡蛋、猪肉、牛肉、羊肉等)均质后加入50ml离心管中,加入9ml提取剂,立即混匀将样品摇散,涡动5分钟后于4000转/分钟离心5分钟;取4ml上清液至干净的离心管中,在50℃~60℃氮气吹干后,加入2ml纯化剂涡动1分钟混匀;加入660μl样品稀释液,涡动1分钟后4000转/分钟离心5分钟;弃上清液及中间层杂质,留下层澄清液于试管中,即可获得处理后的样品。
[0177]
elisa检测试剂盒:金刚烷胺elisa检测试剂盒的检测方法包括:
[0178]
步骤1)回温,将包被板放至室温25℃回温1小时-2小时;
[0179]
步骤2)加样,将处理后的样品或各标准品溶液按50μl/孔加入每孔中,再加入酶标工作液25μl,加入抗体工作液25μl;
[0180]
步骤3)孵育,室温孵育25分钟;
[0181]
步骤4)洗涤,弃去孔内液体,将每孔加入250μl 1
×
洗涤液,重复洗涤4~5次,拍干;
[0182]
步骤5)显色,加入100μl tmb显色液(a液与b液以1∶1v/v混匀),室温反应15分钟;
[0183]
步骤6)终止,每孔加入50μl终止液,轻微振荡混匀;
[0184]
步骤7)读od值,用酶标仪在450nm或者450/630nm波长读取每孔的吸光值b。
[0185]
用各标准品浓度的吸光值b除以0标准品浓度的吸光值b0,乘以100%,得到相对吸光度b/b0,以金刚烷胺标准品的浓度(ng/ml)的对数值为横坐标,以b/b0为纵坐标,绘制标准曲线,如图6所示;再根据各样品孔计算b/b0%,可以从标准曲线计算出样品中的金刚烷胺的残留浓度,再乘以样品的稀释倍数0.66,即可得到样品的实际金刚烷胺残留浓度。
[0186]
4.3elisa检测试剂盒
[0187]
金刚烷胺elisa检测试剂盒中包被原(实施例2.2制备的包被原a)包被浓度的优化
[0188]
将金刚烷胺包被原a配置6个梯度量:0.01μg/ml、0.05μg/ml、0.10μg/ml、0.15μg/ml、0.20μg/ml、0.25μg/ml,按照实施例4.1的包被条件制备酶标板,抗体浓度的选择为0.01μg/ml、0.02μg/ml、0.04μg/ml和0.06μg/ml,按照实施例4.2进行检测不同抗原/抗体浓度下的吸光值b0,以od值范围在1.5~2.0之间为最佳包被原浓度,测定吸光度b,确认金刚烷胺包被原a的优选包被浓度为0.10μg/ml~0.20μg/ml,具体数据如表4所示:
[0189]
表4金刚烷胺包被原a包被浓度优化
[0190][0191]
实施例5金刚烷胺生物芯片检测试剂盒的制备及检测方法的建立
[0192]
5.1金刚烷胺生物芯片检测试剂盒的制备
[0193]
点样液的配制:
[0194]
5%甘油溶液的配制:精密称定5.00g甘油置100ml容量瓶中,加少量纯化水轻轻旋转使其溶解充分,避免产生过多气泡,再加纯化水置刻度线,上下翻转振摇10次,备用;
[0195]
5%山梨醇溶液的配制:精密称定5.00g山梨醇置250ml烧杯中,加适量纯化水并搅拌使其完全溶解,再完全转移至100ml容量瓶中,加纯化水置刻度线,上下翻转振摇10次,备用;
[0196]
0.05%曲拉通溶液的配制:用移液枪量取50μl曲拉通置100ml容量瓶中,加适量纯化水使其完全溶解,再加纯化水置刻度线,上下翻转振摇10次,备用;
[0197]
dmso溶液:直接采用dmso试剂即可;
[0198]
pbs(ph6.8)溶液配制:先配置0.2mol/l的磷酸氢二钠溶液和0.3mol/l的磷酸二氢钠溶液,再将两者按照49:51的体积比进行混合,得到ph值为6.8的磷酸盐缓冲液;
[0199]
将上述溶液按照10∶15∶0.1∶50∶100的体积比混合均匀,作为点样液。
[0200]
金刚烷胺芯片:用点样液将实施例2制备的金刚烷胺包被原a稀释到0.03mg/ml~0.04mg/ml,作为检测点金刚烷胺点样液;用点样液将鼠igg分别稀释至50μg/ml、100μg/ml、200μg/ml,作为质控点点样液,分别点样于图7中点1、2、3,设定3个浓度,是便于根据调试结果选择对应的质控点进行数据统计分析;将点样液作为空白对照点点样液点样于点4。开启点样仪,设定程序和点样参数,20nl/点,将检测点金刚烷胺点样液点样于点5、质控点点样液点样于图7中的1、2、3,空白对照点点样液点样于图7中的4点(本发明以3
×
3矩阵为例进行阐述)。将已点样的膜取出置芯片底板中部,加上盖板压紧,两边卡上固定边条,组装成金刚烷胺芯片,封装,2~8℃保存。
[0201]
其中,鼠igg的包被量为1~4ng/点;所述质控品点共三个点(对应图7中的1、2、3),质控品点1的包被量为大于等于1ng/点而小于2ng/点;质控品点2的包被量为2ng/点;质控品点3的包被量为大于2ng/点而小于等于4ng/点。
[0202]
上述各点中,除点1、2、3、4分别固定于检测芯片的左上角、左下角、右下角、右上角外,点5可以分别点样于检测芯片其他任意位置,只需与其他点的边缘相距≥700μm,而任意点与点之间的最短距离也为≥700μm。质控品点1、质控品点2、质控品点3、空白对照点样点4到检测芯片亚单元上边缘、下边缘的距离≥8mm,到检测芯片亚单元左边缘、右边缘的距离≥5mm。
[0203]
金刚烷胺生物芯片检测试剂盒包括一个或多个金刚烷胺芯片亚单元,由底端、上格栅、设置于其间由所述底端、上格栅夹紧的检测芯片组成独立的检测孔,所述一个检测孔对应于一个所述检测芯片亚单元,当所述抗体联检试剂盒包括多个金刚烷胺芯片亚单元时,各个所述独立的检测芯片亚单元集成为微阵列芯片。图7显示了具有不同数量金刚烷胺芯片亚单元的试剂盒,图7中o、p、q分别为具有一个、三个、多个抗体检测芯片亚单元的试剂盒,其局部放大图显示了一个金刚烷胺芯片亚单元中检测芯片上的点样点。
[0204]
酶标工作液:用酶标稀释液按1∶200~1∶2000v/v稀释hrp-羊抗鼠igg。
[0205]
抗体工作液:将金刚烷胺抗体稀释至0.06μg/ml。
[0206]
tmb底物液:tmb(3,3
′
,5,5
′‑
四甲联苯胺)溶液,商品化产品,无菌分装。
[0207]
洗涤液:将1l 0.01m pbs溶液中加入1ml吐温-20,混匀后即为洗涤液。
[0208]
提取剂:乙腈(分析纯)。
[0209]
纯化剂:正己烷(分析纯)。
[0210]
样品稀释液:0.01m pbs溶液。
[0211]
其中金刚烷胺生物芯片的制备在点样时,会同时在每孔点4个质控点(1个点样液质控点,3个鼠igg质控点)。
[0212]
将以上各组分连同无尘纸组装,即为金刚烷胺生物芯片检测试剂盒,简称试剂盒2。
[0213]
5.2金刚烷胺生物芯片检测试剂盒检测方法的建立
[0214]
检测前先对样品进行前处理,前处理方法按照实施例4.2进行。
[0215]
金刚烷胺生物芯片检测试剂盒的检测方法包括:
[0216]
步骤(1)平衡,将试剂盒各组分置室温平衡30分钟;
[0217]
步骤(2)浸润,每孔加入250μl洗涤液(每孔约4~5滴),静置浸润3分钟,甩掉并拍干孔内液体;
[0218]
步骤(3)加样,将50μl样品或标准品溶液加入芯片的微孔中,加入酶标二抗25μl,加入抗体工作液25μl;
[0219]
步骤(4)孵育:在微孔板内恒温振荡器中30℃1000转/分钟,振荡孵育15分钟;
[0220]
步骤(5)洗涤,弃去孔内液体,每孔加入250μl洗涤液(每孔约4~5滴,勿溢出),浸洗4次,每次浸泡约10秒,在吸水纸上拍干;
[0221]
步骤(6)显色,加入100μl tmb底物液,在微孔板恒温振荡器中30℃1000转/分钟,振荡显色10分钟;
[0222]
步骤(7)读数,甩掉液体,打开芯片夹具,用无尘纸适度按压芯片,吸干芯片膜面的液体,用微孔盘芯片影像仪检测,需在5分钟内读完数据,查看检测结果。
[0223]
试剂盒2为后台网站内置标曲(其中标曲如图8),无需重新建立标准曲线,可以直接由微孔盘芯片影像仪读取检测结果。
[0224]
5.3试剂盒2中金刚烷胺芯片包被浓度的优化
[0225]
将金刚烷胺抗原配制8个浓度分别为5μg/ml、10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、100μg/ml、200μg/ml进行点样,点样体积为20nl,在芯片上分别加入不同的单抗梯度浓度(0.01μg/ml、0.02μg/ml、0.04μg/ml、0.08μg/ml)按照实施例5.2步骤进行反应。
[0226]
根据灰度值(灰度值代表抗原点反应后的颜色深浅,可以由未联网的微孔盘影像仪通过识读软件直接读取)的大小来确定抗原的最佳浓度,灰度值为15000~18000时的抗原浓度为金刚烷胺试剂盒的优选抗原浓度。结果(见表5),金刚烷胺抗原包被浓度优选为30~50μg/ml(即0.6~1ng/点)。
[0227]
表5金刚烷胺抗原包被浓度优化
[0228][0229]
实施例6试剂盒1、试剂盒2的评价
[0230]
6.1灵敏度测定
[0231]
按照试剂盒1、试剂盒2各自的检测方法,将金刚烷胺标准品梯度稀释为0ng/ml、0.2ng/ml、0.6ng/ml、1.8ng/ml、5.4ng/ml、16.2ng/ml等6个浓度,建立标准曲线,以此来确定试剂盒灵敏度和半抑制浓度。
[0232]
结果:试剂盒1的ic
50
为0.9~1.2ng/ml,灵敏度为0.2ng/ml,相当于0.2ppb;试剂盒2的ic
50
为0.7~1.0ng/ml,灵敏度为0.2ng/ml,相当于0.2ppb。也就是说试剂盒1、2的灵敏度高于国标检测方法的检测限1.0ng/ml。
[0233]
同时,对20份同一基质的样品进行不同浓度的金刚烷胺添标回收率测定,从标曲中计算出样品的实际残留浓度,再根据20份样品的浓度平均值和3倍标准差来确认试剂盒的检测限,数据结果表明:试剂盒1和试剂盒2的灵敏度均为0.2ng/ml,均高于国标检测方法的检测限1.0ng/ml(国标检测方法gb31660.5-2019)。
[0234]
6.2特异性检测
[0235]
按照试剂盒1和试剂盒2各自的检测方法,用pbs分别将不同药物标准品溶液进行
梯度稀释,绘制标准曲线,计算出不同药物的ic
50
和交叉反应率。与其他药物的交叉反应率越小,说明金刚烷胺试剂盒对检测金刚烷胺的特异性越好,检测结果如下表所示:
[0236]
表6金刚烷胺单克隆抗体的特异性检测
[0237][0238]
6.3准确性测定
[0239]
分别向阴性样本如鸡肉中加入不同的金刚烷胺标准品浓度,使得样品的最终残留浓度为0.5μg/kg,1.0μg/kg,2.0μg/kg,使用试剂盒的前处理方法得到不同添加浓度的样品溶液;分别从两种试剂盒的三个批次中各抽取三个试剂盒,计算出不同批次之间和同批次不同试剂盒之间的变异系数,每个实验重复3次。结果如下表所示:试剂盒1和试剂盒2的不同浓度添标回收率均在100%
±
20%范围内,批内变异系数小于7%,批间变异系数小于11%,试剂盒检测值准确性良好。
[0240]
表7试剂盒1
[0241][0242]
表8试剂盒2
[0243][0244]
6.4稳定性测定
[0245]
分别将酶联免疫试剂盒和生物芯片检测试剂盒储存在2~8℃,经过15个月的不断监测,两种试剂盒的ic
50
、最大s/n值和金刚烷胺的添加浓度变化均在正常范围内。考虑到实际运输和储存中可能发生的意外情况,分别将试剂盒在37℃9天做热稳定性实验和-20℃冷冻9天实验,实验结果表明,试剂盒各项指标正常。以上数据表明,该试剂盒稳定性良好,可
以在4~8℃储存至少一年。
[0246]
6.5临床样品检测
[0247]
从全国不同地区(内蒙、哈尔滨、沈阳、河北、洛阳、驻马店、成都、广州、厦门、杭州、南京、广西等地)和不同超市购买不同基质的样品各3份(鸡肉、鸭肉、鹅肉、鸡/鸭/鹅肝、牛肉、羊肉、猪肉、鸡蛋等),按照国标方法gb31660.5-2019对样品进行检测,确认为阴性样本后,使用试剂盒1和试剂盒2进行加标回收率检测,大量数据表明:试剂盒1和试剂盒2对不同基质样品的加标回收率均在正常范围内(100%
±
20%),可以用于多种靶标的检测。
[0248]
同时,从市场上购买2个品牌的金刚烷胺检测试剂盒(按照试剂盒说明书进行操作测定),确认不同厂家试剂盒的ic
50
、灵敏度和检测限以及不同样品添加浓度的检测值重复性(阴性样本为鸡肉、鸭肉),数据如下;
[0249]
表9不同试剂盒灵敏度、ic
50
测定
[0250][0251]
表10不同试剂盒三孔cv值检测
[0252][0253]
从以上数据可以看出,试剂盒1和试剂盒2在灵敏度和重复性方面,均优于其他两种品牌的检测试剂盒。
[0254]
实施例7基因工程抗体的制备及应用
[0255]
将实施例3中的单克隆抗体3g7的重链可变区、轻链可变区基因序列分别进行扩增,将重链可变区基因、轻链可变区基因通过连接肽链接,分别构建重组质粒3g7-scfv,将scfv基因插入到pcdna-3.1载体中,构建了pcdna-3g7-scfv真核表达系统,转染mdck细胞进行表达。
[0256]
按照实施例3所述ic-elisa方法对表达后的单链抗体3g7进行ic-elisa测定(金刚烷胺添标浓度为1ppb),结果见表11:小分子化合物对抗原/抗体反应抑制率正常,这表明单链抗体3g7与金刚烷胺小分子及其抗原均具有良好的反应特性。
[0257]
表11单链抗体3g7的ic-elisa测定
[0258]
抗原包被浓度elisaic-elisa抑制率0.1μg/ml1.60.850.0%0.2μg/ml2.21.341.0%0.3μg/ml2.92.224.2%
[0259]
以上结果显示seq.id no.1、seq.id no.2可用于金刚烷胺工程抗体的制备。
[0260]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1