一种海蒿子岩藻聚糖及其制备方法和应用
1.本发明涉及天然高分子技术领域,具体涉及一种具有抗h1n1流感病毒活性的海蒿子岩藻聚糖及其制备方法和应用。
背景技术:
2.海蒿子(sargassum pallidum)是一种褐藻,属于马尾藻属,广泛分布于中国黄海和东海,一直被用作中草药,据报道其生物活性和硫酸化程度、分子量、单糖组成和主聚合物链的结构密切相关。《中药大辞典》记载,海蒿子性苦、咸、寒、入肺、脾、肾经,具有软坚、消痰、利水、泻热之功效,可用于治疗瘰疠、瘿瘤、积聚、水肿、脚气和睾丸肿痛等病症。岩藻聚糖是一类具有高度异质性的硫酸化多糖,是海蒿子多糖中的重要组成成分,研究发现其具有多种生物活性,例如抗凝剂和抗血栓形成、抗肿瘤、抗病毒和抗氧化活性。
3.流感一直是一个重大的公共卫生问题,在2009年4月下旬,一种新出现的毒株(h1n1亚型)在短时间内导致全球大流行,然而目前用于临床的几种神经氨酸酶(na)抑制剂已发现菌株对其显示出耐药性,如在2008
‑
2009年流感季节结束时,全世界多达98%的h1n1亚型分离株表现出对奥司他韦的耐药性,在某些可能需要延长化疗时间以控制持续病毒复制的病例中也观察到对na抑制剂耐药株。为了克服na抑制剂治疗流感的缺点,开发可单独使用或与现有抗病毒药物联合使用的新型抗病毒药物具有重要意义。
4.现有技术中,已发现来自海藻的硫酸化多糖对不同病毒显示出明显的抑制作用,并被普遍评价为抗病毒物质。例如,专利申请cn202010197957.5公开了一种具有抗氧化和调节肠道菌群功效的海蒿子多糖的制备方法,运用超声辐射联合双氧水氧化协同降解得到平均分子量为130
–
510kda的海蒿子多糖,可显著提高人体肠道中有益菌属的丰度,同时降低有害菌属的丰度,其肠道微生物利用率提高约7%;专利申请cn201910268836.2公开了一种海蒿子多糖硒的制备方法与应用,通过硒化反应制备海蒿子多糖硒,该多糖具有显著的α
‑
葡萄糖苷酶抑制活性,能显著提高细胞抗氧化酶活性和降低丙二醛的含量。但是,有关海蒿子中岩藻聚糖及其降解多糖的提取纯化和抗h1n1流感病毒的研究未见报道。
5.因此,需要提供一种针对上述现有技术不足的改进技术方案。
技术实现要素:
6.本发明的主要目的是提供一种海蒿子岩藻聚糖,具有抗h1n1流感病毒活性。
7.本发明的第二目的是提供上述海蒿子岩藻聚糖的制备方法,通过热水提取并用cacl2除去其中褐藻酸,离子层析和凝胶层析纯化得到海蒿子岩藻聚糖sf0,并采用逐步部分酸水解对其进行降解改变多糖的分子量。
8.本发明的第三目的是提供上述海蒿子岩藻聚糖在制备抗h1n1流感病毒药物中的应用。
9.为实现上述目的,本发明采用以下技术方案:
10.本发明提供的海蒿子岩藻聚糖,具有抗h1n1流感病毒活性,其中岩藻聚糖硫酸根
含量为9%
–
13%,相对分子质量为9
–
15kda。
11.作为本发明的优选方案,所述海蒿子岩藻聚糖按照摩尔百分比计包括45%
–
55%的甘露糖、40%
–
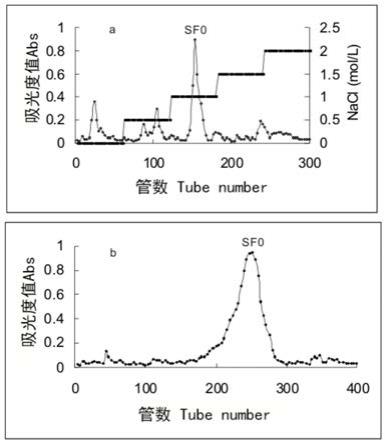
50%葡萄糖醛酸和0.1%
–
5%半乳糖。
12.作为本发明的优选方案,所述海蒿子岩藻聚糖按照摩尔百分比计由50.1%的甘露糖、44.9%葡萄糖醛酸和4.0%半乳糖组成。
13.本发明提供上述海蒿子岩藻聚糖的制备方法,包括以下步骤:
14.(1)脱脂:海蒿子粉用95%乙醇在75
–
90℃下回流3
–
5h,重复2
–
3次,去除脂质并将残留物干燥;
15.(2)热水提取:经脱脂处理的干粉按料液质量体积比为1:10
–
50用70
–
90℃热水提取2
–
3h,重复2
–
3次,离心,收集所有上清液,浓缩;
16.(3)cacl2除褐藻酸:3mol/l cacl
2 4℃沉降8
–
12h,重复1
–
2次,离心,将上清液透析、浓缩和冻干,得到粗海蒿子岩藻聚糖;
17.(4)纯化:粗海蒿子岩藻聚糖在q
‑
sepharose fast flow柱上层析,用去离子水和nacl溶液(0.5、1、1.5、2mol/l)以3ml/min梯度洗脱,每管接6ml,每种流动相接60管,收集1.5mol/l nacl洗脱得到的主多糖,用sepharose 4b fast flow柱纯化,得到海蒿子岩藻聚糖,被命名为sf0;
18.(5)逐步部分酸水解:将海蒿子岩藻聚糖sf0在50
–
70℃下用0.05
–
0.15mol/l tfa处理2
–
3h,用超滤管离心超滤除去低分子量的寡糖,浓缩液中的多糖被命名为sf1,sf1用0.2
–
0.3mol/ltfa在70
–
80℃下水解1
–
1.5h,并用同类型的管子进行超滤,浓缩液中的多糖被命名为sf2,sf2用0.4
–
0.6mol/l tfa在90
–
105℃下水解0.75
–
1.25h并超滤,浓缩液中的多糖被命名为sf3,即得。
19.作为本发明的优选方案,超滤管规格mw=3.5
–
5kda。
20.作为本发明的优选方案,步骤(2)中,海蒿子粉和热水的料液质量体积比为1:20
–
50,更优选为1:30。
21.作为本发明的优选方案,步骤(3)中,沉淀褐藻酸的cacl2浓度为3mol/l,沉降温度为4℃,沉降时间为10h。
22.作为本发明的优选方案,步骤(5)中,逐步部分酸水解过程中,第一步水解中,水解温度60℃,tfa浓度0.1mol/l,水解时间3h;第二步水解中水解温度80℃,tfa浓度为0.2mol/l,水解时间1.5h;第三步水解中水解温度100℃,tfa浓度0.5mol/l,水解时间1h;上述三步水解后超滤所用的超滤管规格mw=5kda。
23.本发明提供上述海蒿子岩藻聚糖在制备抗h1n1流感病毒药物中的应用。
24.有益效果:
25.(1)本发明首次提出海蒿子中岩藻聚糖具有较高的抗h1n1流感病毒活性,并通过逐步酸水解法对其进行降解,得到一种分子质量为9
–
15kda,主要由甘露糖和葡萄糖醛酸构成的海蒿子岩藻聚糖,与未降解的海蒿子岩藻聚糖相比抗h1n1流感病毒ic50降低约1/2,抗h1n1流感病毒活性增大。
26.(2)本发明从海蒿子多糖提取岩藻聚糖,并对其进行纯化,使制备的岩藻聚糖纯度高,不含蛋白、核酸等杂质。
附图说明
27.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。其中:
28.图1为实施例1中sf0的洗脱曲线。
29.图2为实施例1中四种多糖的红外光谱。
具体实施方式
30.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
31.本发明提供的海蒿子岩藻聚糖具有抗h1n1流感病毒活性,其中岩藻聚糖硫酸根含量为9%
–
13%,相对分子质量为9
–
15kda。
32.作为本发明的优选方案,本发明的海蒿子岩藻聚糖按照摩尔百分比计包括45%
–
55%的甘露糖、40%
–
50%葡萄糖醛酸和0.1%
–
5%半乳糖。
33.作为本发明的优选方案,本发明的海蒿子岩藻聚糖按照摩尔百分比计由50.1%的甘露糖、44.9%葡萄糖醛酸和4.0%半乳糖组成。
34.本发明提供上述海蒿子岩藻聚糖的制备方法,包括以下步骤:
35.(1)脱脂:海蒿子粉用95%乙醇在75
–
90℃下回流3
–
5h,重复2
–
3次,去除脂质并将残留物干燥;
36.(2)热水提取:经脱脂处理的干粉按料液质量体积比为1:10
–
50用70
–
90℃热水提取2
–
3h,重复2
–
3次,离心,收集所有上清液,浓缩;
37.(3)cacl2除褐藻酸:3mol/l cacl
2 4℃沉降8
–
12h,重复1
–
2次,离心,将上清液透析、浓缩和冻干,得到粗海蒿子岩藻聚糖;
38.(4)纯化:粗海蒿子岩藻聚糖在q
‑
sepharose fast flow柱上层析,用去离子水和nacl溶液(0.5、1、1.5、2mol/l)以3ml/min梯度洗脱,每管接6ml,每种流动相接60管,收集1.5mol/l nacl洗脱得到的主多糖,用sepharose 4b fast flow柱纯化,得到海蒿子岩藻聚糖,被命名为sf0;
39.(5)逐步部分酸水解:将海蒿子岩藻聚糖sf0在50
–
70℃下用0.05
–
0.15mol/l tfa处理2
–
3h,用超滤管(mw=3.5
–
5kda)离心超滤除去低分子量的寡糖,浓缩液中的多糖被命名为sf1,sf1用0.2
–
0.3mol/ltfa在70
–
80℃下水解1
–
1.5h,并用同类型的管子进行超滤,浓缩液中的多糖被命名为sf2,sf2用0.4
–
0.6mol/l tfa在90
–
105℃下水解0.75
–
1.25h并超滤,浓缩液中的多糖被命名为sf3。
40.作为本发明的优选方案,步骤(2)中,海蒿子粉和热水的料液质量体积比为1:20
–
50。
41.作为本发明的优选方案,步骤(2)中,海蒿子粉和热水的料液质量体积比为1:30。
42.作为本发明的优选方案,步骤(3)中,沉淀褐藻酸的cacl2浓度为3mol/l,沉降温度为4℃,沉降时间为10h。
43.作为本发明的优选方案,步骤(5)中,逐步部分酸水解过程中,第一步水解中,水解温度60℃,tfa浓度0.1mol/l,水解时间3h;第二步水解中水解温度80℃,tfa浓度为0.2mol/
l,水解时间1.5h;第三步水解中水解温度100℃,tfa浓度0.5mol/l,水解时间1h;上述三步水解后超滤所用的超滤管规格mw=5kda。
44.本发明提供上述海蒿子岩藻聚糖在制备抗h1n1流感病毒药物中的应用。
45.实施例1
46.将海蒿子粉用95%乙醇在85℃下蒸馏4h(3次)以去除脂质并将残留物干燥,粉碎;所得粉末用80℃热水按1:30的料液比提取3h(重复3次),离心,收集所有上清液,浓缩;加入cacl2至3mol/l,沉降温度为4℃,放置10h,然后离心,将上清液透析、浓缩和冻干,得到粗海蒿子岩藻聚糖。
47.粗岩藻聚糖在q
‑
sepharose fast flow柱上层析,用去离子水和nacl溶液(0.5、1、1.5、2mol/l)以3ml/min梯度洗脱,每管接6ml,每种流动相接60管,收集1.5mol/lnacl洗脱得到的主多糖,用sepharose 4b fast flow柱纯化得到海蒿子岩藻聚糖,命名为sf0。
48.sf0在60℃下用0.1mol/ltfa处理3h。用超滤管(mw=5kda)离心超滤除去低分子量的寡糖,浓缩液中的多糖被命名为sf1。sf1用0.2mol/ltfa在80℃下水解1.5h,并用同类型的管子进行超滤。浓缩液中的多糖被命名为sf2。最后,sf2用0.5mol/ltfa在100℃下水解1h并超滤,浓缩液中的多糖被命名为sf3。
49.实施例2
50.将海蒿子粉用95%乙醇在90℃下蒸馏5h(2次)以去除脂质并将残留物干燥,粉碎;所得粉末用75℃热水按1:40的料液比提取2h(重复3次),离心,收集所有上清液,浓缩;加入cacl2至3mol/l,沉降温度为4℃,放置12h,然后离心,将上清液透析、浓缩和冻干,得到粗海蒿子岩藻聚糖。
51.粗岩藻聚糖在q
‑
sepharose fast flow柱上层析,用去离子水和nacl溶液(0.5、1、1.5、2mol/l)以3ml/min梯度洗脱,每管接6ml,每种流动相接60管。收集1.5mol/lnacl洗脱得到的主多糖,用sepharose 4b fast flow柱纯化得到海蒿子岩藻聚糖,命名为sf0。
52.sf0在55℃下用0.15mol/ltfa处理2h。用超滤管(mw=5kda)离心超滤除去低分子量的寡糖,浓缩液中的多糖被命名为sf1。sf1用0.25mol/ltfa在75℃下水解1.5h,并用同类型的管子进行超滤。浓缩液中的多糖被命名为sf2。最后,sf2用0.4mol/ltfa在105℃下水解1h并超滤,浓缩液中的多糖被命名为sf3。
53.实施例3
54.将海蒿子粉用95%乙醇在95℃下蒸馏3h(3次)以去除脂质并将残留物干燥,粉碎;所得粉末用80℃热水按1:30的料液比提取2h(重复3次),收集所有上清液,浓缩;加入cacl2至3mol/l,沉降温度为4℃,放置9h,然后离心,将上清液透析、浓缩和冻干,得到粗海蒿子岩藻聚糖。
55.粗岩藻聚糖在q
‑
sepharose fast flow柱上层析,用去离子水和nacl溶液(0.5、1、1.5、2mol/l)以3ml/min梯度洗脱,每管接6ml,每种流动相接60管。收集1.5mol/lnacl洗脱得到的主多糖,用sepharose 4b fast flow柱纯化得到海蒿子岩藻聚糖,命名为sf0。
56.sf0在70℃下用0.05mol/ltfa处理3h。用超滤管(mw=3.5kda)离心超滤除去低分子量的寡糖,浓缩液中的多糖被命名为sf1。sf1用0.3mol/ltfa在70℃下水解1h,并用同类型的管子进行超滤。浓缩液中的多糖被命名为sf2。最后,sf2用0.4mol/ltfa在105℃下水解1h并超滤,浓缩液中的多糖被命名为sf3。
57.按以上实施例1制得的海蒿子多糖通过以下方法进行结构鉴定和活性分析,实施例2和3的结果与实施例1相似。
58.多糖的组成成分分析
59.总糖含量测定
60.以葡萄糖为标准品,用硫酸
‑
苯酚法测定总糖含量;配制溶液:5%苯酚溶液:水浴加热重蒸酚至溶解,取5ml重蒸酚溶液于100ml容量瓶中蒸馏水定容,4℃下避光保存。1mg/ml标准品溶液:准确称取干燥至恒重的葡萄糖标准品25mg于25ml容量瓶中,蒸馏水定容。0.5mg/ml待测样品溶液:准确称取干燥至恒重的多糖5mg于试管,加1ml蒸馏水溶解,再加9ml水稀释混匀,备用。
61.实验过程:分别吸取葡萄糖标准溶液0,0.05,0.1,0.15,0.2,0.25,0.3ml于试管中,加水补至0.5ml。另取一试管吸入适量0.5mg/ml多糖溶液。每管分别加入配制苯酚溶液0.5ml、浓硫酸2.5ml,混匀。该过程平行3次。水浴条件设置为100℃,试管在此条件下加热反应15min,自然冷却至室温,490nm处测定每管溶液吸光度,绘制标准曲线得到回归方程,多糖总糖的含量通过样品的吸光度数值代入回归方程计算得知。
62.总糖醛酸含量测定
63.以半乳糖醛酸为标准品,用硫酸
‑
咔唑法测定糖醛酸含量;配制溶液:硫酸
‑
硼砂溶液:准确称取硼砂1.8g于200ml烧杯中,加入20ml蒸馏水加热溶解,摇匀,取180ml浓硫酸放于冰箱降温至4℃,将其加入溶有硼砂的烧杯中混匀、冷却、4℃存放过夜。1mg/ml咔唑溶液:准确称取50mg咔唑试剂于50ml容量瓶中,乙醇定容,摇匀备用。0.5mg/ml标准品溶液:准确称取干燥至恒重的半乳糖醛酸标准品12.5mg于25ml容量瓶中加水定容。5mg/ml待测样品溶液:准确称取干燥至恒重的多糖5mg于试管,加1ml蒸馏水溶解、混匀备用。
64.实验过程:分别吸取半乳糖醛酸标准溶液0,0.03,0.04,0.05,0.06,0.07,0.08ml及待测样品溶液适量于各试管中(平行三组),加水补至0.2ml,每管分别加入配制硫酸
‑
硼砂溶液1.2ml、咔唑溶液0.04ml,震荡混匀,沸水加热10min后冷却至室温,分光光度计530nm下测各溶液吸光度。绘制标准曲线计算待测样品糖醛酸含量。
65.蛋白含量测定
66.以牛血清蛋白为标准品,用bca试剂盒法计算蛋白含量。配制bca工作液:取bca试剂盒中solution a与solution b分别3000μl、60μl于试管中,混匀。稀释bsa标准品:取10μlbsa标准品(5mg/ml)于1.5ml离心管中加去离子水90μl,混匀。加样:96孔板中加入稀释后的bsa标准品0,1,2,4,8,12,16,20μl,加去离子水将每孔标准品补足到20μl。加入多糖样品稀释液适量,同样加去离子水至20μl。每孔加入bca工作液200μl,小心吹打混匀,放置于60℃条件下30min。反应完成后冷却,562nm处酶标仪测其吸光度。建立标准曲线计算多糖中蛋白含量。
67.硫酸根含量测定
68.配制溶液:1mol/l盐酸溶液:准确量取浓盐酸16.66ml于烧杯中,转移至200ml容量瓶,水定容。0.6mg/ml标准品溶液:准确称取干燥至恒重的硫酸钾试剂108.75mg于烧杯中,1mol/l盐酸溶液溶解硫酸钾固体,转移至100ml容量瓶中,盐酸溶液定容。0.5%明胶:称取明胶固体1g于烧杯中加水70℃下溶解,转移至200ml容量瓶冷却加水定容,4℃静置过夜。0.5%氯化钡
‑
明胶溶液:称取氯化钡固体0.5g于烧杯中,加入少量0.5%明胶溶液溶解,转
移至100ml容量瓶中,定容。3%三氯乙酸:准确称取三氯乙酸3g,加水溶解转移至100ml容量瓶中,定容。
69.实验过程:标曲绘制:精密吸取k2so4标准溶液0,20,60,100,120,160,200μl,分别置于干净的试管中,补1mol/l的hci至200ul,各管分别依次加入3.8ml三氯乙酸、1mlbacl2
‑
明胶溶液,混合得溶液a。吸取同样的k2so4标准溶液,各管依次加入3.8ml三氯乙酸、1ml明胶溶液,混合得溶液b。将a、b溶液于室温下放置15min,以lmol/l的hci作空白,在360nm处测得吸光度aa、ab。以so
42-
的量为横坐标,aa、ab的吸光度差值为纵坐标绘制标准曲线。样品测定:准确称取多糖样品2mg、量取1mol/l盐酸溶液1ml于安瓿瓶中,震荡溶解后封口,烘箱105℃下反应12h。反应后冷却待用。吸取降解液200μl,按同样步骤加溶液,在360nm出测吸光度,带入标曲计算。
70.多糖分子量测定和单糖组成测定
71.用高效凝胶渗透色谱法(hpgpc)测定多糖的纯度和相对分子量(mw)。色谱柱选用plaquagel
‑
oh柱,用0.2mol/lna2so4等度洗脱,流速为0.5ml/min,柱温35℃,进样量20μl,检测器:agilent1260示差检测器。分别称取葡聚糖标准品,配制成1mg/ml的葡聚糖标准溶液,以葡聚糖的分子量的对数值(logmw)为纵坐标,以出峰时间为横坐标,对曲线进行回归拟合得到葡聚糖分子量分布标准曲线。
72.岩藻聚糖的单糖组成分析采用pmp
‑
柱前衍生高效液相色谱法测定。取5mg多糖溶于1ml2mol/l三氟乙酸(tfa)中,密封于110℃降解4h。水解完毕后室温冷却,溶液加入1ml甲醇,旋转蒸发以除尽多余的tha,重复3
–
4次。将多糖降解后的单糖组分中加入50μl0.3mol/lnaoh溶液,震荡溶解,再加入50μl0.5mol/l的pmp甲醇溶液,涡旋20s,置于70℃的烘箱中反应100min,室温冷却后加入50μl0.3mol/lhcl中和;加水至1ml,再加1ml的氯仿,震荡,静置,把氯仿层去除,同样步骤萃取三次,将水相过0.22μm的滤膜后上液相分析。各单糖标品分别取1mg按照相同步骤进行pmp
‑
柱前衍生。色谱条件如下:色谱柱为agilent eclipse xdb
‑
c18(150mm
×
4.6mm,5μm);流动相为0.1mol/l磷酸盐(ph6.7)缓冲液
‑
乙腈(体积比为82∶18);柱温为25℃;流速为1ml/min;紫外检测器波长为254nm。
73.表1:海蒿子岩藻聚糖的化学组成
[0074][0075]
表1给出了实施例1海蒿子岩藻聚糖的化学组成,从sf0到sf3的这些多糖的分子量从628.1kda明显降低到10.7kda。单糖分析结果表明,从sf0到sf3,岩藻糖、木糖、葡萄糖和半乳糖的含量显著降低。相反,从sf0到sf3,甘露糖和葡萄糖醛酸的百分比从10.7%和
8.3%显著增加到50.1%和44.9%。第三次水解后,该馏分sf3主要由甘露糖和葡萄糖醛酸组成,比例约为1:1。此外,随着tfa浓度的增加,硫酸化基团含量随之降低,总糖醛酸含量增加。这些结果表明sf0的核心由甘露糖和葡萄糖醛酸组成,通过三次酸水解后,得到一种主链结构为甘露糖和葡萄糖醛酸构成的海蒿子岩藻聚糖。
[0076]
红外光谱分析
[0077]
称取未降解海蒿子岩藻聚糖及实施例1降解中的产生三种海蒿子多糖5mg的粉末与kbr粉末混合后压片,采用傅里叶红外光谱仪在4000
‑
400cm
‑1波长范围内进行扫描。
[0078]
图2给出了实施例1中四种多糖的红外光谱,信号显示约3430cm
‑1、2928cm
‑1和1166cm
‑1处的典型多糖特征峰对应于羟基的o
‑
h、吡喃糖的c
‑
h和糖苷的c
‑
o
‑
c。约1258cm
‑1、813cm
‑1处的强吸收带对应硫酸盐的o=s=o和c
‑
o
‑
s的弯曲振动峰,这证实硫酸盐基团的存在。1258cm
‑1处吸收带的强度和化学分析中确定的硫酸盐含量相符。
[0079]
抗甲型流感病毒活性测定
[0080]
通过细胞病变效应试验评估对甲型流感病毒(h1n1)的抗病毒活性。待96孔板中的mdck细胞长成单层后,与流感病毒(a/puertorico/8/34[h1n1];pr/8)在37℃下孵育1h。去除病毒稀释液后,将细胞培养在含有不同浓度岩藻聚糖的感染培养基(rpmi
‑
1640,4μg/ml胰蛋白酶)中,在37℃下孵育48h后,将细胞用100μl4%甲醛在室温下固定20min。去除甲醛后,细胞用0.1%结晶紫染色30分钟。将板洗涤并干燥,并在570nm处测量每个孔的结晶紫染色强度。50%抑制浓度(ic50)表示将流感病毒产量抑制为50%所需的测试样品浓度。利巴韦林(sigma
‑
aldrich,mo,usa)作为阳性对照进行平行评估,抗病毒抑制率r根据(1)式计算。
[0081][0082]
a
sample
:感染h1n1病毒的细胞,用多糖或利巴韦林处理;
[0083]
a
blank
:正常细胞,未添加h1n1稀释液以及多糖或利巴韦林;
[0084]
a
virus
:感染h1n1病毒的细胞,未用多糖或利巴韦林处理。
[0085]
表2:海蒿子岩藻聚糖的抗h1n1病毒活性
[0086]
样品浓度(μg/ml)抑制率(%)50%抑制浓度ic50(μg/ml)sf025017.3529.4sf125022.6445.4sf225033.5311.0sf325042.3266.2利巴韦林25085.024.6
[0087]
检测到海蒿子中得到的4种海蒿子岩藻聚糖的抗hin1病毒活性(表2)。比较它们的抗病毒活性,第1步降解得到的sf1的ic50约为sf0的84.1%,第2步降解得到的sf2约为sf0的59.3%,第3步降解得到sf3的ic50约为sf0的1/2。海蒿子岩藻聚糖的抗h1n1流感病毒活性在250μg/ml的浓度下随着降解步数的进行越来越好。尽管其活性低于利巴韦林,但由于其低细胞毒性,这种岩藻聚糖仍具有潜在的抗病毒价值。此外,这些结果表明,海蒿子多糖的抗h1n1病毒活性不仅与其硫酸基含量有关,还与其分子量和单糖组成有关。
[0088]
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人
员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1