一种光敏剂分子及其在提高肿瘤滞留时间增强大体积肿瘤治疗中的应用
1.本发明属于纳米材料领域,具体涉及一种光敏剂分子及其在提高肿瘤保留时间增强大体积肿瘤治疗中的应用。
背景技术:
2.光动力治疗(pdt)由于其微创性和高度的时空精度,引起了相当多的关注。光敏剂作为光动力治疗的关键部分,将吸收的能量转移到周围的氧气中并产生活性氧(ros),随后与附近的生物大分子(如:脂质、蛋白质、dna)进一步反应以杀死癌细胞并完成光动力治疗。因此,光敏剂在肿瘤部位的有效富集是癌症患者进行光动力治疗的先决条件,其肿瘤滞留效果直接决定了治疗是否准确有效。然而,在活体光动力治疗过程中,大多数有机小分子光敏剂从血流中迅速清除,通常在数小时甚至十几分钟从血液中清除,使得光敏剂无法有效地在肿瘤部位富集和保留,导致光动力治疗效率低下。因此,提高光敏剂在肿瘤部位的保留时间迫在眉睫,这对于保证体内精准高效的pdt具有重要意义。
3.目前延长血液循环并增强肿瘤滞留时间的主要策略之一是将光敏剂纳米工程化,例如有机聚合物纳米粒子、脂质体或无机纳米材料。科研工作者通过改变纳米系统的物理化学特性(即大小、形状和电荷)可以很好地控制及优化肿瘤保留时间。此外,通过用肿瘤靶向基团(例如肽、抗体)进行表面修饰,所谓的“被动靶向”效应可以进一步提高纳米系统的肿瘤保留时间。尽管这些方法延长了光敏剂在肿瘤滞留时间,但这些纳米系统通常在一到三天内从肿瘤中清除,这在许多情况下仍然不足于保证有效的光动力治疗。注射光敏剂后仍需要尽快进行光疗,治疗大体积肿瘤或恶性肿瘤时需要大剂量注射光敏剂或多次注射。然而,这些会增加光动力治疗过程中治疗的风险并导致显著的毒副作用。因此,实现光敏剂在肿瘤部位的长期时间保留是非常可取的,但仍然是光动力治疗的关键挑战之一。
4.提高纳米粒子的稳定性是提高肿瘤保留效果的直接途径,因为在复杂的血液环境中,nps通常容易聚集或崩解,这是导致肿瘤保留时间有限的主要原因之一。
技术实现要素:
5.为解决上述技术问题,本技术提供了一种光敏剂共组装策略,通过极大地提高纳米粒子稳定性来增强肿瘤保留时间。光敏剂在肿瘤部位的保留时间已大幅提升至~10天。光敏剂是通过将蒽引入bodipy
‑
meso位来合成an
‑
bdp。由于蒽的强分子间π
‑
π相互作用,an
‑
bdp和具有两亲性嵌段共聚物(dspe
‑
peg
2000
)自组装成稳定纳米粒子(an
‑
bdp nps)。此外,蒽还能够使an
‑
bdp在光的照射下从单重激发态激发到三重激发态与o2作用下产生1o2。尾静脉注射an
‑
bdp nps在肿瘤部位富集保留时间长达~10天。在常规体积大小的小鼠肿瘤模型中(初始体积为~100mm3),an
‑
bdp nps可以通过一次注射一次光照治疗完全抑制肿瘤生长。而在大体积肿瘤模型(初始体积为~350mm3),相同治疗条件下,仅观察到12%的肿瘤生长抑制率。由于肿瘤滞留时间长,单次注射an
‑
bdp nps可光照3次治疗效果显著提高,而用
同样的两亲性嵌段共聚物(dspe
‑
peg
2000
)包裹临床上使用的光敏剂ce6或porphyrin nps,因为它们很快就会从肿瘤部位清除,并且在相同条件下只能进行一次光治疗,不能抑制大肿瘤的生长。因此,稳定的纳米粒子提高肿瘤保留时间可用于单次注射多次治疗大体积肿瘤,从而减少毒副作用。
6.一种光敏剂,所述光敏剂结构式如ⅰ所示:
[0007][0008]
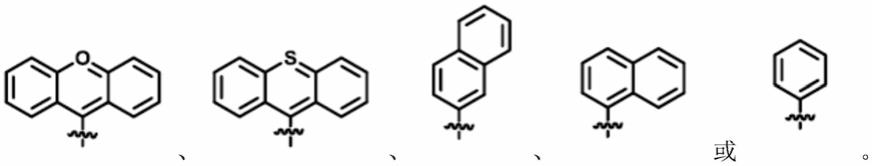
式ⅰ中,r选自:中,r选自:
[0009]
一种纳米光敏剂粒子,将所述的光敏剂与dspe
‑
peg
2000
自组装形成纳米粒子。
[0010]
一种光敏剂在制备抗肿瘤药物中的应用。
[0011]
一种纳米光敏剂粒子在制备抗肿瘤药物中的应用。
[0012]
进一步地,上述技术方案中,所述抗肿瘤药物为用于光动力治疗的抗肿瘤药物。
[0013]
进一步地,上述技术方案中,所述抗肿瘤药物为针对大肿瘤注射一次光敏剂或纳米光敏剂离子,进行多次光动力治疗。
[0014]
进一步地,上述技术方案中,所述光敏剂或纳米光敏粒子在肿瘤部位的保留时间为<300h。
[0015]
进一步地,上述技术方案中,所述大肿瘤为肿瘤体积为300
‑
350mm3。
[0016]
进一步地,上述技术方案中,光动力治疗的次数为1~3次。
[0017]
进一步地,上述技术方案中,对于大体积肿瘤可通过一次给药,三次光照治疗增强治疗效果减少大药剂量和光剂量带来的副作用。
附图说明
[0018]
图1为(a)an
‑
bdp nps自组装示意图和纳米颗粒中的分子间相互作用模式。(b)用于光动力疗法(pdt)的具有延长的血液循环和肿瘤保留的an
‑
bdp nps。
[0019]
图2为(a)an
‑
bdp和an
‑
bdpnps的紫外可见吸收光谱。(b)an
‑
bdp和an
‑
bdpnps的荧光发射光谱。
[0020]
图3为(a)an
‑
bdp在脱气二氯甲烷中630nm处的寿命衰减曲线,激发光源为590nm脉
冲激光。(b)2,6
‑
二碘苯乙烯bodipy分子结构式。
[0021]
图4为an
‑
bdp在630nm光源照射下dpbf的吸收光谱衰减图。
[0022]
图5为an
‑
bdp nps在630nm光照下产生的epr信号。其中红线为tmpo指示的1o2单线态氧信号。
[0023]
图6为(a)an
‑
bdp nps的tem图。(b)an
‑
bdp nps的dls图。
[0024]
图7为(a)an
‑
bdp nps和me
‑
bdp nps在37℃和ph 7.4下,在水、10mm pbs、45g/l bsa和90v%fbs的稳定性。
[0025]
图8为通过分子动力学模拟获得的无定形an
‑
bdp nps(a)和me
‑
bdp nps(b)的快照。
[0026]
图9为(a)an
‑
bdp nps和me
‑
bdp nps在4t1细胞中的随孵育时间摄取成像。
[0027]
图10为an
‑
bdp nps对hela、hepg
‑
2和4t1细胞的暗毒性和光毒性。
[0028]
图11为(a)an
‑
bdp nps在4t1细胞中的亚细胞器定位。(b)4t1细胞中1o2检测。
[0029]
图12为(a)4t1细胞溶酶体破坏的clsm图像。在细胞与an
‑
bdp nps(12μm)孵育后进行红光照射(630nm,27j/cm2)。比例尺:20μm。(b)钙黄绿素am(绿色)和碘化丙啶(红色)共染色4t1活死细胞的荧光成像。在细胞与an
‑
bdp nps(12μm)孵育后进行红光照射(630nm,27j/cm2)。比例尺:500μm。(c)使用流式细胞术对4t1细胞死亡途径进行分析。在细胞与an
‑
bdp nps(12μm)孵育后进行红光照射(630nm,27j/cm2)。
[0030]
图13为(a)尾静脉注射an
‑
bdp和me
‑
bdp nps后,4t1荷瘤小鼠荧光成像图。(b)小鼠肿瘤部位an
‑
bdp和me
‑
bdp nps的相对荧光强度随时间变化归一化曲线图。
[0031]
图14为尾静脉注射an
‑
bdp nps 3天后对主要器官进行体外成像,包括心脏、肝脏、脾脏、肺、肾脏和肿瘤。
[0032]
图15为(a)常规肿瘤大小治疗期间各组小鼠相对肿瘤体积变化(200mw/cm
2 630nm激光照射15min)。(b)小鼠在不同处理期间平均体重变化。(c)评估60天期间不同组的荷瘤小鼠的生存曲线。(d)不同治疗组肿瘤组织的h&e和tunel测定分析。比例尺:h&e为100μm,tunel为50μm。
[0033]
图16为(a)大体积肿瘤(~350mm3)的小鼠进行治疗期间,每组的肿瘤体积变化。小鼠静脉注射。尾静脉注射ce6、porphyrin和an
‑
bdp nps(200μm,100μl)。静脉注射后进行激光照射(635nm,200mw/cm2,15分钟)。ce6和porphyrin尾静脉注射8小时后光照;an
‑
bpd nps+light组尾静脉注射24小时后光照;an
‑
bpd+light(2)的尾静脉注射第1天和第3天进行光照;an
‑
bpd+light(3)尾静脉注射的第1、3和5天进行光照。统计数据以平均值
±
sd来差异性分析,由student’s t检验确定p值<0.05被认为统计学上变化显著(*p<0.05,**p<0.01,***p<0.001)(b)大体积肿瘤荷瘤小鼠在不同治疗期间平均体重变化。(c)来自不同荷瘤小鼠组的肿瘤图像。(d)不同治疗中肿瘤组织的h&e和tunel测定分析。比例尺:h&e为100μm,tunel为50μm。
[0034]
图17为ce6和porphyrin nps尾静脉注射小鼠体内荧光成像图。虚线圆圈表示肿瘤。
[0035]
图18为用不同浓度的an
‑
bdp nps处理的红细胞(rbc)的溶血率。
[0036]
图19为各组小鼠正常组织h&e染色组织学分析。
具体实施方式
[0037]
下述非限定性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。
[0038]
细胞凋亡检测试剂盒(annexin v
‑
fitc)和活性氧试剂盒(dcfh
‑
da)从碧云天生物科技公司购得。活/死细胞染色试剂盒(calcein am/pi),hoechst 33342均购于凯基生物。商业化亚细胞器定位染料如核染料hoechst 33324、溶酶体lysotrackergreen dnd
‑
26、线粒体mitrotracker green fm、propidium iodide(pi)从赛默飞公司购得。
[0039]
hela(人源宫颈癌细胞),mcf
‑
7(人源乳腺癌细胞)和4t1(鼠源乳腺癌细胞)购买于中国科学医学研究所(ibms)。
[0040]
实施例1 an
‑
bdp nps光敏剂分子设计及合成
[0041][0042]
(1)中间体3的合成
[0043]
中间体3的合成:3,5
‑
二甲基吡咯醛(100mg,0.81mm)溶于干燥的ch2cl2(15ml)中。在0℃氩气气氛下,将pocl3(124mg,0.81mm)缓慢加入上述溶液中。将反应溶液在0℃下搅拌1小时,然后在室温加入net3(750mg,7.4mm)搅拌4小时,然后加入bf3·
et2o(0.93ml,7.4mm)反应2小时后,在真空下蒸发溶剂,用etoac(200ml)萃取。然后用h2o(3
×
50ml)洗涤有机层,并用无水na2so4干燥。粗产物用硅胶柱色谱(己烷/etoac=5∶1)纯化,得到99mg(49%)的中间体3(红色晶体)。
[0044]
(2)中间体5的合成
[0045]
在n2气氛下,将适当的蒽醛(2mmol)和2,4
‑
二甲基吡咯(4mmol)溶解在250ml无水ch2cl2中。加入一滴三氟乙酸(tfa),并在室温下搅拌过夜。用薄层色谱(tlc)监测显示醛完全消耗时,加入2mmol 2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌(ddq)在ch2cl2中的溶液,继续搅拌15
‑
20分钟。用水洗涤反应混合物,用硫酸镁干燥,过滤并蒸发。粗化合物通过氧化铝柱色谱粗略纯化,得到棕橙色固体。在氮气保护下,将固体和4ml n,n
‑
二异丙基乙胺(diea)溶解在150ml无水ch2cl2(或无水甲苯)中,并将溶液在室温下搅拌5分钟。然后加入4ml三氟化硼乙醚(bf3·
oet2),并进一步搅拌30分钟。反应液用水洗涤并用无水mgso4干燥,过滤并蒸发。通过硅胶色谱法(ch2cl2/己烷)纯化粗化合物以提供分析纯样品,将其在meoh中重结晶得到橙色针状物。
[0046]
(3)目标化合物的合成
[0047]
将苯甲醛(0.31ml,2.21mm)、3a(中间体3或中间体5)(0.58mm)、acoh(0.10ml)或者催化量的对甲基苯磺酸和哌啶(0.10ml)溶解在甲苯(10ml)中,并加入一定量活化的分子筛。在80℃下搅拌5小时。用水淬灭,将混合物冷却至室温,并用ch2cl2萃取。合并的有机层用盐水洗涤,经无水na2so4干燥并蒸发。粗产物通过tlc(ch2cl2/n
‑
己烷=3:1)纯化,得到最终化合物:
[0048]
an
‑
bdp:1h nmr(400mhz,cdcl3)δ=8.61(s,1h),8.06(d,j=8.4,2h),7.96(d,j=8.6,2h),7.85(d,j=16.3,2h),7.66(d,j=7.5,4h),7.55
–
7.27(m,12h),6.57(s,2h),0.72(s,6h).tof
‑
hrms(ei)(m/z):c
31
h
41
bf2n2计算值:600.2548;检测值:600.2543.
[0049]
13
c nmr(101mhz,cdcl3)δ=152.92,142.07,136.63,136.51,134.31,131.34,130.12,128.99,128.82,128.42,128.39,127.61,127.06,125.82,125.27,119.34,117.83,77.33,77.02,76.70,13.60.
[0050]
me
‑
bdp:1h nmr(400mhz,cdcl3)δ=7.72(m,2h),7.66
–
7.59(m,4h),7.46
–
7.35(m,6h),7.32(d,j=7.1,2h),6.73(s,2h),2.50(s,6h),2.30(s,3h).tof
‑
hrms(ei)(m/z):[m]
+
calcd for c
28
h
25
bf2n2:438.2079;found:438.2091.
[0051]
实施例2 an
‑
bdp nps光敏剂分子的表征
[0052]
(1)紫外可见、荧光光谱表征:精确配备3mmol/l an
‑
bdp和me
‑
bdp的dmso母液,测试溶剂为二氯甲烷,测试浓度为10μm,测试温度为25℃。紫外可见吸收光谱测试范围为300
‑
800nm,荧光发射光谱测试范围为600
‑
900nm。
[0053]
如图2所示,10μm an
‑
bdp在二氯甲烷的紫外吸收光谱发现在578nm和630nm处有两个相邻的吸收峰。而在~640nm处观察到an
‑
bdp的发射,说明允许荧光成像引导pdt。然而,an
‑
bdp nps的吸收光谱在593和645nm处出现两个红移峰,分别属于典型的较宽的soret带和q带。说明形成聚集体an
‑
bdp以一定角度排列,an
‑
bdp nps在水溶液中的吸收峰比单体在二氯甲烷中有明显的红移,说明an
‑
bdp在组装过程中分子间有π
‑
π堆积相互作用发生。
[0054]
(2)纳秒时间分辨瞬态吸收光谱表征:配备浓度为10μm an
‑
bdp的二氯甲烷溶液,并通氮气除氧30min。借助纳秒时间分辨瞬态吸收光谱仪,测试、比较两者的瞬态吸收光谱,并根据数据拟合630nm处三线态寿命。实验中使用的激发光源为590nm脉冲激光。
[0055]
如图3(a)所示,在除氧的二氯甲烷溶剂中,使用590nm脉冲激光激发an
‑
bdp后,拟合an
‑
bdp在630nm处的三线态寿命为14μs,远长于典型的含重原子的pss(例如,2,6
‑
二碘
‑
双苯乙烯bodipy的t=1.7μs)。三线态寿命的延长更加有利于三重态光敏剂与o2能量传递和电子转移。
[0056]
(3)活性氧检测:为了确定an
‑
bdp在红光照射下是否能够产生活性氧,使用1,3
‑
二苯基异苯并呋喃(dpbf)作为1o2指示剂。测定dpbf在415nm处的吸收,根据415nm处吸光度的变化来判断活性氧产生能力。
[0057]
操作步骤:配置2.5ml吸光度为1.0左右dpbf ch2cl2溶液,an
‑
bdp吸光度为0.3左右的二氯甲烷溶液并混合均匀。使用630nm的led灯照射比色皿,每隔30s,测定相应吸收光谱。通过比较415nm处吸光度随时间变化曲线评价各样品的1o2产生水平。光源光功率密度为5mw/cm2。
[0058]
如图4所示,dpbf在415nm处的吸光度有明显的降低,说明an
‑
bdp有产生活性氧的
能力。
[0059]
(4)活性氧物种测定通过电子顺磁共振(epr)光谱进一步验证了活性氧物种。5,5
‑
二甲基
‑1‑
吡咯啉
‑
n
‑
氧化物(dmpo)被用作o2
‑
·
或
·
oh的捕捉剂,2,2,6,6
‑
四甲基
‑1‑
哌啶氧基(tmpo)为1o2的捕捉剂。
[0060]
由图5可以看出辐照an
‑
bdp nps溶液产生与1o2匹配的顺磁信号,表明产生的ros为1o2。
[0061]
实施例3纳米粒子的合成与表征
[0062]
(1)纳米粒子的合成
[0063]
将光敏试剂(an
‑
bdp、或me
‑
bdp)溶解在thf(1mg,1ml)中,在超声处理(180w)下将其加入含dspe
‑
peg
2000
(5mg,5ml)的milli
‑
q水中。所得分散液在超声处理中进一步保持40分钟。此后,将胶体分散体在milli
‑
q水中透析3天,以除去有机溶剂。在透析过程中,每6小时更换milli
‑
q水,最后用生理盐水透析分散液,透析袋为再生纤维素透析袋3500,然后收集透析管中的溶液,溶液即为所需纳米粒子。
[0064]
(2)纳米粒子的表征
[0065]
将一定体积的纳米粒子溶液添加到样品池中,纳米粒子的直径由动态光散射(dls)测定。纳米粒子形貌由透射电子显微镜(tem)测定:取2.5μl稀释后的纳米粒子溶液滴加在碳膜覆盖的铜网上,待自然干燥后,在透射电子显微镜下观察。
[0066]
通过纳米沉淀将an
‑
bdp配制成纳米颗粒。两亲性共聚物(dspe
‑
peg
2000
)用作封装基质。在组装过程中,疏水性芳香平面分子在核内随机积累,亲水性peg链形成水溶性壳。聚集在纳米颗粒中的分子的吸收光谱与游离态的分子有很大不同。使用透射电子显微镜(tem)和动态光散射(dls)表征an
‑
bdp nps的大小和形态(图6)。tem图像显示an
‑
bdp nps具有球形形态,大小均匀为80
‑
90nm,而dls数据表明an
‑
bdp nps的流体动力学直径为120nm。从tem测量获得的较小尺寸可能是由于干燥tem样品中水化层的收缩。
[0067]
(3)纳米粒子稳定性测试
[0068]
将制备好的纳米粒子稀释到一定浓度在pbs、牛血清白蛋白(bsa)、胎牛血清(fbs)不同时间纳米粒子吸光度的变化。用吸光度的变化确定纳米粒子的稳定性。
[0069]
为了验证强的π
‑
π堆积有利于提高纳米粒子稳定性,还合成了meso位甲基的bodipy(me
‑
bdp)并制备me
‑
bdp nps作为比较。然后测试了an
‑
bdp nps和me
‑
bdp nps在体外不同条件下的稳定性。采用归一化吸收强度比率变化来定量化纳米结构保持率(rnf%)。在37℃,ph为7.4时,在纯水、pbs缓冲液和牛血清白蛋白(bsa,45g/l)中孵育48小时后,an
‑
bdp nps和me
‑
bdp nps的rnf值均>95%(图7),说明纳米粒子均未表现出破坏。胎牛血清(fbs,90v/v%)用于模拟血液环境。值得注意的是,即使是高浓度的fbs也不能显著诱导an
‑
bdp nps的破坏。此外,孵育36小时后rnf值仍约为90%。相比之下,me
‑
bdp nps的rnf值急剧下降至44%。因此,an
‑
bdp nps表现出比me
‑
bdp nps高得多的稳定性,这可归因于疏水嵌段内an
‑
bdp分子间强π
‑
π堆积相互作用以及peg链的保护作用使an
‑
bdp nps具有更高的血清稳定性。
[0070]
实施例4 an
‑
bdp nps和me
‑
bdp nps动力学模拟
[0071]
为了揭示纳米颗粒稳定性的可能机制,使用gromacs程序对an
‑
bdp nps和me
‑
bdp nps进行了分子动力学(md)模拟(图8)。实际上,π
‑
π堆积是芳香族化合物的一种特殊空间排
列,可以分为两种类型:错位面对面(offset face
‑
to
‑
face,f
‑
型堆积)和边对面(edge
‑
to
‑
face,t
‑
型堆积)。在f
‑
型堆积中,两个芳族系统形成平行的分子平面,它们的面间距约为在t
‑
型堆积中,两个芳烃系统相互垂直。t
‑
形构象是ch
‑
π相互作用,之前的研究表明,这种t
‑
形比f
‑
型堆叠更稳定。分子动力学模拟获得的无定形聚集体的快照(图8),an
‑
bdp nps的堆积图表明两个相邻的蒽和bodipy平面几乎相互垂直,从而形成分子间ch
‑
π相互作用(h
‑
c的距离为图8a)。此外,在an
‑
bdp nps中发现了f原子和蒽之间的氟键,这进一步增强了纳米颗粒的稳定性。然而,两个me
‑
bdp分子之间的面心距离为(图8b),超出了π
‑
π堆叠的有效距离。这些结果表明an
‑
bdp nps之间的相互作用为ch
‑
π相互作用为主。因此,md计算结果支持我们的猜想,即π
‑
π堆积和氢键增强了纳米颗粒的稳定性。
[0072]
实施例5
[0073]
本发明使用的小鼠乳腺癌4t1(鼠源乳腺癌细胞),hepg
‑
2(人源肝癌细胞),mcf
‑
7(人源乳腺癌细胞)细胞均在含有1%青链霉素混合液、10%胎牛血清的dmem培养基在37℃,2%o2、5%co2环境下培养至对数生长期,经胰酶消化后制备细胞悬液,用于后续不同实验。
[0074]
(1)an
‑
bdp nps和me
‑
bdp nps细胞摄入实时荧光成像
[0075]
取100μl 4t1细胞悬液(1
×
105个/ml)置于含有2ml dmem培养基的共聚焦皿中,37℃、5%co2环境下培养24h至对数生长期。在成像之前用pbs洗涤3次。将2.0μm nps与4t1孵育不同时间,随后,并用hoechst 33342染色细胞核。通过激光共聚焦扫描显微镜拍摄荧光图像。nps的激发波长为590nm,发射波长接受波段在600
‑
700nm范围内检测;hoechst 33342激发波长为405nm,检测波段范围为425
‑
475nm。
[0076]
光敏剂在细胞的摄入及保留时间是光动力抗肿瘤效果的关键因素之一,只有当光敏剂在细胞有效富集及保留,才能在光照后产生的活性氧破坏癌细胞,从而诱导细胞凋亡或死亡,达到抑制肿瘤生长的目的。使用4t1肿瘤细胞研究an
‑
bdp nps的细胞摄取情况(图9)。首先,将4t1细胞与hoechst 33342在黑暗中孵育15min。然后,将4t1细胞与an
‑
bdp nps在黑暗中孵育不同的时间共聚焦显微镜成像。共聚焦激光扫描显微镜(clsm)显示an
‑
bdp nps可以被4t1细胞迅速吸收,并且荧光强度随着孵育时间的增加而增加。值得注意的是,孵育28小时后仍然有强烈的红色荧光,而hoechst 33342的荧光几乎不可见。这些结果表明an
‑
bdp nps是稳定的,可以长时间保留在细胞中。然而,由于细胞胞吐作用,在孵育28小时后me
‑
bdp nps的红色荧光显着降低。因此,强的π
‑
π堆积可以使an
‑
bdp nps具有更高的稳定性和更长的保留时间,这对于在pdt过程杀死肿瘤细胞都至关重要。
[0077]
(2)an
‑
bdpnps的细胞存活率测试
[0078]
本实验采用mtt法测试细胞存活率。
[0079]
操作步骤:mcf
‑
7、hepg
‑
2和4t1细胞接种于96孔板(每孔1
×
104个细胞并在100μl dmem中孵育)。细胞贴壁生长到密度为80%,不同浓度的an
‑
bdp nps孵育4小时。然后用630nm的oled灯(30mw/cm2)照射15分钟。同时,在相同实验条件下,an
‑
bdp nps在没有激光照射的情况下培养细胞也进行了暗细胞毒性研究。进一步孵育24小时后,每孔加入mtt溶液(100μl,0.5mg/ml的dmem),细胞在37℃继续孵育4小时。随后,小心地除去培养基,并加入100μl dmso以溶解甲臜晶体。使用bio
‑
rad酶标仪在490nm处测量吸光度值并计算细胞存活
率:
[0080][0081]
其中,受试组为不同浓度an
‑
bdp nps处理的细胞培养组;空白组为只加培养基组;对照组为未加an
‑
bdp nps细胞培养组;od为甲瓒的dmso溶液在490nm处的吸光。
[0082]
当在黑暗条件下使用12μm的an
‑
bdp nps时,几乎没有观察到细胞毒性,细胞存活率在90%以上,表明an
‑
bdp nps在没有辐射的情况下具有良好的生物相容性。相反,当细胞在27j/cm2光照射(630nm)下与相同浓度的an
‑
bdp nps孵育时,肿瘤细胞的生长被抑制了约70%。观察到浓度和激光功率密度依赖的细胞毒性(图10)。这些结果表明an
‑
bdp nps在辐照下表现出高细胞毒性。
[0083]
(3)细胞内单线态氧产生成像
[0084]
操作步骤:4t1细胞与5μm an
‑
bdp nps孵育3小时,然后用5μm dcfh
‑
da孵育0.5小时后,弃掉培养基,用pbs清洗三次,加入2ml无血清的dmem。在1o2淬灭组中,在细胞用dcfh
‑
da染色之前,向细胞中加入100μm nan3孵育1小时。然后,将细胞用630nm(30mw/cm2)光照射15分钟(27j/cm2)。共聚焦荧光成像用于观察细胞内1o2水平。
[0085]
如图11b,与对照组相比,在630nm led灯光照下,an
‑
bdp nps处理的4t1细胞显示亮绿色荧光,表明ros有效生成。相反,在没有光或纳米颗粒的组中,检测不到绿色荧光。此外,an
‑
bdp nps诱导的ros被nan3(1o2清除剂)完全清除,这意味着细胞内产生的ros是1o2。这些结果清楚地表明癌细胞的死亡是由an
‑
bdp nps介导的pdt中1o2的产生引起的。
[0086]
(4)an
‑
bdp nps亚细胞器共定位成像
[0087]
待4t1细胞在共聚焦皿中生长至对数生长期后,加入2μm an
‑
bdp nps孵育摄取2h,然后用不同的商业化染料对细胞进行共孵育15min。
[0088]
an
‑
bdp nps的红色荧光与溶酶体染料lysotracker green dnd 26(一种商业溶酶体染料)的绿色荧光完全叠加,pearson相关系数为0.87(图11a)。因此,an
‑
bdpnps被细胞内吞并特异性定位在溶酶体中。相比之下,an
‑
bdp nps、商业化线粒体染料(mitotraker green)和细胞核染料(hoechst 33342,图11a)的共定位相关系数却很低。
[0089]
(5)an
‑
bdp nps在红光照射下溶酶体破坏实验
[0090]
本实验采用吖啶橙又称3,6
‑
双(二甲基氨基)吖啶氯化锌盐酸盐(ao)作为溶酶体完整性指示剂来直观指示630nm oled红光激发an
‑
bdp nps产生的1o2对溶酶体的破坏。
[0091]
将4t1细胞接种到35mm共聚焦培养皿上,并在37℃下5%co2环境下培养24小时。然后将4t1细胞暴露于以下不同的处理:对照组,未处理;光照组,用630nm红光以30mw/cm2(27j/cm2)的功率密度照射15分钟;an
‑
bdp nps组,与10μm an
‑
bdp nps在37℃下孵育3小时;an
‑
bdp nps+光照组,在37℃下与10μm an
‑
bdp nps孵育3小时,用630nm红光以30mw/cm2(27j/cm2)的功率密度照射15分钟。在成像实验之前,所有细胞都用ao(5μm)孵育0.5小时。最后,在共聚焦显微镜下观察,并采集荧光图像进行分析。
[0092]
在对照组、an
‑
bdp nps组和光照组观察到大量红色荧光(白色箭头),说明溶酶体是完整的。然而,在an
‑
bdp nps在630nm光照射下ao红色荧光的消失所(图12a),细胞核明显收缩,细胞塌陷(黄色箭头),说明溶酶体的完整性严重受损。
[0093]
(6)an
‑
bdp nps诱导的活/死细胞染色实验
[0094]
将4t1细胞接种到35mm共聚焦培养皿24小时,待细胞生长至对数期,对照组细胞在没有任何处理的情况下孵育;光照组:细胞用630nm(30mw/cm2)led灯照射15分钟;an
‑
bdp nps组:细胞与12μm an
‑
bdp nps在37℃下孵育4小时;加药加光照组(an
‑
bdp nps+light):细胞与12μm an
‑
bdp nps在37℃下孵育4小时,然后用630nm(30mw/cm2)oled灯照射15分钟。根据制造说明用calceinam/pi双染试剂盒对细胞染色,并通过激光共聚焦扫描显微镜(olympus fv
‑
3000)成像。calcein:激发波长:488nm,发射波长在500
‑
540nm处采集。pi:激发波长:488nm,发射波长在650
‑
690nm处采集。
[0095]
然后使用活/死细胞染色实验来确认an
‑
bdp nps在630nm 27j/cm2光照射下的光疗效果(图12b)。calcein am(绿色)检测活细胞,碘化丙啶染料(红色)染色死细胞。an
‑
bdp nps在630nm 27j/cm2光照射下完全损坏了4t1细胞,如红色荧光所示。然而,在单一光和单一an
‑
bdp nps组中仅观察到绿色荧光,表明an
‑
bdpnps在630nm 27j/cm2光照射下导致强的细胞毒性。
[0096]
(7)an
‑
bdp nps诱导的细胞死亡途径验证实验
[0097]
我们还研究了an
‑
bdp nps在光照下产生1o2诱导细胞的死亡途径。4t1细胞培养至对数生长期后,加入12μm an
‑
bdp孵育4h,使用630nm led(30mw/cm2)光源照射15min。使用annexin v
‑
fitc/pi凋亡试剂盒进行染色并通过流式细胞仪测试。
[0098]
操作步骤:将4t1细胞接种到35mm 6孔板孵育24小时,然后分为以下几组:对照组,细胞在没有任何处理的情况下孵育;光照组:细胞用630nm(30mw/cm2)led灯照射15分钟;an
‑
bdp nps组:细胞与12μm an
‑
bdp nps在37℃下孵育4小时;加药加光照组(an
‑
bdp nps+light):细胞与12μm an
‑
bdp nps在37℃下孵育4小时后,用不含edta的胰蛋白酶消化细胞,然后离心1000转5min弃培养基,按照说明说配置工作液并对细胞进行染色。最后,通过流式细胞仪测试细胞的状态。
[0099]
对照组与光照组和an
‑
bdp nps组相似,存活率都在96%以上,并没有检测到明显的凋亡信号。相反,an
‑
bdp nps在630nm 27j/cm2光后(图12c),凋亡细胞的百分比显着增加至35.22%。结果与细胞光毒性结果一致,表明an
‑
bdp nps的pdt可以有效诱导肿瘤细胞的早期凋亡,最终导致细胞死亡。
[0100]
实施例6
[0101]
(1)异种移植肿瘤模型建立(4t1乳腺癌)
[0102]
本实施例所用小鼠均为6周龄balb/c雌鼠购自辽宁长生生物技术股份有限公司,相关实验操作均按照《实验室动物护理和使用指南》和国家研究委员会的规定进行,并通过大连理工大学动物护理与使用委员会批准。文件编号/伦理批准编号:2018
‑
043。建立常规体积肿瘤大小(初始体积为~100mm3),另外为了验证长保留时间有利于大肿瘤或者恶性肿瘤多次治疗,我们还建立了大体积(初始体积为~350mm3)肿瘤模型。
[0103]
(2)体内靶向生物分布及荧光影像
[0104]
为了验证π
‑
π堆积有利于纳米粒子的稳定性从而延长纳米粒子的肿瘤保留时间以及纳米粒子的肿瘤靶向性和最佳治疗时间,取上述荷瘤小鼠,将an
‑
bdp nps或me
‑
bdp nps(100μl,200μm)尾静脉注射到荷瘤小鼠体内,并在注射后的不同时间观察荧光成像(图13a)。激发波长为590nm,发射接受波段为600
‑
700nm。
[0105]
通过小鼠成像分析,绘制出时间依赖型肿瘤区域的标准化荧光强度图像(图13b)。
由图13a可以看出me
‑
bdp nps在注射后18小时首次在肿瘤部位可见红色荧光,36小时后消失,表明在肿瘤部位有限的保留时间。相比之下,an
‑
bdp nps表现出增强的肿瘤保留时间长达240小时,高强度的荧光从12小时持续到180小时,这比以前报道的纳米光敏剂长得多。an
‑
bdp nps优异的肿瘤富集和延长的保留时间是由于封装的an
‑
bdp具有强的π
‑
π堆积和peg壳的保护减少了非特异性蛋白质吸附。注射后240小时,小鼠其他部位几乎检测不到荧光,但大量an
‑
bdp nps仍保留在肿瘤部位,显示出强烈的荧光。在小鼠荧光成像的过程中,an
‑
bdp注射小鼠肿瘤部位和周边正常组织荧光信号对比明显,肿瘤边界非常清楚,具有非常高的信号背景比(signal
‑
to
‑
background ratio,sbr),可以精准引导光动力治疗。长的肿瘤保留时间可以一次注射多次治疗的大肿瘤或者恶性肿瘤。
[0106]
为了定量研究主要器官的生物分布,我们在注射an
‑
bdp nps 3天后处死小鼠,并收集肿瘤和主要器官(心脏、肝脏、脾脏、肺和肾脏)进行成像。如图14,an
‑
bdpnps主要积累在肿瘤组织中,肝脏有较低的富集,这与上述小鼠荧光成像结果一致。an
‑
bdp nps在肿瘤部位的高分布和长时间保留有利于增强pdt。
[0107]
(3)体内肿瘤光动力治疗
[0108]
荧光成像引导的体内实体瘤靶向光动力治疗实验分为两部分,分别测试了常规肿瘤体积模型以及大肿瘤模型的抑瘤效果。
[0109]
(i)常规肿瘤体积抑瘤实验
[0110]
受an
‑
bdp nps优异的肿瘤富集和长保留时间的鼓舞,我们首先研究了an
‑
bdpnps在常规大小(最初~100mm3)肿瘤的小鼠中的抗肿瘤活性。将小鼠分为4组(n=5),包括(1)静脉注射(i.v.)生理盐水(100μl)(对照组);(2)用200mw/cm2635nm激光照射15min(光照组);(3)尾静脉注射an
‑
bdp nps(200μm,100μl)(an
‑
bdp nps组);(4)尾静脉注射200μm,100μl an
‑
bdp nps 48小时后进行后使用635nm激光、200mw/cm2照射15min(an
‑
bdp nps+light组)。用生理盐水和照射(635nm激光、200mw/cm2和15分钟)处理的组(2)中的小鼠用作阴性对照。每隔一天测量小数的体重和体积。
[0111]
(ii)大体积肿瘤抑瘤实验
[0112]
接下来,我们评估了an
‑
bdp nps小鼠的大肿瘤模型的治疗性能,初始肿瘤体积为~350mm3。将小鼠分为6组(n=5),包括(1)静脉注射(i.v.)生理盐水(100μl)(对照组);(2)尾静脉注射200μm,100μl ce6 nps 635nm 200mw/cm2激光照射15min(ce6 nps+light);(3)尾静脉注射卟啉(porphyrin,200μm,100μl nps)200mw/cm2激光照射15min(porphyrin nps+light);(4)尾静脉注射200μm,100μlan
‑
bdp nps使用635nm 200mw/cm2激光照射15min(an
‑
bdp nps+light)。(5)尾静脉注射200μm,100μl an
‑
bdp nps使用635nm 200mw/cm2激光照射两次15min(an
‑
bdp nps+light 2)。(6)尾静脉注射200μm,100μl an
‑
bdp nps使用635nm 200mw/cm2激光照射15min三次(an
‑
bdp nps+light 3)。肿瘤部位的荧光信号以时间依赖性增加,并且在注射ce6和porphyrin后8小时后强度达到最大值。因此,在尾静脉注射8小时后对(2)和(3)组进行光照射(635nm激光,200mw/cm2,15min)。在尾静脉注射an
‑
bdp nps 24小时后对(4)组进行光照射(635nm激光,200mw/cm2,15min)在进行。第(5)组是在尾静脉注射an
‑
bdp nps第1天和第3天后进行两次光照射,第(6)组在尾静脉注射an
‑
bdp nps后第1、3和5天进行光照射。每2天监测一次体重和肿瘤体积,持续18天。治疗结束后收集主要器官(心脏、肝脏、脾脏、肺和肾脏)和肿瘤通过苏木精和伊红(h&e)染色或tunel染色检
查,并通过荧光显微镜(evos xl core,life technologies,usa)观察,进行组织学分析。
[0113]
我们首先测试了an
‑
bdp nps在常规测试尺寸(最初~100mm3)的肿瘤小鼠中的抗肿瘤活性。图15a显示了不同治疗后小鼠肿瘤体积的变化。没有光照射的an
‑
bdpnps对肿瘤生长没有明显影响。在接受单一光照射的小鼠中也观察到相同的结果(图15a),表明所用光剂量(635nm激光,200mw/cm2,15分钟)的安全性。值得注意的是,an
‑
bdp nps和光处理组的肿瘤生长被完全抑制,表明具有极好的肿瘤抑制率。结果可能归因于这样一个事实,即an
‑
bdp nps有效地积累到肿瘤部位,在光照下产生具有细胞毒性的1o2,从而实现高效的pdt。苏木精和曙红(h&e)染色和末端脱氧核苷酸转移酶介导的dutp缺口末端标记(tunel)用于评估抗肿瘤效果(图15d)。h&e染色用于观察肿瘤组织细胞的形态。对于pbs、light和an
‑
bdp nps组,观察到大量基质致密细胞,细胞核和细胞质完整,表明细胞状态良好。相反,在治疗组(an
‑
bdp nps+light)中,细胞核缩小或破碎,几乎没有观察到形态完整的细胞。接下来,tunel染色用于标记细胞凋亡。正如预期的那样,在an
‑
bdp nps+light组中发现的tunel阳性细胞凋亡百分比显着高于任何其他组。在所有组中,an
‑
bdp nps+light在诱导细胞凋亡方面表现出最高的治疗效果。还监测了不同组小鼠的存活率(图15c)。用an
‑
bdp nps+light处理的小鼠显示出最大的存活率,并且在处理60天后仍保持80%的活力。其他组的所有小鼠均在40天内死亡。上述结果表明an
‑
bdp nps表现出增强的pdt,小鼠的体重成缓慢增长(图15b),没有明显变化说明全身毒性可忽略不计。
[0114]
接下来,我们评估了an
‑
bdp nps对小鼠的大肿瘤模型治疗的效果,初始肿瘤体积为~350mm3(图16a)。我们还使用两种商业化临床光敏剂ce6和卟啉(porphyrin)用作比较,同样它们也被封装在相同的两亲性共聚物(dspe
‑
peg
2000
)制备成纳米粒子。在尾静脉注射an
‑
bdp nps 24小时后,在200mw/cm
2 635nm激光照射15分钟不能有效抑制小鼠(an
‑
bdp nps组)肿瘤生长,仅显示12%的肿瘤生长抑制率,这表明对于治疗大肿瘤,多次pdt治疗是必要的。由于an
‑
bdp nps的肿瘤滞留时间长达约10天,我们可以进行多次pdt治疗:第1天和第3天两次,第1、3和5天三次。正如预期的那样,治疗后通过an
‑
bdp nps两次光照(an
‑
bdp nps+light2),肿瘤生长得到抑制,抑瘤率提高到50%。值得注意的是,an
‑
bdp nps+light 3组当小鼠注射an
‑
bdp nps 3轮光照射时,小鼠肿瘤得到有效抑制,部分肿瘤最终消失(平均抑瘤率为90%)。然而,ce6和卟啉组的小鼠在相同条件下只能接受一次光治疗,因为纳米颗粒表现出有限的肿瘤富集和短的肿瘤滞留时间(图17)。因此,ce6和porphyrin nps都没有导致有效的肿瘤生长抑制(12%抑制率),显示出与一次性光处理的an
‑
bdp nps相似的结果(图16a,c)。这些结果清楚地表明,由于增强的肿瘤保留作用,an
‑
bdp nps可以通过单次注射和多次光照治疗对较大体积的肿瘤进行有效的肿瘤光动力治疗。为了评估较大荷瘤小鼠的抗肿瘤作用,我们还在治疗结束后用h&e和tunel染色用于观察肿瘤组织的形态(图16d)。对照组可见大量间质紧密的细胞,细胞核和细胞质完整,说明细胞状态良好。同时,可以观察到ce6+light和porphyrin+light组只有少量细胞中可以检测到细胞核收缩或破碎。相反,在治疗组(an
‑
bdp nps+light 3)中,细胞核萎缩或破裂,几乎没有观察到完整形态的细胞。接下来,tunel染色用于标记细胞凋亡。正如预期的那样,在an
‑
bdp nps+light(3)组中发现的tunel阳性细胞凋亡荧光信号显着高于任何其他组。在所有组中,an
‑
bdp nps+light(3)在诱导细胞凋亡方面表现出最高的治疗效果。说明光敏剂在肿瘤中长时间保留可以增强大肿瘤模型的光动力治疗。
[0115]
(4)体内生物安全性评价
[0116]
首先血液分析评估了an
‑
bdp nps的生物安全性。具体步骤为:将新鲜无菌的脱纤维绵羊血3ml加入到6ml pbs缓冲液,转速1500rpm离心8min,弃上清液直到上清液澄清。之后将所得红细胞制备2%的红细胞悬液。用不同浓度的an
‑
bdp nps与等体积的2%红细胞悬液在37℃180rpm共孵育4个小时。孵育结束后,转速1500rpm离心8min除去完整的红细胞,取上清液用酶标仪测545nm处的吸光度。
[0117][0118]
其中,受试组为不同浓度an
‑
bdp nps处理的红细胞悬液组;阴性对照组为pbs缓冲溶液孵育的红细胞悬液组;阳性对照组为去离子水孵育的红细胞悬液组;od为545nm处的吸光度。
[0119]
接下来还测试了活体的安全性。具体步骤为:将健康小鼠分为4组(n=5),包括(1)静脉注射(i.v.)生理盐水(100μl)(对照组);(2)用200mw/cm
2 635nm激光照射15min(光照组);(3)尾静脉注射an
‑
bdp nps(200μm,100μl)(an
‑
bdpnps组);(4)尾静脉注射200μm,100μl an
‑
bdp nps 48小时后进行后使用635nm激光、200mw/cm2照射15min(an
‑
bdp nps+light组)。取全血经行分析。用生理盐水组用作阴性对照。
[0120]
an
‑
bdp nps生物体内安全性还通过观察治疗期间内各组小鼠体重有无明显变化,以及治疗结束后主要器官的组织染色进行评价。
[0121]
良好的生物相容性是生物医用材料的必要条件之一。首先,测试进行血液分析以评估an
‑
bdp nps的生物安全性。溶血率小于5%被认为材料具有良好的生物相容性。即使当an
‑
bdp nps溶液的浓度高达200μm时,也没有发生明显的溶血(图18),表明对血液具有良好的生物相容性。
[0122]
其次,我们还对小鼠全血进行测试,所有测量参数都在正常范围内(表1),表明由an
‑
bdp nps引起的急性炎症可以忽略不计,生物相容性良好。
[0123]
表1全血细胞检测包括:rbc、wbc、plt、hgb、hct、mcv、mch、neut、lymph、mono。
[0124][0125]
值得注意的是,不同组的小鼠体重缓慢增加,但在整个实验过程中没有观察到额
外的副作用(图15b和16b)。最后在治疗周期结束后主要小鼠器官组织的组织病理学评估。如图19所示,所有组织的h&e染色在所有组中均未显示出显着的病理变化。说明an
‑
bdp nps具有良好的生物相容性。
[0126]
总之,我们已经证明了强π
‑
π堆积稳定纳米光敏剂是一种有前途的平台,可延长纳米光敏剂在光动力治疗期间的血液循环和肿瘤保留时间。an
‑
bdp nps表现出优异的稳定性,可以在肿瘤部位停留长达10天,这比其他任何现有光敏剂的肿瘤保留时间都要长。在常规测试肿瘤体积大小(~100mm3)的小鼠肿瘤模型中一次注射一次光照可以完全抑制肿瘤的生长。更重要的是,这种具有延长肿瘤滞留时间的纳米光敏剂可以通过单次注射和多次光照治疗成功应用于治疗较大体积肿瘤的小鼠肿瘤模型(~350mm3)。我们的工作强调,合理设计的纳米光敏剂能够通过单次注射实现多次pdt,并增强治疗大体积肿瘤或者恶性肿瘤的光动力治疗效果。这项工作提出了一种可用且简便的方法来延长光敏剂的肿瘤保留时间,进一步促进纳米医学的临床转化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1