一种利用姜提取液培养液体益生菌的方法与流程
1.本发明属于益生菌培育技术领域,具体涉及一种利用姜提取液培养液体益生菌的方法。
背景技术:
2.人体肠道微生物是一个复杂的体系,拥有约100万亿个古细菌和细菌个体,高达500-1000种(但以细菌为主),这些微生物中约90%属于厚壁菌门、拟杆菌门和放线菌门,其中厚壁菌门的乳杆菌属以及放线菌门的双歧杆菌属常被认为是益生菌。对于益生菌而言,当达到足够数目,可以改善宿主肠道微生物平衡,进而对宿主健康产生有益影响。
3.人体肠道微生物中益生菌的数量是随着年龄的增长而不断变化的。双歧杆菌主要存在于人的大肠内,约占成年人大肠总微生物量的6-36%。但是,双歧杆菌的数量随年龄增长而逐渐降低,处于老年阶段的人体肠道内双歧杆菌数量下降极为明显。与双歧杆菌相比,人体肠道内乳杆菌数量更少,成年人粪便微生物中乳杆菌仅占0.01%-0.6%。肠道内微生物的失调尤其是某些微生物数量的改变会导致不同疾病的产生,包括自身免疫疾病和过敏性疾病、腹部疾病、肥胖、炎症性肠病(ibd)等。
技术实现要素:
4.本发明的目的在于提供一种可以提高益生菌生长活性的益生菌的培育方法。
5.本发明为实现上述目的所采取的技术方案为:
6.一种益生菌的培育方法,包括:将大高良姜经脱脂处理后用乙醇溶液提取,得到姜提取液;将姜提取液加入mrs液体培养基中得到含姜提取物型液体培养基,并加入橙皮内酯和琼脂粉用以制备得到含姜提取物型固体培养基;将益生菌接种到含姜提取物型固体培养基中进行培育;所述益生菌为植物乳杆菌和/或双歧杆菌。将姜提取液加入mrs液体培养基中后,再加入橙皮内酯和琼脂粉制成含姜提取物型固体培养基,可以用于植物乳杆菌和/或双歧杆菌的培育,姜提取液中的姜提取物在培育益生菌时,刺激益生菌,传代培养后,益生菌活性更强,在姜提取物存在于固体培养基中时同时使用橙皮内酯后,益生菌的生长活性提高,并在后续经果蔬汁培养后,益生菌的保存稳定性提高,生物活性提高。
7.优选地,姜提取液的使用量为mrs液体培养基的1.2-4.2wt%。
8.优选地,橙皮内酯的使用量为含姜提取物型液体培养基0.05-0.6wt%。
9.优选地,姜提取液制备中,将大高良姜洗净,在70-90℃的温度下烘干,将烘干后的大高良姜粉碎,经石油醚脱脂后干燥;将大高良姜粉末加入乙醇溶液中,在50-70℃的温度下浸提2h以上,浸提完成后真空抽滤,得到姜提取液。
10.更优选地,乙醇溶液中乙醇的质量分数为40-60wt%。
11.更优选地,大高良姜粉末的使用量为乙醇溶液的1-5wt%。
12.优选地,mrs液体培养基配方为:牛肉膏粉、酵母浸粉、酪蛋白酶消化物、柠檬酸三铵、乙酸钠、硫酸镁、硫酸锰、磷酸氢二钾、葡萄糖、吐温-80以及蒸馏水。
13.更优选地,牛肉膏粉的使用量为蒸馏水的0.5-2wt%。
14.更优选地,酵母浸粉的使用量为蒸馏水的0.2-0.8wt%。
15.更优选地,酪蛋白酶消化物的使用量为蒸馏水的0.6-1.8wt%。
16.更优选地,柠檬酸三铵的使用量为蒸馏水的0.1-0.4wt%。
17.更优选地,乙酸钠的使用量为蒸馏水的0.2-1.2wt%。
18.更优选地,硫酸镁的使用量为蒸馏水的0.005-0.015wt%。
19.更优选地,硫酸锰的使用量为蒸馏水的0.0005-0.0035wt%。
20.更优选地,磷酸氢二钾的使用量为蒸馏水的0.05-0.4wt%。
21.更优选地,葡萄糖的使用量为蒸馏水的1-4wt%。
22.更优选地,吐温-80的使用量为蒸馏水的0.04-0.2wt%。
23.优选地,含姜提取物型培养基制备中,将姜提取液加入mrs液体培养基中,混合得到含姜提取物型液体培养基,加入琼脂粉,在110-130℃高压灭菌10-30min,冷却至室温,得到含姜提取物型固体培养基。
24.更优选地,姜提取液的添加量为mrs液体培养基的1.2-4.2wt%。
25.更优选地,琼脂粉的添加量为含姜提取物型液体培养基1-3wt%。
26.优选地,含姜提取物型固体培养基制备中还可以加入橙皮内酯,橙皮内酯的添加量为含姜提取物型液体培养基0.05-0.6wt%。橙皮内酯
27.优选地,植物乳杆菌培育中,将植物乳杆菌冻干菌粉用无菌水溶解,接种至含姜提取物型固体培养基上,在恒温培养箱里培养48h以上,平板划线传代培养。
28.更优选地,植物乳杆菌传代培育中至少传三代。
29.更优选地,植物乳杆菌冻干菌粉的使用量为无菌水的4-12wt%。
30.更优选地,接种量为含姜提取物型固体培养基的1-5wt%。
31.双歧杆菌培育:将双歧杆菌冻干菌粉用无菌水溶解,接种至含姜提取物型固体培养基上,在恒温培养箱里培养48h以上,平板划线传代培养。
32.更优选地,双歧杆菌传代培育中至少传三代。
33.更优选地,双歧杆菌冻干菌粉的使用量为无菌水的4-12wt%。
34.更优选地,接种量为含姜提取物型固体培养基的1-5wt%。
35.本发明的目的在于提供一种可以提高益生菌生长活性、保存稳定性和生物活性的利用姜提取液培养液体益生菌的方法。
36.一种利用姜提取液培养液体益生菌的方法,包括:按上述的一种益生菌的培育方法进行传代培育;将传代培育后的益生菌接种至果蔬汁中按扩培工序进行培养,然后经纳米级仪器过滤得到液体益生菌;所述果蔬选自菠萝、柠檬、木瓜、葡萄、奇异果。
37.优选地,传代培育至少传代三次。
38.优选地,果蔬以如下形式存在或使用:浓缩物、提取物、果泥、果酱、果肉。
39.优选地,纳米级仪器为5-10nm过滤筛。
40.优选地,液体益生菌制备中,将传代培育后的植物乳杆菌、双歧杆菌分别接种到果蔬汁中,于恒温培养箱中扩培50-90d,再于透明器皿中进行10-30d的光合作用,纳米级仪器进行过滤,最终得到高浓度的活性液体益生菌。所得益生菌活性高,能降低胃酸和酶作用影响,使益生菌到达人体肠道时保持较高的活性,可迅速吞噬人体肠胃道残留的蛋白得以裂
变。
41.更优选地,植物乳杆菌的接种量为果蔬汁的1-3wt%。
42.更优选地,双歧杆菌的接种量为果蔬汁的1-3wt%。
43.更优选地,透明器皿为玻璃器皿。
44.更优选地,纳米级仪器为5-10nm的过滤筛。
45.高浓度的活性液体益生菌进行灌装得到活性液体益生菌产品。
46.优选地,果蔬汁配制中,将蒸馏水、菠萝、柠檬、木瓜、葡萄、奇异果混合配制得到果蔬汁。在果蔬汁配制中,菠萝、柠檬、木瓜、葡萄、奇异果中任一种均可以如下形式存在或使用:浓缩物、提取物、果泥、果酱、果肉等。
47.更优选地,菠萝的使用量为蒸馏水的10-26wt%。
48.更优选地,柠檬的使用量为蒸馏水的12-30wt%。
49.更优选地,木瓜的使用量为蒸馏水的8-21wt%。
50.更优选地,葡萄的使用量为蒸馏水的16-36wt%。
51.更优选地,奇异果的使用量为蒸馏水的10-24wt%。
52.优选地,果蔬汁配制中,可以使用葡萄皮色素,葡萄皮色素的使用量为蒸馏水的0.6-6wt%。在使用含姜提取物对益生菌进行培育后,益生菌的生长活性提高,在后续采用果蔬汁培养后制备的液体益生菌时,在果蔬汁中使用葡萄皮色素,可以提高液体益生菌的保存稳定性,并且液体益生菌的生物活性更佳。
53.本发明公开了上述方法制备得到的液体益生菌。
54.本发明公开了橙皮内酯和姜提取物在提高益菌生长活性和/或保存稳定性和/或生物活性中的用途。
55.本发明由于将姜提取物加入mrs培养基中得到含姜提取物型液体培养基,并向含姜提取物型液体培养基加入琼脂粉制成含姜提取物型固体培养基,对植物乳杆菌和双歧杆菌进行培育,因而具有如下有益效果:对植物乳杆菌和双歧杆菌在果蔬汁中培养时的生长活性高,在相同时间下,植物乳杆菌和双歧杆菌的繁殖量更高;并且保存稳定性及生物活性均提高。因此,本发明是一种可以提高益生菌生长活性、保存稳定性和生物活性的利用姜提取液培养液体益生菌的方法。
附图说明
56.图1为益生菌od
600
值图;
57.图2为不同培养时间下益生菌od
600
值图;
58.图3为液体益生菌存活率图;
59.图4为小鼠总胆固醇浓度图。
具体实施方式
60.以下结合具体实施方式和附图对本发明的技术方案作进一步详细描述:
61.实施例1:
62.一种利用姜提取液培养液体益生菌的方法,
63.姜提取液制备:将大高良姜洗净,在90℃的温度下烘干,将烘干后的大高良姜粉
碎,经石油醚脱脂后干燥;将大高良姜粉末加入乙醇溶液中,在60℃的温度下浸提3h,浸提完成后真空抽滤,得到姜提取液。乙醇溶液中乙醇的质量分数为50wt%,大高良姜粉末的使用量为乙醇溶液的3wt%。
64.mrs液体培养基配方为:牛肉膏粉、酵母浸粉、酪蛋白酶消化物、柠檬酸三铵、乙酸钠、硫酸镁、硫酸锰、磷酸氢二钾、葡萄糖、吐温-80以及蒸馏水。牛肉膏粉的使用量为蒸馏水的1wt%,酵母浸粉的使用量为蒸馏水的0.4wt%,酪蛋白酶消化物的使用量为蒸馏水的1.2wt%,柠檬酸三铵的使用量为蒸馏水的0.2wt%,乙酸钠的使用量为蒸馏水的0.6wt%,硫酸镁的使用量为蒸馏水的0.008wt%,硫酸锰的使用量为蒸馏水的0.0015wt%,磷酸氢二钾的使用量为蒸馏水的0.1wt%,葡萄糖的使用量为蒸馏水的2wt%,吐温-80的使用量为蒸馏水的0.08wt%。
65.含姜提取物型培养基:将姜提取液加入mrs液体培养基中,混合得到含姜提取物型液体培养基,加入琼脂粉,在110℃高压灭菌30min,冷却至室温,得到含姜提取物型固体培养基。姜提取液的添加量为mrs液体培养基的2.1wt%,琼脂粉的添加量为含姜提取物型液体培养基2wt%。
66.植物乳杆菌培育:将植物乳杆菌冻干菌粉用无菌水溶解,接种至含姜提取物型固体培养基上,在恒温培养箱里培养48h,平板划线传代培养,传三代。恒温培养箱的温度为37℃。植物乳杆菌冻干菌粉的使用量为无菌水的8wt%,接种量为含姜提取物型固体培养基的3wt%。
67.双歧杆菌培育:将双歧杆菌冻干菌粉用无菌水溶解,接种至含姜提取物型固体培养基上,在恒温培养箱里培养48h,平板划线传代培养,传三代。恒温培养箱的温度为37℃。双歧杆菌冻干菌粉的使用量为无菌水的8wt%,接种量为含姜提取物型固体培养基的3wt%。
68.果蔬汁配制:将蒸馏水、菠萝、柠檬、木瓜、葡萄、奇异果混合配制得到果蔬汁。菠萝的使用量为蒸馏水的20wt%,柠檬的使用量为蒸馏水的24wt%,木瓜的使用量为蒸馏水的16wt%,葡萄的使用量为蒸馏水的21wt%,奇异果的使用量为蒸馏水的18wt%。
69.在果蔬汁配制中,菠萝、柠檬、木瓜、葡萄、奇异果均以如下形式使用:果浆。
70.液体益生菌制备:将传代培育后的植物乳杆菌、双歧杆菌分别接种到果蔬汁中,于恒温培养箱中扩培60d,再于透明器皿中进行20d的光合作用,纳米级仪器进行过滤,最终得到高浓度的活性液体益生菌。恒温培养箱的温度为37℃。植物乳杆菌的接种量为果蔬汁的2wt%,双歧杆菌的接种量为果蔬汁的2wt%。透明器皿为玻璃器皿,纳米级仪器为5nm的过滤筛。
71.高浓度的活性液体益生菌进行灌装得到活性液体益生菌产品。
72.实施例2:
73.一种利用姜提取液培养液体益生菌的方法,
74.本实施例与实施例1相比,不同之处仅在于,含姜提取物型培养基制备中,姜提取液的添加量为mrs液体培养基的3.2wt%。
75.实施例3:
76.一种利用姜提取液培养液体益生菌的方法,
77.姜提取液制备:将大高良姜洗净,在90℃的温度下烘干,将烘干后的大高良姜粉
碎,经石油醚脱脂后干燥;将大高良姜粉末加入乙醇溶液中,在60℃的温度下浸提3h,浸提完成后真空抽滤,得到姜提取液。乙醇溶液中乙醇的质量分数为50wt%,大高良姜粉末的使用量为乙醇溶液的3wt%。
78.mrs液体培养基配方为:牛肉膏粉、酵母浸粉、酪蛋白酶消化物、柠檬酸三铵、乙酸钠、硫酸镁、硫酸锰、磷酸氢二钾、葡萄糖、吐温-80以及蒸馏水。牛肉膏粉的使用量为蒸馏水的1wt%,酵母浸粉的使用量为蒸馏水的0.4wt%,酪蛋白酶消化物的使用量为蒸馏水的1.2wt%,柠檬酸三铵的使用量为蒸馏水的0.2wt%,乙酸钠的使用量为蒸馏水的0.6wt%,硫酸镁的使用量为蒸馏水的0.008wt%,硫酸锰的使用量为蒸馏水的0.0015wt%,磷酸氢二钾的使用量为蒸馏水的0.1wt%,葡萄糖的使用量为蒸馏水的2wt%,吐温-80的使用量为蒸馏水的0.08wt%。
79.含姜提取物型培养基:将姜提取液加入mrs液体培养基中,混合得到含姜提取物型液体培养基,加入橙皮内酯和琼脂粉混合,在110℃高压灭菌30min,冷却至室温,得到含姜提取物型固体培养基。姜提取液的添加量为mrs液体培养基的3.2wt%,橙皮内酯的添加量为含姜提取物型液体培养基0.12wt%,琼脂粉的添加量为含姜提取物型液体培养基2wt%。
80.植物乳杆菌培育:将植物乳杆菌冻干菌粉用无菌水溶解,接种至含姜提取物型固体培养基上,在恒温培养箱里培养48h,平板划线传代培养,传三代。恒温培养箱的温度为37℃。植物乳杆菌冻干菌粉的使用量为无菌水的8wt%,接种量为含姜提取物型固体培养基的3wt%。
81.双歧杆菌培育:将双歧杆菌冻干菌粉用无菌水溶解,接种至含姜提取物型固体培养基上,在恒温培养箱里培养48h,平板划线传代培养,传三代。恒温培养箱的温度为37℃。双歧杆菌冻干菌粉的使用量为无菌水的8wt%,接种量为含姜提取物型固体培养基的3wt%。
82.果蔬汁配制:将蒸馏水、菠萝、柠檬、木瓜、葡萄、奇异果混合配制得到果蔬汁。菠萝的使用量为蒸馏水的20wt%,柠檬的使用量为蒸馏水的24wt%,木瓜的使用量为蒸馏水的16wt%,葡萄的使用量为蒸馏水的21wt%,奇异果的使用量为蒸馏水的18wt%。
83.在果蔬汁配制中,菠萝、柠檬、木瓜、葡萄、奇异果均以如下形式使用:果浆。
84.液体益生菌制备:将传代培育后的植物乳杆菌、双歧杆菌分别接种到果蔬汁中,于恒温培养箱中扩培60d,再于透明器皿中进行20d的光合作用,纳米级仪器进行过滤,最终得到高浓度的活性液体益生菌。恒温培养箱的温度为37℃。植物乳杆菌的接种量为果蔬汁的2wt%,双歧杆菌的接种量为果蔬汁的2wt%。透明器皿为玻璃器皿,纳米级仪器为5nm的过滤筛。
85.高浓度的活性液体益生菌进行灌装得到活性液体益生菌产品。
86.实施例4:
87.本实施例与实施例3相比,不同之处仅在于,含姜提取物型培养基制备中,橙皮内酯的添加量为含姜提取物型液体培养基0.42wt%。
88.实施例5:
89.一种利用姜提取液培养液体益生菌的方法,
90.姜提取液制备:将大高良姜洗净,在90℃的温度下烘干,将烘干后的大高良姜粉碎,经石油醚脱脂后干燥;将大高良姜粉末加入乙醇溶液中,在60℃的温度下浸提3h,浸提
完成后真空抽滤,得到姜提取液。乙醇溶液中乙醇的质量分数为50wt%,大高良姜粉末的使用量为乙醇溶液的3wt%。
91.mrs液体培养基配方为:牛肉膏粉、酵母浸粉、酪蛋白酶消化物、柠檬酸三铵、乙酸钠、硫酸镁、硫酸锰、磷酸氢二钾、葡萄糖、吐温-80以及蒸馏水。牛肉膏粉的使用量为蒸馏水的1wt%,酵母浸粉的使用量为蒸馏水的0.4wt%,酪蛋白酶消化物的使用量为蒸馏水的1.2wt%,柠檬酸三铵的使用量为蒸馏水的0.2wt%,乙酸钠的使用量为蒸馏水的0.6wt%,硫酸镁的使用量为蒸馏水的0.008wt%,硫酸锰的使用量为蒸馏水的0.0015wt%,磷酸氢二钾的使用量为蒸馏水的0.1wt%,葡萄糖的使用量为蒸馏水的2wt%,吐温-80的使用量为蒸馏水的0.08wt%。
92.含姜提取物型培养基:将姜提取液加入mrs液体培养基中,混合得到含姜提取物型液体培养基,加入橙皮内酯和琼脂粉混合,在110℃高压灭菌30min,冷却至室温,得到含姜提取物型固体培养基。姜提取液的添加量为mrs液体培养基的2.1wt%,橙皮内酯的添加量为含姜提取物型液体培养基0.42wt%,琼脂粉的添加量为含姜提取物型液体培养基2wt%。
93.植物乳杆菌培育:将植物乳杆菌冻干菌粉用无菌水溶解,接种至含姜提取物型固体培养基上,在恒温培养箱里培养48h,平板划线传代培养,传三代。恒温培养箱的温度为37℃。植物乳杆菌冻干菌粉的使用量为无菌水的8wt%,接种量为含姜提取物型固体培养基的3wt%。
94.双歧杆菌培育:将双歧杆菌冻干菌粉用无菌水溶解,接种至含姜提取物型固体培养基上,在恒温培养箱里培养48h,平板划线传代培养,传三代。恒温培养箱的温度为37℃。双歧杆菌冻干菌粉的使用量为无菌水的8wt%,接种量为含姜提取物型固体培养基的3wt%。
95.果蔬汁配制:将蒸馏水、菠萝、柠檬、木瓜、葡萄、奇异果、葡萄皮色素混合配制得到果蔬汁。菠萝的使用量为蒸馏水的20wt%,柠檬的使用量为蒸馏水的24wt%,木瓜的使用量为蒸馏水的16wt%,葡萄的使用量为蒸馏水的21wt%,奇异果的使用量为蒸馏水的18wt%,葡萄皮色素的使用量为蒸馏水的2wt%。
96.在果蔬汁配制中,菠萝、柠檬、木瓜、葡萄、奇异果均以如下形式使用:果浆。
97.液体益生菌制备:将传代培育后的植物乳杆菌、双歧杆菌分别接种到果蔬汁中,于恒温培养箱中扩培60d,再于透明器皿中进行20d的光合作用,纳米级仪器进行过滤,最终得到高浓度的活性液体益生菌。恒温培养箱的温度为37℃。植物乳杆菌的接种量为果蔬汁的2wt%,双歧杆菌的接种量为果蔬汁的2wt%。透明器皿为玻璃器皿,纳米级仪器为5nm的过滤筛。
98.高浓度的活性液体益生菌进行灌装得到活性液体益生菌产品。
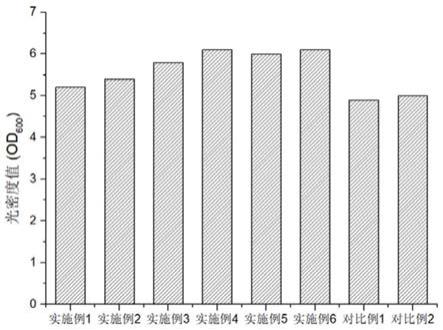
99.实施例6:
100.本实施例与实施例3相比,不同之处仅在于,果蔬汁配制中,葡萄皮色素的使用量为蒸馏水的4.5wt%。
101.对比例1:
102.本对比例与实施例2相比,不同之处仅在于,植物乳杆菌培育和双歧杆菌培育中,将含姜提取物型固体培养基替换为mrs固体培养基。
103.mrs固体培养基:mrs液体培养基中加入琼脂粉,在110℃高压灭菌30min,冷却至室
温。琼脂粉的添加量为mrs液体培养基2wt%。
104.对比例2:
105.本对比例与实施例4相比,不同之处仅在于,植物乳杆菌培育和双歧杆菌培育中,将含姜提取物型固体培养基替换为含有橙皮内酯的mrs固体培养基。
106.mrs固体培养基:mrs液体培养基中加入橙皮内酯和琼脂粉,在110℃高压灭菌30min,冷却至室温。琼脂粉的添加量为mrs液体培养基2wt%,本对比例中橙皮内酯的使用量和实施例4中橙皮内酯的使用量相同。
107.试验例:
108.1.益生菌生长活性测试
109.测试益生菌:植物乳杆菌、双歧杆菌。
110.测试方法:按各实施例和对比例的方法采用含姜提取物型固体培养基对植物乳杆菌、双歧杆菌分别进行传代培育,将传代培育后的植物乳杆菌、双歧杆菌分别接种到mrs液体培养基中,在37℃的温度下恒温培养12h,取样稀释作为待测样,使用紫外分光光度计在600nm波长下测定待测样的光密度值(od
600
)检测。稀释以使培育了24h后的菌液的od
600
值不高于10为宜,测试中各稀释倍数均相同。
111.在益生菌测试中,以植物乳杆菌、双歧杆菌的混合菌液进行光密度值(od
600
)检测,测试结果如图1所示,其中,实施例1方法采用含姜提取物型固体培养基对益生菌培育后,接种到mrs液体培养基培养后,益生菌od
600
值为5.2,同样按实施例2的培育方法处理后并按测试方法进行测试,实施例2处理得到益生菌od
600
值为5.4,对比例1处理得到益生菌od
600
值为4.9,实施例2与对比例1相比,表明姜提取物的使用,在进行植物乳杆菌、双歧杆菌的传代培育后,益生菌活性提高,传代培育后的益生菌在同样时间内繁殖量更高,以od
600
值表征,则相对于对比例1,实施例2测试方法得到益生菌的生长活性提高了10.20%;实施例3测试方法得到的益生菌od
600
值为5.8,实施例4测试方法得到的益生菌od
600
值为6.1,对比例2测试方法得到的益生菌od
600
值为5.0,实施例3-4与实施例2相比,表明在使用姜提取物制备含姜提取物型固体培养基时,橙皮内酯的加入,提高了益生菌的活性,实施例4与对比例2及实施例2、对比例1相比,对比例1与对比例2测试方法得到的益生菌od
600
值基本一致,对合实施例2、4,表明在未使用姜提取物而仅使用橙皮内酯制备固体培养基时,对益生菌的活性没有提高效果,相对于对比例2,实施例4测试方法得到益生菌的生长活性提高了22%;实施例5-6与实施例4相比,表明本发明方法对益生菌活性的提高效果的重现性好。
112.实施例4测试方法测试益生菌od
600
值时,每2h做一次测试,直到24h为止,测试结果如图2所示,其中,益生菌在12h及以前od
600
值迅速升高,在12h以后,od
600
值升高速度放缓。
113.本发明方法制备得到的液体益生菌的生长活性提高了10-25%。
114.2.液体益生菌稳定性测试
115.测试样品:各实施例和对比例制备得到的液体益生菌,以及在10℃的温度下保存6个月,以保存前后菌落数计算益生菌存活率。
116.mrs固体培养基:mrs液体培养基中加入琼脂粉,在110℃高压灭菌30min,冷却至室温。琼脂粉的添加量为含姜提取物型液体培养基2wt%。
117.测试方法:取1ml测试样品,采用无菌水稀释,稀释倍数与益生菌生长活性测试中的稀释倍数相同;吸取0.1ml菌液至mrs固体培养基中,涂布棒使菌液分布均匀,恒温培养
48h,待菌落长成后进行统计。
118.菌落计数:选取菌落数在30-300个之间的培养皿统计菌落总数。当其中有菌落较大片生长或蔓延生长时,不宜采用,若培养皿有一半菌落成片状生长,另一半菌落分布十分均匀,统计生长均匀的培养皿的菌落,做两倍计算,为该培养皿的菌落数。若培养皿上的菌落呈现无明显界限线状生长,每条单链视为一个菌落计数。
119.在益生菌测试中,益生菌保存6个月后的存活率测试结果如图3所示,其中,实施例1方法制备的液体益生菌保存后的益生菌的存活率为36.39%,实施例2方法制备的液体益生菌保存后的益生菌的存活率为37.81%,对比例1方法制备的液体益生菌保存后的益生菌的存活率为33.83%,实施例2与对比例1相比,表明姜提取物的使用,最终制备得到的液体益生菌的稳定性更佳,则相对于对比例1,实施例2测试方法得到液体益生菌的稳定性提高了3.98%;实施例3方法制备的液体益生菌保存后的益生菌的存活率为40.78%,实施例4方法制备的液体益生菌保存后的益生菌的存活率为42.92%,对比例2方法制备的液体益生菌保存后的益生菌的存活率为34.28%,实施例3-4与实施例2相比,表明在使用姜提取物制备含姜提取物型固体培养基时,橙皮内酯的加入,提高了液益生菌的稳定性,实施例4与对比例2及实施例2、对比例1相比,对比例1与对比例2测试方法得到的液体益生菌存活率无显著差异,结合实施例2、4,表明在未使用姜提取物而仅使用橙皮内酯制备固体培养基时,对液体益生菌的保存存活率没有提高效果,但相对于对比例2,实施例4测试方法得到益生菌的稳定性提高了8.64%;实施例6方法制备的液体益生菌保存后的益生菌的存活率为47.67%,实施例6与实施例4相比,表明在按本发明方法制备的果蔬汁中,加入葡萄皮色素后,液体益生菌的稳定性提高,相对于实施例4,实施例6测试方法得到益生菌的稳定性提高了4.75%。
120.本发明方法制备得到的液体益生菌的稳定性提高了3-10%。
121.3.液体益生菌生物学活性测试
122.高脂饲料:小鼠标准饲料60wt%、蔗糖12wt%、蛋黄粉10wt%、猪油12wt%、花生5wt%、胆固醇1wt%。
123.建立肥胖小鼠模型:选取20g的雄性昆明小鼠,以小鼠标准饲料喂养3天后,进行随机分组。分别分成空白组以及测试组,空白组喂以小鼠标准饲料,其余的小鼠喂以高脂饲料。每天喂食饲料、饮用水,每三天更换一次垫料,定时称量小鼠体重,喂养4周后,进行测试实验。
124.测试实验中,空白组继续喂以小鼠标准饲料,同时每天以0.3ml生理盐水进行灌胃;测试组继续喂以高脂饲料,同时每天以0.3ml液体益生菌进行灌胃。测试组以使用的不同实施例或对比例的液体益生菌进行分组及记录。在测试组中分出一组作对照组,对照组继续喂以高脂饲料,同时每天以0.3ml生理盐水进行灌胃。
125.采用总胆固醇试剂盒测定总胆固醇含量,小鼠取血方式为眼眶取血。测定总胆固醇含量严格按照试剂盒标准。总胆固醇低于5.20mmol/l即为正常,高于5.72mmol/l即为异常。
126.以小鼠的总胆固醇含量表征液体益生菌生物学活性,经实施例1的液体益生菌喂养的小鼠的总胆固醇含量为4.6mmol/l,经实施例2的液体益生菌喂养的小鼠的总胆固醇含量为4.5mmol/l,经对比例1的液体益生菌喂养的小鼠的总胆固醇含量为5.1mmol/l,经对照
组的方法喂养的小鼠的总胆固醇含量为6.8mmol/l,表明经高脂饲料喂养后的水鼠的总胆固醇含量超过正常值,经空白组的方法喂养的小鼠的总胆固醇含量为2.2mmol/l,实施例2与对比例1相比,表明姜提取物的使用,最终制备得到的液体益生菌的生物活性更佳,以总胆固醇含量的下降值作为液体益生菌的生物活性的提高值,则相对于对比例1,实施例2测试方法得到液体益生菌的生物活性提高了11.76%;经实施例3的液体益生菌喂养的小鼠的总胆固醇含量为4.2mmol/l,经实施例4的液体益生菌喂养的小鼠的总胆固醇含量为4.1mmol/l,经对比例2的液体益生菌喂养的小鼠的总胆固醇含量为5mmol/l,实施例3-4与实施例2相比,表明在使用姜提取物制备含姜提取物型固体培养基时,橙皮内酯的加入,提高了液益生菌的生物活性,实施例4与对比例2及实施例2、对比例1相比,对比例1与对比例2测试方法得到的液体益生菌生物活性无显著差异,结合实施例2、4,表明在未使用姜提取物而仅使用橙皮内酯制备固体培养基时,对液体益生菌的生物活性没有提高效果,但相对于对比例2,实施例4测试方法得到益生菌的生物活性性提高了18%;经实施例6的液体益生菌喂养的小鼠的总胆固醇含量为3.8mmol/l,实施例6与实施例4相比,表明在按本发明方法制备的果蔬汁中,加入葡萄皮色素后,液体益生菌的稳定性提高,相对于实施例4,实施例6测试方法得到益生菌的稳定性提高了7.32%。
127.本发明方法制备得到的液体益生菌的生物性提高了5-20%。
128.4.微生物检测
129.测试样品:实施例4制备得到的活性液体益生菌产品。
130.大肠菌群检测方法:gb 4789.3-2016。
131.金黄色葡萄球菌检测方法:gb 4789.10-2016。
132.霉菌检测方法:gb 4789.15-2016。
133.本发明制备得到的活性液体益生菌产品中大肠菌群的检测结果小于1,金黄色葡萄球菌检测结果小于1,霉菌检测结果小于1,单位cfu/ml。
134.5.益生菌检测
135.测试样品:实施例4制备得到的活性液体益生菌产品。
136.乳酸菌检测方法:gb 4789.35-2016。
137.双歧杆菌检测方法:gb 4789.34-2016。
138.本发明制备得到的活性液体益生菌产品中乳酸菌的检测结果为2.6
×
10
12
,双歧杆菌检测结果为1.4
×
106,单位cfu/ml。
139.以上实施方式仅用于说明本发明,而并非对本发明的限制,本领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此,所有等同的技术方案也属于本发明的范畴,本发明的专利保护范围应由权利要求限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1