脱氮副球菌氧气诱导型启动子
sphaeroides)、脱氮副球菌(paracoccus denitrificans)pd1222。
11.在一种实施方式中,所述微生物细胞是含所述重组表达载体的重组微生物细胞。
12.在一种实施方式中,所述重组微生物细胞的宿主为好氧反硝化脱氮副球菌dytn
‑
1,该菌株公开于2019年公开的论文《脱氮副球菌dytn
‑
1高效去除污水中的总氮》中。
13.本发明还提供表达外源蛋白的方法,所述方法包括:将所述重组表达载体转入微生物细胞中,在含氧的环境下培养所述微生物细胞。
14.在一种实施方式中,所述含氧的环境中氧气浓度为18~24%。
15.在一种实施方式中,所述方法包括:将所述重组表达载体转入供体菌株中,然后将供体菌株和受体菌株按照一定比例混合均匀,使其直接接触,在此过程中辅助菌株驱使重组载体向受体中迁移完成接合转移。
16.在一种实施方式中,所述表达载体为ind4质粒。
17.在一种实施方式中,所述外源蛋白包括但不限于绿色荧光蛋白。
18.本发明还提供了所述氧诱导型启动子、所述重组表达载体、所述重组微生物细胞或所述方法在调控目的蛋白表达方面的应用。
19.有益效果:本发明通过接合方式在脱氮副球菌中成功筛选到17个受氧气诱导的不同表达强度启动子,分别是p
1845
、p
4237
、p
4462
、p
2480
、p
2068
、p
1851
、p
2486
、p
2495
、p
1746
、p
1849
、p
rpst
、p
mdh
、p
cs
、p
nir
、p
1690
、p
3636
和p
rpsu
。且启动子在有氧状态下单位od的荧光响应值是无氧状态下的2
‑
50倍,说明这些启动子受氧气影响较大,在氧气诱导下有优良的表达效率。针对p.denitrificans氧气诱导型基因元件启动子的挖掘和功能性研究为精细调控基因表达、精细调控代谢通路打下坚实的基础,对利用合成生物学高效脱氮具有极大的意义。
附图说明
20.图1:重组表达载体pind4
‑
pp.den
‑
sfgfp结构示意图。
21.图2:不同氧气诱导型启动子响应强度性能比较图。
具体实施方式
22.限制性内切酶和dna聚合酶分别购自赛默飞和takara公司。多功能酶标仪biotek ht plate reader(winooski,vt,usa)用于检测样品荧光强度。大肠杆菌jm109用于分子克隆,大肠杆菌s17
‑
1λpir作为辅助菌株用于脱氮副球菌dytn
‑
1接合转移,脱氮副球菌dytn
‑
1用于蛋白表达。
23.培养基:
24.m9培养基:甘油4g/l、nh4cl 1g/l、nacl 0.5g/l,kh2po
4 3.0g/l,na2hpo
4 6.78g/l,cacl
2 0.115g/l,mgso
4 0.24g/l。
25.实施例1基因重组载体的构建
26.1.采用引物f:ccatggtgcgtataggtgaagaactg和r:aagcttagaactggcatgcatctttg从含有sfgfp的载体pjkr
‑
h
‑
cdar(购自addgene)中克隆含有ncoi和hindiii酶切位点的sfgfp基因,用限制性内切酶ncoi和hindiii对目的基因sfgfp和质粒pind4(获取自军事医学科学院,公开于论文《山梨糖脱氢酶在脱氮副球菌中的表达》中)分别进行双酶切,构建pind4‑
sfgfp重组表达载体。sfgfp基因片段和pind4酶切反应体系:10
×
quickcut buffer 5
μl,限制性内切酶ncoi和hindiii各1μl,sfgfp或pind4总量为1μg,用dd h2o补足总体积50μl,放入37℃金属浴酶切1h,80℃灭活15min,用1%琼脂糖凝胶电泳检测酶切结果。
27.2.基因片段纯化回收:实验步骤参照生工sangon biotech dna纯化回收试剂盒使用说明书。
28.3.dna连接:测定酶切纯化回收后目的基因sfgfp和质粒pind4的浓度,将其按摩尔比4:1进行混合,加入1μlt4连接酶,2.5μl10
×
t4 dna ligase buffer,用dd h2o补足总体积至25μl,在16℃下连接20h。
29.4.转化:将从
‑
80℃冰箱拿出的感受态细胞e.colijm109在冰上融化10min,向其中加入25μl连接产物,混匀后冰浴15min,之后放入42℃恒温水浴锅中热击90s,迅速放回冰水浴中2min,再向其中加入1000μl的lb培养基(无抗),充分混匀后在37℃,220r/min下复苏1h,最后取100μl复苏后的菌液涂布于含50μg/ml的卡那霉素抗生素的lb固体培养基上,37℃培养12h,待平板上长出单菌落,挑取单菌落进行菌落pcr验证筛选阳性转化子,得到载体pind4‑
sfgfp。
30.5.通过kegg(https://www.kegg.jp/)数据库中搜索paracoccus denitrificans的全基因组序列,搜索p.den
‑
rpst、p.den
‑
rpsu、p.den
‑
2495、p.den
‑
4462、p.den
‑
1690、p.den
‑
3636、p.den
‑
cs、p.den
‑
2480、p.den
‑
4237、p.den
‑
1845、p.den
‑
2068、p.den
‑
1851、p.den
‑
1849、p.den
‑
mdh、p.den
‑
2486、p.den
‑
1746和p.den
‑
nir基因,分析确定p
rpst
、p
rpsu
、p
2495
、p
4462
、p
1690
、p
3636
、p
cs
、p
2480
、p
4237
、p
1845
、p
2068
、p
1851
、p
1849
、p
mdh
、p
2486
、p
1746
和p
nir
启动子序列,使其包含核心区、5'
‑
非编码区(utr)和rbs区域,可直接连接到目标基因的cds区域上游用于基因表达,核苷酸序列分别如seq id no.1~17所示。采用上海生工细菌基因组试剂盒提取脱氮副球菌dytn
‑
1的基因组dna。引物由金唯智生物科技有限公司合成,设计引物的信息见表1。
31.表1 paracoccus denitrifican启动子引物序列信息
[0032][0033]
6.以质粒pind4‑
sfgfp为模板,采用引物f:atggtgcgtataggtgaagaactg和r:gcgcaacgcaattaatgtaagttag制备线性化载体pind4‑
sfgfp,pcr扩增的体系50μl,其中2
×
primestar max dna聚合酶25μl,引物f/r(10μmol/l)各1μl,dna模板1μl,22μldd h2o。扩增程序见表2。pcr产物经1%琼脂糖凝胶电泳检测,按照dna纯化回收试剂盒说明书切胶回收目的片段。
[0034]
表2 pcr扩增程序
[0035][0036]
7.dna连接:测定纯化回收后启动子片段和线性载体的浓度,将其按摩尔比3:1进行混合,加入5μl abclonal连接酶,用dd h2o补足总体积至10μl,在50℃下连接15mim。
[0037]
8.转化:将从
‑
80℃冰箱拿出的感受态细胞e.coli jm109在冰上融化10min,向其中加入15μl连接产物,混匀后冰浴15min,之后放入42℃恒温水浴锅中热击90s,迅速放回冰水浴中2min,再向其中加入1000μl的lb培养基(无抗),充分混匀后在37℃,220r/min下复苏1h,最后取100μl复苏后的菌液涂布于含50μg/ml的卡那霉素抗生素的lb固体培养基上,37℃培养12h,待平板上长出单菌落,挑取单菌落进行菌落pcr验证筛选阳性转化子,得到载体pind4‑
pp.den
‑
sfgfp。
[0038]
实施例2脱氮副球菌接合转化
[0039]
(1)将实施例1构建好的重组质粒pind4‑
pp.den
‑
sfgfp,使用热击法分别转化大肠杆菌s17
‑
1λpir感受态细胞,在50μg/ml的卡那霉素抗性lb培养基上培养24h,挑取单菌落,进行菌落验证并将阳性克隆子转移至lb培养基在200rpm,37℃培养12h时间提取质粒进行测序验证。
[0040]
(2)将步骤(1)构建的含有重组质粒的大肠杆菌s17
‑
1λpir作为供体菌株,脱氮副球菌dytn
‑
1作为受体菌株,分别接种在2支含5ml lb培养基的试管中,37℃过夜培养,分别获得菌体数量为108cfu/ml的菌液。然后将两者按照3:10的体积比转移至同一试管中使试管内供、受体菌混匀并将供、受体菌混合培养物置37℃保温30min。供、受体菌混合培养物保温30min后,将这支试管剧烈振荡使供体菌和受体菌之间的性菌毛断开,从而中止基因的遣传转移。吸取0.1ml菌液涂布于相应的抗性平板培养两天,挑取单菌落进行pcr验证,并将阳性克隆子转移至lb培养基在200rpm,37℃培养12h时间提取质粒进行测序验证得到阳性克隆子。
[0041]
实施例3脱氮副球菌铵盐诱导型启动子调控gfp表达
[0042]
将实施例2步骤(2)得到的阳性菌落经过夜活化后,以2%的接种量接种至含2mlm9培养基的深层孔板中至于有氧的环境下培养;过夜活化的种子液以2%的接种量接种至新鲜m9培养基后分装至5ml离心管,使装液量为4.5ml,以此进行厌氧条件培养。培养48h后取样收集上清液,用pbs缓冲液适当稀释以确保od
600
在0.2
‑
0.8的范围内,使用biotek ht平板阅读器(vt,winooski,usa)在室温37℃下,在485
±
20nm的激发波长和528/20nm的发射波长下测量荧光。最后,通过将od
600
和荧光相除来对荧光进行归一化。
[0043]
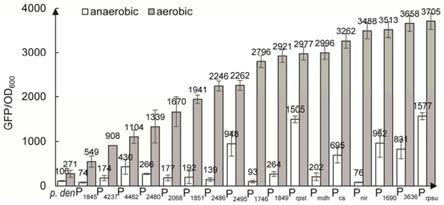
结果显示,不采用诱导型启动子表达的绿色荧光蛋白在厌氧条件下培养的相对荧光强度为100,有氧条件下相对荧光强度为271,通过接合方式在脱氮副球菌中筛选获得的17个受氧气诱导的不同表达强度启动子,在有氧状态下子单位od的荧光响应值是无氧状态下的2
‑
50倍,说明这些启动子受氧气影响较大,在氧气诱导下有优良的表达效率(图2)。
[0044]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1