一种可用于活体检测细胞类型特异神经连接的rAAV及其应用
一种可用于活体检测细胞类型特异神经连接的raav及其应用
技术领域
1.本发明属于病毒载体技术领域,具体涉及一种携带cre依赖表达的1型水通道蛋白与绿色荧光蛋白融合基因的重组腺相关病毒,及其在神经结构环路示踪及功能解析中的应用。
背景技术:
2.大脑是一个复杂而又精细的系统,它是个体的信息处理控制核心。人类大脑中含有数百亿个神经元,其中包含成百上千种细胞类型,神经元之间通过突触连接形成了庞大的神经网络,构成了大脑处理信息、调控行为的结构基础。解析不同细胞类型的神经元亚群在神经网络中扮演的角色,揭示特定类型神经元在特定脑区的数目、定位、形态、输入/输出连接以及相应的生理功能,是理解大脑工作的神经机制的关键。
3.利用携带报告基因的嗜神经工具病毒,感染神经元并标记大脑的神经网络,是目前常用的示踪结构神经网络的技术。工具病毒载体不仅可介导外源基因在多种类型的细胞中稳定高效地表达,还可通过分子元件限制外源基因在特异类型细胞中表达,因此可用于标记细胞类型特异的神经网络,有利于精细地解析神经网络。
4.重组腺相关病毒(recombinant adeno-associated virus,raav)是一类常用于神经环路示踪的病毒载体,它具有多种衣壳蛋白,对应着多种血清型,不同血清型aav感染特性不同。其中raav2-retro(简称retro)血清型aav可通过轴突末梢进入神经元,逆向运输到达神经元胞体并转导外源基因,可用于标记神经纤维直接投射到特定脑区的上游网络。相对于其他标记上游神经连接的病毒载体,raav2-retro具有毒性低、外源基因表达稳定持久、生物安全性高(可与活体mri扫描兼容)等优势。通过结合cre-loxp系统,aav携载的外源基因可在特定类型神经元的特异表达,有利于细胞类型特异的神经网络研究。例如,可在raav基因组中插入dio元件以使外源基因的表达受到cre重组酶的控制。dio元件为double-floxed inverse orientation,是由两种不同的loxp位点组成,在没有cre重组酶的情况下,目的基因不表达,在有cre的情况下,目的基因被翻转至正确的方向,才能开始表达。
5.然而,现有的嗜神经病毒常携带荧光蛋白基因,获得的标记结果多由离体的荧光图像呈现,难以实现在活体水平的全脑结构神经网络的解析。发展高效的活体检测全脑结构神经网络的方法仍是神经网络研究中的一大挑战,发展在活体水平检测细胞类型特异的神经连接的方法更是其中的难点。
6.磁共振成像(magnetic resonance imaging,mri)是一种综合了非侵入性、无电离辐射、高穿透性、适用于软组织等多种优势的成像方法,已被广泛运用于临床诊断与科学研究。编码可被mri检测的蛋白质的基因被称为mri报告基因。mri报告基因目前多用于在活体动物内监测基因表达、细胞迁移等过程。水通道蛋白1(aqp1)基因是近年来报道的一种新型mri报告基因。它的表达产物水通道蛋白(aquaporin,aqp)是一组对水有高度选择通透性的跨膜转运蛋白。过表达aqp1蛋白可影响水分子跨细胞膜扩散率,在细胞及活体组织中产生显著的扩散加权成像(diffusion weighted imaging,dwi)信号的改变,在dwi-mri图像中
呈现暗信号,在表观扩散系数(apparent diffusion coefficient,adc)map中呈高信号。相较于其他mri报告基因,aqp1具有不依赖金属离子、灵敏度高、无明显细胞毒性等多种优势。
7.综上所述,通过raav2-retro载体携带mri报告基因aqp1,可能实现基于mri的神经连接活体检测,再结合cre-loxp系统,可使raav2-retro介导的aqp1表达靶向特定细胞类型神经元,从而可能在活体水平检测特定细胞类型的神经连接。
技术实现要素:
8.本发明的目的在于提供一种可用于活体检测细胞类型特异的神经连接的重组腺相关病毒载体。
9.本发明的另一个目的在于提供可用于活体检测细胞类型特异的神经连接的重组腺相关病毒载体在神经结构环路示踪中的应用。
10.为了实现上述目的,本发明采用以下技术方案:
11.重组腺相关病毒核心质粒:核心质粒携带cre依赖表达的水通道蛋白aqp1基因、荧光蛋白报告基因的表达框。具体地,该质粒是在raav载体质粒的itr中间依次插入cag启动子(seq id no.1所示)、dio元件(seq id no.2所示)、aqp1基因(seq id no.3所示)、2a连接序列(seq id no.4所示)、egfp基因(seq id no.5所示)、wpre转录后调控元件(seq id no.6所示)以及polya序列(seq id no.7所示),构建重组腺相关病毒核心质粒paav-cag-dio-aqp1-2a-egfp-wpre-pa。
12.重组腺相关病毒:该病毒是以paav-cag-dio-aqp1-2a-egfp-wpre-pa为核心质粒制备重组腺相关病毒,具体方法为:将包装raav所需的辅助质粒、raav2-retro(简称retro)血清型质粒、核心质粒共同转染hek293t细胞,收集离心后的细胞沉淀纯化重组腺相关病毒raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa。
13.上述重组腺相关病毒在活体水平检测细胞类型特异神经连接中的的应用:将该重组腺相关病毒注射在cre转基因小鼠的大脑中,病毒感染神经元并在神经元中介导aqp1蛋白表达,通过磁共振成像dwi方法观察活体大脑,在活体大脑中显示其他脑区与注射位点被感染神经元之间的细胞类型特异的神经连接,具体细胞类型由转基因小鼠cre品系决定。在本发明的具体实施方式中,将重组腺相关病毒raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa注射在thy1-cre转基因小鼠的a脑区,经过一段时间后,dwi-mri成像显示b脑区有aqp1引起的dwi信号变化,从而表明a脑区与b脑区存在神经连接,该神经连接为b脑区的thy1阳性特异类型神经元对a脑区有直接轴突投射,该神经连接的细胞类型、方向与连接级数均已确定。由此所得的明确的神经结构连接信息为后续b脑区到a脑区的神经投射的功能解析提供了结构基础。
14.与现有方法相比,本发明具有以下优点:
15.1、本发明中采用的raav2-retro血清型重组腺相关病毒,其可由轴突末梢进入神经元,并通过轴突运输逆向进入神经元胞体,可明确指示神经连接;
16.2、本发明中重组腺相关病毒raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa介导表达的aqp1蛋白是一种dwi-mri造影剂,相对于常用的mri报告蛋白铁蛋白,此造影剂灵敏度高,且不依赖金属离子,可更快地产生mri造影效果;
17.3、本发明提出的方法可在活体水平观察大脑神经连接,适用于长时程观察和处理
前后自身对照实验等,对大脑神经结构网络研究具有重要意义;
18.4、本发明提出的方法得出的神经网络结构连接为细胞类型特异的神经连接,具体细胞类型由转基因小鼠cre品系决定,可灵活应用于检测各种细胞类型特异的神经连接;
19.5、本发明提出的方法得出的神经网络结构连接方向明确,即为逆向标记;
20.6、本发明提出的方法得出的神经网络结构连接级数明确,即为直接连接,而非跨多级突触连接。
附图说明
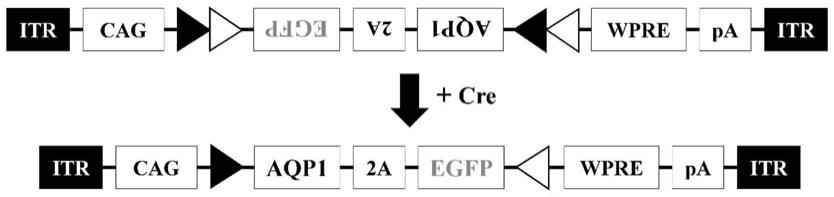
21.图1为raav-cag-dio-aqp1-2a-egfp-wpre-pa病毒的基因组示意图。两侧itr中间为外源表达框,cag为启动子,aqp1为水通道蛋白基因,2a为连接序列,egfp为绿色荧光蛋白基因,wpre为转录后增强元件,pa为polya序列。黑色三角形与白色三角形分别代表不同的loxp位点。在cre重组酶存在的情况下,loxp位点中间的aqp1-2a-egfp序列被翻转至可正常表达的方向。
22.图2为注射raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa的小鼠大脑的mri成像以及荧光成像结果。a为根据dwi-mri图像计算出的adc值的差异结果,箭头指示的脑区ctx、cpu、ins、tha和bla为adc值明显上升(dwi信号下降)的脑区;b为小鼠脑片的绿色荧光成像结果。绿色为病毒介导表达的egfp荧光信号,蓝色为细胞核的dapi染色信号。
23.图3为注射raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa的小鼠脑片的cre免疫组化检测结果。红色荧光信号为cre的免疫组化染色信号,ctx、tha和bla脑区中均有红色和绿色荧光信号,egfp信号与cre免疫组化信号大量重叠。
具体实施方式
24.本发明所述技术方案,如未特别说明,均为本领域的常规技术,所述试剂与材料,如未特别说明,均来源于商业渠道。此处展示的具体实施例仅用于解释本发明,而不用于限定本发明。
25.实施例1:携带cre依赖表达的aqp1与egfp融合基因的质粒paav-cag-dio-aqp1-2a-egfp-wpre-pa的构建与重组腺相关病毒raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa的制备
26.paav-cag-dio-aqp1-2a-egfp-wpre-pa中的dio元件使得目的基因仅在cre存在的情况下,才能开始表达。为了提高目的基因的表达水平,我们选取了真核生物强启动子cag启动子。为了使aqp1基因与绿色荧光蛋白(egfp)报告基因融合表达,我们选取了2a自剪切多肽编码序列作为aqp1基因与egfp基因的连接序列。为了提高目的基因转录后的稳定性,我们在目的基因的3’端增加了wpre转录后调控元件以及polya序列。我们利用常规分子克隆方法在包装raav的核心质粒paav-mcs中的aav的末端重复序列(itr)中间插入cag启动子(seq id no.1所示)、dio元件(seq id no.2所示)、aqp1基因(seq id no.3所示)、2a连接序列(seq id no.4所示)、egfp基因(seq id no.5所示)、wpre转录后调控元件(seq id no.6所示)以及polya序列(seq id no.7所示);获得了含有所需raav基因组的paav-cag-dio-aqp1-2a-egfp-wpre-pa质粒。制备的raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa基因组示意图如图1所示。
27.重组腺相关病毒raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa的包装和纯化步骤如下:
28.首先将hek293t细胞铺到10cm细胞皿中培养至80%密度,将包装raav所需的三个质粒(辅助质粒paav-helper、血清型质粒paav-rc2-retro、核心质粒paav-cag-dio-aqp1-2a-egfp-wpre-pa)以摩尔比(1:1:1)共同转染hek293t细胞。转染72h后,用细胞刮将产毒的贴壁细胞刮下后离心,收集离心后的细胞沉淀。然后,将细胞沉淀裂解液用核酸酶处理,病毒上清液中的raav用peg/nacl沉淀浓缩。将含有raav的裂解液上清用碘克沙醇密度梯度超速离心分离纯化,最后将纯化得到的raav分装后,在-80度冰箱冻存。使用biorad公司的cfx connect荧光定量pcr仪进行实时荧光定量pcr测定raav病毒的滴度。
29.实施例2:注射raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa的小鼠大脑的mri成像以及荧光成像观察
30.将raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa病毒通过脑立体定位注射在thy1-cre小鼠的背侧纹状体脑区(cpu,坐标:ap-0.5mm;ml-2mm;dv-3.3mm),其滴度为5
×
10
12
vg/ml,注射体积为1μl。将对照病毒raav2-retro-cag-dio-egfp-wpre-pa注射在对照组thy1-cre小鼠背侧纹状体脑区,其滴度为5
×
10
12
vg/ml,注射体积为1μl。
31.3周后,使用7.0t磁共振成像仪对动物大脑进行活体mri观察,其中用到的扩散加权成像的序列为基于steam的se-dwi序列,参数为:tr=3000ms,te=24ms,平均次数为2,序列总时长为51min12s。扩散梯度持续时间为7ms,扩散梯度间隔时间为100ms,b值为1000s
·
mm-2
。fov为1.8
×
1.8cm2,空间分辨率为0.18
×
0.18mm,层厚为0.8mm。根据实验组与对照组的dwi图像,计算出两组的adc map并比较adc值的差异。图2a显示了实验组相对于对照组脑区ctx、cpu、ins、tha和bla的adc值明显上升。这表明病毒成功感染神经元,从注射位点cpu经轴突逆向运输到达多个上游脑区(ctx、ins、tha和bla),并介导表达改变dwi-mri信号的aqp1蛋白。从而表明此方法可在活体水平检测出上游脑区(ctx、ins、tha和bla)的thy1阳性神经元与cpu的神经连接。
32.mri实验后,麻醉小鼠,进行心脏灌流后取出鼠脑并做冰冻切片。随后对小鼠大脑切片进行dapi染色,以显示细胞核位置。随后进行荧光成像,结果如图2b所示,绿色为病毒介导表达的egfp荧光信号,蓝色为细胞核的dapi染色信号。绿色荧光信号展示的egfp高表达区域dwi-mri信号改变区域高度一致,均为ctx、cpu、ins、tha和bla等脑区,离体荧光成像的神经连接示踪结果验证了mri的活体检测结果。同时也证明了dwi-mri信号变化是由病毒携带的aqp1高表达引起的。
33.实施例3:注射raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa的小鼠脑片的cre免疫组化检测
34.将raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa病毒通过脑立体定位注射在thy1-cre小鼠的背侧纹状体脑区(cpu,坐标:ap-0.5mm;ml-2mm;dv-3.3mm),其滴度为5
×
10
12
vg/ml,注射体积为1μl。3周后,使用7.0t磁共振成像仪对动物大脑进行活体dwi-mri观察。mri实验后,麻醉小鼠,进行心脏灌流后取出鼠脑并做冰冻切片。随后使用兔来源的cre抗体和羊抗兔二抗(红色)对小鼠大脑切片进行免疫组化染色,以显示cre蛋白的定位。thy1-cre小鼠中表达cre蛋白的神经元即为thy1阳性神经元。图3中红色荧光信号为cre的免疫组化染色信号,ctx、tha和bla脑区中均有红色和绿色荧光信号,并且egfp信号与cre免
疫组化信号大量重叠,表明egfp与cre蛋白表达重叠。从而证明了上游脑区ctx、tha和bla中被绿色荧光蛋白标记的神经元为thy1阳性,即通过raav2-retro-cag-dio-aqp1-2a-egfp-wpre-pa病毒标记,并通过mri活体检测的cpu上游连接的神经元为thy1阳性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1