犬细小病毒纳米抗体CPV-VHH-E3及其应用
犬细小病毒纳米抗体cpv-vhh-e3及其应用
技术领域
1.本发明涉及免疫学领域,特别是涉及一种犬细小病毒纳米抗体cpv-vhh-e3及其应用。
背景技术:
2.犬细小病毒(canine parvovirus,cpv)属于细小病毒科、细小病毒属。cpv是一种dna病毒,但它的变异速度非常快,几乎接近一些rna病毒。该病毒中最广为人知的病毒是犬细小病毒2型(cpv-2),1978年cpv-2在美国爆发并被报道,从那之后cpv以极快的速度席卷全球,相继出现了cpv-2a、cpv-2b、cpv-2c变异毒株。与最开始的cpv-2型相比,新突变型毒株的致病性和传播性更强,不仅犬类对其更加易感,宿主范围还变的更广,猫也可以感染并发病,尤其cpv-2c型突变株更是呈现出了毒力更强、致病力更高和死亡率更快等特点,这也使得cpv的防治工作更加困难。
3.疫苗接种是目前防控cpv最有效的手段,尤其是在适当的时间为幼犬进行接种。目前,使用最多和效果最好的疫苗是弱毒活疫苗,它可以有效保护易感的犬类免受cpv的感染。弱毒疫苗使用的毒株多是由cpv-2弱化所得,具有很好的免疫原性,并且免疫持续期长。但是,随着野毒株的不断变异,异源病毒之间的交叉保护反应较弱,免疫失败的案例时有发生。同时,活疫苗还存在着散毒和毒力返强等生物安全风险,因此虽然弱毒活疫苗是目前使用率最高且免疫保护效果最好的疫苗,但是它并不是预防cpv的最佳选择,随着疫苗研究技术的不断发展,活疫苗必将逐渐被淘汰。
4.纳米抗体是衍生于hcabs的抗体,hcabs是一种仅存在于驼科动物和鲨鱼体内的一种天然缺失轻链、仅由重链组成的抗体。这些重链抗体(hcabs)的抗原结合位点仅由单个结构域形成,即重链抗体的可变区(variable domain of heavy chain of heavy chain antibody,vhh),克隆此结构所形成的的抗体是天然形成的最小抗体片段,因此也被称为纳米抗体(nanobodies,nab)。纳米抗体在骆驼科动物中被命名为vhh。近年来,纳米抗体应用在动物疫病领域的相关研究也越来越多。例如:杨利(2017)等利用重组的抗pcv2纳米抗体作为捕获抗体,构建了一种定量检测pcv2的elisa方法。在该方法中,纳米抗体的应用有效降低了检测时的交叉反应,为猪圆环病毒疫苗的生产提供了一种更好的病毒含量测定方法。杨艳(2021)等通过噬菌体展示技术构建了针对牛病毒性腹泻(bvdv)病毒的纳米抗体文库,并筛选出一个与bvdv-ns3蛋白反应良好的纳米抗体序列,为bvdv的预防和控制及纳米抗体应用开发奠定了一定的基础。而目前,还没有用于防控和治疗犬细小病毒的纳米抗体报道过。
技术实现要素:
5.本发明的目的是提供一种犬细小病毒纳米抗体cpv-vhh-e3及其应用,以解决上述现有技术存在的问题,通过噬菌体展示技术构建了犬细小病毒的纳米抗体免疫文库,通过筛选获得特异性抗cpv纳米抗体cpv-vhh-e3,通过试验验证该纳米抗体可以特异性结合
cpv。
6.为实现上述目的,本发明提供了如下方案:
7.本发明提供一种犬细小病毒纳米抗体cpv-vhh-e3,其重链可变区序列由如seq id no:1所示氨基酸序列组成。
8.seq id no:1如下:
9.qlqlvesgggsvqpggslrlscaasgftldfyrvgwfrqapgkerqgvacigsagdrtfyvdsvkgrftiskdntkntvylqmnslkpedtavyycaavlspritsvqamcthhgegfdywgqgtqvtvssepktpkpq
10.本发明还提供一种编码所述的纳米抗体cpv-vpp-e3的基因,其核苷酸序列如seq id no:2所示。
11.seq id no:2如下:
12.cagttgcagctcgtggagtcgggtggaggctcggtgcaacctggggggtctctgagactctcctgtgcagcctctggattcactttggatttttatcgcgtaggctggttccgccaggccccagggaaggagcgtcagggggtcgcatgtattggtagtgctggtgataggaccttctatgtggactccgtgaagggccgattcaccatctccaaagacaacaccaagaacacggtgtatctgcaaatgaacagcctgaaacctgaggacacagccgtttattactgtgcagcagttcttagtcctcggattactagtgttcaggctatgtgtacccatcatggcgaagggtttgactactggggccaggggacccaggtcaccgtctcctcagaacccaagacaccaaaaccacaa
13.本发明还提供一种含有所述的基因的表达载体。
14.优选的是,所述表达载体为pcdna3.1。
15.本发明还提供一种含有所述的表达载体的宿主细胞。
16.优选的是,所述宿主细胞为hek293f细胞。
17.本发明还提供一种所述的纳米抗体cpv-vhh-e3在制备抗犬细小病毒药物或者疫苗中的应用。
18.本发明还提供一种抗犬细小病毒的组合物,所述组合物包括所述的纳米抗体cpv-chh-e3。
19.本发明公开了以下技术效果:
20.本发明通过噬菌体展示技术成功构建了纳米抗体的cpv免疫文库,初始文库容量为2
×
106cfu/ml,文库多样性良好。通过三轮特异性淘选,成功筛选出特异性的纳米抗体序列cpv-vhh-e3。然后再利用基因重组技术,通过哺乳动物细胞表达系统成功表达出重组的纳米抗体cpv-vhh-e3,并且经elisa、ifa鉴定表明该纳米抗体能特异性结合cpv。因此,本发明有望开发出可用于cpv的临床诊断和治疗的纳米抗体新型制剂,为纳米抗体应用于兽用生物制品领域提供一定的理论储备。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1为cpv-2c在crfk细胞上的cpe;a:cpv-2c接种crfk细胞后出现的cpe;b:正常的crfk细胞;
23.图2为cpv粒子在蔗糖密度梯度中的位置;
24.图3为纯化病毒的检测结果;a:纯化后的cpv;b、c和d:分别为10倍、100倍和1000倍稀释后的纯化病毒;
25.图4为cpv-2c的电镜图片;
26.图5为elisa检测血清抗体效价;
27.图6为vhh基因pcr扩增结果;a:rna;b:第一轮扩增产物;c:第二轮扩增产物(vhh);
28.图7为初始抗体库菌落数;
29.图8为菌液pcr结果;m为maker,1-48为单菌落样品;
30.图9为序列的进化树分析;
31.图10为vhh基因的pcr扩增产物;
32.图11为vhh基因的酶切产物;
33.图12为pcdna3.1-vhh重组表达载体的pcr鉴定;m:2k dna maker;1~12:pcdna3.1-vhh-h1;13~24:pcdna3.1-vhh-e3;25~36:pcdna3.1-vhh-d4;37~48:pcdna3.1-vhh-f5;
34.图13为对照载体pcdna3.1-egfp转染后24小时的荧光图;
35.图14为细胞培养上清sds-page电泳结果;
36.图15为纯化后vhh的sds-page电泳结果;
37.图16为ifa实验结果;a:vhh cpv-h1;b:vhh cpv-e3;c:vhh cpv-d4;d:vhh cpv-f5;e:二抗对照组;f:空白细胞对照组。
具体实施方式
38.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
39.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
40.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
41.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
42.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
43.实施例1犬细小病毒纳米抗体的构建和特异性筛选
44.1、试验材料
45.1.1毒种、细胞、载体和实验动物
46.cpv-2c(ts02株f12代)由中国农业科学院北京畜牧兽医研究所提供;猫肾细胞(crfk、f86代)由中国农业科学院北京畜牧兽医研究所提供;健康羊驼(24月龄、雄性)及pcomb3x载体购自艾柏森(江苏)生物科技有限公司;tg1感受态细胞购自北京博迈德基因技术有限公司;dh5α购自南京vazyme公司。
47.1.2主要试剂溶液配制
48.1)lb液体培养基:分别称取胰蛋白胨10g、酵母提取物5g、氯化钠10g,加去离子水约800ml,搅拌至完全溶解后定容至1l,分装后高压灭菌,常温保存备用。
49.2)lb固体培养基(amp+):分别称取胰蛋白胨10g、酵母提取物5g、氯化钠10g、琼脂粉15g、加去离子水约800ml,加热搅拌至完全溶解,晾至室温后定容至1l,121℃高压灭菌20分钟,降温至50℃左右加入1ml氨苄溶液,混合均匀后分装至一次性无菌培养皿中,静置凝固后置于2~8℃保存备用。
50.3)氨苄溶液(100mg/ml amp):称取氨苄青霉素5g,加去离子水约40ml,完全溶解后定容至50ml,0.22μml针式滤器过滤除菌后分装至1.5ml ep管中,-20℃保存。
51.4)ph8.0 20mm tris-hcl缓冲液:称取tris粉末2.42g,加去离子水约900ml,搅拌溶解后用适量盐酸调节ph至8.0,室温定容至1l,0.22μm过滤除菌,室温保存备用。
52.5)包被缓冲液(ph9.6 50mm碳酸盐缓冲液):称取碳酸钠1.59g、碳酸氢钠2.93g、加去离子水约800ml,搅拌溶解后调节ph至9.6,定容至1l。
53.6)10
×
pbs缓冲液:称取磷酸二氢钾2g、十二水合磷酸氢二钠29g、氯化钾2g、氯化钠80g,加去离子水约800ml,调节ph至7.4,定容至1l。
54.7)洗涤缓冲液(pbst):取10
×
pbs缓冲液100ml、吐温-20 0.5ml,加去离子水定容至1l。
55.8)20%/30%/40%/50%蔗糖溶液:称取6g/9g/12g/15g蔗糖,分别加20mmtris-hcl缓冲液约20ml,完全溶解后用缓冲液定容至30g,0.45μm过滤除菌。
56.9)soc培养基:分别称取胰蛋白胨20g、酵母提取物5g、氯化钠0.5g,加去离子水约900ml,再加入250mm氯化钾10ml,搅拌至完全溶解后定容至1l,高压灭菌,常温保存备用。使用前需加入5ml无菌的2m氯化镁和9ml无菌的40%葡萄糖溶液。
57.2、实验方法
58.2.1cpv的扩繁与纯化
59.取crfk冻存细胞1支,复苏至含5%fbs的dmem培养基中,置于37℃、5%co2培养箱培养,每2~3天传代一次,待细胞状态稳定后扩繁。细胞传代时按1%的比例同步接种cpv-2c ts02株病毒,37℃、5%co2培养4~5天,约80%cpe时收获,于-20℃冻融3次后经8000rpm离心5分钟,收集上清液。细胞培养上清用截留分子量10kd的超滤膜包浓缩10倍,置于20%蔗糖垫上,30000rpm超速离心3小时,沉淀用适量20mm tris-hcl缓冲液重悬。将重悬病毒置于20%、30%、40%和50%的蔗糖密度梯度溶液上层,经35000rpm离心3小时后,用注射器吸出位于30%~40%蔗糖密度区域的病毒条带,用适量缓冲液稀释后再次超离沉淀病毒,去除悬液中的蔗糖,沉淀用适量缓冲液重悬。纯化后的病毒悬液通过cpv抗原检测试纸条和透射电镜的方法进行鉴定,同时用紫外分光光度计测定蛋白浓度以供后续使用参考。
60.2.2高免外周血的获得
61.2.2.1疫苗制备及免疫
62.将纯化病毒以终浓度300μg/ml的量与等体积的弗氏完全佐剂/弗式不完全佐剂混合乳化配苗。一免采用弗氏完全佐剂配制的疫苗,经多点肌肉注射(脊柱两侧和腋下各4个点,每点接种0.2ml)免疫24月龄健康雄性羊驼1只。分别于一免后第14天、28天和42天进行多次加强免疫,加强免疫采用弗氏不完全佐剂配制的疫苗,免疫接种方式及剂量与一免相同。
63.2.2.2抗体水平监测
64.分别于三免和四免后第14天采集免疫羊驼的外周血,分离血清,通过elisa的方法检测cpv抗体效价。elisa检测方法如下:
65.(1)包板:用包被缓冲液将纯化的cpv稀释至5μg/ml,加入96酶标板,100μl/孔,4℃过夜,弃包被液,用pbst洗涤5次。
66.(2)封闭:每孔加300μl pbsm(含5%脱脂奶粉的pbs),37℃封闭2小时,弃封闭液,用pbst洗涤5次,甩干后-20℃保存备用。
67.(3)待测血清稀释孵育:将三免和四免后14天采集的羊驼血清稀释至1000倍、5000倍、25000倍和125000倍,分别加入包被好的酶标板,100μl/孔,每个稀释度2孔,同时用未免疫cpv的羊驼血清作为阴性对照,37℃孵育1小时后弃血清,用pbst洗涤5次。
68.(4)二抗孵育:每孔加入100μl 10000倍稀释的goat anti-alpaca igg h&l(hrp)二抗,37℃孵育1小时后弃去二抗,用pbst洗涤5次。
69.(5)显色:每孔加入100μl tmb显色液,避光孵育15分钟。
70.(6)终止:加入50μl 2m硫酸溶液,终止显色反应。
71.(7)结果判定:测定od
450
值,样品血清与阴性血清吸光值的平均数之比>2.1则判断为阳性,吸光值达到阳性标准的最高稀释倍数作为血清的抗体效价。
72.2.2.3vhh基因扩增
73.2.2.3.1淋巴细胞分离
74.于四免后的第14天经颈静脉采集羊驼外周血约30ml,分装于抗凝管内,缓慢颠倒抗凝管数次,防止血液凝集。2小时内按照淋巴细胞分离液说明书对淋巴细胞进行分离。将采集的新鲜血液按1:1的比例加入生理盐水进行稀释,在10ml水平离心管中先放入5ml淋巴细胞分离液,再将5ml稀释后的血液缓慢加入淋巴细胞分离液上方,1500rpm水平离心20分钟,用注射器小心吸取中间层白色云雾状淋巴细胞。用生理盐水将吸出的淋巴细胞稀释5倍后再次小心加入等量的淋巴细胞分离液上方,1500rpm水平离心20分钟,重复此步骤1次后,将最后一次洗出的淋巴细胞稀释后以1000rpm离心10分钟,沉淀用适量生理盐水重悬。分离出的淋巴细胞应尽快提取rna,或加入适量trizol后于-70℃冷冻保存。
75.2.2.3.2rna提取
76.采用trizol方法提取rna,具体操作如下:
77.(1)取100μl分离的淋巴细胞悬液置于离心管内,加入1ml trizol,反复吹打混匀后室温放置5~10分钟。
78.(2)加入0.2ml氯仿,剧烈摇晃15秒后室温静置5分钟。
79.(3)12000rpm离心15分钟后可见明显分层,吸取上层水相至新的离心管中。
80.(4)加入等体积预冷的异丙醇,混匀后室温静置10分钟。
81.(5)12000rpm离心15分钟,弃上清,沉淀加入1ml不含rnaes酶的75%乙醇冲洗。
82.(6)8000rpm离心10分钟,弃净上清,沉淀在室温放置5~10分钟晾干。
83.(7)加入50μl depc水适当吹打重悬沉淀,56℃水浴5分钟加速溶解。取少量rna溶液测定od值并进行凝胶电泳检测,剩余冻存于-80℃。
84.2.2.3.3反转录
85.经检测质量合格的rna按照takara的cdna合成试剂盒说明书进行反转录。具体操作如下:
86.1)在pcr管中配制下列反应混合液,见表1。
87.表1反转录体系1
[0088][0089]
2)65℃反应5分钟后迅速置于冰粉中冷却2分钟。
[0090]
3)在上述反应液中加入下列组分,见表2。
[0091]
表2 rna反转录体系2
[0092][0093]
4)将上述所有反应液置于30℃静置10分钟,42℃反应50分钟,95℃反应5分钟后置于-20℃保存备用。
[0094]
2.2.3.4vhh基因的pcr扩增
[0095]
根据杨艳丽等(杨艳丽等,2019)方法设计了两轮的巢氏pcr引物,以去除羊驼体内vh基因的干扰,同时在第二轮pcr引物中引入sfi i酶切位点,引物序列如下:
[0096]
第一轮pcr引物:
[0097]
vhh f1:5
′‑
gtcctggctgctcttctacaagg-3
′
;
[0098]
vhh r1:5
′‑
ggtacgtgctgttgaactgttcc-3
′
;
[0099]
第二轮pcr引物:
[0100]
sfi i-vhh f2:
[0101]5′‑
gccatgacttatataggcccaggcggcccagttgcagctcgtggagtcagga-3
′
(下划线为
sfi i酶切位点);
[0102]
sfi i-vhh r2:
[0103]5′‑
gccatgacttatataggccggcctggccggggtcttcgctgtggtgcgccgaggaga-3
′
(下划线为sfi i酶切位点);
[0104]
以2.2.3.3反转录的cdna为模板,采用第一轮pcr引物扩增vhh基因片段,pcr反应体系见表2-5,扩增程序见表4。pcr产物经1.0%核酸凝胶电泳鉴定,确认大小约400bp目的条带扩增成功后作为模板进行第二轮扩增,采用第二轮pcr扩增引物,扩增体系和程序均与第一轮相同,见表3及表4。最终扩增产物经凝胶电泳鉴定并回收目的片段凝胶。
[0105]
表3 pcr扩增体系
[0106][0107]
表4 pcr扩增程序
[0108][0109]
2.2.4 m13噬菌体抗体文库的构建
[0110]
2.2.4.1载体构建
[0111]
用sfi i酶分别对2.2.3.4第二轮pcr回收的目的片段和pcomb3x载体进行酶切,酶切反应体系见表5。各组分分别加入pcr管中,混匀后短暂离心至管底,置于37℃反应过夜。
[0112]
表5酶切反应体系
[0113][0114]
酶切产物经核酸电泳凝胶鉴定后回收目的片段。根据回收核酸浓度调整连接体系,用t4 dna连接酶连接vhh基因片段与pcomb3x载体,连接反应体系见表6,反应条件为37
℃30分钟。
[0115]
表6 t4 dna连接酶连接体系
[0116][0117]
2.2.4.2电转化
[0118]
将连接产物通过电转导入tg1感受态细胞,具体电转步骤入下:
[0119]
(1)取出tg1电转感受态细胞1支,置于冰上解冻,待感受态细胞完全融化后加入10μl连接产物,冰上静置10分钟,全部操作尽可能保持在冰上完成;
[0120]
(2)轻轻将上述感受态细胞移入预冷的电转杯,1800v电击1次,立即加入1ml soc培养液,轻柔转移到移入2ml ep管中;
[0121]
(3)37℃、200rpm振荡培养1小时,全部涂布于lb(amp+)固体平板上,37℃倒置培养过夜;
[0122]
(4)将平板上长出的所有菌落收集至5ml lb培养基中,再加入5ml含有40%甘油的lb培养基,即为抗cpv纳米抗体的初始抗体库,分装后于-80℃保存。
[0123]
2.2.4.3初始抗体库的鉴定
[0124]
1)库容的测定:取10μl初始抗体库菌液,用lb培养基稀释1000倍,取200μl稀释后的菌液涂布于固体lb(amp+)培养基平板上,37℃倒置培养过夜。次日计数平板上菌落数目,按照下列公式计算初始文库的库容。库容达到105~106即可达到筛选需求。计算时体积均以μl为单位。
[0125]
库容(cfu/ml)=(菌落数/涂布菌液体积)
×
稀释倍数
×
(1000/原始库取样体积)
[0126]
2)阳性率的检测:从上述平板中随机挑取48个单菌落,加入500μl lb(amp+)培养基,37℃、200rpm振荡培养4小时,以此为模板,用vhh基因的扩增引物sfi
ⅰ‑
vhh f2和sfi
ⅰ‑
vhh r2进行pcr扩增,扩增体系及条件同表2-5和表2-6。pcr产物经1.5%凝胶电泳检测后计算阳性率。
[0127]
3)抗体库多样性分析:随即挑选20个上述pcr检测呈阳性的菌液,送测序公司测序,用dnaman和mega软件分析测序结果并绘制系统进化树,分析抗体库的多样性。
[0128]
2.2.5 cpv特异性重组噬菌体的淘选和富集
[0129]
2.2.5.1 vhh抗体库的扩增和拯救
[0130]
1)取初始库菌液100μl,加入100ml lb(amp+)培养基中,37℃振荡培养4~6小时,使菌液od
600
值达到0.6~0.8。
[0131]
2)加入辅助噬菌体m13k07,按照感染复数(moi)20:1计算添加量,37℃静置30分钟后,再经37℃、180rpm振荡培养30分钟。
[0132]
3)将上述菌液在室温条件下5000rpm离心10分钟,弃上清。
[0133]
4)用200ml lb(amp+、kana+)培养基重悬菌液,并置于30℃、200rpm振荡培养过夜。
[0134]
5)将上述培养液经4℃、8000rpm离心20分钟,收集上清液至干净无菌的玻璃三角瓶内,缓慢向其中加入1/5体积的5
×
peg/nacl溶液,4℃静置5小时。
[0135]
6)4℃、8000rpm离心30分钟,弃净上清后,用2ml pbs重悬沉淀,混匀后,再经8000rpm离心2分钟,弃去沉淀,上清1:1添加40%甘油,分装至无菌ep管中,-20℃保存,此为cpv特异性重组噬菌体库。
[0136]
2.2.5.2 cpv特异性重组噬菌体的淘选和富集
[0137]
用纯化的cpv作为目标抗原包被elisa板,对2.2.5.1中拯救的噬菌体库进行淘选,共淘选3轮,每轮逐渐减少抗原的包被量,以筛选出亲和力更高的cpv特异性重组噬菌体。具体操作方法如下:
[0138]
(1)抗原包板:用包被缓冲液将纯化的cpv稀释至100μg/ml(第一轮淘选用)、10μg/ml(第二轮淘选用)和1μg/ml(第三轮淘选用),分别加入96孔酶标板,100μl/孔,4℃过夜,弃包被液,用pbst洗涤5次。
[0139]
(2)封闭:每孔加300μl pbsm(含5%脱脂奶粉的pbs),37℃封闭2小时,弃封闭液,用pbst洗涤5次,甩干后可置于-20℃保存备用。
[0140]
(3)重组噬菌体库稀释:取拯救出的重组噬菌体库1ml,加入9mlpbsm进行稀释,混合均匀后置于37℃静置1小时。
[0141]
(4)结合:将稀释好的重组噬菌体库加入包被好的酶标板中,100μl/孔,37℃、80rpm振荡反应30分钟,再37℃静置2小时。
[0142]
(5)洗杂:弃去孔内的液体,用pbst洗5次,再用pbs洗5次,弃洗液,甩干。第二、三轮淘选时应相应增加洗涤次数,进一步减少非特异性结合。
[0143]
(6)初次侵染:每孔加入100μl培养到对数生长期的tg1菌液,37℃孵育20分钟,收集菌液。
[0144]
(7)洗脱:每孔加入200μl洗脱液(200mm甘氨酸、ph2.2),置于微量振荡器上轻微振荡10分钟。
[0145]
(8)中和:将孔内的洗脱液吸出,迅速加入1m tris缓冲液(ph9.0)调节ph至7.4,以恢复噬菌体的侵染能力。
[0146]
(9)再次侵染扩增:将上述洗脱液中加入到5ml培养至对数生长期的tg1菌液中,再与初次侵染的菌液混合,37℃静置2小时。加入100ml lb(amp+)培养基中,37℃振荡培养4~6小时,使菌液od
600
达到0.6~0.8。
[0147]
(10)拯救:加入辅助噬菌体m13k07,按照2.2.5.1的步骤2~6进行拯救。
[0148]
沉淀重悬后的上清液即为第一轮淘选所得的重组噬菌体库扩增液,部分保存后其余进行下一轮淘选,第二、三轮淘选步骤与第一轮相同,见步骤3~10。
[0149]
2.2.6噬菌体单克隆检测
[0150]
2.2.6.1单克隆的制备
[0151]
取100μl第三次淘选时2次侵染的混合液(见2.2.5.2步骤9),倍比稀释后涂布于固体lb(amp+)培养基平板上,37℃倒置培养过夜。按照以下步骤制备噬菌体单克隆。
[0152]
(1)在96孔深孔板中加入lb(amp+)液体培养基,800μl/孔,从平板上随机挑选96个单菌落,分别加入板中,37℃、200rpm振荡培养过夜,以此为母板。
[0153]
(2)另取一个96孔深孔板,每孔加入800μl lb(amp+)液体培养基,从母板的对应孔中各吸取100μl菌液接种于此板,置于37℃、200rpm振荡培养2小时,此为检测板。接种后的母板加入50%甘油,600μl/孔,-20℃冻存。
[0154]
(3)向培养后的检测板中加入辅助噬菌体m13k07,moi为20:1,置于37℃培养箱中静置30分钟,再经37℃、200rpm振荡培养30分钟。
[0155]
(4)将检测板置于离心机的酶标板转子中,4000rpm室温离心20分钟,弃去上清,每孔补加800lb(amp+、kana+)培养基重悬菌体,再经37℃、200rpm培养过夜。
[0156]
(5)将检测板再次离心,4℃、4000rpm离心40分钟,将每孔的上清吸出,对应加入一新的96孔深孔板中,即为噬菌体的单克隆,4℃保存备用。
[0157]
2.2.6.2cpv特异性噬菌体的elisa检测
[0158]
以上述噬菌体的单克隆作为一抗进行elisa检测,具体操作方法如下:
[0159]
(1)包板:用包被缓冲液将纯化的cpv稀释至1μg/ml,加入96孔酶标板,100μl/孔,4℃过夜,弃包被液,用pbst洗涤5次。
[0160]
(2)封闭:每孔加300μl pbsm(含5%脱脂奶粉的pbs),37℃封闭2小时,弃封闭液,用pbst洗涤5次,甩干后-20℃保存备用。
[0161]
(3)每孔加入90μl pbsm,将2.2.6.1中得到的噬菌体单克隆加入到对应的酶标板孔中,平行设立一块未包被抗原的阴性对照板,均为10μl/孔,37℃孵育2小时后弃去孔内液体,用pbst洗涤5次。
[0162]
(4)二抗孵育:每孔加入100μl 1000倍稀释的hrp标记的鼠抗m13抗体,37℃孵育1小时后弃去二抗,用pbst洗涤5次。
[0163]
(5)显色:每孔加入100μl tmb显色液,避光孵育15分钟。
[0164]
(6)终止:加入50μl 2m硫酸溶液,终止显色反应。
[0165]
(7)结果判定:测定od
450
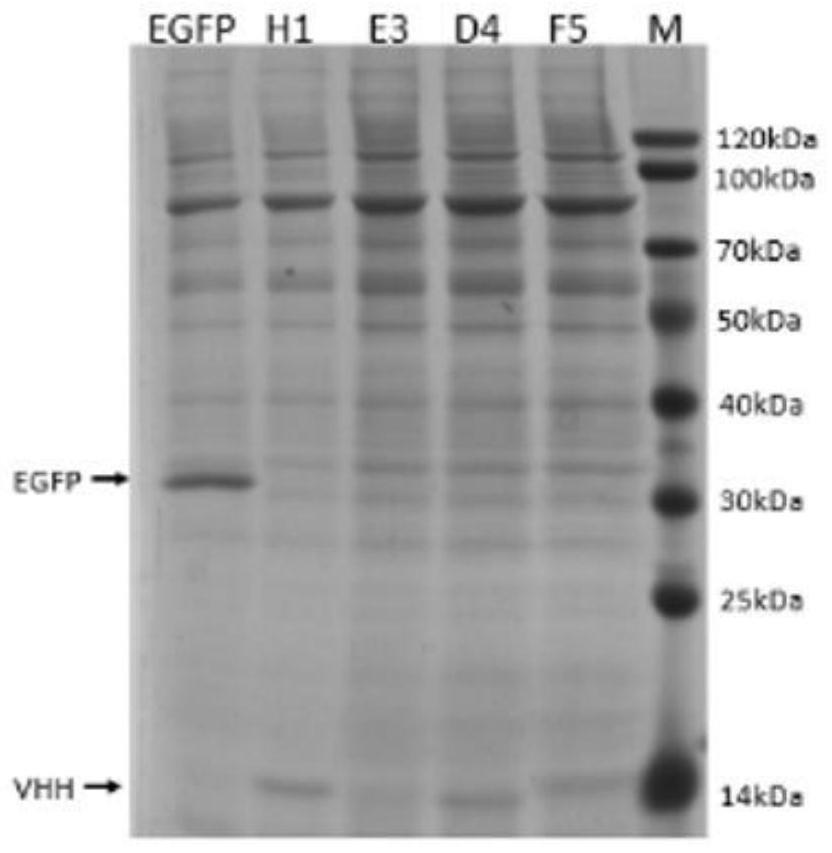
值,样品血清与阴性血清吸光值的平均数之比>2.1则判断为阳性。
[0166]
2.2.6.3阳性单克隆测序
[0167]
根据elisa测定结果,挑选阳性值较高的单克隆,用pcomb3x载体的通用引物(见表7)进行pcr扩增,扩增体系及条件同表3和表4。pcr产物送公司测序,用dnaman软件分析测序结果。
[0168]
表7 pcomb3x载体的通用引物
[0169][0170]
2.3结果与分析
[0171]
2.3.1 cpv的扩繁与纯化
[0172]
用ts02株cpv-2c病毒接种crfk细胞后,37℃培养72小时能够明显观察到细胞病变。接种后约96小时,细胞病变达到80%~90%时(图1),收获接毒细胞,-20℃冻融3次。经4℃、8000rpm离心5分钟,收集上清。细胞培养上清液经过超滤、超离和蔗糖密度梯度分离后得到纯化的cpv。如图2所示,浓缩后的细胞培养上清经过蔗糖密度梯度离心后,可以看到2条主要的蛋白条带,分别收集后经过cpv抗原检测试纸条的检测,确定cpv主要集中在30%
~40%的蔗糖梯度之间。用紫外分光光度计测定纯化后病毒悬液的蛋白浓度约为1.2mg/ml。
[0173]
纯化后的cpv稀释10倍、100倍和1000倍,分别用cpv抗原检测试纸条检测,加样量均为100μl,结果显示纯化病毒稀释1000倍后,依然可见抗原检测线(图3),10~100倍稀释后病毒抗原检测线很明显,表明纯化后的cpv粒子富集程度较高。取少量纯化的cpv,负染后通过电镜观察,可以很快找到cpv粒子(直径约20~30nm),如图4所示,除病毒粒子外的杂蛋白较少,因此,纯化后的cpv可以作为抗原,用以构建cpv特异性的噬菌体文库。
[0174]
2.3.2免疫后的抗体水平
[0175]
分别于三免和四免后14天采集免疫羊驼的外周血,分离血清,用间接elisa的方法测定cpv抗体水平。将血清分别稀释至1000倍、5000倍、25000倍和125000倍后作为一抗,加入包被好cpv的酶标板,同时以非免羊驼的阴性血清作为阴性对照,goat anti-alpaca igg h&l(hrp)为二抗,最终待检样品的od
450
值与阴性血清的od
450
值之比>2.1,则判断为该稀释度阳性,检测结果为阳性的最高稀释度作为血清的cpv抗体效价。od
450
值测定结果见表8,抗体效价结果见图5,由图可知,三免及四免后血清效价均可以达到1:25000,此抗体水平可以进行免疫抗体库的制备。
[0176]
表8 elisa实验数据
[0177][0178]
2.3.3 vhh基因pcr扩增结果
[0179]
四免后第14天采集的羊驼外周血约30ml,按照淋巴细胞分离试剂盒的使用说明书分淋巴细胞,采用trizol法提取淋巴细胞中的rna,rna提取结果见图6,如图所示,提取的rna样品在5k和2k处有明显的28s和18s条带(图6a),表明rna质量很好,可以用于vhh序列的扩增。rna经过反转录后,用第一轮pcr引物扩增产物可见600bp和900bp处有的两条带(图6b),以此为模板第二轮扩增后产物在400bp有明显条带(图6c),符合vhh片段的预期大小。
[0180]
2.3.4初始抗体库的鉴定结果
[0181]
2.3.4.1初始抗体库的库容
[0182]
回收第二轮扩增的vhh目的片段和pcomb3x载体进行酶切连接,电转tg1感受态细胞得到vhh的初始文库。取初始抗体文库菌液10μl,稀释1000倍后取200μl涂布lb(amp+)平板,37℃倒置培养过夜,次日计数平板上的菌落数约为4000个(图7),计算得出初始抗体库的库容约为2.0
×
106cfu/ml,符合免疫文库的库容预期,可以用于特异性噬菌体的淘选。
[0183]
2.3.4.2初始抗体库的阳性率
[0184]
从上述库容测定的菌落平板中随机挑取48个单菌落,加入500μl lb(amp+)培养基,37℃、200rpm振荡培养4小时后作为模板,用特异性引物扩增vhh基因,pcr产物的凝胶电泳结果见图8,其中阳性样品43个,阴性样品5个,重组率约为89.6%。
[0185]
2.3.4.3初始抗体库的多样性
[0186]
通过dnaman软件对20个阳性单克隆的氨基酸序列进行比对分析,结果显示:20条vhh基因的同源性为78.9%,cdr3区的差异较大,表明初始文库中重链可变区基因的多样性较好。通过mega软件绘制序列的遗传进化树,发现各序列之间同源性差异较大,进一步说明初始文库的多样性较好,可以用于特异性噬菌体的筛选。
[0187]
2.3.5噬菌体单克隆检测及测序结果
[0188]
将第三轮淘选后的噬菌体所侵染的菌液用lb培养基进行倍比稀释,稀释后涂布于固体lb(amp+)平板培养基上,37℃倒置培养过夜,次日从平板上随机挑取96个单克隆,增殖后作为一抗,进行elisa检测,结果显示,96个单克隆中有59个为cpv特异性的阳性克隆,占比为61.5%,p/n值最高可以达到22,表明经过三轮淘选后,可以与cpv特异性结合的高亲和力重组噬菌体得到了有效的富集。
[0189]
2.3.6单克隆测序
[0190]
将elisa筛选中p/n值较高的前12株单克隆菌液送基因公司测序,比对分析各序列,并绘制系统进化树(图9),从中挑选出4条差异最大的序列进行vhh的表达及鉴定,分别是cpv-vhh-h1、cpv-vhh-d4、cpv-vhh-f5和cpv-vhh-e3。
[0191]
实施例2犬细小病毒纳米抗体的表达和鉴定
[0192]
1、实验材料
[0193]
1.1细胞、载体和毒种
[0194]
hek293f细胞、crfk细胞、pcdna3.1载体和cpv-2c毒株(ts02株,f15代,106.5tcid50/1ml)均为中国农业科学院北京畜牧兽医研究所提供。dh5α感受态细胞购自北京全式金生物技术有限公司。
[0195]
1.2溶液配制
[0196]
1)pei溶液(1mg/ml):称取100mg pei粉末,加90ml超纯水,边搅拌边缓慢加入hcl调节ph<2.0后继续搅拌3~4小时至完全溶解。完全溶解后缓慢滴加naoh(10mol/l)调节ph至7.0,用量筒定容至1l。再经0.22μm针式滤器过滤除菌后分装至1.5ml离心管中,1ml/支,-80℃保存备用,融化后4℃可保存30天,避免反复冻融。
[0197]
2)蛋白纯化溶液:
[0198]
binding buffer:20mm tris、500mm nacl、20mm咪唑,用盐酸调节ph至8.0;
[0199]
wash buffer:20mm tris、500mm nacl、60mm咪唑,用盐酸调节ph至8.0;
[0200]
elution buffer:20mm tris、500mm nacl、500mm咪唑,用盐酸调节ph至8.0。
[0201]
3)蛋白胶染色液:称取考马斯亮蓝g250 1g,加入1l含有25%异丙醇和10%冰醋酸的溶液中,搅拌至完全溶解。
[0202]
4)蛋白胶脱色液:取醋酸100ml、无水乙醇50ml加入850ml去离子水中,混匀。
[0203]
5)5
×
sds-page电泳缓冲液:称取tris 15.1g、甘氨酸94g、sds 5g、加去离子水定容至1l。使用前用去离子水稀释5倍即可。
[0204]
2、实验方法
[0205]
2.1vhh重组表达载体的构建
[0206]
2.1.1引物设计
[0207]
根据淘选出的4株噬菌体的序列,设计合成带有xma i和xho i酶切位点的通用引物,同时在抗体序列n端添加6
×
his标签序列,引物序列如下:
[0208]
vhh-f:
[0209]5’‑
ggtggtgtacatctcctacatctacgcccccgggcaggtgcagctggtggagtc-3’(下划线部分为xma i的酶切位点);
[0210]
vhh-r:
[0211]5’‑
atggtgatggtggtgctcgagttagtggtggtggtggtggtgagaggagacggtgacct-3’(下划线部分为xho i的酶切位点)。
[0212]
2.1.2目的基因的扩增
[0213]
分别以4株菌液提取的质粒dna为模板进行pcr扩增,反应体系及反应程序见表9及表10,扩增产物经1%琼脂糖凝胶电泳检测。
[0214]
表9 pcr扩增体系
[0215][0216]
表10 pcr扩增程序
[0217][0218]
2.1.3酶切、连接和转化
[0219]
根据琼脂糖凝胶回收试剂盒说明书回收目的片段dna并用紫外分光光度计测定核酸浓度,用xma i和xho i酶分别对回收的目的片段与pcdna3.1载体进行双酶切,酶切反应体系见表11,各组分混匀后短暂离心至管底,置于37℃酶切过夜。
[0220]
表11双酶切反应体系
[0221][0222]
酶切反应结束后进行核酸电泳检测,回收目的片段,用t4 dna连接酶连接vhh基因片段与pcdna3.1载体,连接反应体系见表12。各组分分别加入1.5ml ep管中,短暂离心至管底,于37℃连接30分钟。
[0223]
表12 t4 dna连接酶连接体系
[0224][0225]
将连接产物转化至dh5α感受态细胞中,转化次日,从平板上分别挑取12个单克隆至已含有500μl lb(amp+)培养基的ep管中,200rpm振荡培养4小时,用载体通用引物鉴定转化阳性率,每组挑选3支阳性菌液送公司测序。根据测序结果,挑选序列连接正确且无突变的菌株提取重组表达载体的质粒dna,用于vhh基因的表达。
[0226]
2.2 vhh在hek293f中的瞬转表达
[0227]
复苏hek293f细胞,37℃、5%co2、140rpm振荡培养2~3天传代一次,传代时密度应达到3.0
×
106cells/ml,传代后初始密度为0.3~0.5
×
106cells/ml。复苏后细胞应至少传代2次,使细胞状态稳定且存活率>98%时再用于转染实验。
[0228]
按照如下方法转染hek293f细胞:
[0229]
(1)转染前一天对已培养2-3天的hek293f细胞进行计数,调整细胞密度至1.5
×
106cells/ml。新鲜培养基的添加量应大于终体积的50%,可通过离心细胞更换新鲜培养基来达到该比例。
[0230]
(2)转染当天,细胞计数并用新鲜培养基调整细胞浓度至2.0
×
106cells/ml,分装至6孔细胞培养板中,2.5ml/孔。
[0231]
(3)吸取适量质粒dna及pei溶液,分别添加至300μl opti-mem培养基中,使转染时dna的终浓度为1μg/ml,pei的终浓度为5μg/ml,稀释后的dna经0.22μm滤器过滤除菌,与稀释后的pei溶液混匀,室温静置20分钟后缓慢加入准备好的各孔细胞中。
[0232]
(4)同时以pcdna3.1-egfp载体作为对照质粒,同条件转染。
[0233]
转染后细胞在37℃、5%co2、140rpm振荡培养7天,期间根据细胞状态适量补加新鲜培养基。培养结束后,收集细胞培养液,经8000rpm离心5分钟去除细胞及细胞碎片,收获细胞培养上清,取少量进行sds-page电泳检测目的蛋白表达情况,剩余样品保存在-20℃。
[0234]
2.3 vhh的纯化
[0235]
2.3.1 ni-磁珠亲和纯化
[0236]
采用ni-磁珠亲和纯化的方法对带有6
×
his标签的目的蛋白进行纯化,具体纯化步骤如下:
[0237]
(1)向细胞培养液上清中加入2倍体积的binding buffer混匀,再加入1%体积的ni-磁珠,80rpm振荡吸附2h,置于磁力架上分离磁珠,弃上清;
[0238]
(2)用5倍上样体积的wash buffer冲洗磁珠3次,尽可能洗去杂蛋白;
[0239]
(3)加入原细胞上清体积的1/20倍体积的elution buffer,室温洗脱10-30min,收集洗脱液。
[0240]
2.3.2纯化蛋白的换液、浓缩及检测
[0241]
用3kd截留分子量的超滤管对纯化后的抗体蛋白进行换液,将含有咪唑的elution buffer更换为20mm的tris-hcl(ph8.0),同时进行浓缩。
[0242]
2.3.3vhh的鉴定
[0243]
纯化后的抗体蛋白经sds-page电泳、间接elisa、间接免疫荧光(ifa)和对cpv的中和试验(vn)进行鉴定。
[0244]
2.3.4sds-page电泳检测
[0245]
纯化后的抗体蛋白经sds-page电泳检测其浓度及纯度。取纯化后的蛋白溶液和细胞培养上清各30μl,分别加入10μl 4
×
loading buffer,短暂离心后置于沸水中煮沸10分钟。将制好的sds-page胶板装入垂直电泳槽内,加适量电泳缓冲液。将制好的样品和蛋白marker分别加入凝胶板孔中,10μl/孔。正确连接电泳槽电极,恒压180v进行电泳,当溴酚蓝迁移至胶板底部时停止电泳。取出凝胶置于适量蛋白胶染色液中,轻微振荡染色约30分钟后,用清水冲洗染色液,更换适量蛋白胶脱色液,振荡脱色至背景透明清晰。
[0246]
2.3.5间接elisa检测
[0247]
间接elisa检测方法操作如下:
[0248]
1)抗原包被:用包被缓冲液将纯化的cpv稀释至10μg/ml,将稀释好的cpv抗原液加入elisa板中,100μl/孔,4℃过夜,弃包被液,用pbst洗涤5次。
[0249]
2)封闭:每孔加300μl pbsm(含5%脱脂奶粉的pbs),37℃封闭2小时,弃封闭液,用pbst洗涤5次,甩干。
[0250]
3)一抗孵育:用5%pbstm稀释纯化后的纳米抗体(稀释倍数分别为1:10,1:100,1:1000和1:10000),将稀释后的抗体加到elisa板中,100ul/孔,每个稀释度做3组平行,同时设立阴性对照。37℃孵育1h,用pbst洗涤5次,甩干。
[0251]
4)酶标二抗孵育:用5%pbstm将抗his-hrp抗体进行1:3000稀释,100μl/孔,37℃孵育1h后弃去二抗,用pbst洗涤5次,甩干。
[0252]
5)tmb显色:每孔加入50μl tmb显色液,避光孵育15分钟。
[0253]
6)终止:加入50μl 2m硫酸溶液,终止显色反应。
[0254]
7)结果判定:用酶标仪测定od
450
值。
[0255]
2.3.6 ifa检测
[0256]
间接免疫荧光(ifa)检测方法操作如下:
[0257]
(1)细胞铺板接毒:取已长满单层的crfk细胞一瓶(t75)消化后取1/4细胞悬液,加入含有5%fbs的dmem培养基20ml中,混匀后铺48孔细胞板,200μl/孔。将cpv种毒稀释20倍,100μl/孔加入上述细胞中。封板,置于37℃、5%co2中培养72小时。
[0258]
(2)固定:弃去细胞培养上清,缓慢加入预冷的无水乙醇,100μl/孔,4℃孵育过夜。
[0259]
(3)封闭:弃固定液,用pbst洗3次,600ul/孔,每次2分钟,再用含有5%脱脂奶粉的pbstm作为封闭液,400μl/孔,37℃封闭1小时,用pbst洗3次。
[0260]
(4)一抗孵育:用5%pbstm将纯化的纳米抗体稀释10倍,将稀释后的纳米抗体加到elisa板中,100μl/孔,同时设立cpv小鼠多抗阳性对照(1:10稀释)及阴性对照。37℃孵育1小时,用pbst洗5次。
[0261]
(5)二抗孵育:用5%pbstm将抗his-fitc抗体进行1:1000倍稀释,每孔加入100μl,cpv小鼠多抗阳性对照孔加1:1000倍稀释的抗小鼠-fitc作为二抗,37℃避光孵育1小时,洗涤5次后每孔内加入200μl pbst保持湿润,4℃避光保存。
[0262]
(6)在荧光显微镜下观察实验结果。
[0263]
2.3.7病毒中和抗体检测(vn)
[0264]
cpv中和实验操作如下:
[0265]
(1)纳米抗体的稀释:将纯化后的重组表达纳米抗体分别用dmem稀释5倍,经0.22μm针式滤器过滤除菌后加入96孔细胞板的第一排,每孔100μl,继续进行2倍(100μl+100μl)系列稀释至1:640,每个稀释度做3个重复,同时设立病毒对照和未接毒的正常细胞对照孔。
[0266]
(2)病毒稀释:将cpv-2c细胞毒(f15代,10
6.5
tcid
50
/ml)用dmem稀释30000倍(每100μl约含100个tcid
50
),加入已稀释好抗体的细胞孔中,100μl/孔。将上述稀释好的病毒液继续进行10倍系列稀释至10-1
、10-2
、10-3
,分别含10个、1个和0.1个tcid
50
,作为病毒回归实验加入不含抗体的细胞孔内,每孔100μl,每个稀释度加5个孔。
[0267]
(3)中和:将上述细胞板振荡混匀10秒钟后置于37℃孵育1小时,每半小时混匀一次。
[0268]
(4)加细胞:将消化好的细胞悬液(含15%fbs)加入中和后的细胞孔中,每孔60μl。
[0269]
(5)培养观察:将细胞板置于37℃含5%co2的培养箱中培养7天,观察细胞病变情况。
[0270]
3、结果与分析
[0271]
3.1 vhh重组表达载体的构建
[0272]
根据淘选出的4株噬菌体cpv-vhh-h1、cpv-vhh-e3、cpv-vhh-d4和cpv-vhh-f5的序列设计特异性引物,扩增出4条大小约400bp的vhh片段(图10),符合预期结果。胶回收片段及实验室构建好的pcdna3.1载体(已加入蜂毒信号肽和xmaⅰ酶切位点)分别用xmaⅰ和xhoⅰ酶进行双酶切,酶切产物见图11,切取大小约400bp凝胶,按照胶回收试剂盒说明书回收目的片段。
[0273]
用t4连接酶连接酶切后的片段和载体并转化dh5α感受态细胞,次日每组随机挑选12个单菌落,扩繁后用特异性引物扩增目的片段,pcr产物经凝胶电泳检测显示所有单菌落均为阳性,转化阳性率为100%。(图12)
[0274]
每组随机挑选的3个阳性克隆菌液送测序公司测序,用dnaman比对测序结果,每组送检的3个克隆中至少有2条的序列是连接正确且无突变的,证明4株纳米抗体的重组表达载体pcdna3.1-vhh构建成功,可以进行重组纳米抗体的哺乳动物细胞表达。
[0275]
3.2 vhh的瞬转表达
[0276]
转染后第二天通过荧光显微镜观察对照质粒的转染效果,见图13,计数有荧光/无荧光细胞的数量,计算得出转染效率约为50%。转染后第7天收获细胞上清,经sds-page电泳检测,可见目的蛋白条带,大小约14kd,但表达量较低,可见明显的大小约30kd的egfp对照蛋白条带(图14)。
[0277]
3.3 vhh的纯化
[0278]
4组重组vhh的细胞培养上清和表达egfp的对照细胞培养上清均经过ni-磁珠亲和纯化,纯化后的样品可见明显vhh目的条带(图15),大小约15kda,蛋白纯度>90%,对照蛋白并没有被ni-磁珠富集,结果符合预期。
[0279]
上述实验证明已成功表达出cpv-vhh-h1、cpv-vhh-e3、cpv-vhh-d4和cpv-vhh-f5共4株纳米抗体,且通过标签蛋白6
×
his可以有效富集重组的纳米抗体蛋白。
[0280]
3.4 vhh的鉴定
[0281]
3.4.1间接elisa实验结果
[0282]
用间接elisa的方法鉴定表达的4株纳米抗体的特异性,试验组od
450nm
值与对照组od
450nm
值比值大于2.1判断为阳性(王召阳等,2020),结果显示表达的4株纳米抗体稀释1000倍后与病毒的反应活性依然显著高于阴性对照,表明4株纳米抗体均可与cpv特异性结合。elisa实验结果见表13。
[0283]
表13间接elisa实验数据
[0284][0285]
3.4.2 ifa的实验结果
[0286]
通过间接免疫荧光实验验证4株纳米抗体与cpv的特异性,因重组纳米抗体携带6
×
his标签,如果它们能够特异性结合cpv,则利用带fitc标签的抗his标签抗体作为二抗,即可看到荧光信号。结果显示:4株重组的纳米抗体均可与cpv特异性结合,ifa结果见图16。
[0287]
3.4.3病毒中和实验结果(vn)
[0288]
通过对cpv的中和试验(vn)检测表达的重组纳米抗体的中和活性,结果显示:4条纳米抗体对cpv的中和效价均小于1:10,初步判断该4条vhh不具备cpv中和活性,中和抗体效价测定结果见表14。
[0289]
表14病毒中和实验结果
[0290][0291]
注:“+”表示细胞孔出现cpe。
[0292]
本发明通过sds-page、elisa、ifa以及对cpv的中和效价测定等实验对4条重组纳米抗体进行了生物学特性的鉴定,结果显示通过hek293f细胞表达的4条纳米抗体均能特异性结合cpv,但不具备对cpv-2c毒株的中和活性。分析可能原因有:(1)本实验采用全病毒筛选出的vhh并不是识别病毒感染细胞的关键位点的抗体。vp2蛋白是cpv的免疫原性蛋白,其中包含中和抗原位点,可以尝试以cpv vp2蛋白为目标抗原,对噬菌体文库进行更有针对性
的特异性筛选,或可获得具有中和活性的纳米抗体(xu et al.,2014)。(2)因为纳米抗体的分子量过小,虽然有利于结合抗原位点,但不足以形成有效的空间位阻效应以阻断病毒感染细胞的能力。可以通过一些基因工程的手段对纳米抗体进行修饰,例如通过柔性连接肽段串联纳米抗体构建多聚体或双特异性抗体等,以提高纳米抗体的功能。
[0293]
另外,由于表达的重组纳米抗体具有很高的cpv特异性,或可尝试将其应用于cpv诊断方面研究,例如疾病的快速诊断、抗体标记、病毒定位等。
[0294]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1