逆转录转座基因L1-ATP8B1及其作为肺鳞癌标志物的用途和治疗肺鳞癌的药物
逆转录转座基因l1-atp8b1及其作为肺鳞癌标志物的用途和治疗肺鳞癌的药物
技术领域
1.本发明涉及生物技术领域,特别涉及一种逆转录转座基因l1-atp8b1及其作为肺鳞癌标志物的用途和治疗肺鳞癌的药物。
背景技术:
2.非小细胞肺癌约占所有肺癌的85%,在全球范围内发病率及病死率均居前列,5年生存率仅为19%。非小细胞肺癌主要包括肺腺癌,肺鳞癌和大细胞肺癌。肺鳞癌作为非小细胞肺癌的第二常见病理类型,具有进展快,预后差,化疗敏感性低等特点。相比肺腺癌,肺鳞癌基因变异虽多,却缺乏可靶向的变异位点,且容易发生免疫逃逸,故肺鳞癌患者从靶向治疗和免疫治疗单药治疗中获益有限,亟待寻找新的治疗手段。
3.长散布元件-1(long interspersed element-1,line-1)是人类基因组中唯一具有自主转座能力的逆转录转座子,约占基因组总量的17%。近年来,line-1插入形成的逆转录转座基因的促肿瘤作用一直是癌症研究的热点。全基因组泛癌分析表明,line-1逆转录转座基因可通过促进染色体上着丝粒和端粒丢失,导致抑癌基因的缺失;或启动“断裂-融合-桥接”循环触发癌基因扩增,引起复杂的基因易位和大规模基因重排,影响基因组稳定性,发挥致癌作用。已证实逆转录转座基因l1-apc,l1-pten,l1-myc,l1-brca1与结直肠癌、卵巢癌、乳腺癌和肝癌的发生密切相关,但对于非小细胞肺癌而言,虽然已证实line-1插入是肺鳞癌的不良预后因素,但具体哪些line-1逆转录转座基因参与肺鳞癌的发生和发展过程,目前尚不清楚。
技术实现要素:
4.本发明为了解决上述技术问题,提供了一种逆转录转座基因l1-atp8b1及其作为肺鳞癌标志物的用途和治疗肺鳞癌的药物。
5.本发明是通过以下技术方案得以实现的。
6.一种逆转录转座基因l1-atp8b1,所述逆转录转座基因l1-atp8b1的核酸序列如seq id no.1所示。
7.一种上述逆转录转座基因l1-atp8b1表达水平的检测试剂在制备诊断肺鳞癌产品中应用。
8.进一步的,所述检测试剂为逆转录转座基因l1-atp8b1的上游检测引物和下游检测引物,所述上游检测引物的核酸序列如seq id no.2所示,所述下游检测引物的核酸序列如seq id no.3所示。
9.一种上述逆转录转座基因l1-atp8b1表达水平的抑制剂在制备治疗肺鳞癌产品中应用。
10.进一步的,所述抑制剂选自逆转录转座抑制剂和抗氧化剂中的一种或两种。
11.进一步的,所述逆转录转座抑制剂为奈韦拉平;所述抗氧化剂为n-乙酰半胱氨酸。
12.一种上述逆转录转座基因l1-atp8b1的检测引物,所述检测引物包括上游检测引物和下游检测引物,所述上游检测引物的核酸序列如seq id no.2所示,所述下游检测引物的核酸序列如seq id no.3所示。
13.一种治疗肺鳞癌的药物,所述药物以逆转录转座基因l1-atp8b1为治疗靶点,所述逆转录转座基因l1-atp8b1的核酸序列如seq id no.1所示。
14.进一步的,所述药物选自逆转录转座抑制剂和抗氧化剂中的一种或两种。
15.进一步的,所述逆转录转座抑制剂为奈韦拉平;所述抗氧化剂为n-乙酰半胱氨酸。
16.本技术具有以下有益效果。
17.本发明l1-atp8b1的高表达能够增加肺鳞癌细胞增殖和侵袭的能力,伴随有细胞内活性氧升高,促进小鼠肺鳞癌的发生发展。同时,本技术利用抗氧化剂联合逆转录转座抑制剂,以逆转录转座基因l1-atp8b1为靶点对肺鳞癌进行治疗,获得了很好的治疗效果。本发明的逆转录转座基因l1-atp8b1可以作为一个新的肿瘤标志物,对l1-atp8b1的检测可以用以进行肺鳞癌的早期诊断、分子分型,以及预后评估,同时l1-atp8b1还可能成为一个潜在的治疗靶点,应用于肺鳞癌的临床治疗。
附图说明
18.图1是本发明定量检测逆转录转座基因l1-atp8b1在肺鳞癌和癌旁组织中的表达图;
19.图2是本发明在细胞水平上验证逆转录转座基因l1-atp8b1的存在及其与肺鳞癌发生的相关性图(其中,a为逆转录转座基因l1-atp8b1在不同细胞中表达的琼脂糖电泳图;b为逆转录转座基因l1-atp8b1在不同细胞中的相对表达量对比图;c为逆转录转座基因l1-atp8b1的测序结果图);
20.图3是本发明逆转录转座基因l1-atp8b1的表达量与患者总生存以及tnm分期之间的关系图(其中,a为逆转录转座基因l1-atp8b1与患者总生存的关系图;b为逆转录转座基因l1-atp8b1与tnm分期的关系图);
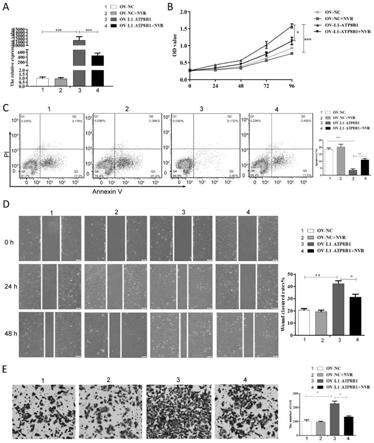
21.图4是本发明逆转录转座基因l1-atp8b1的表达量与肺鳞癌细胞增殖能力、侵袭潜能、凋亡数量的关系,以及奈韦拉平对l1-atp8b1表达水平、肺鳞癌细胞的增殖能力,细胞侵袭数量的影响图(其中,a为不同细胞以及奈韦拉平处理前后l1-atp8b1表达量的对比图;b为不同细胞以及奈韦拉平处理前后细胞增殖能力对比图;c为不同细胞以及奈韦拉平处理前后细胞凋亡数量对比图;d为不同细胞以及奈韦拉平处理前后细胞迁移能力对比图;e为不同细胞以及奈韦拉平处理前后细胞侵袭能力对比图);
22.图5是本发明逆转录转座基因l1-atp8b1促进细胞产生高水平活性氧,以及n-乙酰半胱氨酸对肺鳞癌细胞的增殖、侵袭能力的影响图(其中,a为不同细胞以及奈韦拉平处理前后活性氧含量对比图;b为不同细胞以及n-乙酰半胱氨酸处理前后细胞增殖能力对比图;c为不同细胞以及n-乙酰半胱氨酸处理前后细胞凋亡数量对比图;d为不同细胞以及n-乙酰半胱氨酸处理前后细胞迁移能力对比图;e为不同细胞以及n-乙酰半胱氨酸处理前后细胞侵袭能力对比图);
23.图6是本发明小鼠体内逆转录转座基因l1-atp8b1的表达对肺鳞癌发生发展的影响,以及奈韦拉平单独治疗和与不同浓度n-乙酰半胱氨酸联合治疗的抗肿瘤效果图(其中,
a为对照组和不同处理组肿瘤大小实物图;b为对照组和不同处理组肿瘤大小对比图;c为对照组和处理组小鼠体重对比图)。
具体实施方式
24.下面结合附图和实施例对本发明进行进一步的说明。
25.一、核酸序列
26.逆转录转座基因l1-atp8b1序列(seq id no.1):
27.gttgccgccttgcagtttgatctcagactgctgtgctagcaatcagcgagattccgtgggcgtaggaccctctgagccaggtgtgggatatagtctcgtggtgcgccgtttcttaagccggtctgaaaagcgcaatattcggatgggagtgacccgattttccagaatgtacatggcaagtcaaagcaaacgatcgcaagtaccacgaacaacctcactttatgaacacaaaattcttgtgtattaaggagagtaaatatgcgaataatgcaattaaaacatacaagtacaacgcatttacctttataccaatgaatctgtttgagcagtttaagagagcagccaatttatatttcctggctcttcttatcttacaggcagttcctcaaatctctaccctggcttggtacaccacactagtgcccctg
28.二、实验方法
29.1.临床样本收集
30.本发明共收集来自于肺部肿瘤科就诊并接受部分肺切除手术治疗的肺鳞癌患者样本190例,其中包括153名男性和37名女性,中位年龄为61岁(35-84岁)。这些患者都被确诊为肺鳞癌,临床分期为i期76例,ii期37例,iii期50例,和iv期27例。在进行肺切除手术前,未进行包括化疗或放疗在内的治疗。术后随访时间67-96个月。
31.2.pcr检测
32.(1)trizol法提取总rna
33.①
收集的组织样本,加入适量的trizol,吹打后移入无酶eppendorf管中。确保细胞完全裂解,液体基本澄清;
34.②
将上述eppendorf管室温静置5min,加入氯仿(200μl/1ml trizol),上下颠倒混匀,室温静置10min,4℃,12000g,离心15min;
35.③
小心吸取上层水相置于另一个新的无酶eppendorf管中,加入等体积异丙醇,上下颠倒混匀,室温静置10min,4℃,12000g,离心10min。弃上清;
36.④
用75%乙醇(1ml/1mltrizol)洗沉淀,4℃,7500g,离心5min,弃上清,室温静置数分钟,使沉淀自然干燥。加入适量depc处理的ddw使其溶解,-80℃保存备用;
37.⑤
紫外分光光度法测定rna的浓度和纯度;1%琼脂糖凝胶电泳检测rna的完整性。
38.(2)反转录实验(20μl体系)
39.①
配制如下反应体系,70℃,5min,然后立即置于冰上。体系如下:
40.oligo-(dt)15primer(500μg/ml)
ꢀꢀꢀꢀꢀ
1μl
41.total rna sample
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1μg
42.sterile water
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
补足到10μl
43.②
在反应体系中加入以下试剂,置于pcr仪中,42℃,1h。
[0044][0045]
(3)普通pcr反应
[0046]
pcr扩增反应体系:
[0047][0048]
上游检测引物:5
’‑
cgc ctt gca gtt tga tct ca-3’,下游检测引物:5
’‑
cgtggtacttgcgatcgttt-3’。
[0049]
扩增条件:预变性94℃,5min,变性94℃,30s,退火54℃,30s,延伸72℃,30s,35个循环,72℃延伸7min。根据预测的序列,通过primer premier 5.0设计检测逆转录转座基因的引物,并由santa cruz公司合成。用β-actin做为内参。pcr产物进行1.5%琼脂糖电泳。为了确认在pcr反应中观察和检测的条带确实是最初预测的基因,本发明纯化了pcr产物并对其进行测序验证。
[0050]
(4)实时荧光定量pcr反应
[0051]
反应体系(20μl)如下:
[0052][0053]
反应条件:95℃,30sec;95℃,5sec;64℃,34sec;重复40个循环。每个反应设3个复孔。abi prism 7500仪器自动生成ct值,
△
ct=ct
目的基因-ct
actin
,mrna的相对表达量为2
‑△
ct。
[0054]
表1
[0055][0056]
(5)高通量定量pcr
48小时划痕距离)/0小时划痕距离
×
100%。实验至少重复3次。
[0070]
8.细胞侵袭
[0071]
使用matrigel胶和trans-well板检测所构建的不同细胞的侵袭能力。将细胞以1
×
105个细胞的密度接种在matrigel和100μl无血清rpmi-1640中,接种到具有8μm孔径聚碳酸酯滤膜的24孔板trans-well系统的小室中,下室是含有10%fbs的培养基。细胞孵育48小时后,将膜下表面的细胞用甲醇固定,并用1%甲苯胺蓝染色。通过显微镜拍摄染色的膜并计数发生侵袭的细胞。实验至少重复3次。
[0072]
9.细胞内活性氧的测定
[0073]
使用活性氧检测试剂盒测定细胞内活性氧。收集细胞,用pbs洗涤,与dcfh-da在37℃孵育30分钟,然后用无血清培养基洗涤3次。流式细胞仪检测1
×
107/ml细胞在488nm激发波长和525nm发射波长下的dcf荧光。
[0074]
10.动物实验
[0075]
将处于对数生长期的不同细胞按5
×
105细胞/100μl/只,皮下接种nod/scid小鼠(6-8周龄,18-22g,每组5只)腹股沟部位,构建不同动物模型。每3天观察肿瘤生长情况,连续观察4-6周,比较对照组和实验组小鼠的成瘤率和成瘤时间,成瘤后每天测量肿瘤长短径,按照公式:肿瘤体积=πab2/6计算肿瘤大小(a为长径,b位短径),绘制小鼠肿瘤生长曲线。对于药物治疗实验,动物每天接受奈韦拉平(100mg/kg/天)单独治疗,或与不同浓度n-乙酰半胱氨酸(分别为75mg/kg/天,150mg/kg/天和300mg/kg/天)联合治疗。
[0076]
三、实验结果
[0077]
1.在前期研究中,本技术利用defuse工具发现tcga数据库中90%肺鳞癌样本存在line-1插入。通过整合公共大数据和本地临床样本资料,筛选出13种肺鳞癌相关高频line-1逆转录转座基因,其中l1-atp8b1不仅在肺鳞癌中高表达,还与患者预后显著相关,提示高致病性。进一步的,本发明收取了52对肺鳞癌组织及其癌旁正常组织作为对照,抽提rna后进行反转录,合成的cdna通过定量qpcr,定量检测逆转录转座基因l1-atp8b1在肺鳞癌和癌旁组织中的表达。实验结果参见图1,结果显示,逆转录转座基因l1-atp8b1在肺鳞癌中的表达显著高于其癌旁对照组织(pcr扩增后获得长度为180bp的片段即为目的基因),提示逆转录转座基因l1-atp8b1参与调控肺鳞癌的发生。
[0078]
2.本发明又选取肺癌细胞系(肺腺癌细胞系a549、h1299、肺鳞癌细胞系h520、大细胞肺癌细胞系h460、小细胞肺癌细胞系h446),以及正常细胞系(人正常肺上皮细胞系beas-2b和人上皮细胞系hek293t)作为对照,利用rt-pcr和定量real-time qpcr分别检测逆转录转座基因l1-atp8b1在肺癌细胞系和正常细胞系中的表达。结果显示,逆转录转座基因l1-atp8b1主要在h520细胞中呈现出高表达(图2a-b)。在其他肺癌细胞系,包括2个正常细胞系中的表达几乎未检测到,这提示逆转录转座基因l1-atp8b1的表达与肺鳞癌的发生有关。为了验证在pcr实验中观察的条带确实是最初所预测的基因序列,本发明纯化了pcr产物并对其进行测序。结果显示,逆转录转座基因l1-atp8b1的测序结果与预测的基因序列完全匹配(图2c)。这些结果在细胞水平上验证了逆转录转座基因l1-atp8b1的存在,并表明其存在与肺鳞癌的发生相关。
[0079]
3.本发明还进行了逆转录转座基因l1-atp8b1的表达与肺鳞癌患者性别、年龄、生存时间、tnm分期,和吸烟指数等临床病理指标相关性的研究。本发明收集了190例肺鳞癌标
本,检测了其逆转录转座基因l1-atp8b1的表达。根据高通量定量qpcr的结果,依据逆转录转座基因l1-atp8b1表达量的中位数(2-δct
值大于中位数的样本被定义为高表达,2-δct
的值小于中位数的样本被定义为低表达),将样本分成2组,分析其表达量与患者总生存(os)之间的关系。结果显示,逆转录转座基因l1-atp8b1表达低的患者生存率较高,而l1-atp8b1表达高的患者生存率较低(图3a),显示出了显著性的差异。其他临床参数的分析结果显示,逆转录转座基因l1-atp8b1的表达量与患者tnm分期显著相关,逆转录转座基因l1-atp8b1表达低的患者肿瘤体积较小,不容易发生淋巴转移和远处转移,而l1-atp8b1表达高的患者肿瘤体积较大,容易发生淋巴转移和远处转移(p《0.05,图3b)。此外,l1-atp8b1表达高的患者中吸烟人数显著多于l1-atp8b1表达低的患者(p《0.05)。而l1-atp8b1的表达量与性别、年龄等临床指标无明显相关性(p》0.05)。以上数据表明,逆转录转座基因l1-atp8b1可能是肺鳞癌的一个潜在肿瘤标志物,与肺鳞癌的发生和发展相关,并影响肺鳞癌病人预后。
[0080]
4.为了进一步研究逆转录转座基因l1-atp8b1对于肺鳞癌发生发展的影响,本发明构建了高表达l1-atp8b1的h520细胞(h520
ov-l1-atp8b1
),通过定量pcr检测h520
ov-l1-atp8b1
细胞中l1-atp8b1的表达明显升高(图4a),细胞增殖能力也明显增强(图4b)。并进行了细胞功能的检测,使用annexin-v-fitc凋亡检测试剂盒来测量细胞凋亡,利用划痕实验检测细胞迁移能力,以及用matrigel和trans-well实验检测细胞侵袭能力。结果表明,逆转录转座基因l1-atp8b1的高表达使肺鳞癌细胞凋亡数量减少(图4c),划痕修复能力增强(图4d),侵袭潜能提高(图4e)。
[0081]
本发明又在细胞水平上,以逆转录转座基因l1-atp8b1为治疗靶点,应用逆转录转座抑制剂奈韦拉平进行处理,初步观察该方法的治疗效果。结果表明,加入药物后,明显抑制了逆转录转座基因l1-atp8b1的表达水平(图4a),并且降低了肺鳞癌细胞的增殖能力(图4b),细胞凋亡数量增加(图4c),并降低了细胞的迁移能力(图4d)和侵袭能力(图4e)。
[0082]
5.研究表明,肿瘤细胞中产生的活性氧通常高于正常细胞,高水平的活性氧可以激活许多促癌通路,引起肿瘤的发生和转移。本发明进一步检测了逆转录转座基因l1-atp8b1对活性氧的影响。活性氧检测结果显示,高表达逆转录转座基因l1-atp8b1的h520细胞中活性氧含量显著高于对照细胞,且高水平的活性氧被逆转录转座抑制剂奈韦拉平所抑制(图5a)。本发明又在细胞水平上,基于逆转录转座基因l1-atp8b1产生高水平活性氧,应用抗氧化剂n-乙酰半胱氨酸进行处理,初步观察该方法的治疗效果。结果表明,加入n-乙酰半胱氨酸后,明显降低了肺鳞癌细胞的增殖能力(图5b),细胞凋亡数量增加(图5c),并降低了细胞的迁移能力(图5d)和侵袭能力(图5e)。
[0083]
6.为了在体内验证逆转录转座基因l1-atp8b1对于肺鳞癌发生发展的影响,本发明将处于对数生长期的对照肺鳞癌细胞系h520,以及构建的高表达l1-atp8b1基因的h520细胞(h520
ov-nc
和h520
ov-l1-atp8b1
),皮下接种nod/scid小鼠(6-8周龄,18-22g)腹股沟部位,构建不同动物模型。动物模型构建成功后,每3天观察肿瘤生长情况,连续观察4-6周,成瘤后每天称量小鼠体重,并测量肿瘤长短径,按照公式计算肿瘤大小,绘制小鼠肿瘤生长曲线和小鼠生存曲线。通过比较对照组和实验组小鼠的体重、成瘤率、成瘤时间和成瘤大小,发现接种h520
ov-l1-atp8b1
细胞的小鼠与对照小鼠的体重没有明显差异,但接种h520
ov-l1-atp8b1
细胞的小鼠成瘤时间较对照组短,成瘤体积也显著大于对照组(图6)。本技术进一步地检测奈韦拉平和n-乙酰半胱氨酸的治疗效果,发现单独注射奈韦拉平的治疗组小鼠成瘤体积减小,
而奈韦拉平和n-乙酰半胱氨酸两药联合的治疗效果更加显著。通过将奈韦拉平与不同浓度的n-乙酰半胱氨酸(75mg/kg/天,150mg/kg/天和300mg/kg/天)联合治疗,发现奈韦拉平与150mg/kg/天、300mg/kg/天浓度的n-乙酰半胱氨酸联合的治疗效果优于与75mg/kg/天浓度的n-乙酰半胱氨酸联合,但奈韦拉平与300mg/kg/天n-乙酰半胱氨酸联合的毒性强,引起小鼠体重急剧下降。综合考虑治疗效果与药物毒性,本技术确定的最优配比为奈韦拉平(100mg/kg/天)与150mg/kg/天n-乙酰半胱氨酸联合用药(图6)。
[0084]
本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1